INTRODUÇÃOO sistema auditivo é constituído por vias auditivas aferentes e eferentes que atuam integradamente. A via auditiva eferente é constituída pelos feixes olivococleares medial e lateral, os quais possuem diferenças anatômicas e fisiológicas que coordenam a função independente das duas orelhas1.
As funções das vias auditivas eferentes incluem a modulação das células ciliadas externas da cóclea, diminuição do potencial de ação do nervo coclear, proteção contra o ruído, localização da fonte sonora, melhora na detecção da fonte sonora em ambientes ruidosos1-2. Outro estudo3 relatou que a via auditiva eferente é menos eficiente nos pacientes com queixa de zumbido.
O sistema eferente, por meio do trato olivococlear medial, é o responsável pela modulação dos movimentos das células ciliadas externas pela liberação de acetilcolina na fenda sináptica4.
A via auditiva eferente pode ser avaliada a partir da aplicação de um estímulo acústico contralateral concomitantemente com a captação das emissões otoacústicas (EOAs). O efeito de supressão das EOAs por ruído contralateral vem sendo cada vez mais utilizado, tanto na clínica quanto na pesquisa, por avaliar a via auditiva eferente e ser um procedimento rápido e não invasivo.
Todas as células vivas do corpo humano dependem de um fornecimento adequado de oxigênio e nutrientes para manterem sua função, sendo que tal fornecimento, em última instância, depende da integridade funcional e estrutural do coração e dos vasos sanguíneos.
O fornecimento adequado de nutrientes e oxigênio tem como consequência a produção de energia para que o organismo execute suas atividades metabólicas. Esta produção ocorre via cadeia respiratória mitocondrial. Entretanto, cerca de 5% do oxigênio que é inspirado, ao invés de ser ocupado na produção de energia (adenosina tri-fosfato - ATP) gera espécies ativas de oxigênio (radicais livres). Essas moléculas são altamente reativas com outras moléculas celulares e se não forem controladas podem causar diversos danos fisiológicos e doenças5.
Por tal motivo, os radicais livres são controlados pelo organismo através de um sistema antioxidante enzimático. Este sistema transforma radicais livres como o superóxido e o peróxido de hidrogênio (água oxigenada) em moléculas de água. Além deste sistema endógeno, moléculas antioxidantes provenientes de frutas e verduras atuam na defesa do nosso organismo contra os radicais livres. Entretanto, quando a produção de radicais livres é maior que o seu controle pelos sistemas antioxidantes exógenos e endógenos, ocorre um fenômeno denominado estresse oxidativo. O estresse oxidativo causa dano a moléculas importantes do organismo como as membranas celulares (peroxidação lipídica) e mutações no Ácido Desoxirribonucleico (convencionalmente chamado de DNA, Deoxyribosenucleic Acid - DNA). Essas alterações em geral são conhecidas como genotoxicidade. Assim, a avaliação da ocorrência de maior genotoxicidade, por exemplo, indica que o indivíduo possui um maior nível de estresse oxidativo.
Investigações têm sugerido que o estresse oxidativo causado por diversos fatores de risco, como o fumo, podem alterar a audição6-8. Essa alteração ocorreria via aumento do nível de dióxido de carbono e nicotina, que aumentaria por sua vez a quantidade de radicais livres. Um grande conjunto de evidências sugere que um descontrole na produção destas moléculas causa disfunção endotelial. Essa alteração fisiológica pode levar ao aumento na vasoconstrição dos vasos sanguíneos, aumentando o risco de ocorrência de oclusões trombóticas na vasculatura que irriga os órgãos da audição9-10.
Deste modo, investigar a possível associação entre funções da via auditiva eferente e genotoxicidade, que é um marcador de estresse oxidativo, em indivíduos normo-ouvintes é relevante. Adicionalmente, considerar fatores intervenientes como o tabagismo e o gênero na análise desta associação é importante, uma vez que o tabagismo tende a aumentar o estresse oxidativo do indivíduo e que o gênero pode interferir via diferenças metabólicas (hormonais) e comportamentais.
Com base nessas considerações, o estudo aqui apresentado teve como objetivos principais analisar a associação entre funções da via auditiva eferente, avaliada por meio do efeito de supressão das emissões otoacústicas evocadas produto de distorção (EOAEPDs) e autorrelato de queixas auditivas, com marcadores genotóxicos do estresse oxidativo. Adicionalmente o estudo considerou o tabagismo e o gênero como as principais variáveis intervenientes.
MATERIAL E MÉTODOO delineamento do presente estudo foi do tipo prospectivo-clínico, quantitativo, transversal, contemporâneo. Para tanto, foi feita uma análise da função da via auditiva eferente por meio da análise do efeito de supressão das EOAEPDs e autorrelato de queixas auditivas de dificuldade auditiva, zumbido, dificuldade de ouvir em ambiente ruidoso, dificuldade de entender a fala em grupo e desconforto a sons intensos (queixas que são relacionadas às funções da via auditiva eferente) em 60 voluntários adultos jovens (entre 18 e 32 anos). Esses voluntários foram probabilisticamente selecionados a partir de uma amostra de 1024 indivíduos previamente incluídos no Projeto de Pesquisa "Nutrigenética e Tabagismo: Estudos
In Vivo e
Ex Vivo da Dieta e Atividade Física na Modulação dos Efeitos Pró-Oxidantes do Fumo". O referido projeto foi aprovado pelo Comitê de Ética e Pesquisa da instituição ao qual é vinculado sob o Número 0146.0.243.000-07. Nesses indivíduos também foram avaliados indicadores de genotoxicidade.
Os critérios de inclusão no estudo foram a ocorrência de limiares auditivos normais11, presença de EOAEPD12 e, para ser considerado tabagista, ter fumado mais de 100 cigarros nos últimos 90 dias12.
Todos os participantes, após assinarem o termo de consentimento livre e esclarecido, foram submetidos a:
a)
Anamnese: composta por perguntas fechadas de identificação, antecedentes pessoais e familiares, hábito de tabagismo, quantidade diária, marca de cigarro, tempo de exposição ao fumo, queixas de dificuldade auditiva, zumbido, dificuldade de ouvir em ambiente ruidoso, dificuldade de entender a fala em grupo e desconforto a sons intensos.
b)
Avaliação Audiológica Básica composta de:
- Inspeção visual do meato acústico externo;
- Audiometria Tonal Liminar por via aérea nas frequências de 250, 500, 1000, 2000, 3000, 4000, 6000 e 8000Hz e por via óssea nas frequências de 500, 1000, 2000, 3000 e 4000Hz, quando necessário, com limiares pesquisados de forma descendente13. Para execução da audiometria tonal liminar foi utilizado audiômetro digital de dois canais, marca Fonix, modelo FA-12, tipo I e fones auriculares tipo TDH-39P, marca Telephonics com calibração de acordo com a norma ISO 389-1991. Os indivíduos foram considerados normo-ouvintes quando a média de tons puros dos limiares de via aérea entre 500, 1000 e 2000 Hz, ficaram entre zero e 25dB11.
- Avaliação do Limiar de Reconhecimento de Fala (LRF), com palavras dissilábicas;
- Verificação do Índice Percentual de Reconhecimento de Fala (IPRF), com palavras monossilábicas. Os resultados do IPRF deveriam estar entre 92 e 100% de acertos, indicando que o indivíduo não apresentou dificuldade para compreender a fala14.
- Medidas de Imitância Acústica: timpanometria e pesquisa dos reflexos acústicos contra e ipsilaterais. Para a execução das medidas de imitância acústica foi utilizado um analisador de orelha média INTERACOUSTIC AZ7, com fone TDH-39 e coxim MX-41, com tom-sonda de 220Hz à 70dBNA, e calibração segundo a norma ISO 389-1991. Os reflexos acústicos foram pesquisados nas frequências de 500, 1000, 2000 e 4000Hz. Os indivíduos deveriam apresentar curva timpanométrica do tipo A, indicando mobilidade adequada do sistema tímpano-ossicular14 e reflexos estapedianos presentes15, 16.
Os resultados foram anotados em protocolo padrão.
c)
Mensuração das EOAEPDs e verificação da ocorrência do efeito de supressão das EOAEPDs: o registro das EOAEPDs foi executado dentro de cabine acusticamente tratada. O aparelho utilizado foi o Otoread Clínico da marca Interacoustics/Audiotest.
Na obtenção das EOAEPDs (2F1-F2) foram utilizados dois tons puros na razão de F2/F1=1,22, onde F1 é apresentada na intensidade de 65dBNPS e F2 em 55dBNPS. Para medida das EOAEPDs foram testadas as frequências de 1500, 2000, 3000, 4000, 5000 e 6000Hz. Considerou-se as EOAEPDs presentes, quando a relação sinal/ruído foi igual ou superior a 6dB.
A captação das EOAEPDs foi realizada primeiro na ausência e, após, na presença do ruído na orelha contralateral.
Foi utilizado como estímulo acústico supressor um ruído branco contralateral gerado por um audiômetro digital de dois canais, marca Fonix, modelo FA-12, tipo I e fones auriculares tipo TDH-39P, marca Telephonics, na intensidade de 60dBNA.
A fim de evitar manipulação da sonda das EOAEPDs, o fone foi acoplado na orelha contralateral à captação das EOAEPDs antes do início do teste.
O cálculo da supressão contralateral das EOAEPDs foi obtido pela subtração do nível de resposta das EOAEPDs com estimulação acústica contralateral do nível de resposta das EOAEPDs sem estimulação acústica contralateral17. Valores negativos indicaram presença de supressão das EOAEPDs e valores positivos ou zero indicaram ausência de tal fenômeno. Quanto mais negativo o efeito de supressão, maior a atividade do sistema olivococlear medial.
Foram selecionadas as frequências de 2000, 3000, 4000, 5000 e 6000Hz para análise do efeito de supressão. Adicionalmente, foi realizada uma análise por orelha e para tal, considerou-se o efeito de supressão presente quando este se manifestou em pelo menos três das cinco frequências testadas.
d)
Testes de genotoxicidade: Dentre os testes internacionalmente aceitos para avaliar Danos ao DNA, destacam-se o teste de Genotoxicidade "Ensaio Cometa" e "Análise dos Micronúcleos"18-19. Para a execução desses testes, foi realizada coleta de material biológico (sangue periférico e esfregaço da mucosa oral), efetuada por uma farmacêutica capacitada. De posse da amostra biológica, foram realizados os dois testes de genotoxicidade.
Teste de genotoxicidade "Ensaio Cometa"O Teste Cometa foi realizado de acordo com o método proposto por Singh et al (1988)20 e modificado por Collins et al (1995)21. Para cada indivíduo foram confeccionadas lâminas em duplicata. As lâminas foram analisadas em microscópio óptico binocular da marca Olympus® modelo CX40, com magnificação de 400 vezes. Foram contadas, para cada amostra, 100 células (50 por lâmina). As cinco categorias usadas para classificação do Cometa são aquelas propostas por García (2004)22 e mostradas na Figura 1, a seguir. Com base nos resultados obtidos foi estabelecido o índice de dano ao DNA, que indica genotoxicidade obtido através da divisão do número total de núcleos que apresentaram algum dano pelo número total de núcleos sem danos ao DNA. Uma vez que foram feitas duas lâminas para cada individuo onde foram contados 50 núcleos por lâmina e que ambas as lâminas foram analisadas por dois observadores independentes, para o índice de dano foi considerado a média dos danos observados pelos dois analisadores para 100 núcleos por indivíduo. Os resultados foram anotados em protocolo padrão.
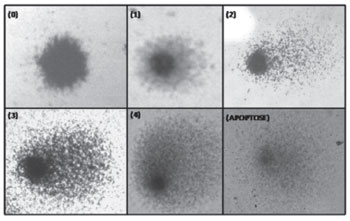
Figura 1. Classificação do Dano ao DNA dos indivíduos analisados. Quanto maior o nível de dano maior o número a ele atribuído. Classe 0 representa células sem dano e classe 4 o mais alto dano.
Presença de micronúcleos foi efetuada através da análise de células da mucosa oral. Para a coleta da amostra de células epiteliais, foi solicitado que o sujeito mordiscasse levemente as bochechas para soltura das células e em seguida realizasse raspagem com uma espátula de madeira nas bochechas. A espátula contendo material celular foi colocada pelo sujeito em um tubo de ensaio cônico, contendo de 3 a 5ml de Solução Fisiológica 0,9%NaCl resfriada a 6°C.
Em seguida, os tubos de ensaio foram centrifugados por 10 minutos a 1000RPM. Para lavagem das células, a solução fisiológica foi trocada, cuidando para que não fossem retiradas as células contidas no fundo do tubo de ensaio. A solução foi homogeneizada com as células, utilizando pipeta Pasteur e centrifugada novamente. O procedimento de lavagem das células/centrifugação foi repetido duas vezes. Em seguida, foi acrescentado 1ml de solução fisiológica, homogeneizado e distribuído em duas lâminas (500µL em cada), pois foram confeccionadas em duplicata para cada indivíduo da amostra. As lâminas secaram em temperatura ambiente. Depois, foi realizada a coloração das mesmas, utilizando o Kit Panótico de Coloração da marca Laborclin®.
Depois de seco, o material foi observado em microscópio óptico binocular da marca Olympus®, modelo CX40, com magnificação de 400x para contagem dos micronúcleos presentes e posterior análise dos dados. Foram contadas 1000 células (500 por lâmina) e os micronúcleos classificados, conforme elucidação na Figura 2. Os resultados foram anotados em protocolo padrão.
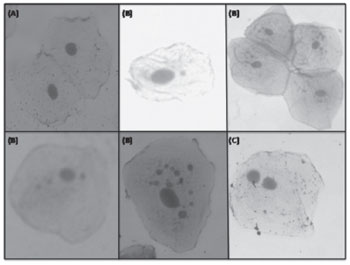
Figura 2. Teste dos Micronúcleos dos indivíduos analisados: (A) Célula sem micronúcleos; (B) Células com um ou mais micronúcleos; (C) Célula binucleada.
Após a coleta dos dados, os resultados obtidos neste estudo foram submetidos à análise estatística. Para realização dos testes foi utilizado o programa SPSS®, Versão 13.0.
Foi realizada análise paramétrica (análise de variância de uma via ou multivariada) seguida de teste
post hoc de Bonferroni quando existiam mais que três parâmetros na variável. Teste
Student t foi utilizado quando existiam somente dois parâmetros. As variáveis categóricas foram analisadas por teste do Qui-quadrado ou Exato de Fisher. Foram consideradas associações significativas aquelas cujo
p<0,05.
RESULTADOSOs voluntários participantes do estudo tinham uma idade média de 24,86±3,68 anos, sendo que eram 30 do gênero masculino e 30 do gênero feminino (N=60). Destes, 15 de cada gênero possuíam hábito de tabagismo e 15 eram não tabagistas.
Funções da via auditiva eferenteAs queixas auditivas relacionadas às funções da via auditiva eferente e a ocorrência de efeito de supressão das EOAEPDs, dos 60 indivíduos analisados no presente estudo, são apresentadas nas Tabelas 1 e 2, respectivamente.
Analisando a ocorrência de efeito de supressão das EOAEPDs por orelha (respostas presentes em pelo menos três das cinco frequências testadas), foi observado que na orelha do lado direito, 19 (31,7%) indivíduos apresentaram o efeito de supressão das EOAEPDs e 41 (68,3%) não apresentaram o mesmo efeito. Na orelha esquerda, 16 (26,7%) indivíduos apresentaram o efeito de supressão das EOAEPDs e 44 (73,3%) não apresentaram o efeito de supressão das EOAEPDs.
Foi constatada interação entre gênero e comportamento tabagista na prevalência de algumas alterações nas funções da via auditiva eferente.
Indivíduos do gênero masculino não tabagistas apresentaram menor ocorrência de efeito de supressão das EOAEPDs em 2000Hz na orelha do lado esquerdo (n=05, 33,3%) quando comparados aos tabagistas (n=12, 80%). Tal diferença foi estatisticamente significativa (
p=0,010). Em 6000Hz na orelha do lado esquerdo a presença do efeito de supressão das EOAEPDs ocorreu em 42,9% (n=6) dos indivíduos do gênero masculino tabagistas e somente em 6,7% (n=1) dos não tabagistas (
p=0,023). Nas demais frequências analisadas não ocorreram diferenças significativas entre efeito de supressão nos indivíduos do gênero masculino tabagistas e não tabagistas.
A ocorrência de dificuldade auditiva, zumbido, dificuldade de ouvir em ambiente ruidoso, dificuldade de entender a fala em grupo e desconforto a sons intensos, quando comparadas entre indivíduos do gênero masculino tabagistas e não tabagistas, não apresentaram diferenças estatisticamente significativas.
No gênero feminino, com exceção da queixa de dificuldade de ouvir em ambiente ruidoso, todos os demais parâmetros avaliados foram similares entre tabagistas e não tabagistas. Como pode ser visualizado na Figura 3, os indivíduos do gênero feminino tabagistas apresentaram maior prevalência de queixa de dificuldade de ouvir em ambiente ruidoso quando comparados aos indivíduos do gênero feminino não tabagistas.
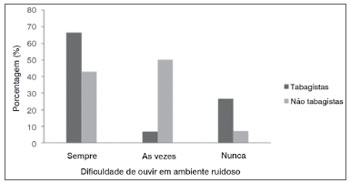
Figura 3. Queixa de dificuldade de ouvir em ambientes ruidosos em indivíduos do gênero feminino, adultos jovens, normo-ouvintes, tabagistas e não tabagistas (p=0,03).
Os indicadores de genotoxicidade considerados no estudo foram comparados entre os indivíduos do gênero masculino e feminino com e sem comportamento tabagista através de análise multivariada. Os resultados observados são descritos na Tabela 3, que apresenta os valores gerais dos indicadores de genotoxicidade, que foram: o índice de dano ao DNA estimado pelo teste Ensaio Cometa, presença de células com um micronúcleo, dois micronúcleos, três micronúcleos e presença de células com pelo menos um micronúcleo (somatório de células com micronúcleos). Para efeitos comparativos, foram utilizados somente os resultados de índice de dano ao DNA por teste Cometa e o somatório de células com pelo menos um micronúcleo.
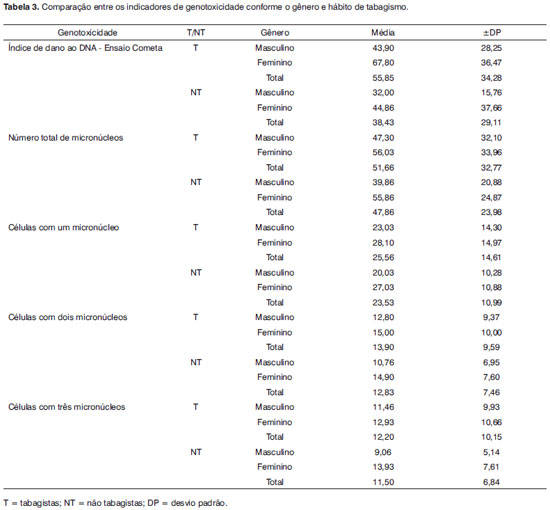
Diferente da prevalência de alterações nas funções da via auditiva eferente, não ocorreu interação entre gênero e tabagismo relacionado à genotoxicidade. Entretanto, foram observados efeitos independentes destas variáveis. No caso, indivíduos tabagistas apresentaram uma média de dano ao DNA observada pelo Ensaio Cometa significativamente maior do que indivíduos não tabagistas (
p=0,033). Também foi observado um maior índice de genotoxicidade pelo teste Ensaio Cometa nos indivíduos do gênero feminino (
p=0,025), independente de ser tabagista.
Associação entre funções da via auditiva eferente e indicadores de genotoxicidade com a influência potencial do gênero e tabagismo.
Não foram observadas associações significativas entre a ausência de efeito de supressão das EOAEPDs, queixas de dificuldade de ouvir em ambiente ruidoso, dificuldade de entender a fala em grupo e desconforto a sons intensos e genotoxicidade.
Entretanto, indivíduos com queixa de dificuldade auditiva apresentaram um índice de dano ao DNA avaliado por teste Cometa significativamente maior (64,14±44,8) do que indivíduos sem queixa de dificuldade auditiva (45,59±30,51), (
p=0,049). Este resultado foi independente do gênero e hábito de tabagismo. O autorrelato de zumbido também foi associado com maior índice de genotoxicidade (63,15±35,20) (
p=0,027). Similar ao observado para a dificuldade auditiva, não foi observada influência do gênero e tabagismo nesta associação.
DISCUSSÃOOs resultados aqui descritos mostraram que alguns indicadores das funções da via auditiva eferente avaliados no estudo são influenciados pela interação entre gênero e tabagismo. Adicionalmente, observou-se que tanto a queixa de dificuldade de audição quanto a ocorrência de zumbido possam estar associadas a maiores índices de genotoxicidade independente do gênero e hábito do tabagismo. A relevância destes resultados encontra-se no fato da população aqui estudada ainda ser de adultos jovens (18 a 32 anos) e normo-ouvintes.
Uma vez que há poucos estudos relacionados às funções da via auditiva eferente e genotoxicidade em normo-ouvintes adultos jovens, a seguir, serão discutidos em maior detalhe os resultados obtidos, a começar pelas estimativas de prevalência de alterações que foram observadas.
Para o gênero masculino, o efeito de supressão das EOAEPDs ocorreu em maior porcentagem nas frequências de 2000Hz da orelha do lado esquerdo e 6000Hz da orelha do lado direito, apenas em homens tabagistas. O fato de os tabagistas apresentarem maior ocorrência de efeito de supressão das EOAEPDs pode ser justificado por uma das substâncias encontradas no cigarro ser a nicotina. Associado a isso, uma pesquisa23, que estudou o receptor nicotínico de acetilcolina α9 e α10, relatou que recentemente essas unidades foram identificadas como componentes críticos do sistema auditivo via sistema olivococlear medial e as propriedades farmacológicas deste receptor assemelham-se a resposta colinérgica de células ciliadas externas. Conforme o autor, esse receptor desempenha um papel na mediação da resposta das fibras auditivas eferentes, pois é responsável pela inibição eferente coclear, fato que justifica em partes o achado do presente estudo. Outros autores24 também estudaram os receptores nicotínicos nas vias auditivas, investigando o papel dos mecanismos colinérgicos na propagação dos estímulos auditivos e relataram que os seus resultados são consistentes com a hipótese de que os mecanismos colinérgicos nicotínicos desempenham um papel na propagação de estímulos auditivos.
Para as demais queixas auditivas analisadas, relacionadas às funções da via auditiva eferente, não ocorreram diferenças significativas entre indivíduos do gênero masculino tabagistas e não tabagistas. Esses resultados não puderam ser comparados com outros estudos, pois não foram encontrados relatos similares a esta investigação na literatura científica indexada sobre as funções da via auditiva eferente em indivíduos tabagistas. Entretanto, é importante salientar que o tabagismo interfere na função auditiva25. O fumo pode alterar a audição através de seus efeitos sobre os processos antioxidantes ou nos vasos sanguíneos que fornecem os órgãos da audição25 e produz aumento do nível de dióxido de carbono e nicotina9. Este fato pode comprimir veias sanguíneas ou causar contração das veias e oclusões trombóticas. Existe um número consistente de estudos que sugerem fortemente ser o tabagismo um fator de risco associado à perda da audição25-29, por este motivo, é considerado importante estudar a interferência do tabagismo nas funções da via auditiva eferente.
Tabagistas do gênero feminino apresentaram predomínio de queixa de dificuldade de entender a fala em ambiente ruidoso (Figura 3). Acredita-se que esta queixa esteja relacionada com o sistema auditivo eferente2, pois esse sistema é importante na proteção contra o ruído, localização da fonte sonora e melhora na detecção da fonte sonora em ambientes ruidosos, entretanto, não foram encontrados relatos de o tabagismo interferir nesta função.
No presente estudo foi observado que os indivíduos tabagistas, independente do gênero, e as mulheres, independentes de serem tabagistas, apresentaram índices elevados de genotoxicidade, o que foi evidenciado pelas diferenças estatisticamente significativas nos índices de dano ao DNA por teste Cometa, que avalia genotoxicidade provocada por estresse oxidativo (Tabela 3). Outros estudos também evidenciaram que o tabagismo provoca aumento do estresse oxidativo, causando genotoxicidade6-8, que pode interferir nos processos celulares como replicação e transcrição, resultando em morte de células e/ou mutações celulares.
Outros autores30 também investigaram o efeito do tabagismo sobre danos oxidativos do DNA em células de sangue periférico. Utilizaram o 8-hydroxydeoxy-guanosina (8-OH-dG) como marcador. De dez voluntários saudáveis do sexo masculino com idade 20 e 22 anos, 5ml de sangue foram coletados antes e 10 minutos depois de fumar dois cigarros em 10 minutos. Após a lise das membranas das células sanguíneas de DNA isolaram leucócitos utilizando um extrator de DNA e os níveis de 8-OH-dG foram determinados por cromatografia líquida de alta eficiência com detecção eletroquímica. Os resultados demonstraram que os níveis médios de 8-OH-dG aumentaram significativamente (p<0,05) de 3,3±0,8dG para 5,1±2,5dG depois de fumar. Os autores concluíram que o tabagismo provoca danos oxidativos do DNA em células de sangue periférico em um tempo relativamente curto, corroborando os achados do presente estudo.
Na Colômbia8, similar ao presente estudo, foi estudada a genotoxicidade por exposição a tabagismo em jovens. Os autores8 avaliaram a frequência de aberrações cromossômicas em linfócitos do sangue periférico de 32 jovens tabagistas e 32 jovens não tabagistas, com idade entre 19 e 29 anos. Verificaram que a frequência de aberrações cromossômicas foi significativamente maior nos jovens tabagistas (6,02 ± 0,52) do que em não tabagistas (3,04 ± 0,50) e igualmente, confirmaram a presença de uma associação entre tabagismo e genotoxicidade.
Verificando a ocorrência de interação entre genotoxicidade e funções da via auditiva eferente, foi observado que somente os indivíduos com queixas de dificuldade da audição e zumbido, independente de gênero ou hábito de tabagismo, apresentaram maiores índices de genotoxicidade com diferenças estatisticamente significativas. As demais funções da via auditiva eferente não apresentaram associação positiva com genotoxicidade nos indivíduos analisados no presente estudo. Não foram encontrados na literatura compulsada estudos que avaliem a associação entre aspectos funcionais da via auditiva eferente e genotoxicidade provocada por estresse oxidativo, entretanto, pelo fato de o estresse oxidativo ocorrer em qualquer parte do organismo, é sugerido que também poderia estar interferindo nas funções da via auditiva eferente. Um estudo que relaciona o estresse oxidativo à audição10 sugeriu que o estresse oxidativo estaria implicado como um fator importante nos eventos cocleares, como perda auditiva neurossensorial induzida por ruído ou medicamentos ototóxicos. Apesar das espécies reativas de oxigênio, também conhecidas como radicais livres de oxigênio, serem subprodutos normais do metabolismo aeróbico celular, essas moléculas instáveis podem prejudicar lipídeos celulares, proteínas e ácidos nucleicos em DNA se o saldo de antioxidantes correspondente é perturbado. As consequências de tais rupturas podem ser detectadas bioquímica e histologicamente, e podem ser demonstradas funcionalmente. Esses autores10 observaram que cobaias expostas ao ruído, com mudança permanente do limiar auditivo, produziram danos oxidativos mensuráveis para DNA coclear.
O conjunto dos resultados aqui descritos pode ser considerado relevante, ainda que existam limitações metodológicas no estudo. Estas incluem: pequeno tamanho da amostra e ser a referida pesquisa um estudo transversal. Entretanto, estudos exploratórios iniciais, como é o caso, geralmente baseiam-se em análises com tal delineamento a fim de indicar se investigações complementares com um maior tamanho amostral e com delineamentos longitudinais ou de intervenção são necessárias. Por tal motivo, acredita-se que este trabalho possua relevância na área da saúde auditiva e seus distúrbios.
CONCLUSÕESO presente estudo sugere que em adultos jovens normo-ouvintes que referem queixas relacionadas às funções da via auditiva eferente, como zumbido e dificuldade auditiva, já é possível observar associação com estresse oxidativo, mais especificamente com genotoxicidade considerando interações entre gênero e tabagismo. Entretanto, investigações complementares que visem analisar a influência de outras variáveis em tal associação são necessárias.
REFERÊNCIAS BIBLIOGRÁFICAS1. Guinan JJJ. Olivocochlear efferents: anatomy, physiology, function, and the measurement of efferent effects in humans. Ear Hear. 2006; 27(6):589-607.
2. Breuel MLF, Sanchez TG, Bento RF. Vias auditivas eferentes e seu papel no sistema auditivo. Arq Int Otorrinolaringol.2001;5(2):62-71.
3. Fávero ML, Sanchez TG, Nascimento AF, Bento RF. A função do trato olivococlear medial em indivíduos com zumbido. Arq Int Otorrinolaringol.2003;7(4):263-7.
4. Sahley TL, Nodar RH, Musiek FE. Efferent Auditory System: structure and function. 1ª ed. San Diego: Singular publishing group;1997.p.1-23.
5. Csiszar A, Podlutsky A, Wolin MS, Losonczy G, Pacher P, Ungvari Z. Oxidative stress and accelerated vascular aging: implications for cigarette smoking. Front Biosci.2009;14:3128-44.
6. Agnez-Lima LF, Medeiros SRB, Maggi BS, Quaresma GAS. Base excision repair in sugarcane. Genet Mol Biol.2001;24(1-4):123-9.
7. Bjelland S, Seeberg E. Mutagenicity, toxicity and repair of DNA base damage induced by oxidation. Mutat Res.2003;29:37-80.
8. Arboleda-Moreno Y, Hoyos LS, Carvajal S, Sierra-Torres CH. Genotoxicidad por exposición a cigarrillos en fumadores jóvenes en Colombia. Rev Panam Salud Publica.2004;15(6):367-72.
9. Zelman S. Correlation of smoking history with hearing loss. JAMA. 1973;223:920.
10. Van Campen LE, Murphy WJ, Franks JR, Mathias PI, Toraason MA. Oxidative DNA damage is associated with intense noise exposure in the rat. Hear Res.2002;164:29-38.
11. Lloyd LL, Kaplan H. Audiometric interpretation: a manual o basic audiometry. University Park Press: Baltimore;1978.p.16-17,94.
12. Prado-Lima PAS, Chatkin JM, Taufer M, Oliveira G, Silveira E, Neto CA, et al. Polymorphism of 5HT2A serotonin receptor gene is implicated in smoking addiction. Am J M Genet Part B.2004;128B(1): 90-3.
13. Kemp DT. Stimulated acoustic emissions from within the human auditory system. J Acoust Soc Am.1978;64:1386-91.
14. Jerger J, Speacks C, Trammell J. A new approach to speech audiometry. J Speech Hear Disord.1968;33:318.
15. Jerger, J. Clinical experience with impedance audiometry. Arch Otolaryngol. 1970;92(4):311-24.
16. Jerger S, Jerger J. Alterações auditivas: uma manual para avaliação clínica. Atheneu: São Paulo;1989.p.102.
17. Durante AS, Carvallo RMM. Mudanças das emissões otoacústicas por transientes na supressão contralateral em lactentes. Pro Fono. 2006; 18(1):49-56.
18. Fenech M. The in vitro micronucleus technique. Mutat Res. 2000; 455(1-2):81-95.
19. Silva J, Erdtmann B, Henriques JAP. Genética Toxicológica. Porto Alegre: Alcance; 2003.p.422.
20. Singh NP, McCoy MT, Tice RR, Schneider EL. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res.1988;175:184-91.
21. Collins AR, Ma AG, Duthie SJ. The kinetics of repair of oxidative DNA damage (strand breaks and oxidised pyrimidines) in human cells, Mutat Res (DNA Repair).1995;336:69-77.
22. Garcia O, Mandina T, Lamadrid AI, Diaz A, Remigio A, Gonzalez Y et al. Sensitivity and variability of visual scoring in the comet assay: Results of an interlaboratory scoring exercise with the use of silver staining. Mutat Res.2004;556:25-34.
23. Lustig LR. Nicotinic acetylcholine receptor structure and function in the efferent auditory system. Anat Rec.2006;288A:424-34.
24. Harkrider AW, Hedrick MS. Acute effect of nicotine on auditory gating in smokers and non-smokers. Hear Res.2005;202:114-28.
25. Cruickshanks KJ, Klein R, Klein BEK, Wiley TL, Nondahl DM, Tweed TS. Cigarette smoking and hearing loss: the epidemiology of hearing loss study. JAMA.1998;279:1715-19.
26. Noorhassim I, Rampal KG. Multiplicative effect of smoking and age on hearing impairment. Am J Otolaryngol.1998;19:240-3.
27. Sharabi Y, Reshef-Haran I, Burstein M, Eldad A. Cigarette Smoking and Hearing Loss: Lessons from the Young Adult Periodic Examinations in Israel (YAPEIS) Database. Isr Med Assoc.2002;4:1118-20.
28. Agrawal Y, Platz EA, Niparko JK. Risk factors for hearing loss in US adults: data from the national health and nutrition examination survey, 1999 to 2002. Otol Neurotol.2009;30:139-45.
29. Oliveira DCCM, Lima MAMT. Da audiometria tonal limiar em baixa e alta frequência: comparação dos limiares auditivos entre tabagistas e não-tabagistas. Braz J Otorhinolaryngol.2009;75(5):738-44.
30. Kiyosawa H, Suko M, Okudaira H, Murata K, Miyamoto T, Chung MH, et al. Cigarette Smoking Induces Formation of 8-Hydroxydeoxyguanosine, One of the Oxidative DNA Damages in Human Peripheral Leukocytes. Free Radic Res Commun.1990;11(1): 23-7.
1. Mestre em Distúrbios da Comunicação Humana pela Universidade Federal de Santa Maria, Fonoaudióloga.
2. Mestre em Distúrbios da Comunicação Humana pela Universidade Federal de Santa Maria. Fonoaudióloga.
3. Doutora em Distúrbios da Comunicação Humana pela Universidade Federal de São Paulo. Professor Associado do Curso de Fonoaudiologia da Universidade Federal de Santa Maria.
4. Pós-doutorado em Demografia do Envelhecimento, University of California-EUA, Professora Adjunta da Universidade Federal de Santa Maria.
5. Doutor em Medicina Veterinária pela Universidade Federal de Santa Maria, Professor Titular do Departamento de Morfologia da Universidade Federal de Santa Maria.
Universidade Federal de Santa Maria.
Endereço para correspondência:
Andressa Boer Fronza
Av. Getúlio Vargas 1735 Centro
Doutor Maurício Cardoso RS 95925-000.
Tel.: 55 9961-6616/ 55 3534-1241
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 10 de março de 2010. cod. 6960
Artigo aceito em 29 de maio de 2010.


