INTRODUÇÃOUma das mais importantes disfunções da glândula tireoidea é o hipotireoidismo (congênito ou adquirido) no qual a produção ou a função dos hormônios tireoidianos está comprometida, resultando em redução generalizada no metabolismo de todos os sistemas. O hipotireoidismo afeta 2% das mulheres adultas e 0,2% dos homens1-3.
A diminuição da acuidade auditiva tem sido associada à disfunção da glândula tireoidea e descrita por diversos autores. Ritter, em 1974, salientou que a perda auditiva pode ser a manifestação otorrinolaringológica mais comum do hipotireoidismo congênito e adquirido, e os sintomas auditivos podem ocorrer isoladamente ou associados à vertigem e ao zumbido4. A real incidência de perda auditiva em pacientes com hipotireoidismo ainda é incerta, podendo afetar 25% dos pacientes com hipotireoidismo adquirido e 35-50% dos pacientes com hipotireoidismo congênito5,6. Os mecanismos fisiopatológicos da perda auditiva no hipotireoidismo não estão totalmente estabelecidos. Sabe-se que nesta desordem hormonal, há redução na produção de energia celular, comprometendo a microcirculação e, consequentemente a oxigenação e o metabolismo de órgãos envolvidos. As estruturas da orelha interna também são afetadas, como a estria vascular e o Órgão de Corti7. Os hormônios tireoidianos controlam a síntese de proteínas, a produção de mielina e das enzimas e o nível dos lipídios no sistema nervoso central. Além disso, o T4, por si só, pode agir como um neurotransmissor. Assim, acredita-se que no hipotireoidismo, a deficiência auditiva possa ter origem na cóclea, retrococlear e/ou nas vias auditivas centrais8.
Pesquisas experimentais têm tentado determinar os locais comprometidos das vias auditivas no hipotireoidismo. Saito et al.9, em pesquisa experimental em cães, constataram redução no número de células neuronais no córtex cerebral e alterações estruturais no labirinto membranoso e na porção petrosa do osso temporal. Assim, à semelhança do que acontece no diabetes melito, a deficiência auditiva no hipotireoidismo parece envolver inúmeras estruturas10-12.
Os exames de audiometria tonal liminar, imitanciometria e métodos eletrofisiológicas, como potenciais evocados auditivos do tronco encefálico (PEATE), e emissões otoacústicas (EOAT) têm sido utilizados para avaliação auditiva dos pacientes com hipotireoidismo. Os resultados dessas avaliações auditivas, tanto clínicas como experimentais, não são homogêneos. Os estudos de Ben-Tovim et al.5, em ratos, e os de Rubinstein et al.13, em suínos, ambos com hipotireoidismo induzido experimentalmente, demonstraram alterações na amplitude e na latência dos potenciais auditivos eletrofisiológicos, sendo reversíveis após o tratamento com reposição do hormônio tireoidiano. Segundo Ben-Tovim et al.5, as alterações constatadas no PEATE estão diretamente associadas aos níveis séricos de T4 livre. Himelfarb et al.14 constataram queda significativa nos limiares audiométricos e alterações no PEATE em pacientes com disfunção da glândula tireoidea e salientaram a associação estatisticamente significativa entre a perda auditiva e os baixos níveis do T4 livre. De forma semelhante, Anand et al.15 detectaram redução dos limiares audiométricos e alterações no PEATE em 16 pacientes (de um total de 20 pacientes) com hipotireoidismo sem tratamento. Após o tratamento de reposição hormonal por um período de 3,7 meses, os autores registraram melhora expressiva nos limiares audiométricos, no entanto, os resultados do PEATE mantiveram-se alterados, sendo detectada redução da amplitude das latências absolutas das ondas I, III e V e aumento na latência absoluta da onda V e dos interpicos LI-III e L I-V.
Di Lorenzo et al.8, analisando os potenciais evocados auditivos de pacientes com hipertireoidismo e hipotireoidismo, antes e após a terapia de reposição hormonal, observaram que 25% dos pacientes com hipotireoidismo apresentavam alterações no PEATE, representadas pela diferença interauricular superior a 0,2ms, aumento na latência absoluta da onda V e dos interpicos LIII-V e LI-V. Essas alterações se mantiveram mesmo depois de 6 a 12 meses de terapia de reposição hormonal, questionando-se o caráter reversível da deficiência auditiva nestes pacientes.
No hipotireoidismo subclínico, os resultados também são controversos. Ozata et al.12 não observaram alterações nos PEATE em 20 de seus pacientes. Por outro lado, Figueiredo et al.16 avaliaram 23 pacientes na condição subclínica da doença e encontraram diferenças expressivas nas latências absolutas das ondas III e V, e dos interpicos LI-III, LIII-V e LI-V.
A pesquisa das emissões otoacústicas é um método eletrofisiológico rápido e confiável. Tem se mostrado útil no estudo de doenças cocleares, bem como na avaliação da audição em pacientes com distúrbios metabólicos. Khechinaschvili et al.17, avaliando a acuidade auditiva de 50 pacientes com hipotireoidismo, constataram que as emissões otoacústicas estavam ausentes em alguns pacientes que apresentaram limiares audiométricos normais. Registraram também alterações no PEATE em 30% dos pacientes, sugerindo que o comprometimento auditivo em pacientes com hipotireoidismo possa ser multissetorial.
Pelo exposto, observa-se que os resultados das avaliações audiológicas em pacientes com hipotireoidismo são conflitantes, tornando-se necessário ampliar os estudos nessa linha de pesquisa. Assim, o objetivo do presente estudo foi avaliar a acuidade auditiva de pacientes portadores de hipotireoidismo adquirido, utilizando-se audiometria tonal limiar, pesquisa dos potenciais auditivos do tronco encefálico e pesquisa das emissões otoacústicas transientes.
MATERIAL E MÉTODOSEste estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos da Universidade onde a pesquisa foi realizada (protocolo número 2023/2006). Foram compostos dois grupos de estudo: o grupo de hipotireoidismo (GH), composto por 30 pacientes portadores de hipotireoidismo adquirido, confirmado por exames clínicos e laboratoriais, e o grupo controle (GC), composto por 30 voluntários sem doença da glândula tireoidea e pertencente à faixa etária correspondente, sendo submetidos à mesma sequência de avaliação utilizada no grupo de amostral. Foram adotados os seguintes critérios de exclusão: possuir idade superior a 60 anos, ter sido submetido à cirurgia otológica previamente, possuir exame de otoscopia alterado, trabalhar em ambiente ruidoso ou possuir exame audiométrico compatível com perda auditiva induzida por ruído, possuir audiometria com perda auditiva do tipo condutiva ou curva timpanométrica do tipo B ou C, relatar uso de medicamentos ototóxicos, relatar antecedentes de surdez familiar, relatar perda auditiva desde a infância ou ser portador de síndrome genética.
Os parâmetros clínicos investigados foram: idade, tempo de diagnóstico do hipotireoidismo, sintomas auditivos e/ou vestibulares, resultados de exames bioquímicos (glicemia de jejum, triglicérides, colesterol total) e exames hormonais (TSH, T4 livre). Para esses parâmetros foram considerados normais os seguintes valores: T4 livre e TSH, entre 0,8-1,9ng/dL e 0,4-4,0mUI/mL, respectivamente; glicemia em jejum entre 70 e 99mg/dL; colesterol total inferior a 200mg/dL; triglicérides abaixo de 150mg/dL.
Para as avaliações auditivas foram realizados os seguintes testes: audiometria tonal liminar (audiômetro Amplaid, modelo A321, Itália), Imitanciometria (imitanciômetro Amplaid, modelo 775, Itália), Pesquisa das Emissões Otoacústicas Transientes - EOAT (ILO 288 Echoport, OtodynamicLtda, Inglaterra) e Pesquisa dos Potenciais Evocados Auditivos do Tronco Encefálico - PEATE (equipamento Nihon Koden, modelo Neuropack MEB 7102 k, Japão).
Os resultados audiométricos foram classificados quanto ao tipo e o grau. Quanto ao tipo, as perdas foram classificadas em: condutiva (limiares da via aérea superiores a 25dB e os limiares de via óssea normais, com gap aéreo-ósseo); mista (limiares tanto de via área como de via óssea superiores a 25dB, com gap aéreo-ósseo) e sensório-neural (limiares de via aérea e via óssea superiores a 25dB, sem gap aéreo-ósseo). Os pacientes com perdas condutivas ou mistas foram excluídos da pesquisa. Quanto ao grau, as perdas auditivas foram classificadas em: leve (limiares entre 26 a 40dB); moderada (limiares entre 41 a 70dB); severa (limiares entre 71 a 90dB) e profunda (limiares acima de 91dB).
Foram incluídos na pesquisa apenas indivíduos com curvas timpanométricas tipo A. Os critérios utilizados para classificar EOAT como presentes ou ausentes foram: reprodutibilidade de sinal acima de 50% e amplitude do sinal da resposta de 3 dB NPS acima do espectro de ruído em duas ou mais frequências. No estudo dos potenciais evocados de tronco encefálico (PEATE) foi utilizado estímulo monoaural através de cliques filtrados (entre 300 e 4.000Hz), com duração de 0,1 milissegundos, frequência de 17 cliques por segundo e polaridade rarefeita. A intensidade do estímulo foi de 90dBNPS, sendo utilizados 2.000 cliques, em tempo de análise 10ms, mantendo-se a impedância dos eletrodos abaixo de 5Kohms.
Na metodologia estatística, para o estudo das associações entre as variáveis e comparação das proporções entre os grupos, foi utilizado o teste qui-quadrado, o teste exato de Fisher e o teste de Goodman. Na comparação dos atributos com distribuição normal foi utilizado o teste t de Student, considerando-se nível de significância de 5%.
RESULTADOSTodos os participantes do estudo eram do sexo feminino, 70% dos pacientes possuíam hipotireoidismo secundário à tireoidite de Hashimoto. Em ambos os grupos, houve predomínio da faixa etária entre 31 e 50 anos sobre as demais faixas etárias (p<0,05). A maioria dos pacientes com hipotireoidismo (60%) conhecia o diagnóstico da doença há menos de cinco anos. O hipotireoidismo subclínico, no qual os valores de TSH estão alterados, mantendo-se os valores normais de T4 livre, foi observado em 50% dos pacientes com hipotireoidismo. Entre os demais diagnósticos etiológicos de hipotireoidismo, destacaram-se a tireoidectomia total ou parcial e a origem idiopática.
A maioria dos participantes com hipotireoidismo não apresentava co-morbidades (53,34%; p<0,05). Depressão foi diagnosticada em 26,66% dos demais pacientes e hipertensão em 13,34
Sintomas cócleo-vestibulares foram relatados por participantes de ambos os grupos, porém foram mais frequentes nos pacientes com hipotireoidismo (p<0,05), destacando-se a perda da audição (13,33%), o zumbido (16,67%) e a vertigem (3,33%). Ressalta-se que 26,67% desses pacientes apresentavam os três sintomas associados (Tabela 1). A maioria dos pacientes do grupo controle não relatava sintomas cócleo-vestibulares (73,33%).
Na análise comparativa dos resultados dos exames bioquímicos (glicemia de jejum, triglicérides, colesterol total) dos participantes de ambos os grupos, não foi observada diferença estatisticamente significativa (p>0,05). Diabetes melito não foi diagnosticada em nenhum dos participantes. Tabelas 2,3 e 4. Níveis elevados de TSH foram observados apenas nos pacientes com hipotireoidismo, sendo que e 50% deles apresentavam também níveis reduzidos de T4 livre.
Limiares audiométricos elevados foram registrados em 22 orelhas (36,67%) dos pacientes com hipotireoidismo e em apenas sete orelhas (11,67%) dos pacientes do grupo controle (p<0,05), havendo predomínio de perda auditiva leve/moderada e sensorioneural nos dois grupos (Figura 1). Não houve relação significativa entre os limiares audiométricos alterados e os níveis séricos de glicemia, triglicérides, colesterol total, TSH e T4 livre (p>0,05).
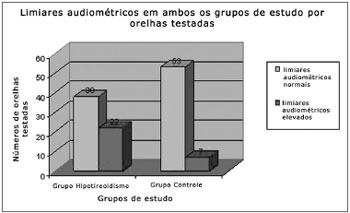
Figura 1. Limiares audiométricos em ambos os grupos de estudo por orelhas testadas.
A pesquisa dos potenciais evocados auditivos do tronco encefálico (PEATE) mostrou-se alterada em 10 orelhas de pacientes com hipotireoidismo e em nenhum dos participantes do grupo controle (p<0,05). Os valores médios das latências absolutas de L-V mostraram-se estatisticamente mais elevados no grupo com hipotireoidismo (p<0,05)(Tabela 5). Os demais parâmetros do PEATE apresentaram comportamento semelhante em ambos os grupos.
As emissões otoacústicas evocadas transientes estavam ausentes em número maior de pacientes com hipotireoidismo (20%) quando comparado ao grupo controle (6,67%)(p<0,05). As amplitudes das emissões otoacústicas transientes (EOAT) foram também menores nos pacientes com hipotireoidismo (p<0,05). Em ambos os grupos, os valores de amplitude das emissões estiveram mais rebaixados nas frequências mais elevadas (Tabela 6).
DISCUSSÃONeste estudo, nos pacientes com hipotireoidismo adquirido, a tireoidite de Hashimoto representou a principal causa (70%), resultado este já esperado por se tratar da principal causa de hipotireoidismo do tipo auto-imune, no qual o parênquima glandular é invadido por infiltrado linfoplasmocitário, produzindo anticorpos contra a própria glândula18. Ressaltamos que 50% dos pacientes tinham o diagnóstico de hipotireoidismo subclínico, caracterizado por concentrações séricas normais de T4 livre e níveis elevados de TSH. No hipotireoidismo subclínico, a tireoidite de Hashimoto é também a principal causa, correspondendo a 50-80% dos casos1,2,12,18,19.
Em relação aos valores de TSH e T4 livre, observou-se que todos os pacientes com hipotireoidismo apresentavam valores séricos alterados de TSH. Deve-se considerar o fato de que todos esses pacientes eram acompanhados periodicamente nos ambulatórios de endocrinologia, estavam em terapia de reposição hormonal, e mesmo assim apresentavam níveis alterados de TSH, com ou sem alteração dos níveis de T4 livre.
A análise dos sintomas cócleo-vestibulares demonstrou que aproximadamente 73% dos voluntários do grupo controle não apresentavam sintomas nessa esfera, porém alguns deles referiam sintomas isolados de zumbido, à semelhança dos pacientes portadores de hipotireoidismo. O zumbido é frequente na população geral, afetando de 35 a 40% dos indivíduos adultos, e apresenta múltiplas causas. Sintomas associados de zumbido, vertigem e hipoacusia foram relatados por 26,67% dos pacientes com hipotireoidismo, indicando possível comprometimento conjunto dos sistemas coclear e vestibular. Sintomas cócleo-vestibulares associados às doenças metabólicas são relativamente frequentes, apresentam curso crônico e caráter permanente20-23.
Limiares audiométricos elevados foram registrados em um grupo maior de pacientes com hipotireoidismo (22 orelhas) do que nos participantes do grupo controle, e na maioria deles, predominou a perda auditiva do tipo neurossensorial de leve a moderada intensidade e bilateral. A fisiopatologia do envolvimento auditivo nos distúrbios metabólicos tem sido tema de várias pesquisas. Os autores consideram que vários sítios das vias auditivas estão envolvidos nesse processo, podendo haver comprometimento das estruturas endococleares, retrococleares e central11,17.
Neste estudo, as co-morbidades mais prevalentes foram depressão (26,66%) e hipertensão (13,34%). A maior prevalência de hipertensão nos indivíduos com hipotireoidismo foi reportada previamente por Kotsis et al.24 que registraram níveis mais elevados de pressão arterial sistólica no grupo de pacientes com hipotireoidismo, quando comparado ao grupo controle. Sabe-se que a hipertensão é um importante fator predisponente ao comprometimento da audição, por afetar as estruturas do ducto coclear, em especial a estria vascular, sensível às variações pressóricas.
Outros importantes co-fatores riscos para a perda auditiva são as alterações nos exames bioquímicos. Neste estudo, com relação à glicemia de jejum, observou-se que 40% dos pacientes com hipotireoidismo tinham níveis moderadamente elevados de glicemia de jejum (entre 100 e 125mg/dL), entretanto, nenhum paciente possuía o diagnóstico de diabetes. Provavelmente, esses níveis glicêmicos, discretamente alterados, não determinaram alterações auditivas. No entanto, salientamos a necessidade de um estudo mais aprofundado sobre o metabolismo de carboidratos para melhor interpretação dos resultados, como o teste de tolerância à glicose e a curva insulinêmica, pois a literatura é farta em publicações que demonstram a alta incidência de sintomas cócleo-vertibulares e diminuição da audição em pacientes diabéticos22,23.
Os distúrbios do metabolismo dos lipídios podem também causar sintomas cócleo-vestibulares e comprometer as estruturas da orelha interna. Em pesquisa clínica, Karlidag et al.25 realizaram audiometria tonal em 274 pacientes com deslipidemia e em 60 indivíduos saudáveis, observando limiares audiométricos mais elevados em pacientes com alterações lipídicas. Analisando os resultados deste estudo, observa-se que os níveis séricos de triglicérides e de colesterol total foram ligeiramente mais elevados em ambos os grupos, e provavelmente não tiveram relação com os exames audiológicos alterados.
Ao analisarmos os pacientes com exames audiométricos alterados observamos que 75% deles apresentaram valores de TSH entre 4 e 30mUI/mL e em apenas em alguns casos os níveis séricos do TSH estavam muito elevados. Exames audiométricos alterados foram também registrados em pacientes com níveis adequados de T4 livre. Assim, os limiares audiométricos não parecem ter relação com os índices séricos desses hormônios.
Valores alterados do PEATE foram registrados em 10 orelhas dos pacientes com hipotireoidismo, com latências absolutas das ondas I,III e V superiores aos do grupo controle, porém apenas os valores de L-V determinaram diferença estatística (p<0,05). O diagnóstico das lesões retrococleares no hipotireoidismo já havia sido destacado por Anand et al.15 em 80% dos seus pacientes com distúrbios hormonais, sendo esse índice muito superior ao observado no presente estudo. Importantes alterações PEATE foram também observadas por Figueiredo et al.16 em pacientes com hipotireoidismo subclínico, destacando o aumento da latência absoluta da onda I e da onda V, bem como dos interpicos LI-III, LIII-V e LI-V.
As emissões otoacústicas transientes estavam ausentes em um maior número de pacientes com hipotireoidismo. Na interpretação dos resultados das emissões otoacústicas, é importante avaliar não apenas a presença ou ausência do traçado, mas também a amplitude da resposta. Estas estiveram sistematicamente reduzidas em todas as frequências analisadas no grupo de pacientes com hipotireoidismo, quando comparadas às do grupo controle.
CONCLUSÕESSintomas cócleo-vestibulares foram mais frequentes em pacientes com hipotireoidismo, salientando-se o zumbido, a hipoacusia e a vertigem. Pacientes com hipotireoidismo apresentaram maior número de alterações nas avaliações audiométricas e nos testes eletrofisiológicos (PEATE e EOAT). A perda auditiva foi do tipo neurossensorial, de leve a moderada intensidade e bilateral. No PEATE, o aumento da latência absoluta de L-V foi a alteração mais significativa. Emissões otoacústicas ausentes ou com amplitudes mais baixas foram mais frequentes nos pacientes com hipotireoidismo. As alterações audiológicas não apresentaram relação com os níveis séricos do TSH ou T4 livre.
REFERÊNCIAS BIBLIOGRÁFICAS1. Freitas MC, Lima LHC. Diagnóstico e tratamento do hipotireoidismo. In_ Vilar L, editor. Endocrinologia Clínica. Guanabara Koogan; 2006.p.219-30.
2. Jaime JC. Auto-imunidade endócrina. In: Greenspan FS & Gardner DG, editores. Endocrinologia Básica e Clínica. 7ª edição. Rio de Janeiro: McGraw-Hill Interamericana do Brasil; 2006.p.71-87.
3. Molina PE. Glândula tireóide. In: Molina PE, Editora. Fisiologia endócrina. 2ª. Edição. São Paulo: McGraw-Hill Interamericana do Brasil; 2007.p.69-94.
4. Ritter FN. The effects of hypothyroidism upon the ear, nose and throat. Laryngoscope. 1967;77:1427-79.
5. Ben-Tovim R, Zohar Y, Laurian N, Laurian L, Zohiar S. Auditory brain stem response in experimentally induced hypothyroidism in albino rats. Laryngoscope. 1985;95:982-6.
6. Vanasse M, Fisher C, Berthezene F, Roux Y, Volman G, Mornex R. Normal brainstem auditory evoked potentials in adult hypothyroidism. Laryngoscope. 1989;99:302-6.
7. Oliveira JAA. Fisiologia da Audição - Cóclea ativa In: Figueiredo MS. Emissões Otoacústicas e BERA. São José dos Campos: Pulso Editorial; 2003.p.1-34.
8. Di Lorenzo L, Foggia L, Panza N, Calabrese MR, Motta G, Tranchino G, et al. Auditory brainstem response in thyroid diseases before and after therapy. Horm Res. 1995;43:200-5.
9. Saito T, Sato K, Saito H. An experimental study of auditory dysfunction associated with hyperlipoproteinemia. Arch Otorhinolaryngol. 1986;243(4):242-5.
10. Lareau E, Vanasse M, Hebert R, Letarte J, Glorieux J, Desjardins M, et al. Somatosensory evoked potentials and auditory brain-stem responses in congenital hypothyroidism. A longitudinal study before and after treatment in six infants detected in the neonatal period. Electroencephalogr Clin Neurophysiol. 1986;64:501-10.
11. Meyherhoff WL. Hypothyroidism and the ear: Electrophysiological, morphological and chemical considerations. Laryngoscope. 1979;89:1-25.
12. Ozata M, Ozkardes A, Corakci A, Gundogan MA. Subclinical hypothyroidism does not lead to alterations either in peripheral nerves or in brainstem auditory evoked potentials (BAEPs). Thyroid. 1995;5:201-5.
13. Rubinstein M, Perlstein TP, Hildesheimer, M. Cochlear action potentials in experimentally induced hypothyroidism in guinea pigs. Acta Otolaryngol. 1975;79 suppl 331:1-10.
14. Himelfarb MZ, Lakretz T, Gold S, Shanon E. Auditory brain stem responses in thyroid dysfunction. J Laryngol Otol. 1981;95:679-86.
15. Anand VT, Mann SBS, Dash RJ, Mehra YN. Auditory investigations in hypothyroidism. Acta Otolaryngol. (Stockh) 1989;108:83-7.
16. Figueiredo LCMS, Lima MAMT, Vaisman M. Alterações na audiometria de tronco encefálico em mulheres adultas com hipotireoidismo subclínico. Rev Bras Otorrinolaringol. 2003;69:542-47.
17. Khechinaschvili S, Metreveli D, Svanidze N, Knothe J, Kevanishvili Z. The hearing system under thyroid hipofunction. Georgia Med News. 2007;144:30-3.
18. Azevedo M, Sales B, Maia L, Leal E. Interpretação dos Testes de função tireoideana. In: Vilar L, editor. Endocrinologia Clínica. 3 ª. Edição. Rio de Janeiro: Guanabara Koogan; 2006.p.219-30.
19. Papi G, Uberti ED, Betterle C, Carani C, Pearce PT, Braverman LE, Roti E. Subclinical hypothyroidism. Curr Opin Endocrinol Diabetes Obes. 2007;14:197-208.
20. Sanchez TG, Medeiros IR, Levy CP, Ramalho JDA R, Bento RF. Tinnitus in normally hearing patients: clinical aspects and repercussions. Braz J Otorhinolaryngol. 2005;71:427-31.
21. Ganança MM, Caovilla HH, Ganança FF, Serafini F. Dietary management for tinnitus control in patients with hyperinsulinemia. A Retrospective Study. Int Tinnitus J. 1995;1(1):41-5.
22. Lisowska G, Namystowski G, Morawski K, Strojek K. Otoacoustic emissions and auditory brain stem responses in insulin dependent diabetic patients. Otolaryngol Pol. 2002;56:217-25.
23. Pessin AB, Martins RH, Pimenta Wde P, Simões AC, Marsiglia A, Amaral AV. Auditory evaluation in patients with type 1 diabetes. Ann Otol Rhinol Laryngol. 2008;117:366-70.
24. Kotsis V, Alevizaki M, Stabouli S, Pitiriga V, Rizos Z, Sion M, et al. Hypertension and hypothyroidism: results from an ambulatory blood pressure monitoring study. J Hypertens. 2007;25:993-9.
25. Karlidag T, Açik Y, Kaygusuz I, Yalçin S, Gungor MY, Demirbãrg E. The effect of hyperlipidemia on hearing function. Kulak Burun Bogaz Ihtis Derg. 2002;9:112-6.
1. Fonoaudiólogo e Pós-Graduando do Curso de Bases Gerais da Cirurgia da Faculdade de Medicina -Unesp- Botucatu.
2. Médico Otorrinolaringologista da Disciplina de Otorrinolaringologia, Doutor em Cirurgia, Faculdade de Medicina - Unesp- Botucatu.
3. Professora Doutora da Disciplina de Endocrinologia da Faculdade de Medicina de Botucatu.
4. Professora Doutora do Departamento de Bioestatística do Instituto de Biociências -Unesp-Botucatu.
5. Acadêmico do Curso de Medicina -Unesp- Botucatu.
6. Professora Livre Docente da Faculdade de Medicina de Botucatu - Unesp. Responsável pelo ambulatório de foniatria e voz.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 9 de setembro de 2009. cod. 6627
Artigo aceito em 20 de novembro de 2009


