INTRODUÇÃOO carcinoma da nasofaringe (NPC) apresenta uma distribuição geográfica e étnica distinta da dos restantes tumores da cabeça e pescoço. No ano de 2000, foram registados 64 798 casos em todo o mundo, sendo mais de 80% destes casos reportados aos países asiáticos, principalmente a China e restantes nações do sudeste da Ásia1. Globalmente é uma doença rara, com uma incidência inferior a 1/100000 indivíduos por ano em indivíduos caucasianos da América do Norte e países ocidentais. A incidência mais elevada é encontrada no Sul da China (25-30/100000 indivíduos por ano), especialmente na região de Cantão.
O NPC constitui um tipo distinto de cancro da cabeça e pescoço. A Organização Mundial de Saúde (OMS) distingue 3 tipos histológicos do NPC baseados no grau de diferenciação. O Tipo I diz respeito aos carcinomas epidermoides queratinizantes, o Tipo II aos não-queratinizantes e o Tipo III aos carcinomas indiferenciados, também denominados de linfoepiteliomas, caracterizados por um infiltrado linfocítico proeminente. Esta interacção entre células tumorais e linfócitos parece ser crucial para a propagação contínua do componente maligno dos carcinomas do Tipo III2. Destes, as variantes II e III são as mais frequentes e apresentam características etiológicas comuns, ligadas à infecção pelo vírus Epstein-Barr (EBV). Primeiramente descrito por Epstein e Barr em 19643, o EBV é um Gamma Herpesvírus do género dos Linfocriptovírus, taxonomicamente denominado Vírus Herpes Humano 4, sendo o homem o seu hospedeiro natural exclusivo.
A infecção primária é habitualmente adquirida na infância e 95% dos adultos são portadores do vírus, já que este persiste na forma latente nos linfócitos B do hospedeiro. O vírus é o agente responsável pela Mononucleose Infecciosa e é também reconhecida a sua associação com o Linfoma de Burkitt e com o NPC4. A taxa de endemicidade para o vírus Epstein-Barr varia conforme a região geográfica, sendo extremamente elevada no Norte da África (Algéria e Tunísia) e China e extremamente baixa no Norte da Europa (Dinamarca e Holanda)5.
Os tumores da nasofaringe são constituídos por células neoplásicas derivadas do epitélio não queratinizante com um infiltrado linfocitário do estroma e apresentam um prognóstico reservado entre os tumores malignos da cabeça e pescoço. Estudos publicados demonstram que a infecção por EBV nas células epiteliais da nasofaringe ocorre antes da expansão clonal da população de células tumorais6. Estudos em tecidos normais da nasofaringe e em biopsias de tecido pré-maligno demonstram a presença de alterações genéticas numa fase precoce da carcinogénese, indicando que a infecção estável das células epiteliais pelo EBV requer um ambiente celular alterado5.
Têm sido publicados vários estudos acerca dainfecção por EBV e o desenvolvimento de carcinoma da nasofaringe7. As prevalências dos tipos histológicos são diferentes em regiões endémicas e não endémicas. Nas áreas endémicas, o Tipo III representa mais de 97% dos casos, enquanto que o tipo queratinizante é mais comum nos países ocidentais (~75%)2. Para além das diferenças nas características histológicas, a infecção latente pelo vírus Epstein-Barr está presente em quase todos os casos de NPC nas regiões endémicas, mas normalmente ausente nos carcinomas do Tipo I, mais comuns em regiões não-endémicas8.
Um estudo hospitalar anteriormente publicado pelo nosso grupo demonstrou que ao contrário do que se observa nos outros países ocidentais, a prevalência de carcinomas dos Tipo II e III no Norte de Portugal era superior à frequência dos restantes grupos, com uma percentagem de 93.75% de carcinomas não-queratinizantes e apenas 6.25% de carcinomas queratinizantes, num total de 350 doentes analisados9.
O objectivo deste estudo consistiu na detecção do vírus Epstein-Barr em tecido tumoral da nasofaringe e sangue periférico de doentes com carcinoma da nasofaringe e em indivíduos saudáveis, provenientes duma área não-endémica, de baixo risco.
MATERIAL E MÉTODOSSelecção dos casosFoi efectuada uma revisão dos casos de carcinoma da nasofaringe que deram entrada no Serviço de Otorrinolaringologia do Instituto.
Foram estudados 43 casos com fragmentos incluídos em blocos de parafina, dos quais foi possível a análise da presença do EBV em 19 casos de carcinoma indiferenciado da nasofaringe (10 homens e 9 mulheres)(idades compreendidas entre 13 e 86 anos). Foram também incluídas no estudo 17 biópsias de tecido tumoral da nasofaringe e amostras de sangue periférico provenientes de 32 doentes com carcinoma indiferenciado da nasofaringe (idades compreendidas entre 20 e 71 anos) e 45 amostras de dadores de sangue sem doença oncológica conhecida idades compreendidas entre 18 e 64 anos).
Extracção e purificação de DNAO DNA viral nas amostras de blocos de parafina foi extraído através de uma digestão enzimática, usando 200ml de um tampão de digestão (TrisHCL 10mM, KCl 50mM, MgCl2 2.5mM, 0.5% Tween 20). Os tubos foram incubados durante a noite a 37ºC, sendo a lise interrompida pela incubação a 95ºC durante 10 min. O DNA obtido foi purificado pelo método fenol-clorofórmio e ressuspenso em 50ml de água bidestilada. As amostras foram congeladas a -20ºC para uso posterior.
Relativamente às amostras de sangue periférico, foram recolhidos 5ml de sangue periférico de cada doente para um tubo com EDTA para o isolamento de plasma. As amostras foram centrifugadas a 1600 x g e o plasma foi cuidadosamente removido dos tubos com EDTA e transferido para tubos de polipropileno. As amostras foram armazenadas a -20ºC até serem processadas. O DNA das amostras de plasma foi extraído através do kit comercial Qiagen Blood mini kit (Qiagen). O protocolo utilizado seguiu os passos recomendados pelo fabricante. Foram utilizados 200µL de plasma para a extracção do DNA por colunas.
A extracção do DNA a partir de amostras de biópsias da nasofaringe foi efectuada a partir de tecido fresco, recorrendo ao kit comercial QIAamp Tissue Kit (Qiagen), utilizando o protocolo recomendado pelo fabricante.
Análise da presença de EBV no tecido tumoral em amostras de blocos de parafinaA amplificação do DNA viral foi realizada através do método nested PCR, utilizando os seguintes primers (DE 5' PARA 3'): E3-44mer: GCGGGTGGAGGGAAAGG; E5-25mer: GTCAGCCAAGGGACGCG; E3-2PCR: GCCACCTGGCAGCCCTAAAG e E5-2PCR: AGGCTGCCCACCCTGAGGAT. Os primers E3-44mer e E5-25mer foram utilizados na primeira reacção de PCR, sendo seguida de outra reacção de PCR com os primers E3-2PCR e E5-2PCR, tendo o produto final um peso de 184pb. As reacções de PCR foram realizadas num termociclador programável (Biometra), juntando a cada tubo de PCR 2ml de DNA a uma mistura constituída por: tampão 1X, 1.5mM de MgCl2, 0.2mM de dNTPs, 0.5mM de cada primer e 1U de Taq polymerase. As condições da primeira reacção de PCR foram as seguintes: desnaturação inicial a 94°C durante 5min; 40 ciclos de 30s a 94ºC, 30s a 57ºC e 1min a 72ºC, e um passo de extensão final de 7min a 72ºC. Dois ml dos produtos obtidos na primeira reacção foram sujeitos a uma segunda PCR. Os parâmetros da segunda reacção foram idênticos aos da primeira, excepto a temperatura de annealing que passou de 57ºC para 50ºC. Foi efectuada electroforese em gel de agarose a 3% (p/v) corado com brometo de etídeo e visualizado sob luz ultra-violeta.
Análise da presença de EBV no tecido tumoral de biopsias e sangue periféricoA detecção do EBV nas amostras de tecido fresco e sangue periférico foi realizada através da metodologia de PCR em tempo-real. Os primers de PCR foram seleccionados de modo a emparelharem com a região BALF5 do genoma viral que codifica a DNA polimerase viral. As sequências dos primers forward e reverse foram, respectivamente: 5'- CGGAAGCCCTCTGGACTTC- 3' e 5'- CCCTGTTTATCCGATGGAATG - 3'. Foi utilizada uma sonda fluorogénica (VIC5'- TGTACACGCACGAGAAATGCGCC -3'TAMRA) com uma sequência localizada entre os primers do PCR, sintetizada pela PE Applied Biosystems (Foster city, Calif.). A reacção de PCR foi realizada usando o kit de PCR Taq-Man (PE Applied Biosystems). Resumindo, 2.5µL de solução de extracção de DNA a partir de 200µL de plasma foram adicionados a uma mistura de PCR contendo 10mM de Tris (pH 8.3), 50mM de KCl, 10mM de EDTA, 5mM de MgCl2, 100µM de dATP, dCTP, dGTP e dTTP, 0.2µM de cada primer, 0.1µM da sonda e 1.25U da AmpliTaq Gold (PE Applied Biosystems). Seguiu-se a amplificação, começando com um ciclo a 50ºC durante 2min., a activação da AmpliTaq Gold durante 10 min. a 95ºC, 47 ciclos de 15 seg. a 95ºC e 1 min. a 62ºC. Todo o processo foi efectuado por um detector de sequências modelo ABIPRISM 7300 (PE Applied Biosystems).
Controlo de Qualidade de DNAEfectuou-se a PCR para as sequências do gene da β-globina, com o objectivo de confirmar a presença de DNA amplificável. A sequência alvo é um segmento de 110pb e foram utilizados os seguintes primers (de 5' para 3'): PCO3: ACACAACTGTGTTCACTAGC; PCO4: CAACTTCATCCACGTTCACC. O protocolo incluiu 40 ciclos de 20s a 95ºC, 45s a 55ºC e 45s a 75ºC.
Análise estatísticaA análise estatística dos resultados foi efectuada recorrendo ao software estatístico SPSS (vs 15.0). As diferenças entre as médias foram calculadas pelo teste t-student. O teste de qui-quadrado foi utilizado na comparação entre as frequências das variáveis categóricas. Um valor de p<0.05 foi considerado estatisticamente significativo.
RESULTADOSA descrição da amostra no grupo dos casos de carcinoma da nasofaringe (NPC) e no grupo controlo está descrita na Tabela 1. No grupo dos casos com carcinoma da nasofaringe foram utilizadas amostras provenientes de tecido tumoral da nasofaringe em blocos de parafina e tecido fresco e sangue periférico dos doentes. No grupo controlo, constituído por indivíduos sem doença oncológica conhecida, foram utilizadas amostras de sangue periférico. O número total de casos analisados foi de 68 doentes com NPC e 45 indivíduos controlo. No grupo dos casos, 19 amostras eram provenientes de tecido tumoral em blocos de parafina (idade média de 56.6 anos, desvio padrão de 11.4), 17 amostras de tecido fresco (idade média de 51.8 anos, desvio padrão de 7.4) e 32 amostras de sangue periférico (idade média de 48.1 anos, desvio padrão de 11.3) de doentes com NPC. A idade média dos indivíduos do grupo controlo foi de 51.8 anos (desvio padrão de 7.4). A frequência de indivíduos do género masculino e feminino foi de 73.5% e 26.5%, respectivamente no grupodos casos com NPC e de 60.0% e 40.0%, respectivamente no grupo controlo.

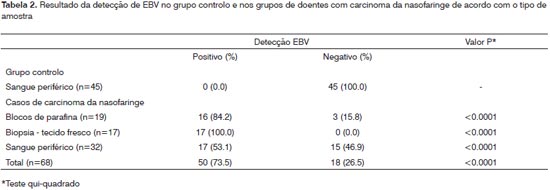
A frequência de casos EBV positivos nas amostras de tecido tumoral em blocos de parafina foi de 84.2%. Os resultados da detecção de EBV nas amostras de tecido fresco demonstram uma percentagem de casos positivos de 100%, corroborando outros estudos publicados que demonstram que todas as células tumorais da nasofaringe apresentam DNA do vírus10,11. No caso de amostrasprovenientes de sangue periférico dos doentes com NPC foi encontrada uma frequência de casos EBV positivos de 53.1%. No grupo controlo, não foi encontrado DNA de EBV no sangue periférico de indivíduos saudáveis (Tabela 2). Foram encontradas diferenças estatisticamente significativas nas frequências de casos EBV positivos e negativos no grupo controlo e no grupo de doentes com NPC (P<0.001 em todos os tipos de amostras analisadas; Tabela 2).
Na Tabela 3, estão descritos os resultados relativos àcomparação das frequências de casos EBV positivos e negativos atendendo ao género dos doentes com carcinoma da nasofaringe e do grupo controlo. Não foram encontradas diferenças estatisticamente significativas na distribuição dos casos EBV positivos e negativos, atendendo ao género dos grupos analisados. A análise da detecção de EBV de acordo com o estádio tumoral (Tabela 4) indica que a frequência de casos EBV positivos é superior em tumores de estádio mais avançado, apesar desta diferença estar no limiar da significância estatística (P=0.069).
DISCUSSÃOA frequência de casos EBV positivos nas amostras de tecido tumoral em blocos de parafina foi de 84.2%. Embora a frequência de casos EBV positivos seja alta, seria de esperar que todos os tecidos apresentassem células infectadas com EBV. Este resultado deve-se provavelmente à qualidade do DNA nas amostras e à eficiência da extracção e purificação do DNA viral a partir de amostras de fragmentos de tecido tumoral em blocos de parafina. Dada a qualidade insuficiente das amostras, foi utilizado um protocolo de nested PCR, de forma a aumentar a sensibilidade do método de detecção. De facto, os resultados da detecção de EBV nas amostras de tecido fresco demonstram uma percentagem de casos positivos de 100%, corroborando outros estudos publicados que demonstram que todas as células tumorais da nasofaringe apresentam DNA do vírus10, 11. No caso de amostras provenientes de sangue periférico dos doentes com NPC foi encontrada uma frequência de casos EBV positivos de 53.1%. No grupo controlo, não foi encontrado DNA de EBV no sangue periférico de indivíduos saudáveis.
Estes resultados indicam uma maior frequência de casos EBV positivos no grupo de doentes com NPC, e esta diferença foi estatisticamente significativa, independentemente do tipo de amostra analisada (P<0.001 para as amostras de blocos de parafina, tecido fresco e sangue periférico).
Estudos recentes indicam que doentes com carcinoma da nasofaringe apresentam DNA de EBV em circulação no sangue periférico12-14. A análise da detecção de EBVde acordo com o estádio tumoral (Tabela 4) indica que a frequência de casos EBV positivos é superior em tumores de estádio mais avançado, apesar desta diferença estar no limiar da significância estatística (P=0.069). Estes resultados indicam que tumores mais avançados parecem libertar DNA de EBV mais facilmente ou e maior quantidade para o sangue periférico dos doentes.
Foi detectado DNA de EBV em todas as amostras de biopsias de tecido tumoral fresco da nasofaringe, indicando que o protocolo de real-time PCR utilizado é sensível e indicado para a detecção de EBV. A análise da detecção de EBV em sangue periférico tem sido alvo de pesquisas recentes, no sentido de avaliar as implicações clínicas da presença de EBV circulante no sangue periférico de doentes com carcinoma da nasofaringe. Este estudo indica que a frequência de casos EBV positivos detectados no sangue periférico é superior em tumores de estádio mais avançado. Estes resultados podem servir de base para estudos futuros, no sentido de avaliar o valor do teste como marcador tumoral auxiliar de diagnóstico. Por outro lado, com o auxílio de testes quantitativos, que visam à quantificação dos níveis de EBV circulantes no sangue de doentes com NPC, poderá ser avaliado o valor dos níveis do vírus como marcador de prognóstico nestes doentes. Estes testes parecem apresentar um elevado valor médico, dada a sensibilidade do método e a facilidade de amostragem, sendo apenas necessária a recolha de sangue periférico, uma técnica não invasiva com potencial de aplicabilidade clínica.
As taxas de incidência do carcinoma da nasofaringe apresentam uma distribuição distinta em termos étnicos e geográficos. Dada a baixa incidência em países ocidentais, pouco se sabe acerca da biologia destes tumores em áreas não endémicas, dado que a maioria dos estudos se centram em populações de elevado risco, com características próprias, que podem não ser necessariamente as mesmas que se verificam nos outros países. A desigual prevalência destes tumores em todo o mundo sugere uma etiologia complexa relacionada com factores genéticos e ambientais, e ambos os factores de risco parecem ser diferentes na sua distribuição geográfica, tanto em termos de exposição ambiental, como em termos de background genético. Estudos anteriores indicam que o EBV necessita de um ambiente genético alterado para promover a proliferação das células7. O perfil genético pode então alterar a susceptibilidade do indivíduo à imortalização das células pelo vírus, modulando o impacto dos efeitos do EBV na carcinogénese destes tumores.
CONCLUSÕESEstes resultados indicam que se observam diferenças na pesquisa do vírus Epstein-Barr no grupo de doentes com NPC e no grupo controlo, sem tumor.
Este estudo pode ajudar na compreensão dosmecanismos biológicos do cancro da nasofaringe e da correlação destes tumores com a infecção por EBV numa área não-endémica, de baixo risco.
AGRADECIMENTOSEste projecto foi financiado pelo Ministério da Saúde de Portugal (CFICS-261/1999).
REFERÊNCIAS BIBLIOGRÁFICAS1. Parkin D. Cancer Burden in the year 2000. The global Picture. Eur J Cancer. 2001;37:S4-S66.
2. Marks JE PJ, Menck HR. The National Cancer Data Base report on the relationship of race and national origin to the histology of nasopharyngeal carcinoma. Cancer. 1998;83:582-8.
3. Epstein M, Barr Y. Virus particles in cultures lymphoblasts from Burkitt´s lymphoma. Lancet. 1964;1:702-3.
4. Baumforth KR, Young LS, Flavell KJ, Constandinou C, Murray PG. The Epstein-Barr virus and its association with human cancers. Mol Pathol. 1999;52(6):307-22.
5. Young LS RA. Epstein-Barr virus: 40 years on. Nat Rev Cancer. 2004;4:757-68.
6. Raab-Traub N. Epstein-Barr virus and nasopharyngeal carcinoma. Semin Cancer Biol. 1992;3(5):297-307.
7. Spano JP BP, Atlan D, Bourhis J, Pignon JP, Esteban C, Armand JP. Nasopharyngeal carcinomas: an update. Eur J Cancer. 2003;39:2121-35.
8. Raab-Traub N. Epstein-Barr virus in the pathogenesis of NPC. Semin Cancer Biol. 2002;12(6):431-41.
9. Breda E, Catarino R, Azevedo I, Fernandes T, Barreira da Costa C, Medeiros R. [Characterization of the clinical evolution of nasopharyngeal carcinoma in Portuguese population]. Acta Otorrinolaringol Esp. 2007;58(5):191-7.
10. Thompson MP, Kurzrock R. Epstein-Barr virus and cancer. Clin Cancer Res. 2004;10(3):803-21.
11. Vera-Sempere F, Burgos J, Botella MS, Morera C. Comparative analysis of Epstein-Barr virus (EBV) detection by nested-PCR and non-isotopic in situ hybridization in nasopharyngeal carcinoma (NPC). Clin Chim Acta. 1998;271(2):119-32.
12. Leung SF, Zee B, Ma BB, Hui EP, Mo F, Lai M, et al. Plasma Epstein- Barr viral deoxyribonucleic acid quantitation complements tumornode- metastasis staging prognostication in nasopharyngeal carcinoma. J Clin Oncol. 2006 1;24(34):5414-8.
13. To EW, Chan KC, Leung SF, Chan LY, To KF, Chan AT, et al. Rapid clearance of plasma Epstein-Barr virus DNA after surgical treatment of nasopharyngeal carcinoma. Clin Cancer Res. 2003 15;9(9):3254-9.
14. Chan KC, Lo YM. Circulating EBV DNA as a tumor marker for nasopharyngeal carcinoma. Semin Cancer Biol. 2002;12(6):489-96.
1. MD, Médico Otorrinolaringologista.
2. MSc, Investigadora, Microbióloga.
3. MD, Médica Oncologista.
4. MD, Médica Radiologista.
5. MD, Médico Otorrinolaringologista.
6. PhD, Investigador, Farmacêutico.
Instituto Português de Oncologia Francisco Gentil do Porto, EPE.
Endereço para correspondência:
Eduardo Breda - MD
Instituto Português de Oncologia, Porto, Serviço de Otorrinolaringologia
R. Dr. Ant. Bernardino Almeida
4200-072, Porto, Portugal
Tel: 351-22 5084000
E-mail: erbreda@gmail.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 25 de março de 2009. cod. 6324
Artigo aceito em 29 de abril de 2010


