INTRODUÇÃOOs carcinomas epidermoides de cabeça e pescoço representam aproximadamente 3% de todas as neoplasias malignas e acometem diversas regiões anatômicas das vias aerodigestivas superiores (VADS)1. O tratamento desses pacientes depende de diversos fatores, entre os quais a experiência do serviço, a localização e o estádio clínico (EC) do tumor, as condições clínicas e a aceitação do paciente2-4.
Nos primeiros três anos após o tratamento, observase uma elevada incidência de recidivas, principalmente locais e regionais5-10. Elas são as principais causas de falha no tratamento de pacientes com carcinoma epidermoide de VADS11,12. Depois do terceiro ano, o aparecimento de um segundo tumor primário (STP) torna-se uma causa importante de morbi-mortalidade13,14.
O primeiro a documentar a ocorrência de várias neoplasias simultâneas em um mesmo paciente foi Billroth15. Em 1932 Warren e Gates15 realizam uma grande revisão de várias séries de casos de neoplasias primárias múltiplas e apresentam também 1.078 autópsias, onde identificaram 40 casos (3,7%) de tumores múltiplos. Nesse estudo os autores propuseram e utilizaram os seguintes critérios para a identificação de neoplasias primárias múltiplas: a confirmação diagnóstica de malignidade para os tumores, a distinção entre eles e a exclusão da possibilidade de um tumor ser metástase do outro.
Slaughter et al.16 em 1953 propõem a teoria da "mucosa condenada" para explicar a elevada incidência de STP em carcinomas induzidos por fatores ambientais. Introduzem o conceito de "campo de cancerização" devido à ocorrência de carcinomas epidermoides multicêntricos de cavidade oral.
Coletando dados de nove Registros Populacionais de Câncer nos EUA, Day e Blot17 avaliam os riscos de STP em 21.371 pacientes com diagnóstico de câncer de boca e faringe. A taxa de desenvolvimento de STP foi de 3,7% ao ano. Os STP de boca, faringe e esôfago representaram 37%, os de cavidade nasal, laringe e pulmão 31% e o restante dos 34%, em ordem decrescente, trato digestivo inferior, próstata, vias urinárias, mama e trato genital feminino. O risco de STP nas VADS variou de 4,2 a 30 [esôfago (RR 23,0; IC 95% 19,0 - 26,0), boca e faringe (RR 20,0; IC 95% 18,0 - 22,0), laringe (RR 6,8; IC 95% 5,5 - 8,4), cavidade nasal e seios paranasais (RR 4,9; IC 95% 2,0 - 10,1) e pulmão (RR 4,2; IC 95% 3,9 - 4,6)]. O risco elevado persistiu por mais de 5 anos após o diagnóstico do tumor primário e foi maior nos paciente com 60 anos ou menos.
O objetivo deste estudo é avaliar a incidência e caracterizar o perfil dos STP em pacientes com carcinoma epidermoide de cabeça e pescoço, tratados com intenção curativa em uma única instituição terciária de um país em desenvolvimento.
MATERIAL E MÉTODOEste é um estudo retrospectivo em que foram revisados os prontuários médicos de todos os pacientes portadores de carcinoma epidermoide de VADS, previamente não tratados, que iniciaram tratamento nos anos de 1988, 1994 e 1999. Foram escolhidos esses anos por terem sido coletados dados completos pelo Registro Hospitalar de Câncer do Hospital, um banco de dados revisado e informatizado18.
As regiões topográficas das VADS incluídas nesse estudo foram:
boca (lábio e cavidade oral); faringe (naso, oro e hipofaringe); cavidade nasal e seios paranasais; laringe.
O EC dos STP foi revisto com base nos dados registrados nos prontuários, segundo os critérios da versão de 2002 da American Joint Committee on Cancer (AJCC)19. Para o diagnóstico dos STP foram utilizados os critérios de Warren e Gates15.
Para a análise foi considerada como a data do diagnóstico do STP aquela da confirmação anatomopatológica. Quando essa data não estava disponível, foi considerada a data dos exames complementares e finalmente, quando esses também não estavam disponíveis, a data da consulta, ou seja, do diagnóstico clínico. Os tumores diagnosticados nos primeiros seis meses do diagnóstico do primeiro tumor foram classificados como sincrônicos e, após seis meses, metacrônicos.
A análise estatística foi realizada com o programa de SSPS 10.0 para Windows20. Estatísticas descritivas de frequências absolutas e relativas foram utilizadas para descrever as variáveis categóricas. Medidas de tendência central (média e/ou mediana) foram utilizadas para descrever as variáveis quantitativas.
A probabilidade de sobrevida foi calculada pelo método de Kaplan-Meier21 e a comparação entre as curvas foi realizada pelo teste de log-rank. Para o cálculo da sobrevida livre de STP, foi considerado o tempo, em meses, decorrido entre o tratamento inicial e a data do diagnóstico do STP. Para a sobrevida após o STP, foi considerado o tempo, em meses, decorrido entre a data do STP e a data da última informação objetiva. Em todos os testes estatísticos foram considerados significantes os valores de p menores ou iguais a 0,05.
RESULTADOSForam incluídos no estudo 624 pacientes, admitidos nos anos de 1988, 1994 e 1999. A maioria deles (520; 83,3%) era do sexo masculino. A idade variou de 10 a 93 anos (mediana de 58,6 anos). As localizações mais frequentes dos tumores primários foram a boca (251 casos;40,2%), a orofaringe (150 casos;24,1%) e a laringe (135 casos; 21,6%) (Tabela 1). Quando agrupados por estádio clínico, 293 casos (46,9%) foram classificados como estádio clínico IV (Tabela 2).
O período de seguimento variou de menos de um mês a 204,1 meses (média de 49,8 meses e mediana de 28,8 meses). Em 59 casos (9,4%) foram diagnosticados e registrados STP durante o período de seguimento. Em 4 (6,8%) os tumores foram sincrônicos e, em 55, metacrônicos (93,2%). Nos casos de STP, ocorreram três perdas de seguimento (5,1%).
A sobrevida livre de segundo tumor primário variou de 2 meses a 191,3 meses (média de 50,8 meses e mediana de 42,5 meses). Em apenas 8 casos (13,5%), o diagnóstico do STP foi realizado no primeiro ano de seguimento. Por outro lado, 20 casos (33,9%) foram diagnosticados após o quinto ano de seguimento (Figura 1).
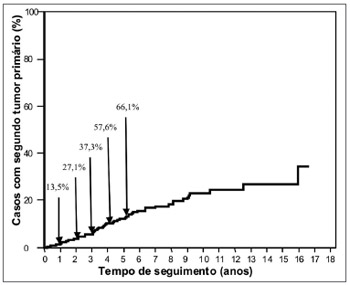
Figura 1. Frequência cumulativa de diagnósticos de segundo tumor primário em relação ao período de seguimento dos 624 casos analisados.
O local mais acometido por STP foi a mucosa das VADS em 29 casos (49,1%), seguida pelo pulmão em 13 casos (22,0%) e pelo esôfago em 7 casos (11,9%). Os 6 casos agrupados em outros tumores incluem um tumor de cólon, um de endométrio, um de tireoide, um de próstata, um de rim e uma leucemia (Tabela 3).
A orofaringe e a boca foram os locais mais frequentes de STP nas VADS, com 14 (48,3%) e 9 (31,0%) casos, respectivamente. Um caso foi considerado como STP oculto e não recidiva regional, já que o primeiro tumor eracarcinoma in situ glótico tratado inicialmente com cirurgia. Esse diagnóstico foi feito 30,4 meses após o tratamento do tumor primário (Tabela 3).
Dos 59 casos de STP, 12 (20,3%) foram classificados como EC I, 9 (15,3%) EC II, 9 ECIII (15,3%), 17 (28,8%) EC IV sem metástase à distância e 8 (13,5%) com metástase à distância no momento do diagnóstico. Não foi possível a classificação por EC em 4 casos (6,8%) (Tabela 4).
Em 33 casos (55,9%) foi possível a realização de tratamento radical e a principal modalidade de tratamento foi a cirurgia. Já nos 16 casos (27,1%) submetidos a tratamento paliativo, a principal modalidade de tratamento foi a radioterapia exclusiva (Tabela 5).
A sobrevida pós-segundo tumor primário em 5anos para os pacientes submetidos a tratamento radical foi significativamente maior, 43,5% (mediana de 21,0 meses) do que a observada no grupo submetido a tratamento paliativo (mediana de 8,1 meses) ou a cuidados de suporte (mediana de 5 meses). A sobrevida mais longa no grupo que recebeu tratamento paliativo foi de 31,1 meses e no grupo que recebeu apenas suporte foi de 11,2 meses (p<0,001) (Figura 2).
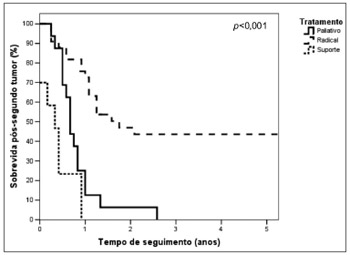
Figura 2. Curvas de sobrevida pós-segundo tumor primário de acordo com o tipo de tratamento do segundo tumor.
A sobrevida em 5 anos dos pacientes que tiveram o STP classificado como EC I, II ou III também foi significativamente maior, 34,4% (mediana de 13,7 meses), do que a dos grupos classificados como EC IV sem metástase (mediana de 15,6 meses) e EC IV com metástase (mediana de 6,3 meses) (p=0,003) (Figura 3). No grupo classificado como EC IV sem metástase, três pacientes estavam vivos sem evidências de doença em atividade, todos com STP de VADS (boca, EC T4N0M0; orofaringe, T4N0M0 e primário oculto TxN2aM0), com seguimento variando de 34,2 a 46,0 meses, e um quarto paciente também com STP de VADS (base de língua, T2N2bM0) foi perdido de seguimento com 80,2 meses. Já no grupo EC IV com metástase a maior sobrevida foi de 12,3 meses.
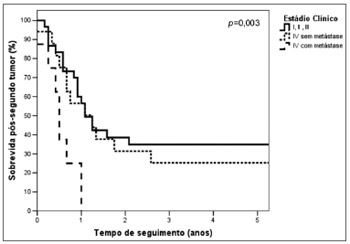
Figura 3. Curvas de sobrevida pós-segundo tumor primário de acordo com o estádio clínico do segundo tumor.
A sobrevida foi diferente de acordo com a localização do STP (Figura 4) (p=0,005). Apenas os pacientes com tumores de VADS e de estômago tiveram seguimento maior que 5 anos. Nos pacientes com STP de VADS, a sobrevida em 5 anos foi de 32,2% (mediana de 16,2 meses).Dois pacientes com STP de estômago estavam vivos: um deles, com seguimento de 8,4 meses, recebendo cuidados de suporte desde o diagnóstico do STP e o outro, com seguimento de 54,8 meses, submetido a tratamento cirúrgico radical sem evidência de doença em atividade. Um terceiro paciente, também tratado com cirurgia radical, foi perdido de seguimento sem evidência de doença após 87,6 meses.
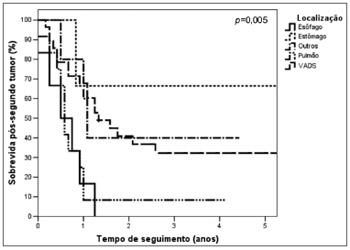
Figura 4. Curvas de sobrevida pós-segundo tumor primário de acordo com a localização do segundo tumor.
Dos 13 casos de STP de pulmão, apenas um paciente estava vivo sem evidências de doença em atividade, com seguimento de 49,3 meses. O tumor desse paciente foi classificado como T1N0M0, EC I e foi tratado cirurgicamente. A sobrevida mediana dos pacientes com STP de pulmão foi de 7,3 meses.
No grupo de pacientes com STP de esôfago, a maior sobrevida foi de 15,6 meses (mediana de 9,7 meses). Nos outros tumores, formados por um grupo heterogêneo de neoplasias malignas, dois pacientes estavam vivos, um com carcinoma papilífero de tireoide e outro com adenocarcinoma de próstata, com seguimento de 51,7 e 53,3 meses, respectivamente.
DISCUSSÃONeste estudo revisamos os prontuários de todos o pacientes com carcinoma epidermoide de VADS, tratados no Hospital.nos anos de 1988, 1994 e 1999. A escolha desses três anos não foi aleatória. Nos últimos anos o hospital vem organizando um banco de dados informatizado com detalhadas informações sócio-demográficas e clínicas dos pacientes (Registro Hospitalar de Câncer). Inicialmente, após detalhada revisão dos prontuários, foram cadastrados os pacientes admitidos em 1988, 199418 e, mais recentemente, 1999. Dessa forma escolhemos esses três anos devido à facilidade para a precisa identificação dos casos de interesse ao estudo, assim como para a coleta de parte dos dados sócio-demográficos e clínicos.
Dos 624 casos analisados no estudo, 59 (9,4%) evoluíram com STP. A incidência de STP nos tratados por tumores de VADS parece aumentar de forma relativamente constante com o passar do tempo. Vikram et al.13 relatam uma taxa aproximada de 6% ao ano, com uma incidência de 14,03% na sua série de casos. Já Day e Blot17 estimam que a taxa de desenvolvimento de STP seja de 3,7% ao ano. Nosso seguimento variou de menos de um mês a17 anos (mediana de 2,4 anos). Se considerarmos nosso tempo mediano de seguimento, a incidência de STP de 9,4% está entre as estimativas dos dois autores citados anteriormente.
O diagnóstico de STP foi realizado em 33,9% dos casos após o quinto ano de seguimento. Di Martino et al.22 também observam que, em 42% dos pacientes, o diagnóstico de STP ocorreu após o quinto ano de seguimento. Franco et al.23, em estudo caso-controle, também evidenciam que o tempo de seguimento é importante fator relacionado ao desenvolvimento de STP.
Sturgis e Miller14, em artigo de revisão, concluem que o risco para o desenvolvimento de STP se mantém constante com o passar do tempo e esses tumores são a principal causa de falha no tratamento dos carcinomas epidermoides de VADS em estádio inicial. Franchin et al.24, estudando exclusivamente pacientes com tumores iniciais de laringe tratados com radioterapia exclusiva, também evidenciam que o desenvolvimento de STP foi a principal causa de morte nesse grupo.
Os principais locais acometidos por STP foram a mucosa das VADS (49,1%), o pulmão (22,0%) e o esôfago (11,9%), tumores relacionados aos mesmos fatores ambientais de risco. Leon et al.25 e Day e Blot17 também evidenciam a maior incidência de STP nas VADS. Por outro lado, a maioria dos STP identificados na série de Vikram et al.13 eram localizados no esôfago (44%) e no pulmão (37,5%).
Neste estudo, os STP foram classificados conforme o EC, porém eles têm comportamento biológico distinto, o que compromete algumas comparações. Pacientes com tumores de VADS EC IV são muitas vezes candidatos a tratamento radical, com possibilidades significativas de cura, já pacientes com tumores EC IV de pulmão apresentam doença metastática.
A indicação de tratamento radical foi significativamente relacionada ao EC I, II ou III dos pacientes com STP (p<0,001), porém o momento do diagnóstico do STP não teve relação com o EC e nem com a sobrevida.
A sobrevida pós-segundo tumor primário em 5 anos, para os pacientes com STP EC I, II e III e para os submetidos a tratamento radical, foi significativamente maior (p=0,003 e p<0,001, respectivamente).
A localização do STP também influenciou na sobrevida (p=0,005), tendo as melhores taxas os pacientes com STP localizados nas VADS (32,2% em 5 anos). É importante ressaltar que os tumores localizados na mucosa das VADS estão acessíveis ao esse locorregional, realizado nas consultas de seguimento dos pacientes tratados por com câncer de cabeça e pescoço, o que pode favorecer um diagnóstico precoce.
Por outro lado, a sobrevida mediana para os sete casos com STP de esôfago neste estudo foi de 9,7 meses com a maior sobrevida de 15,6 meses. A sobrevida tam-bém foi pequena, mediana de 7,3 meses, para os 13 casos de STP de pulmão, sendo que nesse grupo apenas um paciente, classificado como estádio clínico I, estava vivo após 49,3 meses de seguimento.
Vários estudos avaliam o uso rotineiro da tríplice endoscopia (endoscopia digestiva alta, broncoscopia e nasofibrolaringoscopia) na avaliação inicial e no acompanhamento de pacientes com tumores de cabeça e pescoço, para o diagnóstico de STP26-31. Porém é importante avaliar o impacto do diagnóstico dos STP na sobrevida desse grupo de pacientes comparando-a com a daqueles submetidos a exame de rotineiro de seguimento sem uso de métodos endoscópicos em pacientes assintomáticos.
CONCLUSÕESDos 624 casos analisados no estudo, 59 (9,4%) evoluíram com STP. Em 4 (6,8%) os tumores foram sincrônicos e, em 55, metacrônicos (93,2%).
O diagnóstico de STP foi realizado após o quinto ano de seguimento em 33,9% dos casos.
As VADS foram as mais acometidas por STP (49,2%), seguidas pelo pulmão (22,0%) e pelo esôfago (11,9%).
A maior sobrevida pós-STP foi no grupo de pacientes com STP nas VADS (sobrevida em 5 anos de 32,2% com mediana de 16,2 meses).
REFERERÊNCIAS BIBLIOGRÁFICAS1. Cancer Facts & Figures 2008 [online]. Atlanta: American Cancer Society; 2008 [cited 2008 Mar 7]. Available from: http://www.cancer.org/docroot/STT/content/STT_1x_Cancer_Facts_and_Figures_2008.asp.
2. Mendenhall WM, Amdur RJ, Stringer SP, Villaret DB, Cassisi NJ. Radiation therapy for squamous cell carcinome of the tonsillar region: a preferred alternative to surgery? J Clin Oncol. 2000;18:2219-25.
3. Mendenhall WM, Stringer SP, Amdur RJ, Hinerman RW, Moore-Higgs GJ, Cassisi NJ. Is radiation therapy a preferred alternative to surgery for squamous cell carcinoma of the base of tongue? J Clin Oncol. 2000;18:35-42.
4. Gehanno P, Dependt J, Guedon C, Kebaili C, Koka V. Primary and salvage surgery for cancer of the tonsillar region: a retrospective study of 120 patients. Head Neck. 1993;15:185-9.
5. Cooney TR, Poulsen MG. Is routine follow-up useful after combinedmodality therapy for advanced head and neck cancer? Arch Otolaryngol Head Neck Surg. 1999;125:379-82.
6. de Visscher AVM, Manni JJ. Routine long-term follow-up in patients treated with curative intent for squamous cell carcinoma of the larynx, pharynx, and oral cavity: does it make sense? Arch Otolaryngol Head Neck Surg. 1994;120:934-9.
7. Snow GB. Follow-up in patients treated for head and neck cancer: how frequent, how thorough and for long? Eur J Cancer. 1992;28: 315-6.
8. Haas I, Hauser U, Ganzer U. The dilemma of follow-up in head and neck cancer patients. Eur Arch Otorhinolaryngol. 2001;258:177-83.
9. Boysen M, Natvig K, Winther FO, Tausjö J. Value of routine followup in patients treated for squamous cell carcinoma of the head and neck. J Otolaryngol. 1985;14:211-4.
10. Boysen M, Lövdal O, Tausjö J, Winther FO. The value of follow-up in patients treated for squamous cell carcinoma of the head and neck. Eur J Cancer. 1992;28:426-30.
11. Kowalski LP. Results of salvage treatment of the neck in patients with oral cancer. Arch Otolaryngol Head Neck Surg. 2002;128:58-62.
12. Carvalho AL, Magrin J, Kowalski LP. Sites of recurrence in oral and oropharyngeal cancers according to the treatment approach. Oral Dis. 2003;9:112-8.
13. Vikram B, Strong EW, Shah JP, Spiro R. Second malignant neoplasms in patients successfully treated with multimodality treatment for advanced head and neck cancer. Head Neck Surg. 1984;6:734-7.
14. Sturgis EM, Miller RH. Second primary malignancies in the head and neck cancer patient. Ann Otol Rhinol Laryngol. 1995;104:946-54.
15. Warren S; Gates O. Multiple primary malignant tumors: a survey of the literature and a statistical study. Am J Cancer. 1932;16:1358-403.
16. Slaughter DP, Southwick HW, Smejkal W. "Field cancerization" in oral stratified squamous epithelium. Cancer. 1953;6:963-8.
17. Day GL, Blot WJ. Second primary tumors in patients with oral cancer. Cancer. 1992;70:14-9.
18. Hamada GS, Nishimoto IN, Torloni H. Registro hospitalar de câncer: estatística de 1994. [Monografias do Registro Hospitalar de Câncer]. São Paulo: Hospital A. C. Camargo, Pro-Onco; 1996.
19. American Joint Committee on Cancer. AJCC cancer staging manual, 6th ed. New York: Springer; 2002.
20. SPSS]. Statistical package for social science, statistical data analysis for Windows. Chicago, Illinois: SPSS Inc; 2000.
21. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Static Assoc. 1958;53:457-81.
22. Di Martino E, Sellhaus B, Hausmann R, Minkenberg R, Lohmann M, Esthofen MW. Survival in second primary malignancies of patients with head and neck cancer. J Laryngol Otol. 2002;116:831-8.
23. Franco EL, Kowalski LP, Kanda JL. Risk factors for second cancers of the upper respiratory and digestive systems: a case-control study. J Clin Epidemiol. 1991;44:615-25.
24. Franchin G, Minatel E, Gobitti C, Talamini R, Vaccher E, Sartor G, et al. Radiotherapy for patients with early-stage glottic carcinoma: univariate and multivariate analyses in a group of consecutive, unselected patients. Cancer. 2003;98:765-72.
25. Leon X, Quer M, Diez S, Orus C, Lopez-Pousa A, Burgues J. Second neoplasm in patients with head and neck cancer. Head Neck. 1999;21:204-10.
26. Parker RG, Hill JH. Panendoscopy in screening for synchronous primary malignancies. Laryngoscope. 1988;98:14-9.
27. Haughey BH, Gates GA, Arfken CL, Harvey J. Meta-analysis of second malignant tumors in head and neck cancer: the case for an endoscopic screening protocol Ann Otol Rhinol Laryngol. 1992;101:105-12.
28. ujala K, Sipilä J, Grenman R. Panendoscopy and synchronous second primary tumors in head and neck cancer patients. Eur Arch Otorhinolaryngol. 2005;262:17-20.
29. Murakami S, Hashimoto T, Noguchi T, Hazamada S, Uchida Y, Suzuki M, et al. The utility of endoscopic screening for patients with esophageal or head and neck cancer. Dis Esophagus. 1999;12:186-90.
30. Tincani AJ, Brandalise N, Andreollo NA, Lopes LR, Montes CG, Altemani A, Martins AS. Importance of upper digestive endoscopy using lugol dye solution for the diagnosis of superficial esophageal cancer and dysplasia in patients with head and neck neoplasms. Arq Gastroenterol. 2000;37:107-13.
31. Guardiola E, Chaigneau L, Villanueva C, Pivot X. Is there still a role for triple endoscopy as part of staging for head and neck cancer? Curr Opin Otolaryngol Head Neck Surg. 2006;14:85-8.
1. MD, Cirurgião de Cabeça e Pescoço, Hospital Regional do Vale do Paraíba/Universidade de Taubaté.
2. MD, PhD, Cirurgião de Cabeça e Pescoço, Hospital do Câncer de Barretos.
3. MD, PhD, Chefe do Serviço de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital A. C. Camargo.
Departamento de Cirurgia de Cabeça e Pescoço e Otorrinolaringologia do Hospital A. C. Camargo.
Endereço para correspondência:
Rua Professor Antonio Prudente 211 Liberdade
São Paulo 01509-010.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 22 de junho de 2009. cod. 6466
Artigo aceito em 7 de agosto de 2009


