INTRODUÇÃO Nos últimos anos houve um grande avanço no entendimento dos mecanismos envolvidos na audição; vários genes que participam desses processos foram descobertos e as formas como eles interagem tem sido intensamente investigada. A etiologia da deficiência auditiva pode ser devido a mutações em um único gene ou pela combinação de mutações em genes diferentes, além dos fatores ambientais, incluindo infecção perinatal, trauma cerebral afetando a cóclea, ou drogas ototóxicas, tais como os antibióticos aminoglicosídeos, ou até mesmo da interação entre os fatores ambientais e genéticos1.
Mutações em DNA mitocondrial (mtDNA) são responsáveis por uma variedade de doenças afetando muitos órgão e tecidos2. Muitas das mutações mtDNA descritas na literatura estão associadas tanto com formas de deficiência auditiva neurossensorial sindrômicas como não-sindrômicas3,4. A função da mitocôndria é disponibilizar energia para as células sob a forma de trisfosfato de adenosina (ATP). Desta forma, os órgãos que requerem maior quantidade de energia são os que mais apresentam alterações funcionais em casos de mutações do DNA mitocondrial, como as células nervosas, musculares, endócrinas, ópticas e auditivas. Como a cóclea consome grandes quantidades de energia, alterações no DNA mitocondrial de células ciliadas causam deficiência auditiva em uma proporção de 0,5% a 1% de todas as deficiências auditivas de origem genética5.
A maioria das alterações moleculares encontradas em DNA mitocondrial, que estão associadas à deficiência auditiva, estão presentes nos genes 12S rRNA e tRNA. Em particular, mutações que afetam o gene 12S rRNA são responsáveis por perda auditiva neurossensorial nãosindrômica e aumento da susceptibilidade à ototoxicidade dos antibióticos aminoglicosídeos6,7.
Esses antibióticos são drogas clinicamente importantes, utilizadas em todo o mundo, principalmente em países desenvolvidos no controle de infecções bacterianas em pacientes hospitalizados. Entretanto, em países em desenvolvimento, esses medicamentos ainda são rotineiramente utilizados em infecções de menores proporções8. Os antibióticos aminoglicosídeos exercem seu efeito antibacteriano ligando-se diretamente na subunidade 16S e 30S do RNA ribossomal (rRNA) bacteriano, causando terminação prematura da síntese proteica. O uso dessas drogas frequentemente leva à toxicidade, envolvendo os sistemas renal, vestibular e auditivo. O prejuízo renal é geralmente reversível, visto que a ototoxicidade do sistema auditivo e vestibular é frequentemente irreversível9.
Relatos na literatura descrevem que os casos de ototoxicidade aminoglicosídica podem ter uma predisposição genética com padrão de herança autossômico dominante, autossômico recessivo, ligado ao cromossomo X, ou mitocondrial. Nos casos familiais de deficiência auditiva ototóxica, à hipersensibilidade aos aminoglicosídeos é frequentemente transmitida por herança materna, sugerindo envolvimento do genoma mitocondrial7.
Estudos realizados em genoma mitocondrial de pacientes com ototoxicidade aminoglicosídica revelaram a identificação de mutações em DNA mitocondrial no gene 12S rRNA. A mutação A1555G foi a primeira mutação mitocondrial a ser descrita10, e desde então tem sido identificada em muitas famílias, de diferentes etnias, segregando com deficiência auditiva neurossensorial não-sindrômica com ou sem exposição aos aminoglicosideos11. Há pouco tempo, uma transição C → T na posição 1494 do gene 12S rRNA foi identificada em uma família chinesas com deficiência auditiva neurossensorial não-sindrômica, incluindo indivíduos afetados com e sem exposição prévia aos aminoglicosídeos12 e, subsequentemente, em outras duas famílias chinesas13 e três espanholas14. A heterogeneidade clínica da deficiência auditiva nesses casos está diretamente relacionada com a idade de início de administração e com o período de exposição à droga. Quanto menor a idade de início de administração, maior o grau de severidade da deficiência auditiva desenvolvida pelo paciente15.
A mutação A1555G é estruturalmente equivalente à mutação C1494T. Ambas estão situadas em uma região, altamente conservada do 12S rRNA, relacionada com a ligação dos aminoglicosídeos na bactéria11. Estas mutações parecem alterar a estrutura secundária do 12S rRNA, de modo que se assemelhe a subunidade ribossomal bacteriana, conduzindo dessa forma a um aumento na susceptibilidade aos aminoglicosídeos e consequentemente a seu efeito ototóxico10.
Muitos estudos bioquímicos relatam o potencial patogênico da mutação C1494T, indicando que os aminoglicosídeos modulam a expressividade e a penetrância da deficiência auditiva quando associada a esta mutação13. No entanto, a mutação C1494T não foi descrita em nenhuma família de outras etnias até o momento16,17. Neste estudo, nós investigamos a presença da mutação mitocondrial C1494T entre os pacientes com deficiência auditiva e com audição normal expostos aos aminoglicosídeos e nos pacientes com deficiência auditiva que não tiveram contato com o antibiótico.
MATERIAL E MÉTODO Casuística Este estudo caracterizou-se por uma pesquisa clínica e experimental (Comitê de Ética, parecer n° 484/2006), em indivíduos com deficiência auditiva sem exposição aos antibióticos aminoglicosídeos e em recém-nascidos vivos ouvintes e com deficiência auditiva, prematuros e de alto risco que permaneceram ao menos 48 horas em UTIN (Unidade de Terapia Intensiva Neonatal) e tiveram contato com o antibiótico.
A casuística foi composta por 60 indivíduos, sendo 20 com deficiência auditiva sem histórico de sensibilização ao uso de aminoglicosídeos (Grupo B), 20 indivíduos ouvintes (Grupo C) e com diagnóstico audiológico de deficiência auditiva neurossensorial não-sindrômica (Grupo A, n=20) que utilizaram aminoglicosídeos.
Extração do DNA genômico A análise da amostragem foi realizada em DNA isolados pela técnica de fenol-clorofórmio18 a partir de leucócitos de sangue periférico, após a obtenção do consentimento livre esclarecido.
Amplificação do gene 12S rRNA Os indivíduos foram previamente analisados quanto à presença de mutações no gene GJB2 e GJB6, uma vez que mutações nestes genes são responsáveis por uma grande proporção dos casos de surdez não-sindrômica com herança autossômica recessiva19,20, e as mutações mitocondriais A1555G no gene 12S rRNA21 e A7455G no gene tRNA(SerUCN)22. Dentre os indivíduos que não apresentaram tais mutações foi investigada a mutação C1494T.
A partir de amostras de DNA extraídas de sangue periférico, um fragmento de 441pb da sequência do gene 12S rRNA (GenBank: NC_001807), foi amplificada por PCR utilizando os primers C1494TF (5'-GTCGAAGGTGGATTTAGCAGT- 3') e C1494TR (5'-GCAGAAGGTATAGGGGTTAG- 3'). A reação de amplificação foi realizada utilizando 200 a 500ng de DNA genômico, 10mM de solução contendo desoxinucleotídeos (dATP, dCTP, dGTP e dTTP), 10pmol/ml de cada primer; 2,0U de Taq DNA polimerase; tampão de PCR 10X (Tris-HCl 10mM pH 8,8) e 3mM de MgCl2, em um volume final de 50ml, nas seguintes condições: um ciclo de desnaturação à 95°C por 5 mim; 30 ciclos de desnaturação à 94°C por 30s; anelamento à 54°C por 2 min, extensão à 65°C por 1mim; 7 min de extensão final à 65°C. Os produtos de amplificação foram submetidos à eletroforese em gel de agarose 1% e subsequentemente corados com brometo de etídeo.
Identificação da mutação C1494T no gene 12S rRNA
A investigação molecular da mutação C1494T no gene da 12S rRNA foi realizada por análise do polimorfismo dos fragmentos de restrição (PCR-RFLP) utilizando a enzima Hph I, de acordo com as especificações do fabricante e, analisadas em gel de agarose 1,5%. A presença do alelo 1494T aboli o sítio de Hph I na sequência gerando um fragmento de 441pb. Dessa forma, indivíduos com o alelo 1494C apresentam fragmentos de 370pb e 71pb.
RESULTADOS Na tentativa de elucidar os aspectos moleculares dos efeitos ototóxicos dos aminoglicosídeos, nós rastreamos a mutação C1494T em 40 pacientes com deficiência auditiva neurossensorial não-sindrômica. Destes, 20 pacientes apresentam histórico de uso de antibiótico aminoglicosídeos. Outros 20 indivíduos com audição normal, porém com exposição ao aminoglicosídeo, também foram estudados. Após a amplificação de um fragmento do gene 12S rRNA (441pb) (Figura 1) e subsequente digestão com Hph I (Figura 2) das 60 amostras de DNA de pacientes dos grupos A, B e C, não identificamos a mutação C1494T em nenhuma das amostras analisadas.
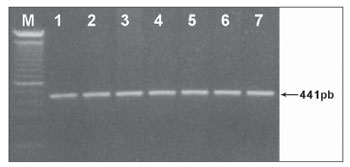
Figura 1. Fragmento de 441pb do gene 12S rRNA amplificado por PCR e analisado em gel de agarose 1%. (M) - marcador de peso molecular (100pb).
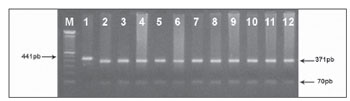
Figura 2. Rastreamento da mutação mitocondrial C1494T por PCRRFLP. Um fragmento de 441pb foi clivado com a enzima de restrição Hph I. O DNA mitocondrial normal gera dois fragmentos de restrição (370pb e 71pb) e o mutante perde o sítio de restrição e não ' clivado pela enzima (441pb). (M) - marcador de peso molecular (100pb); (1)- produto de PCR não digerido. (2-12) - pacientes sem a mutação C1494T.
Estudos funcionais demonstram que a mutação C1494T ocasiona uma disfunção mitocondrial leve e sensibilidade aos aminoglicosídeos, indicando, portanto, que a presença da mutação C1494T, isoladamente, não é responsável pelo fenótipo de deficiência auditiva. Entretanto, a perda da audição pode ser potencializada por fatores modificadores externos, como os aminoglicosídeos, e também por interações gênicas. Na ausência de exposição aos aminoglicosídeos, a transição C àT na posição 1494 do gene 12S rRNA possui, in vivo, um fraco potencial patogênico15.
A ototoxicidade dos aminoglicosídeos se deve à ligação dos mesmos com os receptores das células ciliadas da orelha interna. A formação de complexos aminoglicosídeos-receptores produz modificação na membrana celular e na sua permeabilidade, afetando a função dos cílios e causando, posteriormente, a destruição destas células23. Na presença da mutação C1494T as células auditivas tornamse ainda mais susceptíveis, pois com a mudança de base numa região altamente conservada do 12S rRNA, a região se assemelhará a subunidade ribossomal bacteriana11.
Dados relatados em uma família chinesa demonstraram a interação da mutação C1494T com outros genes, na qual indivíduos portadores dessa mutação apresentavam deficiência auditiva independentemente da exposição aos aminoglicosídeos. Por outro lado, também foi divulgado que indivíduos com a mutação C1494T que não foram expostos ao antibiótico não apresentavam perda auditiva12.
No presente estudo, avaliamos a presença da mutação C1494T em indivíduos ouvintes e com deficiência auditiva que utilizaram aminoglicosídeos e os que não utilizaram o antibiótico. No entanto, não foram encontrados casos positivos para essa mutação, reforçando os resultados encontrados em estudos anteriores, que relatam que a mutação C1494T é pouco frequente na população mundial13,16,17,24.
CONCLUSÃO Nossos dados sugerem que a deficiência auditiva dos indivíduos analisados não está relacionada com a ototoxicidade da mutação C1494T. Porém, a ausência da mutação C1494T no genoma mitocondrial desses indivíduos não descarta a possibilidade de existência de mutações em outros genes não avaliados neste trabalho. Sendo assim, estudos posteriores em outros genes serão necessários para esclarecer a etiologia da deficiência auditiva desses indivíduos.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Morton CC. Genetics, genomics and gene discovery in the auditory system. Hum Mol Genet. 2002;11:1229-40.
2. DiMauro S, Davidzon G. Mitochondrial DNA and disease. Ann Med. 2005;37:222-32.
3. Guan MX. Molecular pathogenetic mechanism of maternally inherited deafness. Ann NY Acad Sci. 2004;1011:259-71.
4. Jacobs HT. Disorders of mitochondrial protein synthesis. Hum Mol Genet. 2003;15:293-301.
5. Ribeiro FAQ, de Carvalho MFP. As deficiências auditivas relacionadas às alterações do DNA mitocondrial. Rev Bras Otorrinolarigol. 2002;68(2):268-75.
6. Fischel-Ghodsian N. Genetic factors in aminoglycoside toxicity. Pharmacogenomics. 2005;6:27-36.
7. Guan MX. Prevalence of mitochondrial 12S rRNA mutations associated with aminoglycoside ototoxicity. Volta Rev. 2005;105:211-27.
8. Fischel-Ghodsian N. Genetic factor in aminoglycoside ototoxicity. Ann NY Acad Sci. 1999;884:99-109.
9. Li Z, Li R, Chen J, Liao Z, Zhu Y, Qian Y, et al. Mutation analysis of the mitochondrial 12S rRNA gene in Chinese pediatric subjects with aminoglycoside-induced and non-syndromic hearing loss. Hum Genet. 2005;117(1):9-15.
10. Prezant TR, Agapian JV, Bohlman MC, Bu X, Öztas S, Qiu WQ, et al. Mitochondrial ribosomal RNA mutation associated with both antibiotic- induced and non-syndromic deafness. Nat Genet. 1993;4:289-94.
11. Zhao H, Young WY, Yan Q, Li R, Cao J, Wang Q, et al. Functional characterization of the mitochondrial 12S rRNA C1494T mutation associated with aminoglycoside-induced and non-syndromic hearing loss. Nucleic Acids Res. 2005;33(3):1132-9.
12. Zhao H, Li R, Wang Q, Yan Q, Deng JH, Han D, et al. Maternally inherited aminoglycoside-induced and nonsyndromic deafness is associated with the novel C1494T mutation in the mitochondrial 12S rRNA gene in a large Chinese family. Am J Hum Genet. 2004;74(1):139-52.
13. Wang Q, Li QZ, Han D, Zhao Y, Zhao L, Qian Y, et al. Clinical and molecular analysis of a four-generation Chinese family with aminoglycoside-induced and nonsyndromic hearing loss associated with the mitochondrial 12S rRNA C1494T mutation. Biochem Biophys Res Commun. 2006;340(2):583-8.
14. Rodríguez-Ballesteros M, Olarte M, Aguirre LA, Galán F, Galán R, Vallejo LA, et al. Molecular and clinical characterisation of three Spanish families with maternally inherited non-syndromic hearing loss caused by the 1494C->T mutation in the mitochondrial 12S rRNA gene. J Med Genet. 2006;43(11):e54.
15. Han D, Dai P, Zhu Q, Liu X, Huang D, Yuan Y, et al. The mitochondrial tRNA(Ala) T5628C variant may have a modifying role in the phenotypic manifestation of the 12S rRNA C1494T mutation in a large Chinese family with hearing loss. Biochem Biophys Res Commun. 2007;357(2):554-60.
16. Konings A, Van Camp G, Goethals A, Van Eyken E, Vandevelde A, Ben Azza J, et al. Mutation analysis of mitochondrial DNA 12SrRNA and tRNASer(UCN) genes in non-syndromic hearing loss patients. Mitochondrion. 2008;8:377-82.
17. Mkaouar-Rebai E, Tlili A, Masmoudi S, Charfeddine I, Fakhfakh F. New polymorphic mtDNA restriction site in the 12S rRNA gene detected in Tunisian patients with non-syndromic hearing loss. Biochem Biophys Res Commun. 2008;369(3):849-52.
18. Lewin HA, Stewart-Haynes JA. A simple method for DNA extraction from leukocytes for use in PCR. Biotechniques. 1992;13(4):522-4.
19. Gasparini P, Estivill X, Volpini V, Totaro A, Castellvi-Bel S, Govea N, et al. Linkage of DFNB1 to non-syndromic neurosensory autosomalrecessive deafness in Mediterranean families. Eur J Hum Genet. 1997;5(2):83-8.
20. del Castillo I, Villamar M, Moreno-Pelayo MA, Del Castillo FJ, Alvarez A, Tellería D, et al. A deletion involving the connexin 30 gene in nonsyndromic hearing impairment. N Engl J Med. 2002;346:243-9.
21. Estivill X, Govea N, Barceló E, Badenas C, Romero E, Moral L, et al. Familial progressive sensorineural deafness is mainly due to the mtDNA A1555G mutation and is enhanced by treatment of aminoglycosides. Am J Hum Genet. 1998;62(1):27-35.
22. Reid FM, Vernham GA, Jacobs HT. A novel mitochondrial point mutation in a maternal pedigree with sensorineural deafness. Hum Mutat. 1994;3(3):243-7.
23. de Oliveira JAA, Canedo DM, Rossato M. Otoproteção das células ciliadas auditivas contra a ototoxicidade da amicacina. Rev Bras Otorrinolaringol. 2002;68(1):7-13.
24. Xing G, Chen Z, Wei Q, Tian H, Li X, Zhou A, et al. Mitochondrial 12S rRNA A827G mutation is involved in the genetic susceptibility to aminoglycoside ototoxicity. Biochem Biophys Res Commun. 2006;346(4):1131-5.
1. Graduanda, Estudante 4° Ano Biomedicina, Centro Universitário Hermínio Ometto - UNIARARAS.
2. Graduanda, Estudante 4° Ano Biomedicina, Centro Universitário Hermínio Ometto - UNIARARAS.
3. Livre-docente, Pesquisadora do Centro de Biologia Molecular e Engenharia Genética, CBMEG-UNICAMP.
4. Doutorado, Professor Assistente do Núcleo de Ciências da Saúde, NUCISA - Centro Universitário Hermínio Ometto - UNIARARAS.
Endereço para correspondência:
Ana Postal, Bruna Palodetto, Edi Lúcia Sartorato, Camila Andréa De Oliveira
Nucisa - Centro Universitário Hermínio Ometto - UNIARARAS
Laboratório de Genética Humana/CBMEG-UNICAMP
Profa. Dra. Camila Andréa de Oliveira
Núcleo de Ciências da Saúde - NUCISA
Centro Universitário Hermínio Ometto - UNIARARAS
Av. Maximiliano Barutto, 500 - Araras - SP - 13607-339
Tel: + 51 (0xx19) 3543-1400 ramal 269
E-mail: caol@uniararas.br
Este trabalho foi financiado pelo Programa Institucional de Bolsa de Iniciação Científica - PIBIC/CNPq e pelo Centro Universitário Hermínio Ometto - UNIARARAS.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 6 de novembro de 2008. cod. 6112.
Artigo aceito em 2 de fevereiro de 2009.


