INTRODUÇÃO A Fibrose Cística é a doença hereditária autossômica recessiva mais comum entre caucasoides1-6. Apresenta uma frequência de 1:6.000 a 1:2.000 nascidos vivos na população branca de países desenvolvidos1,3,4,6-9, sendo rara em negros (1:30.000) e em amarelos (1:90.000)10,11. No Brasil, a incidência é de 1:9.500 no Paraná12, 1:8.700 em Santa Catarina13 e 1:10.000 em Minas Gerais14.
A doença é causada por mutações do gene da proteína reguladora de condutância transmembrana da FC (CFTR ou cystic fibrosis transmembrane regulator protein) que se localiza na região q31 do braço longo do cromossomo 715-17. Esse gene, descrito em 198915-17, codifica uma proteína que funciona como um canal de cloro, sendo que a disfunção desse canal resulta em um transporte anormal de sódio, cloro e água através da membrana apical das células epiteliais das vias respiratórias e das glândulas exócrinas. Os fluxos anormais de sal e água levam à desidratação dos fluidos das glândulas exócrinas e alteram as propriedades viscoelásticas das mucinas5,6,18,19.
A grande maioria dos pacientes com FC (mais de 90%)3,6,18,20-25 desenvolve rinossinusites crônicas e recorrentes com ou sem pólipos nasais. A alteração da composição e da viscosidade do muco leva à disfunção do clearance mucociliar e à obstrução dos óstios de drenagem dos seios paranasais, predispondo a inflamação local com consequente hipoxia e aumento da pressão parcial de dióxido de carbono. Isso resulta em edema da mucosa, maior comprometimento da função ciliar e favorece a colonização e infecção bacteriana, especialmente por Staphylococcus aureus e por Pseudomonas aeruginosa3,6,18,26.
A polipose nasal em pacientes com FC foi descrita pela primeira vez em 195927 e, até hoje, pouco se sabe sobre sua fisiopatologia28-30. Sua frequência é bastante variável em diferentes populações e depende da técnica de avaliação26,29,31-42.
Acredita-se que o comprometimento nasossinusal possa agravar o quadro pulmonar20 e, portanto, a participação do otorrinolaringologista na abordagem desse grupo especial de pacientes se torna cada vez mais importante. No Brasil, estudos recentes26,40,41 demonstram a preocupação de uma melhor caracterização, do ponto de vista nasossinusal, dos pacientes com FC já que há uma grande heterogeneidade genética, um amplo espectro de mutações com uma grande variedade de apresentações clínicas28 que podem ser explicadas por características fenotípicas específicas da população brasileira e até mesmo da população de cada região do país.
O objetivo deste estudo é caracterizar, do ponto de vista nasossinusal, as crianças e adolescentes com FC em Minas Gerais por meio de um questionário (anamnese), do exame clínico e da endoscopia nasal.
CASUÍSTICA E MÉTODO O projeto de pesquisa e o termo de consentimento foram aprovados pelo Comitê de Ética em Pesquisa da XXX (número do protocolo: 177 / 2002). Todos os pacientes e/ou seus responsáveis concordaram em participar do estudo e assinaram o Termo de Consentimento Livre e Esclarecido.
O presente estudo, clínico descritivo transversal, foi realizado por meio de uma anamnese dirigida, exame otorrinolaringológico completo e exame endoscópico nasal de 100 pacientes com idade entre sete meses e 18 anos com diagnóstico de FC e diferentes graus de acometimento pulmonar. Todos os pacientes envolvidos apresentavam características clínicas compatíveis e o diagnóstico de FC confirmado pelo teste do suor (método de Gibson e Cooke43) de acordo com o critério da Cystic Fibrosis Foundation8.
Os pacientes foram avaliados nos Serviços de Pneumologia Pediátrica e de Otorrinolaringologia do Hospital XXX da XXX entre julho de 2002 e janeiro de 2004. Os pacientes hospitalizados, com diagnóstico de infecção de vias aéreas superiores em atividade, em uso de antibióticos sistêmicos ou de corticoides tópicos nasais foram examinados três a seis meses após, quando já não apresentavam esses critérios de exclusão.
O exame endoscópico das cavidades nasais foi realizado, após anestesia tópica do nariz com neotutocaína, com endoscópio flexível de 3,2mm de diâmetro (Machida Endoscopy Co., Japão) e, em alguns casos, complementado com o endoscópio rígido de 4mm de diâmetro com ângulo de 00 (Fiegert Endotech, Alemanha).
Os pacientes com pólipos nasais estadiados de acordo com o estadiamento endoscópico proposto por Lund e Kennedy44. Este estadiamento avalia os seguintes parâmetros: edema da mucosa nasal, presença de secreção e presença de pólipos. Para cada um deles foi dada uma pontuação de 0 a 2, conforme o Quadro 1. A avaliação foi realizada bilateralmente e a pontuação total (0 - 12) corresponde à somatória da pontuação de cada lado.
Para análise estatística dos dados coletados foram utilizados: análise descritiva, intervalos de confiança (calculados pelo EpiInfo 2004), comparação de médias pelo teste de Kruskal-Wallis e os testes paramétricos - teste "t" e ANOVA (Analysis Of VAriance). Quando o valor de p correspondente a estes testes (teste "t", ANOVA e Kruskal- Wallis) foi menor que 0,05 (ou 5%), as médias foram consideradas estatisticamente diferentes.
RESULTADOS Na amostra estudada, 61% dos pacientes eram do sexo masculino e com idade variando entre sete meses e 18 anos (média: 8,4 anos) sendo 50% menores de oito anos e 75% menores de 11 anos. A maioria dos pacientes (59%) avaliados é constituída de feodermas e nenhum deles é melanoderma ou da raça amarela.
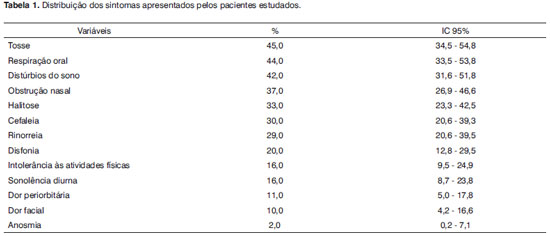
As queixas relacionadas com o acometimento das vias aéreas superiores mais frequentemente relatadas pelos pacientes e/ou seus responsáveis foram tosse, respiração oral predominante, distúrbios do sono (caracterizados como sono agitado, roncos noturnos e acordares repetidos), obstrução nasal, halitose, cefaleia e rinorreia, como apresentadas na Tabela 1. Vinte por cento dos pacientes não apresentavam nenhum dos sintomas listados no momento da avaliação.
O exame clínico e endoscópico nasal mostrou que 36% dos pacientes apresentavam o meato médio (MM) sem alterações bilateralmente. Não foi possível a avaliação do recesso esfenoetmoidal (REE) na maioria dos pacientes (51% à direita e 58% à esquerda) por serem pouco desenvolvidos nas crianças e de difícil avaliação na presença de desvios de septo, secreção, pólipos e abaulamento medial da parede lateral do nariz. Trinta pacientes apresentavam o REE normal bilateralmente. O abaulamento medial da parede lateral do nariz foi identificado em 41 pacientes sendo bilateral em 36 deles. Os pacientes em que os óstios tubários não foram visibilizados apresentavam hiperplasia adenoideana causando sua obstrução (Tabela 2).
Não foi observada associação estatisticamente significativa (p = 0,68) entre a idade e a presença de abaulamento medial da parede lateral do nariz.
Ao exame endoscópico nasal, 58% dos pacientes apresentavam secreção mucoide, principalmente em assoalho nasal, e 28% apresentavam secreção mucopurulenta (25% em MM). Houve associação entre a presença de secreção nasal ao exame endoscópico e o relato de rinorreia (p = 0,05), como esperado. A presença de secreção nasal foi mais comum em pacientes entre seis e 18 anos do que em pacientes com cinco anos ou menos.
Quatorze pacientes (14%) apresentavam pólipos nasais à endoscopia nasal, apenas cinco (35,7%), bilateralmente. Não houve diferença estatisticamente significante entre os lados do nariz em relação à presença de pólipos (p = 1,0) e de secreção mucopurulenta (p = 0,67). Foi, entretanto, observada, na Tabela 3, a associação estatisticamente significante entre pólipos nasais e secreção mucopurulenta (p = 0,02) e também entre pólipos nasais e qualquer tipo de secreção (p = 0,02).
Não foi evidenciada associação entre sexo e polipose nasal (p = 0,07), nem entre idade e polipose (Tabela 3). Entretanto, observou-se que 50% dos casos de polipose nasal foram diagnosticados em crianças de seis anos ou menos e nenhum pólipo foi identificado em pacientes com 16 anos ou mais. Dos 14 pacientes com pólipos, nove (64,3%) tinham entre quatro e 12 anos.
Nenhum dos pacientes avaliados apresentava polipose obliterante. O estadiamento Lund-Kennedy44 dos 14 pacientes com pólipos nasais está demonstrado no Gráfico 1, de acordo com edema de mucosa, secreção nasal e presença dos pólipos e sua extensão, bilateralmente.
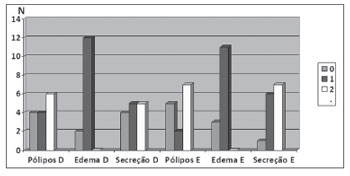
Gráfico 1. Estadiamento endoscópico Lund-Kennedy dos 14 pacientes com pólipos nasais.
A maioria dos trabalhos citados a seguir é europeia e norte-americana e alguns deles envolvem tanto crianças quanto adultos com FC, portanto, retratam uma população distinta da população do presente estudo. Há, ainda, poucas publicações sobre as características da população de fibrocísticos de países em desenvolvimento e com casuísticas bem menores que a deste estudo.
Achados clínicos Em relação aos sintomas mais frequentemente relatados, as crianças e adolescentes com FC avaliadas no presente estudo apresentaram, além da tosse que foi a queixa mais frequente (45%), respiração oral (44%), sono agitado (42%), obstrução nasal (37%), halitose (33%), cefaleia (30%) e rinorreia (29%). Tanto a respiração oral quanto os distúrbios do sono têm íntima relação com a obstrução nasal15. Apenas dois pacientes se queixaram de anosmia e cerca de 10% acusaram dor periorbitária ou em face. A frequência de cada um desses sintomas em pacientes com FC, na literatura, é muito variável, mas, de modo geral, maior do que a encontrada no nosso meio. Trabalhos europeus e norte-americanos recentes mostraram que os sintomas mais frequentemente associados à FC são tosse (em cerca de 60%)29, obstrução nasal (em 60 a 90,5%)3,29,45,46, rinorreia (em 20 a 85,7%)3,29,36,45,46, cefaleia (em 22,6 a 71,4%)3,29,46, dor facial (em 15 a 57,1%)45,46 e distúrbios do sono como agitação, roncos e sonolência diurna (em 37%), especialmente nos pacientes com obstrução nasal acentuada15. No Brasil, Boari e Castro Jr.42 reportaram baixa ocorrência de sintomas de rinossinusite com exceção da tosse. A grande variação dos achados provavelmente se deve a amostras pequenas e com diferentes faixas etárias.
É importante ressaltar que, apesar de alguns estudos demonstrarem que até 100% dos pacientes fibrocísticos apresentam pansinusopatia à tomografia computadorizada dos seios da face3,6,18,20-25, 20% dos pacientes avaliados não apresentavam nenhum dos sintomas questionados e 36% não apresentavam alterações em meatos médios bilateralmente. Isso se repete em outros estudos em que não existe uma correlação entre os achados tomográficos e as manifestações clínicas. Segundo Moss e King47, a relativa baixa frequência de queixas nasais ocorre porque os pacientes ou responsáveis dão maior atenção às manifestações mais graves da doença, existe uma "adaptação" aos sintomas nasais crônicos e há um desconhecimento do quanto às manifestações nasossinusais podem interferir na evolução do quadro pulmonar, sendo subestimadas.
Endoscopia nasal Há uma grande variedade de achados endoscópicos em pacientes com FC e uma tendência de aumento de diagnóstico de pólipos nasais ao longo do tempo. Entre 1961 e 2005, a prevalência da polipose nasal variou de cinco a 57%26,29,31-38,40-42. Isto pode ser explicado pelo aumento da sobrevida dos pacientes fibrocísticos nos países desenvolvidos, pela seleção dos pacientes, pelo tamanho das amostras, pelas diferentes faixas etárias estudadas e principalmente pelo uso rotineiro mais recente da endoscopia nasal como técnica diagnóstica3,19,48. Brihaye et al.29 mostraram que mais de 25% dos pólipos deixam de ser identificados com o exame clínico via rinoscopia anterior antes da realização da endoscopia nasal em pacientes com FC. Isso porque uma visão adequada do meato médio e da metade posterior do nariz só pode ser obtida por meio da endoscopia nasal4,21,49. Boari e Castro Jr42 compararam os achados clínicos, tomográficos e endoscópicos e verificou que a endoscopia nasal contribuiu de forma expressiva na avaliação da rinossinusite crônica e da polipose nasal do paciente com FC, caracterizando de forma fidedigna as condições nasossinusais.
No presente estudo, a polipose nasal foi encontrada em apenas 14% das crianças e adolescentes com FC apesar de o método de avaliação ser semelhante ao dos trabalhos mais recentemente publicados. Estudos realizados exclusivamente com crianças e adolescentes mostram diferentes frequências de pólipos nasais: 22,2% de 27 pacientes com FC por Denoyelle et al.36 na França, 57% de 23 pacientes com FC por Yung et al.19 na Inglaterra e 32,6% de 89 pacientes por Cimmino et al.6 na Itália. Schmitt et al.41 avaliaram retrospectivamente, por meio de prontuários médicos, 893 crianças com FC, a maior amostra encontrada na literatura, e apenas 5% delas apresentavam pólipos nasais.
Estudos realizados no Brasil também mostram grande variação na frequência de diagnóstico de pólipos nasais em pacientes com FC. Weber e Ferrari40 encontraram pólipos nasais em 39,1% dos pacientes com FC numa amostra de 23 pacientes com idade entre um ano e 9 meses e 22 anos e 8 meses. Boari e Castro Jr42 encontraram pólipos em apenas três (8,82%) dos 34 pacientes com FC, entre seis e 22 anos, avaliados com endoscopia nasal. Já Sakano et al.26 identificaram pólipos nasais em 36% dos 50 pacientes, maiores de 2 anos, avaliados com endoscopia rígida e sob anestesia geral, método que pode ter permitido um diagnóstico mais preciso dos pólipos, mesmo que muito pequenos. Todos esses três trabalhos avaliaram pacientes da mesma região geográfica, o estado de São Paulo.
Sabendo-se que há uma grande heterogeneidade genética da FC, um amplo espectro de mutações com uma grande variedade de apresentações clínicas28, a baixa prevalência de polipose nasal encontrada quando comparada com os achados dos países desenvolvidos poderia ser explicada por características genotípicas específicas da população estudada. Pode-se também suspeitar do subdiagnóstico da FC no Brasil e do óbito precoce dos pacientes com complicações pulmonares e, talvez, com polipose nasal associada, lembrando que no Brasil, a sobrevida dos pacientes fibrocísticos é menor que a dos fibrocísticos nos países desenvolvidos onde a expectativa de sobrevida chega a 31,6 anos6,50. Em um estudo brasileiro recente realizado por Alvarez et al.51, a sobrevida mediana dos 104 pacientes com FC avaliados foi de 18 anos e quatro meses após o diagnóstico.
Nossos resultados mostram que todos os pacientes com pólipos nasais apresentavam secreção nasal associada, mas não foi encontrada relação entre a presença de pólipos nasais e sintomas como tosse, rinorreia, respiração oral, sono agitado, cefaleia e nem obstrução nasal, apesar de alguns autores1,3,24,28 descreverem a obstrução nasal como sintoma característico de pacientes com FC e pólipos nasais. Gentile e Isaacson28 compararam 19 pacientes com FC, entre seis e 25 anos, com e sem polipose nasal, e a queixa mais frequente em pacientes com polipose foi obstrução nasal. Já Henriksson et al.5 também não encontraram diferenças entre os pacientes com e sem pólipos nasais em relação a sintomas como rinorreia, obstrução nasal e respiração oral. Kennedy e Loury52 já haviam relatado a ausência de paralelo entre os sintomas nasais e a ocorrência de pólipos nasais.
No presente estudo, não houve associação estatisticamente significativa entre pólipos nasais e a idade, mas 64,3% dos pacientes com pólipos tinham entre quatro e 12 anos, o que coincide com o relatado por Jaffe et al.53 e por Sakano et al.26 (88,89% dos casos de polipose em pacientes menores que 15 anos). Entretanto, não foi baixa a prevalência de pólipos em crianças mais novas, conforme o relato de Brihaye et al.3, já que sete (50%) das 14 crianças e adolescentes com pólipos nasais tinham seis anos ou menos, e a criança mais nova com pólipo nasal tinha idade de oito meses, com diagnóstico diferencial realizado por meio da tomografia computadorizada de nariz e seios da face. Nenhum outro autor descreveu pólipos nasais em pacientes com FC menores de um ano e quatro meses de idade.
Acredita-se que o abaulamento medial da parede lateral do nariz se deve à pressão intraluminal exercida pelos pólipos e/ou pelas secreções viscosas retidas nos seios paranasais, especialmente em crianças mais novas que têm maior elasticidade da parede lateral que os adultos3,21. Quarenta e um por cento dos pacientes estudados apresentavam o abaulamento medial da parede lateral do nariz, o que coincide com os achados da literatura (de 12 a 76%)3,29,46. Entretanto, não foi observada relação estatisticamente significativa entre o abaulamento da parede lateral do nariz com a idade dos pacientes avaliados.
Estadiamento endoscópico da polipose nasossinusal O estadiamento endoscópico da polipose nasal é necessário para quantificar a gravidade da doença e para avaliar a resposta terapêutica. Além disso, permite a comparação de dados de diferentes autores, caracterizando os diferentes grupos de pacientes com pólipos nasais. Entretanto, não há um estadiamento endoscópico uniforme, consensual e único na literatura44.
Diferentes autores, usando diferentes métodos de estadiamento, encontraram uma prevalência de polipose obliterante variável: alguns estudos mostram que a polipose era extensa em até 70% dos casos enquanto outros não identificaram nenhum paciente fibrocístico com polipose obliterante3,5,6,19,29.
Nenhuma das 14 crianças com pólipos nasais avaliadas neste estudo apresentava polipose obliterante. Dez pacientes apresentavam pólipos nasais à direita e 9 apresentavam pólipos à esquerda. A pontuação máxima segundo o estadiamento Lund-Kennedy44 foi 10 e a mínima foi dois, o que reafirma a grande variação de achados endoscópicos nasais em fibrocísticos com polipose nasal.
Nossos resultados mostram que as características clínicas e endoscópicas nasais das 100 crianças e adolescentes estudadas foram, em parte, diferentes das descritas na população de fibrocísticos de países desenvolvidos e mesmo da população de diferentes regiões do Brasil. Nos países latino-americanos, a falta de informações a esse respeito é evidente e esforços devem ser dirigidos para a melhor compreensão das peculiaridades da nossa população de pacientes com FC e para que os tratamentos específicos e medidas de saúde pública sejam precoces e não exclusivamente baseados em dados internacionais. Futuros trabalhos envolvendo os grandes centros de tratamento de FC no Brasil de forma padronizada seriam de extremo valor na abordagem multidisciplinar desses pacientes.
CONCLUSÃO O presente estudo permite concluir que, na população estudada:
as principais manifestações otorrinolaringológicas foram tosse, respiração oral, sono agitado, obstrução nasal, halitose, cefaleia e rinorreia e, de modo geral, encontradas em menor proporção do que em outros estudos envolvendo pacientes com FC;
a polipose nasal estava presente em apenas 14% dos pacientes e em nenhum caso se tratava de polipose obliterante;
houve associação significativa entre a presença de polipose nasal e a presença de secreção nasal mas não entre a polipose nasal e idade ou polipose nasal e sintomas como obstrução nasal, tosse e cefaleia;
o abaulamento medial da parede lateral do nariz foi identificado por meio da endoscopia nasal em grande porcentagem dos pacientes (41%);
a endoscopia nasal foi realizada com sucesso em todos os 100 pacientes e se mostrou um exame de fácil realização e indispensável na avaliação nasossinusal dos pacientes fibrocísticos, especialmente em pacientes com manifestações respiratórias sem diagnóstico preciso ou de difícil controle clínico, independentemente da idade.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Leiberman A, Cole P, Corey M, Forte V, Levinson H. Otolaryngological and rhinomanometric findings in cystic fibrosis. Am J Rhinol. 1991;5(2):61-5.
2. Ramsey B, Richardson MA. Impact of sinusitis in cystic fibrosis. J Allergy Clin Immunol. 1992;90:547-52.
3. Brihaye P, Jorissen M, Clement PAR. Chronic rhinosinusitis in fibrosis (mucoviscidosis). Acta Otorhinolaryngol Belg. 1997;51:323-37.
4. Watelet JB, Cauwenberge PV, Bachert C. The nose in cystic fibrosis. Eur Respir Mon. 2001;18:47-56.
5. Henriksson G, Westrin KM, Karpati F, Wikström A, Stierna P, Hjelte L. Nasal polyps in cystic fibrosis. Clinical Endoscopic Study with nasal lavage fluid analysis. Chest. 2002;121:40-7.
6. Cimmino M, Cavaliere M, Nardone M, Plantulli A, Orefice A, Esposito V, et al. Clinical characteristics and genotype analysis of patients with cystic fibrosis and nasal polyposis. Clin Otolaryngol. 2003;28:125-32.
7. Crozier DN. Cystic Fibrosis - a not-so-fatal disease. Pediatr Clin North Am. 1974;21(4):935-50.
8. Cystic Fibrosis Foundation, Clinical practice guidelines for cystic fibrosis, Bethesda, Maryland, 1997.
9. Ratjen F, Döring G. Cystic fibrosis. Lancet. 2003;361:681-9.
10. Aitken ML, Fiel SB. Cystic fibrosis. Dis Mon. 1993;5-52.
11. Davis PB. Cystic fibrosis. Pediatr Rev. 2001;22(8):257-64.
12. Santos GPC, Domingos MT, Wittog EO, Riedi CA, Rosório NA. Programa de triagem neonatal para fibrose cística no estado do Paraná: avaliação após 30 meses de sua implantação. J Pediatr. 2005;81(3):240-4.
13. Honório LFO, Ludwig Neto N, Barbosa E, Perin N, Gastaldi LA, Ferreira JE et al. Avaliação da triagem neonatal para fibrose cística no estado de Santa Catarina. J Bras Pneumol. 2006;32(1):S1.
14. Reis F, Melo SO, Vergara AA. Programa de triagem neonatal para fibrose cística de Minas Gerais (PETN-FC): aspectos clínicos e laboratoriais. J Bras Pneumol. 2006;32(1):S1.
15. Riordan JR, Rommens JM, Kerem B, Alon N, Rozmahel R, Grzelczak z, et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA. Science. 1989;245:1066-73.
16. Kerem B, Rommens JM, Buchanan JA, Markiewicz D, Cox TK, Chakravarti A, et al. Identification of the cystic fibrosis gene: genetic analysis. Science. 1989;245:1073-80.
17. Rommens JM, Iannuzzi MC, Kerem B, Drumm ML, Melmer G, Dean M, et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science. 1989;245:1059-65.
18. Batsakis JG, El-Naggar AK. Cystic fibrosis and the sinonasal tract. Ann Otol Rhinol Laryngol. 1996;105:329-30.
19. Yung MW, Gould J, Upton GJG. Nasal polyposis in children with cystic fibrosis: a long-term follow-up study. Ann Otol Rhinol Laryngol. 2002;111:1081-6.
20. Daniel S. Infection and inflammation CF: management of the basics upper airway diseases. Paediat Resp Rev. 2006;7S:S154-S155.
21. Coste A, Gilain L, Roger G, Sebbagh G, Lenoir G, Manach Y, et al. Endoscopic and CT-scan evaluation of rhinosinusitis in cystic fibrosis. Rhinology. 1995;33(3):152-6.
22. Umetsu DT, Moss RB, King VV, Lewiston NJ. Sinus disease in patients with severe cystic fibrosis: relation to pulmonary exacerbation. Lancet. 1990;335:1077-8.
23. Davidson TM, Murphy C, Mitchell M, Smith C, Light M. Management of chronic sinusitis in cystic fibrosis. Laryngoscope. 1995;105:354-8.
24. Weber A, Kiefer J, Peters S, Schneider M, Bargon J, May A. Eosinophilic cationic protein as a marker of nasal inflammation in patients with cystic fibrosis. Laryngoscope. 1999;109:1696-702.
25. Rosbe KW, Jones DT, Rahbar R, Lahiri T, Auerbach AD. Endoscopic sinus surgery in cystic fibrosis: do patients benefit from surgery? Int J Pediatr Otorhinolaryngol. 2001;61:113-9.
26. Sakano E, Ribeiro AF, Barth L, Condino Neto A, Ribeiro JD. Nasal and paranasal sinus endoscopy, computed tomography and microbiology of upper airways and the correlations with genotype and severity of cystic fibrosis. Int J Pediatr Otorhinolaryngol. 2007;71:41-50.
27. Lurie MH. Cystic Fibrosis of the pâncreas and nasal mucosa. Ann Otol Rhinol Laryngol. 1959;68:478.
28. Gentile VG, Isaacson G. Patterns of sinusitis in cystic fibrosis. Laryngoscope. 1996;106:1005-9.
29. Brihaye P, Clement PAR, Dab I, Desprechin B. Pathological changes of the lateral nasal wall in patients with cystic fibrosis (mucoviscidosis). Int J Pediatr Otorhinolaryngol. 1994;28:141-7.
30. Hulka GF. Head and neck manifestations of cystic fibrosis and ciliary dyskinesia. Otolaryngol Clin North Am. 2000;33(6):1333-41.
31. Shwachman H, Kulczycki LL, Mueller HL, Flake CG. Nasal polyposis in patients with cystic fibrosis. Pediatrics. 1962;30:389-401.
32. Magid SL, Smith CC, Dolowitz DA. Nasal mucosa in pancreatic cystic fibrosis. Arch Otolaryngol. 1967;86:212-6.
33. Neely JG, Harrison GM, Jerger JF, Greenberg SD, Presberg H. The otolaryngologic aspects of cystic fibrosis. Trans Am Acad Ophthalmol Otolaryngol. 1972;76:313-24.
34. Cunningham DG, Gatti WM, Eitenmiller AM, Gorger PNV. Cystic fibrosis: involvement of the ear, nose, and paranasal sinuses. Ill Med J. 1975;148(4):470-4.
35. Cepero R, Smith RJH, Catlin FI, Bressler KL, Furuta GT, Shandera KC. Cystic fibrosis - an otolaryngologic perspective. Otolaryngol Head Neck Surg. 1987;97:356-60.
36. Denoyelle F, Garabedian EN, Sardet A, Tournier G, Bellity A. Atteinte de la sphère orl dans la mucoviscidose. Ann Otolaryngol. 1990;107:200-4.
37. Triglia JM, Belus JF, Dessi P, Noirclerc M, Cannoni. Les manifetations rhinosinusiennes de la mucoviscidose. Ann Otolaryngol. 1993;110:98-102.
38. Triglia JM, Nicollas R. Nasal and sinus polyposis in children. Laryngoscope. 1997;107:963-6.
39. Hadfield PJ, Rowe-Jones JM, Mackay IS. The prevalence of nasal polyps in adults with cystic fibrosis. Clin Otolaryngol. 2000;25(1):19-22.
40. Weber SAT, Ferrari GF. Incidência e evolução da polipose nasal em crianças e adolescentes com fibrose cística. Braz J Otorhinolaryngol. 2008;74(1):16-20.
41. Schmitt EJ, Neaville W, Pougdee T. Prevalence of cystic fibrosis in children who present with nasal polyposis. J Allergy Clin Immunol. 2005;115(2)S1:516.
42. Boari L, Castro Jr NP. Diagnóstico de rinossinusite crônica em pacientes com fibrose cística: correlação entre anamnese, nasofibroscopia e tomografia computadorizada. Braz J Otorhinolaryngol. 2005;71(6):705-10.
43. Gibson LE, Cooke RE. A test for concentration of eletrolytes in sweat in cystic fibrosis of the pancreas utilizing pilocarpine by iontophoresis. Pediatrics. 1959;23(3):545-49.
44. Lund VJ, Kennedy DW. Staging for rhinosinusitis. Otolaryngol Head Neck Surg. 1997;117:S35-40.
45. Stern RC, Boat TF, Wood RE, Matthews LW, Doershuk CF. Treatment and prognosis of nasal polyps in cystic fibrosis. Am J Dis Child. 1982;136:1067-70.
46. Nishioka GJ, Barbero GJ, König P, Parsons DS, Cook PR, Davis WE. Symptom outcome after functional endoscopic sinus surgery in patients with cystic fibrosis: a prospective study. Otolaryngol Head Neck Surg. 1995;113(4):440-5.
47. Moss RB, King VV. Management of sinusitis in cystic fibrosis by endoscopic surgery and serial antimicrobial lavage. Reduction in recurrence requiring surgery. Arch Otolaryngol Head Neck Surg. 1995;121(5):566-72.
48. Thomé DC, Voegels RL, Cataldo de la Cortina RA, Butugan O. Bilateral ethmoidal mucocele in cystic fibrosis: report of a case. Int J Pediatr Otorhinolaryngol. 2000;55:143-8.
49. Mackay IS, Djazaeri B. Chronic sinusitis in cystic fibrosis. J R Soc Med. 1994;87 Supl 21:17-9.
50. Cystic Fibrosis Foundation, Patient Registry. Bethesda, Maryland: 2002 Annual Data Report; 2003.
51. Alvarez AE, Ribeiro AF, Hessel G, Bertuzzo CS, Ribeiro JD. Fibrose cística em um centro de referência no Brasil: características clínicas e laboratoriais de 104 pacientes e sua associação com o genótipo e a gravidade da doença. J Pediatr. 2004;80(5):371-9.
52. Kennedy DW, Loury MC. Nasal and sinus pain: current diagnosis and treatment. Semin Neurol. 1988;8(4):303-14.
53. Jaffe BF, Strome M, Khaw KT, Shwachmann H. Nasal polypectomy and sinus surgery for cystic fibrosis: a 10-year review. Otolaryngol Clin North Am. 1977;10:81-90.
1. Mestre em Pediatria pela Faculdade de Medicina da Universidade Federal de Minas Gerais, Médica otorrinolaringologista do Hospital das Clínicas da Universidade Federal de Minas Gerais.
2. Pós-doutorado no Service de Pédiatrie et Pneumologie Pédiatrique do Hôpital d'Enfants Armand-Trousseau/Faculté de Médecine Saint-Antoine/Université Pierre et Marie Curie, PARIS VI., Professor titular do Departamento de Pediatria da Faculdade de Medicina da Universidade Federal de Minas Gerais e Coordenador da Unidade de Pneumologia Pediátrica e da Equipe Multidisciplinar de Fibrose Cística do Hospital das Clínicas da Universidade Federal de Minas Gerais.
3. Doutorado em Medicina-Oftalmologia pela Faculdade de Medicina da Universidade Federal de Minas Gerais, Professora Adjunta da Faculdade de Medicina da Universidade Federal de Minas Gerais.
4. Livre-docente pela Faculdade de Medicina de Ribeirão Preto da Universidade Federal de São Paulo, Professor Adjunto da Faculdade de Medicina da Universidade Federal de Minas Gerais.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 31 de agosto de 2008. cod. 6018.
Artigo aceito em 22 de junho de 2009.


