INTRODUÇÃOAs alterações, destruições e interrupções da arquitetura da cadeia ossicular na orelha média de seres humanos podem ser de origem infecciosa, traumática, tumoral, congênita ou por cirurgias prévias. Entretanto, os processos inflamatórios infecciosos1, focais ou generalizados que acometem a orelha média são os mais prevalentes. Essa patologia é definida como otite média.
As otites médias afetam 2% da população sendo que 8% de crianças em idade escolar. Acometem então milhões de pessoas todos os anos, gerando grandes gastos financeiros2.
Desse modo, se analisarmos somente o número de otites médias crônicas e suas muitas variantes: colesteatoma, granuloma de colesterol, otites adesivas, otite granulomatosa, a porcentagem de pessoas que podem precisar de intervenção cirúrgica para correção de defeitos nos ossículos é enorme. As cirurgias para reconstrução da cadeia ossicular são denominadas ossiculoplastias. As primeiras reconstruções foram feitas por Wullstein em 1956(3).
Nas ossiculoplastias são utilizados diferentes materiais, todos com bons resultados4, que segundo a sua natureza e origem são denominados autoenxertos, homoenxertos e próteses sintéticas5.
Os autoenxertos6 são os remanescentes dos ossículos, ossos da cortical craniana7 e cartilagem do próprio paciente8.
Os enxertos homólogos são ossículos obtidos em bancos de doações de órgãos, porém, após a AIDS, estão praticamente extintos.
Os materiais sintéticos são os mais utilizados. Dentre eles, temos as próteses de titânio9-11, cerâmica12,13, hidroxiapatita14,15, plastipore16, e cimento ósseo17.
O biosilicato® é um novo material que pode ser usado em orelhas médias com o objetivo de reconstruir a cadeia ossicular. Constitui-se uma vitrocerâmica bioativa do tipo A, ou seja, que se liga a tecido ósseo ou a tecido mole em algumas horas, devido à formação de hidroxicarbonatoapatita em sua superfície de contato, quando em contato com fluidos corpóreos18.
O objetivo deste trabalho é avaliar a ototoxicidade e vestibulotoxicidade do biosilicato em cobaias, para posterior utilização em humanos.
MATERIAL E MÉTODOConforme aprovação do Comitê de Ética, sob registro no 046/2005, foram utilizadas 15 cobaias albinas macho pesando 400g a 600g, com reflexo de Preyer presente e Emissões Otoacústica Produto de Distorção (equipamento: ILO 92 CAE System otodynamics LTD) presentes bilateralmente. Estas otoemissões foram feitas no pré e no pós-operatório (antes das cobaias serem sacrificadas) sem sedação, divididos em 3 grupos de 5 cobaias cada.
Estas cobaias foram anestesiadas com pentobarbital intraperitoneal 40mg/kg e injetado penicilina; logo em seguida infiltramos a região retroauricular com solução de xilocaína a 2% associado a adrenalina na diluição de 1:200.000 bilateralmente. Uma incisão retroauricular de aproximadamente 1 cm foi realizada até a exposição da bula bilateralmente, uma janela óssea foi aberta sob visão do microscópio DF Vasconcelos para o acesso a orelha média.
Nos grupos 1 e 2 foi colocado Biosilicato® em pó (Figura 1), fechando-se a bula com cimento ósseo em um total de 10 cobaias. No grupo 3 (controle) houve somente a abertura da bula, fechando-se em seguida com cimento odontológico.
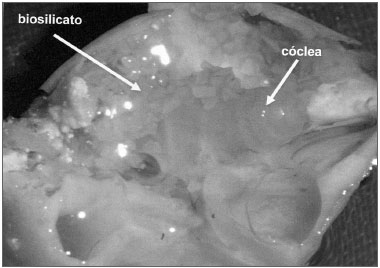
Figura 1. Cóclea de cobaia com otosilicato em pó, ao redor da cóclea e janela redonda.
No grupo 1 as cobaias foram sacrificadas 30 dias após e no grupo 2 e 3 foram sacrificadas com 90 dias após o procedimento cirúrgico. Suas cócleas, sáculo, utrículo e ampolas vestibulares foram retiradas para estudo de microscopia eletrônica de varredura (MEV).
As cobaias foram sacrificadas em tempo programado sob anestesia com éter, sendo decapitadas para posterior remoção de suas cócleas da bula.
Com dissecção microscópica as cócleas foram perfundidas em solução de fixação com glutaraldeído 3% a 4º Celsius e mantidas na solução por 24 horas para fixação. Os passos seguintes foram realizados no Laboratório de Microscopia Eletrônica do Departamento de Biologia celular e Molecular e de Bioagentes Patogênicos.
A solução de glutaraldeído a 3% em tampão fosfato 0,1M, pH = 7,4, foi injetada nas cócleas através da janela redonda por 4 horas a 4º Celsius, lavadas três vezes por 5 minutos com a mesma solução tampão, após foram fixadas com tetróxido de ósmio 1% por 2 horas a 4º Celsius e submetidas a uma desidratação à temperatura ambiente em uma bateria crescente de etanol (50%, 70%, 90% e 95% - uma vez por 10 minutos em cada concentração) e etanol absoluto três vezes por 15 minutos. Terminada a desidratação, foi realizada a secagem pelo método do ponto crítico em CO2, onde o material ficou desprovido de água. Após ser fixado em porta espécime adequado, o material foi revestido em câmara de vácuo com vapores de ouro e examinados por MEV (Microscópio Jeol JSM 5200).
Os resultados obtidos da MEV, depois de fotografados, foram analisados através de cocleogramas. Foram utilizadas as contagens do número de células ciliadas externas da espira basal da cóclea, em determinado campo fotográfico, sendo contadas dez células, presentes ou ausentes.
As máculas sacular e utricular, assim como as ampolas dos canais semicirculares, foram preparadas da mesma forma que a cóclea e montadas em porta espécime separado. Determinou-se que o dano ao neuroepitélio vestibular seria baseado no desaparecimento ou rarefação dos feixes de estereocílios das células ciliadas vestibulares avaliadas por MEV.
RESULTADOSTodas as 5 cobaias (10 orelhas), que foram sacrificadas com 30 dias apresentaram células ciliadas externas e internas preservadas sem nenhum sinal de ototoxicidade (Figura 2) quando avaliadas por MEV. Foi realizado teste exato de Fisher (nível de significância de p?0,05) com resultado de p=1, indicando ausência de ototoxicidade no grupo do otosilicato, estatisticamente significativa.
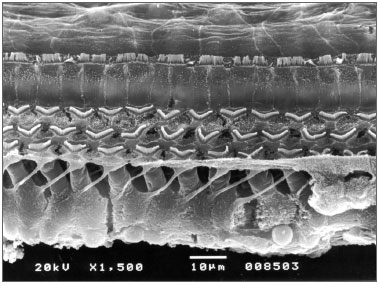
Figura 2. Rampa basal da cóclea do grupo de otosilicato com 30 dias, onde observamos a presença de todas as células ciliadas externas e internas.
As cobaias que foram sacrificadas com 90 dias apresentaram no grupo 2, com otosilicato e no grupo 3, apenas com abertura bular (5 cobaias em cada grupo), totalizando 20 orelhas, não mostraram sinais de ototoxicidade (Figura 3). Pelo teste exato de Fisher, p=1, não ocorreu ototoxicidade nos grupos 2 e 3 com significância estatística.

Figura 3. Rampa basal do grupo de otosilicato com 90 dias. Presença de células ciliadas externas e internas sem lesão.
Não observamos sinais de vestibulotoxicidade nas cobaias testadas com 30 e 90 dias de exposição ao otosilicato (p>0,05). (Figuras 4 e 5)
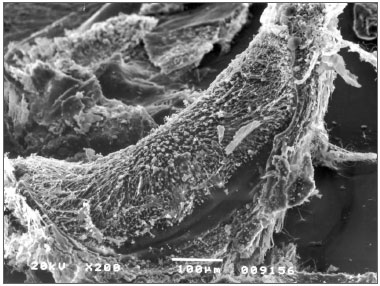
Figura 4. Crista da ampola do canal lateral sem alteração. Grupo de otosilicato 30 dias.
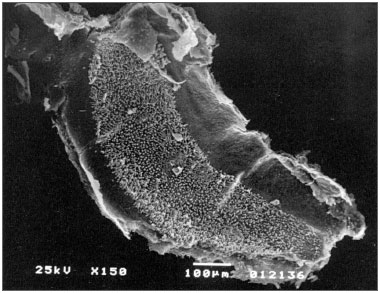
Figura 5. Mácula sacular do sáculo do grupo otosilicato 90 dias, sem lesão.
Diferentes modelos animais foram testados para avaliar a ototoxicidade de materiais biocompatíveis para uso de próteses em orelha média como rato19, camundongo20, cobaias21, coelhos1, gato22. Zikk et al.21 utilizou grânulos de ceravital, não observando perda auditiva medida pelo potencial evocado auditivo de tronco encefálico em 100% dos animais.
O otosilicato (biosilicato®) comprovou não ser ototóxico ou vestibulotóxico para as cobaias testadas, não havendo nenhuma destruição de células ciliadas externas ou internas cocleares com 30 ou 90 dias de exposição, comprovando ser um material de boa tolerabilidade e compatibilidade como já demonstrado em outros estudos18. No estudo de Moura (2007) também foi observada a formação de hidroxicarbonato apatita na superfície do otosilicato após 24 horas, em líquido de cultura de células, mostrando sua alta bioatividade (classe A). Com esta acelerada osteogênese in vitro, existe uma menor possibilidade de extrusão para este material no pós-operatório de ossiculoplastias.
Assim, com a aprovação pelo Comitê de Ética Experimental em humanos, iniciamos a utilização deste material como prótese para a orelha média em humanos, seja prótese parcial, quando temos o estribo presente, ou prótese total, quando apoiamos a prótese diretamente na platina do estribo. Iniciamos os procedimentos cirúrgicos em humanos, com expectativa de sucesso pelos primeiros resultados obtidos, porém devido ao número reduzido de casos e pelo tempo de acompanhamento restrito este estudo necessitará ser ampliado.
CONCLUSÃOO otosilicato (biosilicato®) não apresentou ototoxicidade ou vestibulotoxicidade para as cobaias estudadas, mostrando-se ser um material seguro e promissor para utilização como prótese para reconstrução ossicular em humanos.
REFERÊNCIAS BIBLIOGRÁFICAS1. Reck R. Bioactive glass-ceramics in ear surgery: animal studies and clinical results. Laryngoscope. 1984; 94(2 Pt 2 Suppl 33):1-54.
2. Caldas N, Caldas Neto SS. Reconstrução ossicular do ouvido médio - custos versus resultados. Rev Bras Otorrinolaringol. 1989;55(3):127-32.
3. Wullstein H. The restoration of the function of the middle ear, in chronic otitis media. Ann Otol Rhinol Laryngol. 1956;65(4):1021-41.
4. Neto S C, Ganança F F, Caldas N. Reconstrução ossicular em timpanosclerose. Rev Bras Otorrinolaringol. 1991;57(3):128-34.
5. Arnaldo Linden A, Costa S S, Smith M M.Timpanoplastia: Evolução nas técnicas de reconstrução de cadeia ossicular. Rev Bras Otorrinolaringol. 2000;66(2):136-42.
6. Desaulty A, Shahsavari S, Pasquesoone X. Ossicular reconstruction with autograft in type III. Rev Laryngol Otol Rhinol. (Bord) 2005;126(1):19-23.
7. Romanet P, Duvillard C, Delouane M. Mastoid cortical bone grafts in ossiculoplasty. Ann Otolaryngol Chir Cervicofac. 2000;117(2):105-9.
8. Neumann A, Schultz-Coulon HJ, Jahnke K. Type III tympanoplasty applying the palisade cartilage technique: a study of 61 cases. Otol Neurotol. 2003;24(1):33-7.
9. Stupp CH, Stupp HF, Grun D. Replacement of ear ossicles with titanium prostheses. Laryngorhinootologie. 1996;75(6):335-7.
10. Nguyen DQ, Lavieille JP, Schmerber S. Failure rate and revision surgery in ossiculoplasty with Kurz titanium prosthesis. Rev Laryngol Otol Rhinol. (Bord) 2004;125(3):157-62.
11. Ho SY, Battista RA, Wiet RJ. Early results with titanium ossicular implants. Otol Neurotol. 2003;24(2):149-52.
12. Reck R, Helms J. The bioactive glass ceramic Ceravital in ear surgery. Five years experience. Am J Otol. 1985;6(3):280-3
13. Niparko JK, KeminkJL, Graham MD, Kartush JM. Bioactive glass ceramic in ossicular reconstruction: a preliminary report. Laryngoscope. 1988;98(8 Pt 1): 822-5.
14. Folia M, Abedipour D, Naiman N,Truy E. Revision ossiculoplasty: anatomical and functional results. Rev Laryngol Otol Rhinol. (Bord) 2006;127(3):121-5.
15. Truy E, Naiman AN, Pavillon C, Abedipour D, Lina-Granade G, Rabilloud M. Hydroxyapatite versus titanium ossiculoplasty. Otol Neurotol. 2007;28(4):492-8.
16. Shea JJ, Emmett JR. Biocompatible ossicular implants. Arch Otolaryngol. 1978;104(4):191-6.
17. Hoffmann KK, Kuhn JJ, Strasnick B. Bone cements as adjuvant techniques for ossicular chain reconstruction. Otol Neurotol. 2003;24(1):24-8.
18. Moura J, Teixeira LN, Ravagnani C, Peitl O, Zanotto ED, Beloti MM, et al. In vitro osteogenesis on a highly bioactive glass-ceramic (Biosilicate). J Biomed Mater Res. A2007;82(3):545-57.
19. Pinilla M, Ramirez-Camacho R, Jorge E, Trinidad A, Vergara J. Ventral approach to the rat middle ear for otology research. Otolaryngol Head Neck Surg. 2001;124(5):515-7.
20. Kawanabe K, Yamamuro T, Nakamura T, Kotani S. Effects of injecting massive amounts of bioactive ceramics in mice. J Biomed Mater Res. 1991;25(1):117-28.
21. Zikk D, Rapoport Y, Bloom J, Himelfarb MZ. Auditory brain-stem responses in guinea pigs following middle ear implantation of Ceravital. Eur Arch Otorhinolaryngol. 1990;248(2):102-4.
22. Mischke RE, Hyams V, Shea JJ, Gross CW. Proplast in the middle ear and oval window of cats. Arch Otolaryngol. 1977;103(8):489-92.
1 Professor Doutor, Professor Assistente do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
2 Médico Residente em Otorrinolaringologia do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
3 Médico Residente em Otorrinolaringologia do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
4 Professor Doutor, Docente em Engenharia de Materiais da Universidade Federal de São Carlos.
5 Professor Doutor, Professor Assistente do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
6 Professor Titular de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 14 de julho de 2008. cod. 5939
Artigo aceito em 20 de outubro de 2008.


