INTRODUÇÃOOs princípios básicos da cirurgia sustentam-se em três alicerces: a diérese, a síntese e a hemostasia1. Vários aparelhos que produzem calor foram desenvolvidos e introduzidos na prática cirúrgica nos últimos anos a fim de melhorar a hemostasia, com mínimo dano tecidual durante as operações. Esses aparelhos incluem eletrocautérios, radiofrequência e laser de CO2, os quais usam energia térmica para desnaturar proteínas levando ao tamponamento vascular e consequente hemostasia, mas apresentam desvantagem devido ao aquecimento lateral do campo operatório, podendo danificar as estruturas da região de sua aplicação e atrasar a cicatrização da ferida2.
Atualmente, entre os métodos diferenciados de incisão e hemostasia disponíveis, destacam-se o bisturi harmônico ultrassônico (BHU), a radiofrequência, o eletrocautério e o raio laser3.
O aquecimento do tecido provocado pelo BHU apresenta grau mínimo na profundidade em comparação ao laser, radiofrequência e eletrocautério, com reduzido dano tecidual4. Metternich et al.5,6 mostram a diferença macroscópica da cicatrização da mucosa em feridas realizadas com bisturi com lâmina fria (BLF) e BHU, porém estes trabalhos direcionam o objetivo para a facilidade do uso dos instrumentos e pouco relatam o resultado dos efeitos no processo de cicatrização. Dessa forma o estudo histopatológico experimental torna-se importante para o reconhecimento da evolução do processo cicatricial nas lesões da cavidade oral tratadas com este tipo de instrumento. Com o objetivo de avaliar a evolução macro e microscópica do processo de cicatrização de feridas realizadas com BHU na mucosa jugal, desenvolvemos estudo experimental em ratas.
MATERIAL E MÉTODO
Desenho do EstudoEstudo prospectivo do processo de cicatrização realizado com 30 ratas (Rattus norvegicus albinus, Rodentia mammalia) da linhagem Wistar. O estudo foi aprovado pelo Comitê de Ética em Uso de Animais da Pontifícia Universidade Católica do Paraná, com protocolo no 69, e obedeceu a lei federal nº 6638 e às orientações do Colégio Brasileiro de Experimentação Animal (COBEA). Foram utilizadas 10 ratas em cada tempo de avaliação (terceiro, sétimo e décimo quarto dias), escolhidos aleatoriamente.
ProcedimentoO procedimento cirúrgico foi executado com os animais sob anestesia geral através do uso de quetamina e xylasina intramuscular. Todos os animais receberam uma incisão longitudinal na mucosa jugal de ambos os lados da boca, utilizando-se no lado esquerdo o BLF e no lado direito o BHU. Tomou-se como referência a altura da rima labial, com a incisão se estendendo por um centímetro de comprimento e profundidade até o plano muscular. As feridas não sofreram tratamento de síntese e a cicatrização foi por segunda intenção. Utilizou-se acetaminofen por via oral com dose única de 200 mg/kg no pós-operatório.
A avaliação clínica foi realizada no pós-operatório imediato, terceiro, sétimo e décimo quarto dias. Logo após a confecção da incisão, foi observada a presença ou ausência de sangramento e quando presente classificou-se de leve quando se percebia sinal de sangue sobre a ferida, moderado quando exigia compressão para estancar o sangramento e acentuado quando, mesmo com a compressão, o sangramento se mantinha. Na avaliação macroscópica evolutiva das feridas verificou-se se estavam abertas ou fechadas, largas ou estreitas, com ou sem tecido de granulação. Nas feridas fechadas, observou-se se estavam deprimidas ou imperceptíveis. Os animais, em grupos de dez escolhidos aleatoriamente, foram submetidos à eutanásia conforme o tempo programado de pós-operatório através de injeção intraperitoneal de pentobarbital sódico na dose de 120 mg/kg (resolução 714 do Conselho Federal de Medicina Veterinária).
Análise HistopatológicaApós a eutanásia, a cicatriz da mucosa jugal de ambos os lados foram retiradas através de fragmento fusiforme e fixados em formol a 10% por 24 horas. Após processadas, foram coradas com hematoxilina-eosina (HE). A análise morfológica foi realizada nos três momentos determinados, ou seja, terceiro, sétimo e décimo quarto dias após a provocação da lesão.
Avaliou-se a quantidade de células predominantes na reação inflamatória, a presença de edema intersticial, de congestão vascular, grau de formação de tecido de granulação e de fibroplasia, microabscessos e necrose.
Análise morfométrica foi realizada apenas no sétimo e décimo quarto dias, uma vez que os marcadores estavam direcionados para a fase crônica da inflamação e cicatrização.
O Sirius red foi utilizado para a avaliação do colágeno. A imunoistoquímica foi avaliada com anticorpos anti-fator VIII e anti-CD3, para contagem de vasos neoformados e linfócitos T, respectivamente.
A análise estatística para comparação dos dois tipos de bisturis foi realizada através do teste não-paramétrico de Wilcoxon, teste binomial e o teste não paramétrico de Mann-Whitney.
RESULTADOSRegistrou-se o óbito de um animal no pós-operatório imediato por sangramento acentuado na incisão feita com BLF. Ainda na observação imediata das 30 ratas, as incisões com BLF eram estreitas e as realizadas com BHU largas (Figuras 1 e 2). No terceiro dia as feridas com BHU eram mais largas e mais deprimidas e todas se apresentavam com tecido de granulação. No sétimo dia todas as incisões com BLF estavam fechadas e niveladas enquanto que as feitas com BHU apresentavam-se abertas, largas, deprimidas e com tecido de granulação. No décimo quarto dia as cicatrizes das incisões feitas com BLF apresentavam-se imperceptíveis, e aquelas realizadas com BHU estavam ainda não totalmente epitelizadas.
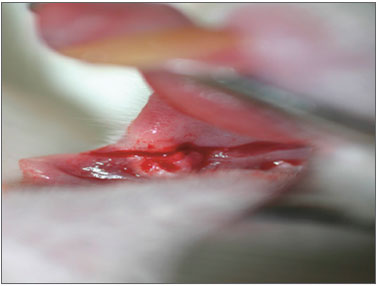
Figura 1. Aspecto imediato da incisão com BLF.
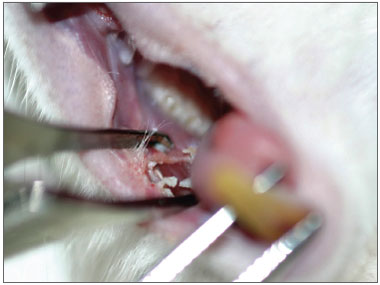
Figura 2. Aspecto imediato da incisão com BHU.
Na análise microscópica no terceiro dia, ambas as feridas apresentavam processo inflamatório agudo. No sétimo dia, nas incisões com BLF a cicatrização da ferida era completa e com processo inflamatório crônico. Nas incisões com BHU as feridas apresentavam ainda processo inflamatório agudo. No décimo quarto dia os cortes histológicos das cicatrizes das incisões feita com BLF mostravam regeneração completa e as incisões feitas com BHU apresentavam processo inflamatório crônico (Figuras 3, 4, 5, 6, 7 e 8).

Figura 3. Fotomicrografias de cortes histológicos mostrando a presença do processo inflamatório, no terceiro dia de evolução, nas feridas feitas com BLF (HE, 100 X).
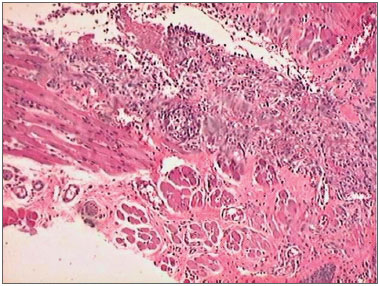
Figura 4. Fotomicrografias de cortes histológicos mostrando a presença do processo inflamatório, no terceiro dia de evolução, nas feridas feitas com BHU (HE, 100 X).
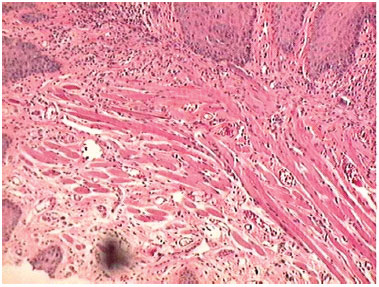
Figura 5. Fotomicrografias de cortes histológicos mostrando a presença do processo inflamatório, no sétimo dia de evolução, nas feridas feitas com BLF (HE, 100 X).
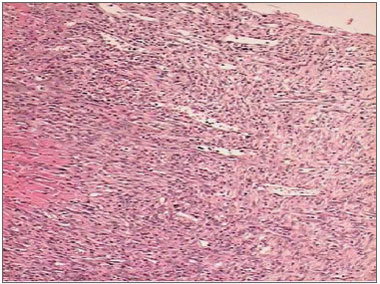
.
Figura 6. Fotomicrografias de cortes histológicos mostrando a presença do processo inflamatório, no sétimo dia de evolução, nas feridas feitas com BHU (HE, 100 X).
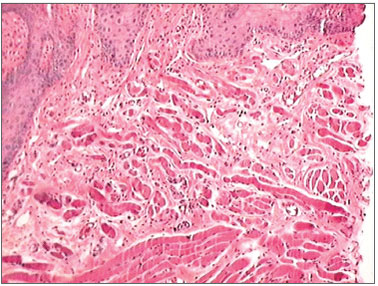
Figura 7. Fotomicrografias de cortes histológicos mostrando a presença do processo inflamatório, no décimo quarto dia de evolução, nas feridas feitas com BLF (HE, 100 X).
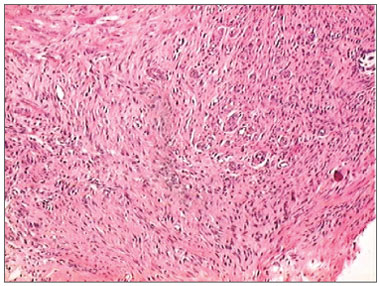
Figura 8. Fotomicrografias de cortes histológicos mostrando a presença do processo inflamatório, no décimo quarto dia de evolução, nas feridas feitas com BHU (HE, 100 X).
Na microscópica morfométrica a avaliação do colágeno foi no sétimo e décimo quarto dia. As intensidades do colágeno no sétimo dia foram maiores nas feridas feitas com BLF tanto na fração I (p=0,005) como na III (p=0,037) (Tabela 1). No décimo quarto dia os valores se mantiveram favoráveis ao BLF para colágeno I (p=0,008) porém com maior intensidade para colágeno III com o BHU (p=0,038) (Tabela 2).
A análise com anti-CD3 no sétimo dia revelou maior número de linfócitos T nas feridas feitas com BHU (p= 0,005), já no décimo quarto dia a concentração dessas células era semelhante nas duas feridas (Tabela 3). A análise com anti-fator VIII tanto no sétimo dia e décimo quarto dias revelou maior número de neovasos nas feridas feitas com BHU com p=0,005 para o sétimo e décimo quarto dias (Tabela 4).
DISCUSSÃOO BHU é um instrumento de corte e hemostasia simultânea. Tem sido utilizado largamente em videocirurgias e recentemente em procedimentos otorrinolaringológicos e nas cirurgias de cabeça e pescoço. Suas propriedades são defendidas por vários autores3-13. No estudo ora apresentado houve uma tendência a melhor hemostasia provocada pelo BHU, pois as incisões feitas com este aparelho não apresentaram sangramento. Entretanto, nas feridas realizadas com BLF ocorreu a morte de um animal devido a hemorragia. As feridas feitas com BLF foram mais finas e no sétimo dia já estavam reepitelizadas, o que não ocorreu de forma completa até o décimo quarto dia nas feridas feitas com BHU14. Provavelmente o atraso do processo se deva ao fato de que, mesmo desenhando incisões de igual tamanho, após a confecção, as incisões feitas com BHU resultam em feridas mais amplas do que as feitas com BLF. Sinha e Gallagher2 demonstraram que na mucosa oral de Guinea pig o BHU promoveu processo inflamatório prolongado e mais intenso e confirmou essas informações em todas as fases da análise. O BHU mostrou processo inflamatório maior em relação ao BLF, e isto é compreensível, pois as incisões feitas com BLF resultaram em margens regulares e bem definidas enquanto as resultantes do BHU eram mais largas e com maior destruição tecidual, o que levou a um processo inflamatório mais intenso e prolongado na cicatrização. Considerando que a reação inflamatória se mostrou mais intensa e prolongada nas feridas feitas com BHU, era de se esperar que existisse atraso com relação à fibroplasia2,14,15. No presente estudo verificou-se que a densidade do colágeno encontrada nos cortes histológicos foi maior nas feridas resultantes com BLF no sétimo dia de avaliação. Além disso, no décimo quarto dia encontrou-se maior quantidade de colágeno III nas feridas resultantes do BHU, demonstrando que havia atraso de maturação cicatricial. A análise com imunoistoquímica demonstrou processo inflamatório maior e mais prolongado nas feridas feitas com BHU15 pela quantidade de linfócitos T e neovasos. Embora as incisões realizadas com BHU produzam atraso no processo cicatricial em relação às produzidas com BLF e confirmadas neste estudo pelas avaliações clínicas, microscópicas morfológicas e morfométricas, o BHU é um instrumento de corte e coagulação simultânea e com baixa produção de energia térmica nos tecidos, proporcionando uma operação limpa e mais rápida, devido à ausência de sangramento. Mais estudos devem ser feitos para comprovar o efeito da temperatura nos tecidos em relação à profundidade, pois outros tipos de bisturis elétricos e com raio laser transmitem muito calor ao contrário do BHU que produz menos calor em relação a estes aparelhos.
CONCLUSÃOIncisões com BHU realizadas na mucosa jugal de ratas proporcionou atraso do processo de regeneração, promoveu processo inflamatório mais acentuado e prolongado, desenvolveu maior atividade angiogênica e atrasos na fibroplasia e maturação das cicatrizes, comparado a incisões com BLF.
REFERÊNCIAS BIBLIOGRÁFICAS1. Rutkow IM. Moments in surgical history: Willian Stewart Halsted. Arch Surg. 2000;135(12):1478.
2. Sinha UK, Gallagher LA. Effects of steel scalpel, ultrasonic scalpel, CO2 Laser, and monopolar and bipolar electrocirurgy on wound healing in Guinea Pig oral mucosa. Laryngoscope. 2003;(113):228-36.
3. Emann TA, Cushieri A. How safe is high-power ultrasonic dissection? Ann Surg. 2003;237(2):186-91.
4. Metternich FU, Sagowski C, Wenzel S, Jakel T, Lewver R, Koch U. Prelimary results for superficial parotidectomy using the ultrasonically activated scalpel (Ultracision Harmonic Scalpel). Laryngorhinootologie. 2003;82(7):514-9.
5. Metternich FU, Wenzel S, Sagowski C, Jakel K, Koch U. Surgical treatment of rinophyma with the ultrasonic scalpel (Ultracision Harmonic Scalpel). Laryngorhinootologie. 2003;82(2):132-7.
6. Metternich FU, Wenzel S, Sagowski C, Jakel T, Koch U. The "Ultracision Harmonic Scalpel" ultrasound activated scalpel. Initial results in surgery of the tongue and soft palate. HNO. 2002;50(8):733-8.
7. Metternich FU, Sagowski C, Wenzel S, Jakel K. Tonsillectomy with the ultrasound activated scalpel. Initial results of technique with Ultracision Harmonic Scalpel. HNO. 2001;49(6):465-70.
8. Sood S, Corbridge R, Powles J, Bates G, Newbegin CJR. Effectiveness of the ultrasonic harmonic scalpel for tonsillectomy. Ear Nose Throat J. 2001;80(8):514-8.
9. Ramos FA, Ferreira RDP, Silva RHS, Prado EP, Corso R, Pinto JA. Comparative study between two tonsilectomy techniques: Ultracision harmonic scalpel and traditional dissection with cold scalpel. Rev Bras Otorrinolaringol. 2004;70(3):316-22.
10. Koch C, Friedrich T, Metternich F, Tannapfel A, Reimann HP, Eichfeld U. Determination of temperature elevation in tissue during the application of the harmonic scalpel. Ultrasound Med Biol. 2003;29(2):301-9.
11. Haegner U, Handrock M, Schade H. "Ultrasound Tonsillectomy" in comparison with traditional tonsillectomy. HNO. 2002;50(9): 836-43.
12. Laszig R, Ridder GJ, Aschendorff A, Fradis M. Ultracision: an alternative to electrosurgery in revision cochlear implant surgery. Laryngoscope. 2002;112(1):190-1.
13. Sherman JA, Davis HT. Ultracision: the harmonic scalpel and its possible uses in maxillofacial surgery. J Oral Maxillofac Surg. 2000;38(5): 530-2.
14. Hambley R, Hebda PA, Abell E, Cohen BA, Jegasothy BV. Wound healing of skin incisioins produced by ultrasonically vibrating knife, scalpel, electrosurgery, and carbon dioxide laser. J Dermatol Surg Oncol. 1988;14: 1213-12
15. Liboon J, Funkhouser W, Terris D J. A Comparison of mucosal inicsions made by scalpel, CO2 laser, electrocautery, and constant-voltage electrocautery. Otolaryngol-Head Neck Surg. 1997;116(3):379-85.
1 Mestrado em Clínica Cirúrgica, médica otorrinolaringologista.
2 Doutor em Clínica Cirúrgica, Professor Adjunto da UFPr e Prof. Titular da PUCPr.
3 Doutor em otorrinolaringologia, Chefe do departamento de otorrinolaringologia e professor titular da UFPr.
4 Doutor em otorrinolaringologia, Professor adjunto do departamento de otorrinolaringologia da UFPr.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 18 de fevereiro de 2008. cod 5720
Artigo aceito em 15 de setembro de 2008.


