Introdução A deficiência auditiva na infância apresenta uma prevalência mundial de 1,5/1000 nascidos vivos, com variação de 0,8 a 2/1000. Pode ser classificada em sensorioneural, condutiva ou mista; uni ou bilateral; simétrica ou assimétrica; sindrômica ou não-sindrômica; congênita, peri ou pós-natal; genética ou não-genética; pré-lingual, peri-lingual ou pós-lingual. De acordo com o Bureau International D'Audiophonologie (BIAP), classifica-se a perda auditiva em leve (20 a 40 dBNA), moderada (40 a 70 dBNA), severa (70a 90 dBNA) e profunda (acima de 90 dBNA).1,2,3
A identificação e reabilitação precoces são essenciais para o desenvolvimento da fala, da linguagem e outras funções cognitivas durante a idade escolar. Além disso, pesquisas mostram a existência de um período crítico nos primeiros anos de vida para a aquisição da fala. A ausência de estimulação auditiva adequada na infância pode impedir o total desenvolvimento e amadurecimento das vias auditivas centrais.2,3
Este estudo analisa as principais causas de deficiência auditiva em alunos freqüentadores
da Escola de Ensino Especial para deficientes auditivos e visuais "Anne Sullivan" situada em São Caetano do Sul e compara os dados obtidos com a literatura mundial.
Casuística e método A Escola Municipal "Anne Sullivan" destaca-se pelo ensino e estimulação de crianças com deficiência auditiva e visual, promovendo a sua alfabetização e integração na sociedade, através do ensino de LIBRAS (linguagem de sinais) até o segundo grau de escolaridade.
Realizou-se um estudo retrospectivo através do levantamento de prontuários de todas os alunos freqüentadores da Escola no ano de 2001. Aplicou-se um protocolo constituído de informações minuciosas da anamnese com a família, investigação do passado obstétrico da mãe, incluindo gestação, parto e intercorrências, avaliações fonoaudiológica e psicológica, exame otorrinolaringológico completo e o desenvolvimento e a interação do paciente com a família e sociedade. Além dessas informações, foi feito um levantamento da investigação médica e fonoaudiológica realizada desde a época da suspeita da deficiência pela família até a sua confirmação com exames diagnósticos objetivos.
Foram examinados as causas determinantes e os fatores contribuintes para a perda auditiva, a distribuição por sexo, a idade da suspeita e do diagnóstico bem como o grau da disacusia. (Quadro 1)
Resultados Cento e trinta e um pacientes foram examinados, sendo 67 do sexo masculino (51%) e 64 do sexo feminino (49%). Em relação à idade, 14% dos casos estavam entre 3 a 9 anos (19 alunos), 58% entre 10 a 16 anos (75 alunos), 20% entre 17 a 23 anos (26 alunos), e 8% entre 24 e 30 anos (11 alunos). (Gráfico 1)
A disacusia sensorioneural foi a mais encontrada, representando 99% dos casos. Quanto ao grau, 65% dos casos (85 alunos) apresentavam perda profunda, 33% dos casos (44 alunos) severa e 2% (2 casos) moderada. (Gráfico 2) Não havia nenhum caso de perda leve.
Na análise dos dados referentes à causa identificável, os resultados estão na Tabela 1. A etiologia não definida chegou a 25,2% dos casos e a rubéola congênita em 23,6%.
Cerca de 19,8% dos alunos (26 casos) apresentaram múltiplos fatores na anamnese em relação aos períodos pré e peri-natais. (Tabela 2)
Quanto à idade da suspeita da deficiência, dois picos foram observados, dos 8 a 10 meses e 12 a 24 meses de idade. A confirmação diagnóstica foi de 12 a 30 meses na maioria das crianças (Gráficos 3 e 4) através da realização de Potenciais Evocados Auditivos do Tronco Cerebral (BERA).
Todas os alunos examinados estavam protetizados. Cerca de 20% dos alunos (27 casos) colocaram o aparelho auditivo aproximadamente 1 ano após o diagnóstico; 17% dos pacientes (22 casos) após 2 anos e 14% dos alunos (18 casos) foram protetizados no momento do diagnóstico. (Gráfico 5)
Discussão Segundo Walch et al.1, a história extraída dos pais sobre causas hereditárias, pré, peri ou pós-natais para a deficiência é o método mais eficiente para se tentar estabelecer a etiologia da deficiência auditiva em crianças. Assim como em nosso protocolo, a anamnese deve incluir questões sobre infecções e uso de medicamentos durante a gravidez, dados a respeito do nascimento (peso, asfixia, hiperbilirrubinemia), comportamento e desenvolvimento da criança e a situação familiar. De uma maneira geral, a causa pode ser classificada em hereditária, adquirida e desconhecida.
Em muitas situações, mesmo com uma investigação minuciosa, a etiologia precisa da perda auditiva não pode ser definida, como demonstraram Niehaus et al.4 após revisão da literatura de 1953 a 1995. Walch et al.1 (44% de crianças sem causa definida) e Lima et al. (33%) também encontraram a mesma dificuldade diagnóstica.
Em nosso levantamento retrospectivo, a etiologia não definida foi a mais representativa, com 25,2% dos casos, corroborando com os estudos descritos.5 Está evidente que um número significante de perdas auditivas classificadas como desconhecidas, na realidade representam casos que podem ser de causa hereditária recessiva ou mesmo resultantes de infecções subclínicas por vírus, como por exemplo, o Citomegalovírus.6
Testes genéticos, imunológicos e de funções hepáticas e tireoideanas devem ser requisitados para diminuir esse grande número de disacusias classificadas como de origem desconhecida. Tomografia computadorizada de alta resolução contribui na pesquisa diagnóstica, pois pode detectar de 8 a 20% dos casos de malformações da orelha resultantes de insultos ocorridos no final do terceiro trimestre de gestação.1
A rubéola congênita é a principal causa pré-natal de perda auditiva pelos seus efeitos teratogênicos. Há vulnerabilidade importante do feto no primeiro trimestre da gestação aos efeitos do vírus que costuma provocar a tríade clássica: catarata congênita, surdez e malformações cardíacas.1,7 Constatamos em nosso estudo que a rubéola congênita correspondeu a 23,6% dos casos e foi a causa identificável mais expressiva de deficiência auditiva, confirmando estudos já realizados nos países em desenvolvimento.5,8-11
Outras etiologias relevantes foram associações de fatores patogênicos (19,8%) como descritos na Tabela 2 e a meningite foi a etiologia pós-natal mais importante de disacusia sensorioneural. (Tabela 1) A incidência de meningite na literatura varia de 6 a 22%.1,5,12-15 Em nosso estudo apresentou relevância de 8,4%. Pode haver perda auditiva uni ou bilateral, variando de moderada a profunda. Os principais patógenos envolvidos são Meningococos, Pneumococos, Estreptococos B hemolíticos e Haemophylus influenzae.
O emprego abusivo de drogas ototóxicas, principalmente antibióticos aminoglicosídeos para o tratamento de broncopneumonias e enterocolites, pode determinar a disacusia sensorioneural em índices expressivos. Em nosso estudo foi responsável por 3% dos casos. Outros antimicrobianos poderiam ser empregados com benefício, porém com menores efeitos deletérios.16-19
Diante desses dados, observa-se que algumas das principais causas de perda auditiva na infância como rubéola, meningite e ototoxicidade, são passíveis de prevenção. Utilizando-se medidas simples como programas de vacinação, orientação pré-natal adequada, maior informação de profissionais de saúde quanto à prescrição de medicações ototóxicas, pode-se realizar a profilaxia da deficiência auditiva.
A consangüinidade não mostrou incidência estatisticamente significante (2,3%), o que difere da literatura pesquisada, na qual ocupa posição de destaque, principalmente nos países desenvolvidos e nos países árabes.20-22 Pesquisadores acreditam que mais de 60% dos casos congênitos são causados por fatores genéticos. Além disso, uma fração da perda auditiva pós-lingual também tem origem genética. Mais ainda, muitos estudos estimam que metade a um terço da surdez em humanos apresenta um componente hereditário e, possivelmente uma mutação genética associada.1,23
Apesar da baixa relevância em nosso estudo (1,5%), as otites de repetição, quando não diagnosticadas e tratadas precocemente, podem prejudicar o desenvolvimento cognitivo em crianças.24
A deficiência auditiva em crianças e jovens ainda é um importante problema de saúde pública no Brasil, não só em sua prevalência como também nas conseqüências devastadoras do seu diagnóstico e tratamento tardios.
A detecção precoce tornou-se uma prioridade desde 1990 nos Estados Unidos, onde se considerava ideal o diagnóstico da deficiência até 12 meses de idade, segundo o documento Healthy People 2000: National Health Promotion and Disease Prevention Objectives.2,3 O Joint Comittee for Infant Hearing (1994) e o Consenso Europeu de Milão (1998) consideram três meses de idade como sendo a época ideal do diagnóstico. Hoje, nos Estados Unidos foi criado o Marion Downs National Center for Infant Hearing cuja preocupação é o Rastreio Universal de todos os recém-nascidos.25 Tudo isso propõe a reabilitação precoce das crianças para proporcionar o desenvolvimento da linguagem e comunicação.
O Consenso do Instituto Nacional de Saúde de 1993 dos Estados Unidos recomenda o screening audiológico para todas as crianças admitidas nas Unidades de Terapia Intensiva neonatais e todas as outras crianças até os 3 primeiros meses de vida, com Emissões Otoacústicas (EOAs) como exame inicial, seguido pelos Potenciais Evocados Auditivos do Tronco Cerebral (BERA) se EOAs alteradas.1-3,26-28
Embora sejam relativamente de alto custo, os métodos de screening são altamente sensíveis e não invasivos, além de totalmente viáveis para a detecção precoce da perda auditiva. Entretanto, a precocidade da identificação dessa desordem nos países em desenvolvimento está absolutamente inadequada e atrasada.1,5 Em nosso trabalho, observamos que a idade da suspeita da deficiência auditiva pela família predominou em 2 picos: 8 a 10 meses e entre 12 a 24 meses de vida, que corresponde a uma faixa etária muito tardia para proporcionar o desenvolvimento adequado das crianças na sociedade. Além disso, o diagnóstico foi confirmado através de exames objetivos (Potenciais Evocados Auditivos do Tronco Cerebral) somente entre 12 a 30 meses de idade na maioria das crianças.
Infelizmente, sabe-se que o Brasil ainda não apresenta uma triagem neonatal universal disponível em todos os Hospitais e Maternidades Públicas. Uma grande porcentagem de gestantes não tem acesso a um acompanhamento pré-natal eficiente.
A prevenção da surdez comprovadamente custa muito menos do que o seu tratamento (protetização ou implante coclear). Além disso, a reabilitação dessas crianças para o desenvolvimento do processo auditivo e sua integração na sociedade é muito mais dispendiosa e trabalhosa para a área da saúde do que a simples profilaxia.
Em relação ao período de protetização, a maioria dos alunos (20%) somente conseguiu o aparelho auditivo 1 ano após a confirmação diagnóstica da perda auditiva. Houve casos que levaram 5 a 10 anos para a protetização. Basicamente tal fato pode ser explicado pela dificuldade econômica na compra e manutenção do aparelho auditivo pelas famílias carentes.
Certamente todos esses dados provocam certa indignação, principalmente quando se sabe que a maioria das causas adquiridas de perda auditiva (rubéola congênita, uso de drogas ototóxicas, meningite, etc.) poderiam ser prevenidas, e em países desenvolvidos raramente ocorrem atualmente, conforme comprovamos em nosso levantamento. Ainda, no Sistema Público de Saúde do Brasil o fornecimento de aparelhos auditivos é precário, muito deficiente e vagaroso.
Diante da expressiva porcentagem de causas não definidas, sugere-se a elaboração e aplicação de um questionário detalhado pelas instituições de saúde a fim de minimizar este número, bem como a realização de exames objetivos precocemente frente à suspeita da deficiência. É imprescindível a conscientização de pais e profissionais envolvidos (professores, pediatras, otorrinolaringologistas) para que as crianças sejam encaminhadas precocemente para instituições especializadas.
Conclusão A etiologia não definida para perda auditiva foi a mais representativa, seguida pela rubéola congênita. A maioria das causas adquiridas observadas nos alunos da Escola Especial "Anne Sullivan", assim como no Brasil, é totalmente passível de prevenção.
Atualmente, o diagnóstico e o tratamento (protetização) são demasiadamente tardios e não possibilitam o desenvolvimento do processo auditivo adequado para as crianças.
Referências Bibliográficas 1. Walch C, Anderhuber W, Köle W, Berghold A. Bilateral sensorineural hearing disorders in children: etiology of deafness and evaluation of hearing tests. Int J Pediatr Otorhinolaryngol 2000;53:31-8.
2. Brookhouser PE, Grundfast K M. In: Cummings CW et al. Otolaryngology Head and Neck Surgery. 3rd ed. St. Louis: ed. Mosby; 1998. p.504-34.
3. Stelmachowicz PG, Gorga MP. In: Cummings CW. et al. Otolaryngology Head and Neck Surgery. 3rd ed. St. Louis: ed. Mosby; 1998. p.401-17.
4. Niehaus HH, Olthoff E, Kruse E. Früherkennung und hörgerätversorgung unilateraler kindlicher schwerhörigkeiten. Laryngo-Rhino-Otol 1995;74:657-62.
5. Silveira JAM. Estudo da deficiência auditiva em crianças submetidas a exames de potenciais evocados auditivos. Etiologia, grau de deficiência e precocidade diagnóstica. [Tese de Doutorado] Faculdade de Medicina da Universidade de São Paulo, São Paulo, 1992.
6. Lagasse N, Dhooge I, Govaert P. Congenital CMV-infection and hearing loss. Acta Otorhinolaryngol Belg 2000;54(4):431-6.
7. Niedzielska G, Katsha E, Szymola D. Hearing defects in children born of mothers suffering from rubella in the first trimester of pregnancy. Int J Pediatr Otorhinolaryngol 2000;54:1-5.
8. Silva AA, Maudonnet O, Panhoca R. A deficiência auditiva na infância. Retrospectiva de dez anos. ACTA AWHO 1995;14(2):72-5.
9. Kadoya R, Ueda K, Miyazaki C, HidayaY, Tokugawa K. Incidence of congenital rubella syndrome and influence of the rubella vacination program for schoolgirls in Japan, 1981-1989. Am J Epidemiol 1998;148(3):263-8.
10. Schluter WW, Reef SE, Redd SC, Dyklwicz CA. Changing epidemiology of congenital rubella syndrome in the United States. J Infect Dis 1998;178(3):636-41.
11. Hinman AR, Hersh BS, Quadros CA. Rational use of rubella vaccine for prevention of congenital rubella syndrome in the Americas. Rev Panam Salud Publica 1998;4(3):156-160.
12. Jayarajan V, Rangan S. Delayed deterioration of hearing following bacterial meningitis. J Laryngol Otol 1999;113:1011-14.
13. Yeat SW, Mukari SZ, Said H, Motilals R. Post meningitic sensorineural hearing loss in children - alterations in hearing level. Med J Malaysia 1997;52(3):285-90.
14. Drake R, Dravitski J, Voss L. Hearing in children after meningococcal meningitis J Paediatr Child Health 2000;36(3):240-3.
15. Kapoor RK, Kumar R, Misra PK, Sharma B, Shukla R, Dnivedee S. Brainstem auditory evoked response (BAER) in childhood bacterial meningitis Indian J Pediatr 1996;63(2):217-25.
16. Marlow ES, Hunt LP, Marlow N. Sensorineural hearing loss and prematurity Arch Dis Child Fetal Neonatal 2000;82:F141-4.
17. Sone M, Schachern P.A, Paparella MM. Loss of spiral ganglion cells as primary manifestation of aminoglycoside ototoxicity. Hear Res 1998;115(1-2):217-23.
18. Minja BM. Etiology of deafness among children at the Buguruni school for deaf in Dar es Salaam, Tanzânia. Int J Pediatr Otorhinolaryngol 1998;42(3):225-31.
19. Borradori C, Fawer CL, Buclin T, Calame A. Risk factors of sensorineural hearing loss in preterm infants. Biol Neonate 1997;71(1):1-10.
20. Lui X, Xu L, Zhang S, Xu Y. Prevalence and aetiology of profound deafness in the general population of Sichuan, China. J Laryngol Otol 1993;107(11):990-3.
21. Zakzouk S. Consanguinity and hearing impairment in developing countries: a custom to be discouraged. J Laryngol Otol 2002;116(10):811-6.
22. Vartiainen E, Kemppinen P, Karjalainen J. Prevalence and etiology of bilateral sensorineural hearing impairment in a Finnish childhood population. Int J Pediatr Otorhinolaryngol 1997;41(2):175-85.
23. Zakzouk SM, Al-Anazy F. Sensorineural hearing impaired children with unknown causes: a comprehensive etiological study. Int J Pediatr Otorhinolaryngol 2002;64(1):17-21.
24. Ruben RJ. Persistency of an effect: otitis media during the first year of life with nine years follow-up. Int J Pediatr Otorhinolaryngol 1999;49:S115-8.
25. Ribeiro A, Castro F, Oliveira P. Surdez Infantil. Rev Bras Otorrinolaringol 2002;68(3):417-23.
26. Parving A. The need for universal neonatal hearing screening - some aspects of epidemiology and identification. Acta Paediatr Suppl 1999;432:69-72.
27. Isaacson G. Universal newborn hearing screening in an Inner-City, managed care environment. Laryngoscope 2000;110:881-94.
28. Eden D, Ford RPK, Hunter MF, Malpas TJ, Darlow B, Gourley J. Audiological screening of neonatal intensive care unit graduates at high risk of sensorineural hearing loss. N Z Med J 2000;113:182-3.
Quadro 1
Protocolo - Deficiência auditiva - Disciplina de Otorrinolaringologia da FMABC
1. Nome
2. Idade
3. Sexo
4. Tipo de disacusia: sensorioneural / condutiva / mista
5. Grau: leve / moderada / severa / profunda
6. Bilateral / Unilateral
7. Gestação / Parto / intercorrências
8. Causas:
a. Hereditária / congênita
b. Pré-natal: rubéola / toxoplasmose / sífilis / citomegalovirose / herpes / drogas abortivas / drogas ototóxicas / sarampo
c. Peri-natal: hipóxia / prematuridade / hiperbilirrubinemia / trauma de parto / drogas ototóxicas / ruído
d. Pós-natal: otites de repetição / sarampo / meningite / caxumba / encefalite / drogas ototóxicas / TCE / trauma acústico / sepsis
9. Casos na família:
10. Idade da suspeita:
11. Idade da confirmação:
Método:
12. Idade da intervenção:
13. Uso de prótese auditiva:
14. Tipo de comunicação predominante:
15. Exame ORL completo:
Tabela 1. Etiologia da disacusia Etiologia / Número de casos / %
Desconhecida / 33 / 25,2%
Rubéola congênita / 31 / 23,6%
Meningite / 11 / 8,4%
Drogas ototóxicas / 4 / 3%
Anóxia neonatal / 4 / 3%
Hereditariedade / 3 / 2,3%
Hiperbilirrubinemia / 3 / 2,3%
Síndrome genética / 3 / 2,3%
Consangüinidade / 3 / 2,3%
Prematuridade / 2 / 1,5%
Otites de repetição / 2 / 1,5%
Citomegalovirose / 1 / 0,8%
Caxumba / 1 / 0,8%
Drogas abortivas / 1 / 0,8%
Mal formações cranianas / 1 / 0,8%
Trauma cranioencefálico / 1 / 0,8%
Fatores associados / 26 / 19,8%
TOTAL / 131 / 100
Tabela 2. Fatores associados pré-natais e peri-natais Fatores no. casos%
Hipóxia + prematuridade + hiperbilirrubinemia + ototóxicos / 4 / 15,3%
Rubéola + hipóxia / 3 / 11,5%
Meningite + hiperbilirrubinemia / 2 / 7,7%
Rubéola + hiperbilirrubinemia / 2 / 7,7%
Hipóxia + hiperbilirrubinemia / 2 / 7,7%
Rubéola + prematuridade / 2 / 7,7%
Consangüinidade + infecção não definida na gestação / 2 / 7,7%
Hereditariedade + caxumba + sarampo / 1 / 3,8%
Hipóxia + drogas ototóxicas / 1 / 3,8%
Hipóxia + prematuridade / 1 / 3,8%
Hipóxia + hereditariedade / 1 / 3,8%
Hipóxia + caxumba + consanguinidade / 1 / 3,8%
Hipóxia + toxoplasmose congênita / 1 / 3,8%
Hipóxia + caxumba + ototóxicos / 1 / 3,8%
Consangüinidade + drogas abortivas / 1 / 3,8%
Consangüinidade + hipóxia + ototóxicos / 1 / 3,8%
TOTAL / 26 / 100
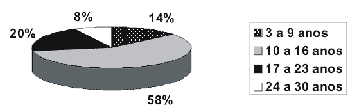
Gráfico 1. Idade
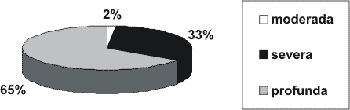
Gráfico 2. Grau da disacusia
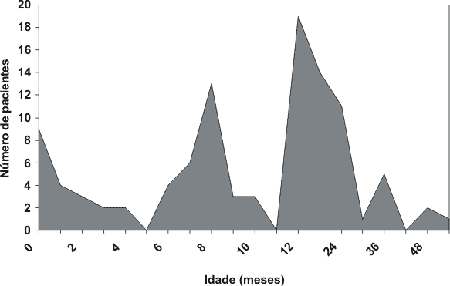
Gráfico 3. Idade da suspeita diagnóstica
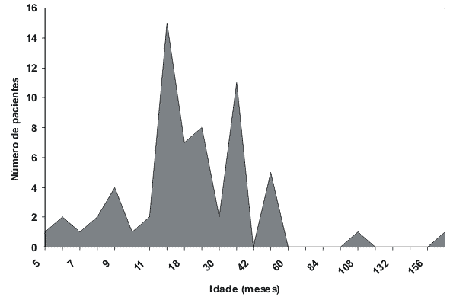
Gráfico 4. Idade da confirmação diagnóstica
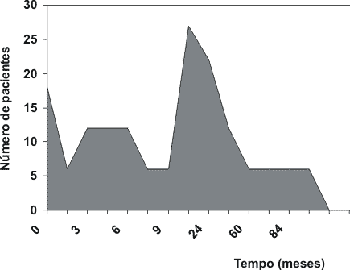
Gráfico 5. Tempo aproximado após o diagnóstico até a protetização
[1] Residentes da Disciplina de Otorrinolaringologia da Faculdade de Medicina do ABC.
[2] Médico Otorrinolaringologista do Hospital Estadual Santo André.
[3] Titular da Disciplina de Otorrinolaringologia da Faculdade de Medicina do ABC.
Instituição: Disciplina de Otorrinolaringologia da Faculdade de Medicina do ABC - Hospital Estadual Santo André - SP.
Endereço para Correspondência: Suzana Boltes Cecatto - Rua São Paulo, 2484 São Caetano do Sul SP 09541-100. - E-mail: suzanacecatto@yahoo.com.br


