INTRODUÇÃOInfecções das vias aéreas superiores (IVAS) representam a causa mais freqüente de consultas médicas na prática clínica, e na população pediátrica causam uma substancial proporção de consultas ao médico da família1. Dor de garganta, um sintoma predominante em faringoamigdalites, é uma das queixas mais comuns em pediatria2, gerando uma considerável quantidade de prescrições de antibióticos. Nos Estados Unidos, 10% de todas as prescrições de antibióticos em pediatria são feitas para o tratamento de faringoamigdalites3. A maioria dos episódios de faringoamigdalites é causada por vírus; streptococcus beta-hemolítico do grupo A (SBHA) ou S. pyogenes são responsáveis por apenas 15% de todos os casos2.
Faringo-amigdalite, uma das IVAS mais comuns em crianças, permanece com sua etiologia ainda confusa entre viral e bacteriana. Variações na flora microbiana amigdaliana podem aumentar o risco de o paciente desenvolver amigdalites de repetição e hipertrofia adenoamigdaliana; e explicar porque algumas crianças são mais susceptíveis a infecções do anel de Waldeyer ainda não é possível. Amigdalectomia apenas ou associada à adenoidectomia em crianças bem selecionadas, com sintomas de infecções recorrentes ou hipertrofia e ronco, é um dos procedimentos cirúrgicos pediátricos mais freqüentes. Estima-se que pelo menos 34-80% dos pacientes com dor de garganta têm uma "possível" etiologia bacteriana4,5, e aproximadamente 24-65%, fazem o exame para identificar Streptococcus ß-hemolítico na garganta1,6.
Na hipótese atual, faringoamigdalite aguda é causada por bactérias aderidas ao epitélio amigdaliano que permanecem presentes em secreções na superfície das criptas amigdalianas.7
As bactérias da superfície amigdaliana podem não representar a presença bacteriana residente dentro das amígdalas. O tratamento, baseado em organismos identificados a partir de raspados das superfícies bacterianas após amigdalites recidivantes pode ser efetivo apenas contra as bactérias da superfície, permitindo que as bactérias residentes nos tecidos internos (núcleos) das amígdalas persistam. Amígdalas hipertrofiadas também abrigam bactérias, predispondo o paciente a infecções de repetição. Em Trinidad e Tobago, antibióticos são largamente usados para tratar crianças com IVAS, e apesar de os clínicos os prescreverem com freqüência, eles reconhecem seu uso excessivo nessas condições8. Não temos informação sobre a carga bacteriana nas amígdalas de crianças caribenhas. O presente estudo investigou a prevalência de microorganismos aeróbios na superfície e nos núcleos das amígdalas em crianças após cirurgia de adenoamigdalectomia para tratar amigdalites de repetição e/ou sintomas de apnéia do sono.
MÉTODOS
PopulaçãoCrianças e adolescentes (=16 anos) com indicação de amigdalectomia para o tratamento de amigdalites de repetição e/ou hipertrofia causando apnéia obstrutiva do sono foram selecionadas para o estudo. Somente aquelas crianças que não haviam recebido medicação antibacteriana nas quatro semanas anteriores à cirurgia planejada foram recrutadas para o estudo. Indivíduos com abscesso periamigdaliano foram excluídos do estudo. Os pacientes com cirurgia marcada foram recrutados à medida que se apresentavam ao centro de estudos para consulta médica, quando compatíveis com os critérios de inclusão. Amigdalectomia era indicada se: (1) uma criança tivesse sofrido pelo menos 4 episódios recorrentes de amigdalite nos 12 meses anteriores; (2) um otorrinolaringologista diagnosticasse ronco e/ou apnéia obstrutiva do sono causados por hipertrofia adenoamigdaliana, e nesses casos tanto as amígdalas quanto a adenóide eram removidas.
ProcedimentoEsse foi um estudo prospectivo, tricêntrico, conduzido em dois institutos do setor público - um localizado ao Norte e outro ao Sul de Trinidad, e em uma creche. O Comitê de Ética da Faculdade de Ciências Médicas, da Universidade das Índias Ocidentais - The Ethics Committee of the Faculty of Medical Sciences, The University of the West Indies, aprovou esse estudo, sob protocolo número: EC22, de 31/01-03/04. Pais/guardiões foram informados quanto à natureza e propósito do estudo, e consentiram quanto ao envio dos tecidos dissecados para exame bacteriológico. Os cuidadores das crianças foram entrevistados por meio de um instrumento testado em um estudo piloto antes da cirurgia, para determinar dados demográficos dos pacientes, história familiar relevante, freqüência de crises de amigdalites, e um passado de tratamento antibacteriano para a crise imediatamente anterior. Agentes anti-sépticos e/ou bactericidas não foram usados durante a cirurgia. As amígdalas dissecadas foram armazenadas em recipientes estéreis, que não permitiam a passagem de ar, a 4ºC e transportadas para o laboratório para processamento no mesmo dia da cirurgia ou dentro de 24 horas do término desta. Quando isso não era possível, os tecidos eram transportados dentro de um período de 7 dias do término da cirurgia, com o resfriamento mantido até a conclusão do processamento do material.
BacteriologiaSwabs estéreis foram aplicados, separadamente, às superfícies das amígdalas esquerda e direita, e subcultivadas em ágar sangue, MacConkey ágar e ágar chocolate. As placas foram incubadas a 37ºC, em 5% CO2 por 24-48 horas, as culturas foram processadas para organismos aeróbios, e os micróbios foram identificados através de metodologia padrão9. Para detectar a microflora no núcleo amigdaliano, a superfície foi primeiro descontaminada por meio de uma lâmina de bisturi aquecida até atingir a "cor de brasa", e então a amígdala era cuidadosamente seccionada por meio de uma incisão para alcançar seu núcleo. Swabs estéreis foram aplicados às superfícies internas expostas das amígdalas direita e esquerda, e foram subcultivadas no meio mencionado anteriormente.
Análise EstatísticaO (A) Paciente (a) era considerado positivo para crescimento bacteriano caso isolados bacterianos fossem encontrados nas superfícies e/ou núcleos de pelo menos uma das amígdalas. As crianças foram agrupadas em duas categorias de 1 a 5 anos e de 6 a 16 anos. Os resultados da análise bacteriana estão apresentados para Staphylococci spp., Streptococci spp. e isolados Gram-negativos. Streptococcos foram classificados como Streptococos a-hemolíticos(SAH) e Streptococos ß-hemolíticos (SBH). Respostas de todas as amostras foram consideradas para análises bacteriológicas e de dados, sem distinção quanto à causa para amigdalectomia, baseado em relatórios prévios que não encontraram diferenças significativas entre pacientes com amigdalites de repetição e apnéia4,10,11. Ferramentas estatísticas de comparação de pares foram usadas para comparar os resultados das avaliações da superfície e interna, e testes qui-quadrados foram usados para amostras independentes.
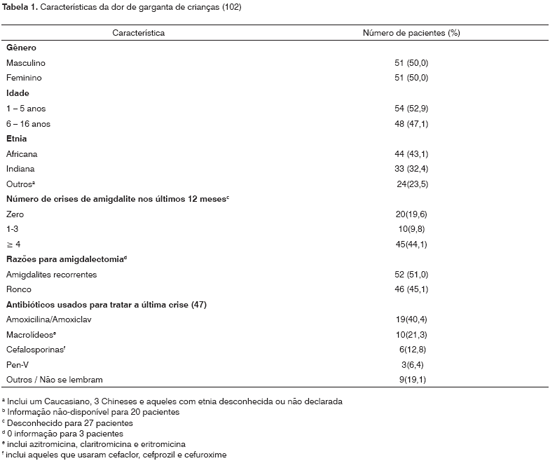
RESULTADOSAmígdalas foram removidas em 51% (52) das crianças com infecções crônicas e em 45,1% (46) daquelas com hiperplasia amigdaliana obstrutiva causando ronco e/ou apnéia. Por acaso, ambos os gêneros foram igualmente representados (50,0% cada). Aproximadamente metade das crianças tinha menos de 6 anos (52,9%) ou estava entre 6 e 16 anos (48,1%) (Tabela 1). A maioria dos pacientes era de linhagem Africana (43,1%) ou Indiana Oriental (32,4%). Cinqüenta e cinco crianças (53,9%) haviam sofrido pelo menos uma crise de dor de garganta nos últimos 12 meses, e dessas, 45 (81,8%) haviam sofrido entre 4 e 16 episódios. Quarenta e sete (52,2%) pacientes (38 com amigdalites recidivantes e nove com hipertrofia) haviam usado agentes antibacterianos para a crise imediatamente anterior de dor de garganta. Amoxicilina isoladamente ou em combinação com clavulanato (40,4%) foram os antibióticos mais freqüentemente prescritos, seguidos por um macrolídio (21,3%) azitromicina (7; 70,0%), claritromicina (2; 20,0%) e eritromicina (1; 10,0%)}. Cefalosporinas de primeira geração foram preferencialmente prescritas em 6 (12,8%) pacientes, e um paciente recebeu cefuroxima. Somente três participantes do estudo receberam prescrições de penicilina V.
Há dados bacteriológicos disponíveis a partir de 90 crianças entre todas que participaram do estudo, porque alguns tecidos (12 crianças) foram descartados por causa de sua má qualidade. Duas (1,1%) das 180 amígdalas (90 esquerdas e 90 direitas) foram negativas para bactérias aeróbias. As freqüências gerais de detecção de Streptococcus spp. Staphylococcus spp. e outros patógenos a partir de tecidos da superfície e do núcleo das amígdalas estão exibidas na Tabela 2. As crianças tinham mais de uma espécie de Streptococcus spp., e um isolado de S. pneumoniae de cada uma foi encontrado nas superfícies e núcleos. No geral, a quantidade de isolados foi proporcionalmente maior a partir das superfícies (271) quando comparado aos núcleos (225).

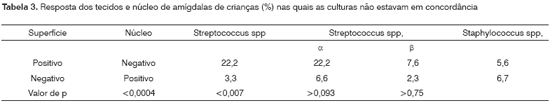
As 360 amostras de tecidos da superfície e do núcleo produziram um total de 800 isolados aeróbios, produzindo uma média de 8,9 isolados por paciente. Desses 800 isolados, 410 (51,3%), 338 (42,3%) e 52 (6,4%) foram respectivamente positivos para Streptococci spp., Staphylococci spp. e outras bactérias. O encontro de estreptococos em isolados (média de 4,56) foi numericamente maior (126; 70,0%) nas superfícies, do que de núcleos (90; 50,0%). As taxas de detecção tanto na superfície (116; 64,4%) quanto no núcleo (115; 63,8%) foram semelhantes para isolados estafilocócicos. Cinqüenta e dois (6,4%) isolados de bactérias gram-negativas de 13 gêneros foram encontrados nas superfícies (16,1%) e núcleos (11,1%). A proporção de respostas positivas das superfícies das amígdalas de crianças (Tabela 3) foi diferente das respostas dos núcleos para Streptococcus spp. (p<0,0004) e para SAH (p<0,007), mas não para SBH a um nível de 5%. O crescimento de Staphylococci spp. nos tecidos de superfície e núcleo foi semelhante.
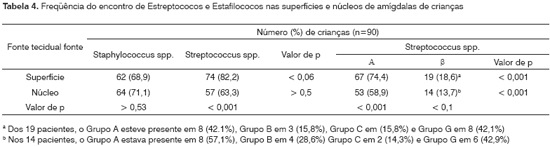
Mais amígdalas (p<0,001) foram positivas para Streptococcus spp. nas superfícies (82,2%) do que nos núcleos (63,3%) (Tabela 4). A produção de estreptococos na superfície (74.4%) para SAH foi maior (p<0,001) do que nos núcleos das amígdalas (58,9%). De forma similar, o encontro de SBH na superfície (18,6%) foi maior do que no núcleo (13,7%) em 10%. Mais pacientes (p<0,001) tiveram mais SAH do que SBH tanto nas superfícies (74,4% vs 18,6%) quanto nos núcleos (58,9% vs 13,7%). Somente 2 isolados de S. pneumoniae, um agente etiológico de pouca importância na dor de garganta e faringoamigdalite foram encontrados nas superfícies.
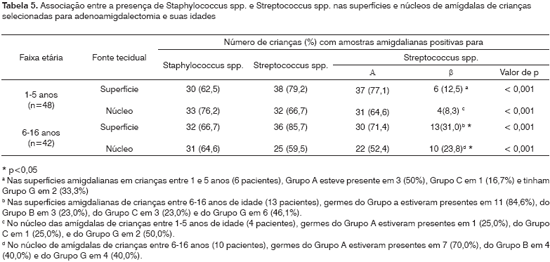
Estreptococos dos Grupos A e G foram os isolados mais freqüentes tanto das superfícies quanto dos núcleos. Nas 19 crianças com SBH nas superfícies, 42,1% (8) tinham Grupo A e Grupo G cada; e 15,8% (3) tinham Grupos B e C cada. Nas 14 crianças com SBH nos núcleos das amígdalas, 57,1% (8) tiveram Grupo A; 28,6% (4) tiveram Grupo B; 14,3% (2) tiveram Grupo C e 42,9% (6 ) tiveram Grupo G.
Encontro de EstafilococosA presença de estafilococos na superfície (68,9%) e no núcleo (71,1%) foi similar nas crianças (p>0,53) (Tabela 4). Apesar dos números de crianças com estafilococos (71,1%) e estreptococos (63,3%) nos núcleos não terem sido significativamente diferentes, mais crianças tiveram estreptococos (82,2%) do que estafilococos (68,9%) nas superfícies amigdalianas (p<0,06). Dois isolados de estreptococos coagulase-negativo foram encontrados, na superfície e no núcleo de amígdalas de duas crianças.
Idade e presença de Streptococcus spp. e Staphylococcus spp.Em crianças com idades entre 1 e 5 anos e 6 e 12 anos, a presença respectiva de estafilococos em superfície e núcleo foi 62,5% e 76,2% (Tabela 5). A freqüência geral da presença de Staphylococcus spp e Streptococcus spp. não foi significativamente afetada pela idade da criança ou sítio tecidual (p > 0,05). Entretanto, crianças mais velhas (p<0,05) (6-16 anos) tiveram SBH nas superfícies amigdalianas (31,0% versus 12,5%) e nos núcleos (23,8% versus 8,3%), comparadas àquelas em idades mais tenras (1-5 anos). Independentemente da idade (Tabela 5), a presença de SAH foi maior do que aquela de SBH nas superfícies amigdalianas (p<0,001) assim como nos núcleos (p<0,001). Crianças mais velhas (6-16 anos) tiveram mais SBH nas superfícies do que nos núcleos (p<0,05). Não houve presença de SBH do Grupo B nas superfícies ou núcleos de amígdalas de crianças mais jovens, enquanto que nas crianças mais velhas (6-16 anos) a presença respectiva destes foi de 23,0% e 40,0%. Independentemente da idade, a presença na superfície de SBHGA foi proporcionalmente maior do que aquela nos núcleos das crianças mais novas (50,0% versus 25,0%) assim como nas crianças mais velhas (84,6% versus 70,0%). Apesar de SBH do Grupo C ter sido encontrado nas superfícies de amígdalas de crianças mais velhas (23,0%) quando comparadas às crianças mais novas (16,7%), bactérias nos tecidos dos núcleos cresceram somente nas amígdalas de crianças mais jovens (25,0%). SBH do Grupo G exibiram um padrão semelhante de crescimento bacteriano na superfície, maior crescimento em crianças mais velhas (46,1%) do que nas mais jovens (33,1%). Entretanto, crescimento bacteriano no núcleo foi maior nas crianças jovens (50,0%) do que nas mais velhas (40%).
Treze bactérias do gênero gram-negativas foram isoladas (Tabela 6). Proteus, Klebsiella, Chromobacterium Pseudomonas spp. e Alcaligenes spp. cresceram tanto nas superfícies quanto nos núcleos de amígdalas (1% a 6%). A prevalência de crescimento coletivo do restante dos germes incluiu Serratia, Acinetobacter, Neisseria spp., Enterobacter aerogenes, Enterobacter cloacae, Citrobacter e Flavobacterium de superfícies (5,0%) e núcleos (7,0%) respectivamente.
DISCUSSÃOEncontramos uma alta associação entre o crescimento de SAH na superfície e no núcleo de amígdalas de crianças com significativa colonização de SBH nas superfícies e núcleos em crianças mais velhas. Aproximadamente metade das crianças avaliadas estava entre 1-5 (53,3%) ou (6-16) anos (46,7%). Idade é um fator preditor da etiologia infecciosa em amigdalites pediátricas; infecções virais são mais comuns em crianças com menos de 3 anos, e infecções por SBHGA são mais freqüentes em (em crianças maiores de 6 anos.).12 As crianças receberam mais freqüentemente amoxicilina/amoxicilina com clavulanato e macrolídeos. Em relatos advindos de Trinidad8 e Espanha,13,14 amoxicilina com clavulanato e amoxicilina foram mais freqüentemente prescritos para IVAS em ambulatórios de cuidados primários e penicilina V nunca foi recomendado, mesmo apesar de ser o medicamento de escolha para tratar SBHGA3. Steinman et al.15 relataram um aumento no uso de antibióticos de largo espectro, especialmente azitromicina, claritromicina e amoxicilina com clavulanato, em crianças norte-americanas atendidas em ambulatórios de cuidados primários entre 1991-99. O crescente uso empírico desses agentes para IVAS que têm etiologia predominantemente viral indica sua utilização desnecessária.
Streptococcus spp. e Staphylococcus spp. foram os aeróbios mais prevalentes nas amígdalas de crianças independentemente do sítio. No total, as crianças eram portadoras de proporções semelhantes de bactérias aeróbias nas superfícies e nos núcleos, com uma média total de 8,9 isolados por criança e médias respectivas de superfície e núcleo de 3,0 e 2,5 isolados. Nossos resultados se comparam com achados de estudos britânicos16 de 9,2 e 8,8 de média de isolados na superfície e no núcleo amigdaliano, respectivamente. Entretanto, a amostra não foi limitada a crianças. Crianças italianas com amigdalites recidivantes que não haviam recebido antibioticoterapia nos 20 dias antes da coleta da amostra, demonstraram um padrão semelhante de crescimento de bactérias aeróbias nas superfícies (69,2%) e nos núcleos (59,2%)17 de suas amígdalas.
O crescimento total de estreptococos e aquele de SAH em comparação com SBH foi maior nas superfícies do que nos núcleos amigdalianos. A alta prevalência de SAH na superfície e no núcleo de amígdalas comparado aos SBH na flora oral e nasofaríngea é esperada. Brook et al.18 relataram que Staphylococcus aureus, SAH e SBH foram os isolados aeróbios gram-positivos mais predominantes nas superfícies e núcleos de amígdalas em crianças com amigdalites recorrentes. Surow et al.19 relataram que em culturas da superfície a flora respiratória normal cresceu, mas estafilococos foram isolados mais comumente a partir do núcleo. Altas concentrações de SAH na cavidade oral e na nasofaringe inibem o crescimento de SBH nas amígdalas, e funciona como um mecanismo que reduz as taxas de recorrência de infecções estreptocócicas de garganta20, que ficam alteradas devido a distúrbios induzidos por antibióticos. A taxa na qual encontramos SBH esteve consistente com relatos da faixa etária de pico de incidência de infecções por SBHGA acima de 6 anos3. Crianças são o maior reservatório de SBHGA e representam a população-alvo de faringoamigdalites induzidas por SBHGA e suas complicações supurativas e não-supurativas.21 Infecções por SBHGA são comuns em crianças em idade escolar que se misturam com outras crianças na escola e na vizinhança22 formando um grupo de crianças "altamente colonizadoras" que podem infectar seus pares. A menor incidência de SBH em crianças mais jovens pode ser explicada pelo contato mais restrito que têm com seus pares e também pela presença residual de anticorpos maternos.
Streptococcus pyogenes deve seu maior sucesso como patógeno à sua capacidade de colonizar, se multiplicar rapidamente e se espalhar pelo corpo do hospedeiro evitando a fagocitose. Encontramos uma presença cada vez maior de SBHGA nas superfícies (42,1%) e núcleos (57,1 %) amigdalianos do que as taxas divulgadas de 15,5%23, 21%24, e 28%25 em gargantas de crianças aparentemente saudáveis ou daquelas com amigdalites recidivantes (16,9%)26,27 ou hipertrofia amigdaliana (20%)21,23. Surow et al.19 relataram uma taxa de colonização de 19,6% nos núcleos amigdalianos, enquanto Kielmovitch et al.26 encontraram uma alta prevalência de S. pyogenes em culturas de superfícies de amígdalas de crianças com hipertrofia amigdaliana obstrutiva. A alta taxa observada de colonização por S. pyogenes pode ter ocorrido porque excluímos aquelas crianças que haviam recebido tratamento antibacteriano nas 4 semanas antecedentes, contrastando com Surow et al.19, que limitou esse tempo a apenas uma semana antes do estudo. S. pyogenes produz múltiplas adesinas com diferentes especialidades que permitem sua colonização em nichos das vias aéreas superiores27. A natureza dessas adesinas pode diferir nos tecidos da superfície e do núcleo de amígdalas de crianças, e isso pode explicar a discordância entre o crescimento de Streptococcus spp. e SAH na superfície e no núcleo. Maiores estudos sobre a natureza protéica dessas adesinas e sua ancoragem à superfície celular podem elucidar a alta taxa de colonização de SBHGA encontrada em crianças. Mesmo assim, nossos dados sugerem que as crianças de Trinidad têm alta colonização por S. pyogenes, e constituem um reservatório de SBHGA, sendo uma fonte para re-infecção latente.
Os isolados não-SBHGA encontrados foram dos Grupos C e G, que estão intimamente relacionados, e compartilham fatores de virulência com o SBHGA e esporadicamente ocorrem em faringoamigdalites agudas como patógeno incomum28. Eles estão gerando grande interesse como patógenos nosocomiais e oportunistas emergentes primariamente em infecções de olhos, ouvidos, garganta, celulite, e mais raramente meningite, septicemia, endocardite ou glomerulonefrite29. Crianças indianas25 e italianas30 em idade escolar portadoras de SBH tiveram altas taxas de prevalência de 43,2% e 38,8% de SBH do Grupo G Lancefield respectivamente. Esses achados em crianças caribenhas suscitam novas pesquisas para elucidar a questão de crianças saudáveis portadoras de SBH e aquelas com faringoamigdalites. Baixas taxas de presença de S. pneumoniae encontram apoio em relatos de pesquisas que não identificaram S. pneumoniae em faringoamigdalite31, IVAS e dor de garganta23.
Os poucos estudos que relatam ter encontrado estafilococos na flora amigdaliana de crianças não demonstram diferenças entre amígdalas normais e aquelas doentes. S. aureus foi a bactéria que mais comumente (9,9%) cresceu em culturas de amígdalas de 1000 crianças israelenses saudáveis com menos de 2 anos de idade32. A prevalência de estreptococos foi semelhante com ou sem patologia amigdaliana em crianças brasileiras33 (27% versus 28%) e holandesas4 (6% em ambos os grupos). Gaffney et al.34 isolaram S. aureus dos núcleos de amígdalas de 29% de um grupo de crianças entre 8 e 14 anos de idade com amigdalite recorrente. Nossa taxa de prevalência mais alta para S. aureus nas superfícies (68,9%) e núcleos (71,1%) amigdalianos ocorreu provavelmente porque cultivamos germes a partir de swabs da superfície e do núcleo de amígdalas dissecadas ao invés de fazê-lo a partir de swabs faríngeos que não são confiáveis, nem válidos7,35. Apesar da atual dessemelhança na freqüência de detecção de estafilococos quando comparado a outros estudos poder representar uma verdadeira diferença, é pertinente mencionar que diferenças na metodologia de detecção e manuseio de peça cirúrgica antes do processamento não podem ser ignoradas.
H. influenzae, um pouco-freqüente isolado Gram-negativo, já foi demonstrado na dor de garganta21, hipertrofia amigdaliana e amigdalites recorrentes17,23. Na Suécia, onde a análise rotineira de swabs da garganta não inclui H. influenzae, Gunnarsson23 discutiu suas implicações etiológicas na faringoamigdalite. A imunização obrigatória de crianças a partir de vacina contra Haemophilus influenzae tipo B em Trinidad e Tobago na última década poderia explicar sua ausência na presente amostra. Estudos em maiores populações bem definidas podem esclarecer o papel etiológico do H. influenzae na amigdalite em crianças de Trinidad. Pelo que os autores têm conhecimento, os vários gêneros de Gram-negativos encontrados no presente estudo ainda não foram relatados. O encontro de espécies de Klebsiella e Pseudomonas, apesar de ter sido em baixa freqüência, ainda assim é preocupante. A exposição a antibióticos pode ter perturbado a flora faríngea e facilitado a re-colonização por essas espécies. A precisa razão porque as crianças adquiriram esses organismos ainda não está clara, e sua relevância clínica ainda precisa ser determinada. Apesar de o estudo ter sido formatado para pesquisar bactérias aeróbias, bactérias anaeróbias e atípicas não podem ser ignoradas e precisam ser investigadas.
O crescimento de bactérias aeróbias mistas a partir de culturas de superfície ou núcleo de amígdalas levanta a possibilidade de bactérias do núcleo representarem bactérias da superfície. Explorando a relação entre bactérias aeróbias do núcleo e da superfície, Brodsky et al.10 relataram achados semelhantes, mas alertaram para o fato de que bactérias da superfície podem não representar verdadeiramente o crescimento bacteriano no núcleo das amígdalas. Outros relatos7,19 não refletem bactérias do núcleo no tecido da superfície amigdaliana. Crises recorrentes de amigdalites, inflamações significativas e aderência bacteriana ao epitélio da mucosa ou infecção nas criptas podem explicar nossos diferentes resultados.
CONCLUSÕESEncontramos um crescimento estreptocócico maior nas superfícies do que nos núcleos das amígdalas, e crescimento de SAH maior do que de SBH nas superfícies do que nos núcleos. O Crescimento de SBHGA foi alto tanto na superfície quanto no núcleo, principalmente em crianças mais velhas. As crianças de Trinidad são altamente colonizadas por S. pyogenes, e constituem um reservatório de SBHGA para re-infecção latente. Sugerimos maiores estudos para se investigar os mecanismos e influência de múltiplas aderências de S. pyogenes em crianças de Trinidad.
AGRADECIMENTOSEsse estudo foi financiado por verba da St Augustine Campus of The University of the West Indies to Lexley M Pinto Pereira, Solaiman Juman e Abiodun Adesiyun. Agradecemos às crianças e seus cuidadores por participarem no estudo e à equipe de apoio dos hospitais que participaram. Aos Drs. A Trinidade, N Armoogam e S Medford que fizeram as cirurgias.
REFERÊNCIAS BIBLIOGRÁFICAS1. Mlynarczyk G, Mlynarczyk A, Jeljaszewicz J. Epidemiological aspects of antibiotic resistance in respiratory pathogens. Int J Antimicrob Agents 2001;18:497-502.
2. Schwartz B, Marcy S M, Phillips WR., Gerber MA, Dowell SF. Pharyngitis-Principles of Judicious Use of Antimicrobial Agents. Pediatrics 1998;101;S171-4.
3. Nyquist AC, Gonzales R, Steiner JF, Sande MA. Antibiotic prescribing for children with colds, upper respiratory tract infections, and bronchitis. JAMA.1998;279:875-7.
4. Meland E, Digranes A, Skjaerven R. Assessment of clinical features predicting streptococcal pharyngitis. Scand J Infect Dis 1993;25:177-83.
5. Hoffmann S. An algorithm for a selective use of throat swabs in the diagnosis of group A streptococcal pharyngo-tonsillitis in general practice. Scand J Prim Health Care 1992; 10:295-300.
6. Ebenfelt A. Bacterial adherence to mucosal epithelium in the upper airways has less significance than believed. J Negat Results Biomed 2003;2:3.
7. Kurien M, Stanis A, Job A, Brahmadathan, Thomas K. Throat swab in the chronic tonsillitis: how reliable and valid is it? Singapore Med J 2000;41:324-6.
8. Mohan S, Dharamraj K, Dindial R, Mathur D, Parmasad V, Ramdhanie J et al. Physician behaviour for antimicrobial prescribing for paediatric upper respiratory tract infections: a survey in general practice in Trinidad, West Indies. Ann Clin Microbiol Antimicrob 2004;3:11.
9. MacFadden JT. Biochemical tests for identification of medical bacteria. Philadelphia: Lippincott, Williams and Wilkins; 2000.
10. Brodsky L, Nagy M, Volk M, Stanievich J, Moore L. The relationship of tonsil bacterial concentration to surface and core cultures in chronic tonsillar disease in children. Int J Pediatr Otorhinolaryngol 1991;21:33-9.
11. Stjernquist-Desatnik A, Holst E. Tonsillar microbial flora: comparison of recurrent tonsillitis and normal tonsils. Acta Otolaryngol 1999;119:102-6.
12. Putto A. Febrile exudative tonsillitis: viral or streptococcal? Pediatrics 1987;80:6-12.
13. Casani Martinez C, Calvo Rigual F, Peris Vidal A, Alvarez de Lavida Mulero T, Diez Domingo J, Graullera Millas M et al. Survey of the judicious use of antibiotics in primary care. An Pediatr (Barc) 2003;58:10-6.
14. Lazaro A, Ochoa C, Inglada L, Eiros JM, Martinez A, Vallano A, et al. Practice variation and appropriateness study of antimicrobial therapy for acute pharyngotonsillitis in adults. Enferm Infecc Microbiol Clin 1999;17:292-9.
15. Steinman MA, Gonzales R, Linder JA, Landefeld CS. Changing Use of Antibiotics in Community-Based Outpatient Practice, 1991-1999. Ann Intern Med 2003;138:525-33.
16. Mitchelmore IJ, Reilly PG, Hay AJ, Tabaqchali S. Tonsil surface and core cultures in recurrent tonsillitis: prevalence of anaerobes and beta-lactamase producing organisms. Eur J Clin Microbiol Infect Dis.1994;13:542-8.
17. Almadori G, Bastianini L, Bistoni F, Paludetti G, Rosignoli M. Microbial flora of surface versus core tonsillar cultures in recurrent tonsillitis in children. Int J Pediatr Otorhinolaryngol 1988;15:157-62.
18. Brook I, Yocum P, Shah K. Surface vs core-tonsillar aerobic and anaerobic flora in recurrent tonsillitis. JAMA 1980;244:1696-8.
19. Surow JB, Handler SD, Telian SA, Fleisher GR, Baranak CC. Bacteriology of tonsil surface and core in children. Laryngoscope 1989;99:261-6.
20. Roos K, Grahn E, Holm SE, Johansson H, Lind L. Interfering alpha-streptococci as a protection against recurrent streptococcal tonsillitis in children. Int J Pediatr Otorhinolaryngol.1993;25:141-8.
21. Tanz RR, Shulman ST. Pharyngitis. In: Long SS, Pickering LK, Prober CG, editors. Principles and practice of paediatric infectious diseases. 1st ed. New York: Churchill Livingstone; 1997.p. 2000-2207.
22. Martin JM, Green M, Barbadora KA, Wald ER. Group A streptococci among school-aged children: clinical characteristics and the carrier state. Pediatrics 2004;114:1212-9.
23. Gunnarsson RK, Holm SE, Soderstrom M. The prevalence of beta-hemolytic streptococci in throat specimens from healthy children and adults. Implications for the clinical value of throat cultures. Scand J Prim Health Care 1997;15:149-55.
24. Navaneeth BV, Ray N, Chawda S, Selvarani P, Bhaskar M, Suganthi N. Prevalence of beta hemolytic streptococci carrier rate among schoolchildren in Salem. Indian J Pediatr 2001;68:985-6.
25. Stjernquist-Desatnik A, Prellner K, Schalen C. High recovery of Haemophilus influenzae and group A streptococci in recurrent tonsillar infection or hypertrophy as compared with normal tonsils. J Laryngol Otol 1991;105:439-41.
26. Kielmovitch IH, Keleti G, Bluestone CD, Wald ER, Gonzalez C. Microbiology of obstructive tonsillar hypertrophy and recurrent tonsillitis. Arch Otolaryngol Head Neck Surg.1989;115:721-4.
27. Hasty DL, Ofek I, Courtney HS, Doyle RJ. Multiple adhesins of streptococci. Infect Immun. 1992;60(6):2147-52.
28. Zaoutis T, Attia M, Gross R, Klein J. The role of group C and group G streptococci in acute pharyngitis in children. Clin Microbiol Infect 2004;10:37-40.
29. Zaoutis T, Schneider B, Moore LS, and Klein JD. Antibiotic Susceptibilities of Group C and Group G Streptococci Isolated from Patients with Invasive Infections: Evidence of Vancomycin Tolerance among Group G Serotypes Journal of Clinical Microbiology, 1999;37:3380-3.
30. Braito A, Galagani I, Mohammed MR, Iozzi C, Ame SM, Haji HS, et al. Epidemiology of streptococcus group A in school aged children in Pemba. East Afr Med J 2004;81:307-12.
31. Soderstrom M, Blomberg J, Christensen P, Hovelius B. Erythromycin and phenoxymethylpenicillin (penicillin V) in the treatment of respiratory tract infections as related to microbiological findings and serum C-reactive protein. Scand J Infect Dis 1991;23:347-54.
32. Berkovitch M, Bulkowstein M, Zhovtis D, Greenberg R, Nitzam Y, Barzilay B, et al. Colonization rate of bacteria in the throat of healthy infants. Int J Pediatr Otorhinolaryngol 2002;15:19-24.
33. Endo LH, Sakano E, Carvalho DS, Bilecki M, Oliveira UM. Comparative bacteriology of the surface of normal and pathological palatine tonsils in children. Acta Otolaryngol Suppl 1996;523:130-2.
34. Gaffney RJ, Freeman DJ, Walsh MA, Cafferkey MT Differences in tonsil core bacteriology in adults and children: a prospective study of 262 patients. Respir Med 1991;85:383-8.
35. Robinson AC, Hanif J, Dumbreck LA, Prichard AJ, Manners BT. Throat swabs in chronic tonsillitis: a time-honoured practice best forgotten Br J Clin Pract 1997;51:138-9.
1 Dr., Professor de Farmacologia.
2 Dr., Palestrante em Cirurgia.
3 Dr., Palestrante Sênior, Biometria e Cabeça, Departamento de Produção de Alimentos.
4 Pesquisadora Fellow.
5 Dr., Professor de Veterinária, Saúde Pública e Diretor da Escola de Medicina Veterinária.
Endereço para correspondência: Lexley M. Pinto Pereira - Faculty of Medical Sciences The University of the West Indies St Augustine, Trinidad. Tel/Fax 1-868-663-8613 - Email: lexleyp@gmail.com
Grant from the Campus Research and Publication fund Committee, No. CRP. 3HE
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 28 de abril de 2007. cod.4480
Artigo aceito em 11 de junho de 2007.


