INTRODUÇÃO A deficiência auditiva pode ser congênita ou adquirida, além de apresentar diferentes graus e tipos. É considerada uma doença com conseqüências vocacionais, educacionais e sociais, devido à grande importância que exerce na comunicação humana.
Uma das causas de perda auditiva adquirida é o uso de drogas ototóxicas, que são medicamentos que causam reações tóxicas às estruturas da orelha interna afetando o sistema auditivo e/ou vestibular. São consideradas drogas ototóxicas os aminoglicosídeos, a carboplatina, a cisplatina, entre outras1.
A incidência de perda auditiva induzida pela cisplatina varia na literatura entre 3 e 100%2. O seu efeito ototóxico afeta inicialmente as freqüências altas, com envolvimento posterior das freqüências mais baixas de acordo com a dose cumulativa da droga3,4, sendo que a perda auditiva induzida pela cisplatina é, geralmente, neurossensorial, bilateral, simétrica e irreversível5,6.
O modo de administração da droga é um dos determinantes para o seu efeito ototóxico, uma vez que, o seu uso em doses altas em uma única apresentação afeta mais a audição do que quando esta mesma dosagem é fracionada7. Além disso, a alteração auditiva pode variar em cada paciente, ou seja, existe uma susceptibilidade individual8,9.
Por ser eficaz em tumores sólidos, a cisplatina é muito utilizada no tratamento de tumor ósseo. Estes representam cerca de 10% das neoplasias malignas que acometem crianças e adolescentes, sendo o sexto tipo de câncer mais comum em crianças e o terceiro em adolescentes e adultos jovens, ficando atrás apenas da leucemia e do linfoma. Dentre os tumores ósseos, o osteossarcoma é o mais freqüente, totalizando cerca de 60% dos casos10.
O tratamento disponível para o osteossarcoma, até a década de 70, era a cirurgia, limitada à amputação de todo o osso. O prognóstico de sobrevida livre da doença era de 10 a 25%. Na década de 70 iniciaram-se as tentativas de quimioterapia coadjuvante no tratamento do osteossarcoma, o que aumentou a taxa de sobrevida dos pacientes11. Desde então, drogas anti-neoplásicas têm sido utilizadas no tratamento do osteossarcoma, dentre elas encontram-se a cisplatina e carboplatina, consideradas ototóxicas.
Nestes pacientes expostos a drogas ototóxicas a monitorização auditiva é de fundamental importância, visto que resulta em uma detecção precoce das perdas auditivas induzidas por drogas ototóxicas, possibilitando a revisão do tratamento ou mesmo a escolha de procedimentos alternativos. Caso estas medidas não sejam possíveis, a família e o paciente devem ser alertados para uma possível perda de audição, pois o prejuízo social da deficiência auditiva induzida por ototóxicos pode contribuir ainda mais para o isolamento do paciente portador de câncer.
Os objetivos do presente estudo foram: avaliar a audição de pacientes com osteossarcoma submetidos a tratamento quimioterápico com a utilização de cisplatina e verificar qual o método de investigação mais adequado para identificar precocemente as alterações auditivas.
MATERIAL E MÉTODO Este estudo contou com aprovação do Comitê de Ética em Pesquisa da UNIFESP/EPM, processo nº 681/00.
O material do presente estudo constituiu-se dos limiares de audibilidade nas freqüências de 250 a 18000 Hz, em dBNPS, das emissões otoacústicas transitórias (EOAT) e por produto de distorção (EOAPD) de 13 pacientes com diagnóstico de osteossarcoma submetidos à quimioterapia, encaminhados pelo Setor de Oncologia Pediátrica do Departamento de Pediatria da Universidade Federal de São Paulo/Escola Paulista de Medicina.
O protocolo elaborado pelo Grupo Brasileiro Cooperativo de Tratamento de Tumores Ósseos (GBCTTO) foi reestruturado a partir dos resultados obtidos no estudo realizado anteriormente, denominado estudo IV5. Este novo protocolo visou, além de aumentar a taxa de sobrevida dos pacientes, diminuir a toxicidade causada pelas drogas administradas na quimioterapia. Atualmente, no tratamento do paciente com osteossarcoma a quimioterapia é realizada antes e depois do procedimento cirúrgico.
Dentre os critérios de elegibilidade dos pacientes portadores de osteossarcoma, para este protocolo, destacam-se: tumor com alto grau de malignidade, que seja comprovado em biópsia e de localização primária.
Foram elaborados dois protocolos de osteossarcoma: não-metastático e metastático, com a mesma base terapêutica. No protocolo para osteossarcoma metastático houve a administração de dois ciclos de 4 g/m2 de ciclofosfamina (CTX). Após a administração de CTX os dois protocolos se igualam em todos os aspectos. A CTX não é considerada uma droga ototóxica, portanto, os indivíduos dos dois grupos foram agrupados para este estudo.
A base do protocolo constituiu-se de oito ciclos quimiterápicos com intervalo de 21 dias entre eles. Destes oito ciclos, quatro foram de cisplatina com dosagem de 120 mg/m2/ciclo que foi dividida em dois dias, ou seja, 60 mg/m2 ao dia. A dosagem total de cisplatina recebida ao final do tratamento foi de 480 mg/m2 em todos os pacientes. Os outros quatro ciclos são de ifosfamina, que não é considerada droga ototóxica.
No período de agosto de 1999 a abril de 2001, foram avaliados 32 pacientes. Destes, foram excluídos: um paciente com tumor de osso parietal, pois a localização deste poderia, devido à proximidade, comprometer as estruturas de orelha interna, e aqueles que não apresentavam todas avaliações, ou seja, o paciente que não realizou todas as avaliações audiológicas sugeridas pelo protocolo.
Desta forma foram avaliados apenas os 13 indivíduos que apresentavam todas as avaliações, cujas idades variaram entre sete e 20 anos, com média de 13,3 anos, sendo seis do sexo feminino e sete do sexo masculino.
Os pacientes foram submetidos à avaliação audiológica constituída por audiometria tonal liminar (250 a 18000 Hz), emissões otoacústicas transitórias (EOAT) e emissões otoacústicas por produto de distorção (EOAPD).
A avaliação audiológica foi realizada antes do início do protocolo, após cada ciclo de cisplatina e ao final do protocolo, portanto cada indivíduo foi avaliado em cinco momentos diferentes.
Os limiares obtidos na audiometria tonal liminar nas freqüências convencionais em dBNA (decibel nível de audição) foram convertidos para dBNPS segundo os valores determinados pelo padrão ANSI-196912, para que neste estudo os limiares obtidos em todas as freqüências apresentassem a mesma referência. Os resultados dos limiares de audibilidade pesquisados nas orelhas direita e esquerda foram agrupados, uma vez que há referências de que a perda auditiva induzida pela cisplatina é bilateral e simétrica13,14.
Na avaliação dos resultados foram agrupados os limiares de audibilidade, por freqüência, obtidos na audiometria em cada avaliação. A partir deste agrupamento foi calculada a média aritmética dos limiares de audibilidade por freqüência em cada uma das avaliações. Comparou-se os limiares médios entre as avaliações por meio do teste de Friedman. Quando houve diferença estatisticamente significante foi empregado o teste de Wilcoxon para determinar a partir de que dosagem houve modificação do limiar de audibilidade.
As EOAT e EOAPD foram avaliadas pela comparação das médias das amplitudes da relação sinal/ruído por freqüência. Para este estudo foi utilizado o de Modelo de Análise de Variância em Blocos. No estudo das EOAT analisou-se também a significância do desaparecimento da resposta no decorrer do tratamento por meio do Teste para Tendências em Proporções.
Todos os testes estatísticos empregados neste estudo apresentam o nível descritivo de 5%.
RESULTADOS A partir do levantamento dos limiares de audibilidade (dBNPS) obtidos nas freqüências de 250 a 18000 Hz após a administração de cada ciclo de cisplatina (120, 240, 360 e 480 mg/m2) foram calculados os limiares médios e investigadas possíveis diferenças entre os mesmos segundo a dosagem cumulativa da droga por meio do teste de Friedman. Quando foram obtidas diferenças significantes entre os limiares aplicou-se o teste de Wilcoxon para identificar em qual ciclo ocorreu a mudança. (Gráfico 1)
Quanto aos valores individuais, todos os pacientes apresentaram mudança dos limiares nas altas freqüências a partir de 9 kHz. Além disso, houve perda auditiva (> 25dBNA) nas freqüências avaliadas à audiometria convencional (250 a 8000Hz):
· 3 kHz em dois indivíduos (15,3%);
· 4 kHz em dois indivíduos (15,3%);
· 6 kHz em dois indivíduos (15,3%);
· 8 kHz em dois indivíduos (15,3%).
Portanto, 100% dos pacientes apresentaram perda auditiva nas altas freqüências e em 61,2% dos casos houve perda auditiva nas freqüências avaliadas à audiometria tonal convencional.
A partir do levantamento da relação sinal/ruído (dB) obtida nas freqüências de 1, 2, 3 e 4 e da resposta global das EOAT em cada um dos pacientes após cada ciclo de cisplatina, foram calculados os valores médios. Aplicou-se o Modelo de Variância em Blocos para estudar se houve mudança na relação sinal/ruído com a dose cumulativa de cisplatina (Gráfico 2). Nos Gráficos 2 e 3 são apresentados os valores médios da relação sinal/ruído das EOAT por banda de freqüência e da resposta global, respectivamente.
A seguir foi investigada a presença e ausência das EOAT em cada uma das avaliações realizadas. Para este estudo foi aplicado o Teste para Tendências em Proporções tanto em relação à resposta global como o estudo por freqüência - 1, 2, 3 e 4 kHz (Tabela 1).
Foram calculadas as amplitudes médias das emissões otoacústicas por produto de distorção (EOAPD), por freqüência (dB) após cada ciclo de cisplatina. Para verificar se houve mudança na amplitude devido ao efeito cumulativo da cisplatina, utilizou-se o Modelo de Análise de Variância em Blocos. Nas freqüências em que observou-se diferença estatisticamente significante um novo estudo estatístico foi aplicado, expressando os níveis descritivos por dose de cisplatina (Gráfico 4).
DISCUSSÃO A análise dos limiares de audibilidade médios das freqüências de 250 a 18000 Hz revelou que houve mudança já após a administração do primeiro ciclo de cisplatina. Esta modificação ocorreu a partir da freqüência de 3 kHz. Entretanto, pode-se constatar perda auditiva somente a partir de 8 kHz, na qual obteve-se o limiar médio de 40,76 dBNPS que corresponde a 27,76 dBNA. Esta perda aconteceu após a dose cumulativa de 480 mg/m2 (Gráfico 1).
Neste caso houve predomínio de comprometimento das freqüências mais altas, com progressão do acometimento de acordo com a dose cumulativa, sem alterações nas freqüências médias e baixas.
A análise estatística revelou que houve diferença significante entre os limiares de audibilidade médios por ciclo de cisplatina nas freqüências de 500 Hz e de 8000 a 18000 Hz. Na freqüência de 500 Hz o limiar de audibilidade foi significativamente melhor após a última dose de cisplatina (480 mg/m2). Isto pode se explicar pelo fato do paciente estar mais habituado à realização do teste e, assim, ter mais atenção aos estímulos, melhorando a resposta.
Nas freqüências de 8 a 18 kHz ocorreu piora nos limiares de audibilidade. A mudança foi estatisticamente significante já após a primeira dose de cisplatina nas freqüências de 13 a 18 kHz. Nas freqüências de 8 a 12 kHz esta mudança ocorreu após a dose de 240 mg/m2.
Assim sendo, a audiometria de altas freqüências detectou a ototoxicidade da cisplatina já após o primeiro ciclo da droga enquanto que na audiometria convencional a alteração no limiar só ocorreu após a dose de 240 mg/m2.
Strauss et al.15 detectaram perda auditiva em 25% dos pacientes expostos à cisplatina, sendo que a perda auditiva se concentrou na faixa de 4 a 8 kHz. No estudo de Skinner et al.16, 35% dos indivíduos apresentaram perda na freqüência de 2000 Hz. Nos estudos de Fausti et al.3 e Park17 houve predomínio de alterações nas altas freqüências.
Quanto aos valores individuais, observou-se que 61,2% apresentaram perda auditiva na faixa de freqüência convencional, sendo que 30,6% dos pacientes apresentaram perda auditiva em freqüências importantes para a compreensão da fala (3 e 4 kHz). Dishtchekenian et al.5 encontraram resultados semelhantes, nos quais foi detectada perda auditiva em 66,6% dos pacientes na faixa de freqüência convencional; o protocolo quimioterápico utilizado contou, além da cisplatina, com a carboplatina (também considerada droga ototóxica) e em doses não fracionadas. Quanto ao grau da perda, em valores médios, Dishtchekenian et al.5 observaram perda de grau moderadamente severo na audiometria convencional. Por outro lado, o presente estudo revelou perda auditiva, em valores médios, de grau leve a moderado. Esta diferença, quanto ao grau de acometimento por freqüências, pode ter se dado pelo fracionamento da droga, ou pelo uso exclusivo de cisplatina, sem a associação da carboplatina.
Dreschler et al.7 observaram alterações auditivas em 80% dos casos, principalmente nas altas freqüências, e destacaram que as freqüências de 12 e 14 kHz foram as mais importantes para a detecção precoce da ototoxicidade da cisplatina. Fausti et al.18 sugeriram as freqüências de 8, 9, 10, 11.2 e 12.5 kHz para o monitoramento auditivo de pacientes expostos à cisplatina, e neste caso a detecção precoce ocorreu em 94% dos casos. Estes dados concordam com este estudo, no qual as altas freqüências detectaram a ototoxicidade anteriormente à audiometria convencional. Além disso, o comportamento nas freqüências de 13 a 18 kHz foi o mesmo, logo algumas destas freqüências poderiam ser eliminadas da avaliação, tornando desta forma o teste mais rápido e igualmente eficaz no seu objetivo.
Quanto às emissões otoacústicas transitórias (EOAT) houve um discreto aumento da relação sinal/ruído média de cisplatina na resposta global e nas freqüências de 1 e 2 kHz, após a dose de 120 mg/m2 (Gráficos 2 e 3).
Este aumento nas EOAT em valores médios concorda com os achados do estudo de Cevette et al.19, no qual os autores descreveram o aumento da amplitude das emissões, após pequena dose de cisplatina, devido provavelmente às mudanças químicas (metabolismo de cálcio e magnésio) que a cisplatina causa nas células ciliadas. A célula sofre um aumento do nível intracelular de cálcio, devido à deficiência de seu antagonista, o magnésio, que aumenta a permeabilidade da membrana citoplasmática. A mobilidade dos cílios das células ciliadas externas é dependente do cálcio intracelular. Assim sendo, em dosagens baixas de cisplatina pode haver um aumento das emissões otoacústicas, que pode ser indicativo de lesão e posterior morte celular.
Ainda se tratando da relação sinal/ruído média, as avaliações após 240, 360 e 480 mg/m2 de cisplatina apresentaram respostas médias maiores que a avaliação inicial. Entretanto, estas respostas foram menores que a da avaliação após 120 mg/m2. Logo, as respostas tendem a aumentar após pequena dose de cisplatina e diminuir após a dose de 240 mg/m2. Este comportamento ocorreu na resposta global e nas freqüências de 1, 2 e 3 kHz. Na freqüência de 4 kHz houve uma diminuição progressiva da relação sinal/ruído de acordo com a dosagem cumulativa de cisplatina (Gráfico 2).
Na análise estatística não foi observada diferença significante entre a resposta global das EOAT e por freqüência obtidas em cada uma das avaliações.
Em relação à presença e ausência da resposta durante o tratamento, verificou-se que a resposta global das EOAT e as freqüências de 1 e 2 kHz continuaram presentes até o final do tratamento. Nas freqüências de 3 e 4 kHz houve progressivo aumento de respostas ausentes no decorrer do tratamento, sendo que apenas a freqüência de 4 kHz apresentou diferença estatisticamente significante quanto à ausência de resposta (Tabela 1).
Allen et al.20 observaram em seu estudo que as EOAT apresentam correlação com os dados observados na audiometria. O mesmo foi observado por Bensadon14 e Durrant, Furman, Carr21. Neste estudo este dado foi observado apenas na freqüência de 4 kHz. Biró et al.22 não observaram mudanças nas EOAT em indivíduos que receberam baixa dose de cisplatina.
Foi verificado um discreto aumento das amplitudes médias das emissões otoacústicas por produto de distorção (EOAPD) em quase todas as freqüências após a dose de 120 mg/m2. Esta condição se manteve nas freqüências de 1001, 1257, 1587 e 2002 Hz nas avaliações subseqüentes. Na freqüência de 2515 Hz a resposta manteve-se estável em todas as avaliações. Nas freqüências de 3174, 4004, 5042 e 6348 Hz, as mais altas deste teste, as amplitudes médias tenderam a diminuir progressivamente de acordo com a dose cumulativa da droga (Gráfico 4).
O estudo estatístico revelou diferença estatisticamente significante entre as amplitudes médias das EOAPD nas freqüências de 3174, 4004, 5042 e 6348 Hz. Entretanto na comparação da amplitude média inicial com as demais não foi observada diferença estatisticamente significante em nenhuma das análises realizadas. É possível, porém, observar que há uma tendência a diminuição do nível descritivo de acordo com a dose cumulativa da droga (Gráfico 4).
No estudo de Ress et al.23 54% dos pacientes apresentaram alteração na audiometria de altas freqüências e 91% apresentaram mudanças nas EOAPD.
As EOAPD não detectaram precocemente a ototoxicidade da cisplatina, mas acompanharam as modificações encontradas na audiometria. Este dado corrobora com os estudos Bensadon14 e Berg et al.24.
Todos estes dados a respeito das emissões otoacústicas fazem crer que elas podem ser utilizadas como instrumento adicional à monitorização auditiva de pacientes expostos à cisplatina, não como teste de escolha. Entretanto, em casos de pacientes que não podem ser avaliados pela audiometria, esta se torna a forma mais eficaz no monitoramento auditivo.
Concluindo, pode-se verificar que a audiometria de altas freqüências é o teste fidedigno para mostrar a progressão do acometimento auditivo devido à ototoxicidade da cisplatina, uma vez que a alteração inicia-se nas freqüências mais altas e progride para as mais baixas de acordo com a dosagem cumulativa da droga, permitindo assim, se possível, mudanças na administração da droga ou orientação ao paciente e/ou família caso não seja possível realizar modificações no protocolo quimioterápico.
Já as emissões otoacústicas, tanto transitórias quanto por produto de distorção, demonstram a alteração celular aumentando e diminuindo sua amplitude, entretanto apenas este dado não permite prever a perda auditiva resultante.
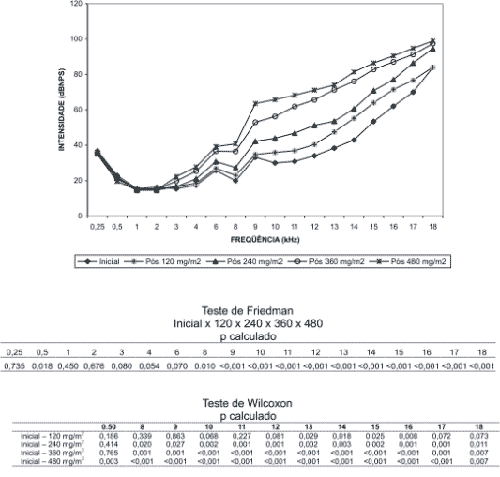
Gráfico 1. Limiares de Audibilidade médios (dB NPS) por freqüência (Hz) por ciclo de cisplatina.
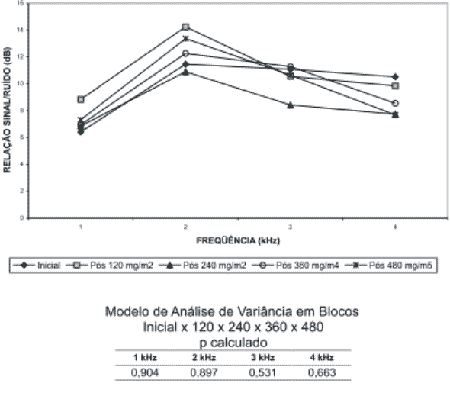
Gráfico 2. Relação sinal/ruído (dB) média das EOAT por banda de freqüência por ciclo de cisplatina.
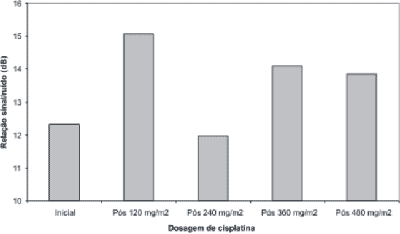
Gráfico 3. Valores médios da relação sinal/ruído (dB) da resposta global das EOAT por ciclo de cisplatina. (p=0,864)
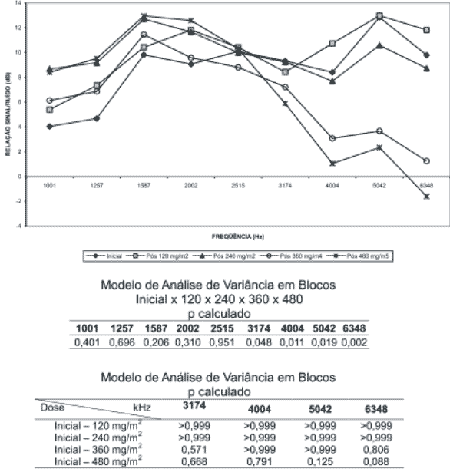
Gráfico 4. Respostas médias da amplitude das EOAPD por freqüência por ciclo de cisplatina.
1. Os limiares de audibilidade caem nas altas freqüências já após a infusão de 120 mg/m2 de cisplatina a partir da freqüência de 8 kHz;
2. A amplitude das EOAT e EOAPD aumenta e diminui durante o processo quimioterápico já a partir da infusão de 120 mg/m2 de cisplatina;
3. A resposta global e as amplitudes nas freqüências de 1, 2 e 3 kHz das EOAT tendem a permanecer presentes até o final do tratamento, com exceção da freqüência de 4 kHz;
4. A audiometria de altas freqüências é o método mais efetivo na detecção precoce da ototoxicidade da cisplatina;
5. Todos os pacientes apresentaram, ao final do tratamento, perda auditiva nas altas freqüências, porém apenas 30,6% apresentaram perda auditiva (3 e 4 kHz) em algumas das freqüências mais importantes para a compreensão da fala.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Schweitzer VG. Ototoxicity of Chemotherapic Agents. Otolaryngol Clin North Am 1993;26 (5):759-789.
2. Ruiz L, Gilden J, Jaffe N, Robertson R & Wang YM. Auditory Function in Pediatric Ostesarcoma Patients Treated with Multiple Doses of cis-Diamminedichloroplatinum (II). Cancer Res 1989;49:742-44.
3. Fausti SA, Henry JA, Schaeffer HI, Olson DJ, Frey RH & Bagby GC. High-Frequency Monitoring for Early Detection of Cisplatin Ototoxicity. Arch Otolaryngol Head Neck Surg 1993;119:661-666.
4. Pasic TR & Dobie RA. Cis-Platinum Ototoxicity in Children. Laryngoscope 1991;101:985-991.
5. Dishtchekenian A, Iório MCM, Petrilli AS & Azevedo MF. Monitorização Auditiva na Ototoxicidade. In: Barros APB, Arakawa L, Tonini MD & Carvalho VA. Fonoaudiologia em Cancerologia. Fundação Oncocentro de São Paulo - Comitê de Fonoaudiologia em Cancerologia; 2000. p. 260-269.
6. Iório MCM, Dishtchekenian A, Garcia AP& Petrilli AS. Ototoxicity of Cisplatin in Osteosarcoma Patients. Anais do 12nd American Academy of Audiology Annual Convention. Chicago; 2000. p. 146.
7. Dreschler WA, VD Hulst RJAM, Tange RA & Urbanus NAM. Role of High-Frequency Audiometry in Early Detection of Ototoxicity. Audiology 1989;28:211-220.
8. Laurell G & Jungnelius U. High-Dose Cisplatin Treatment: Hearing Loss and Plasma Concentrations. Laryngoscope 1990;100:724-734.
9. Brock PR, Bellman SC, Yeomans EC, Pinkerton CR & Pritchard J. Cisplatin Ototoxicity in Children: a Practical Grading System. Med Pediatr Oncol 1991;19:295-300.
10. Link MP & Eilber F. Osteosarcoma. In: Pizzo, P.A. & Poplack, D.G. Principles and Practice of Pediatric Oncology. 3rd edition. Philadelphia: Lippincott Raven Publishers; 1997. p. 889-920.
11. Macedo CR & Petrilli AS. Tumores Ósseos Malignos na Criança e no Adolescente. Pediatr Mod 1999;35 (8):600-608.
12. American National Standard Institute - American National Standards Specification for Audiometers, American Standard, S3.6, 1969.
13. Kopelman J, Budnick AS, Sessions RB, Kramer MB & Wong GY. Ototoxicity of High-Dose Cisplatin by Bolus Administration in Patients with Advanced Cancers and Normal Hearing. Laryngoscope 1988;98:858-863.
14. Bensadon RL. Estudo Clínico e Audiológico da Ototoxicidade da Cisplatina. Comparação entre os Exames de Audiometria Tonal Convencional, Audiometria de Altas Freqüências e Emissões Otoacústicas. [Tese Doutorado]. Faculdade de Medicina. Universidade de São Paulo, 1998.
15. Strauss M, Towfighi J, Lord S, Lipton A, Harvey HA & Brown B. Cis-platinum Ototoxicity: Clinical Experience and Temporal Bone Histopathology. Laryngoscope 1983;93:1554-1559.
16. Skinner B, Pearson ADJ, Amineddine DB, Mathias DB & Craft AW. Ototocixity of Cisplatinum in Children and Adolescents. Br J Cancer 1990;61:927-31.
17. Park KR. The Utility of Acoustic Reflex Threshold and Other Conventional Audiologic Tests for Monitoring Cisplatin Ototoxicity in the Pediatric Population. Ear Hear 1996;17:107-115.
18. Fausti SA, Henry JA, Helt WE, Phillips DS, Frey RH, Noffsinger D, Larson VD & Fowler CG. An Individualized, Sensitive Frequency Range for Early Detection of Ototoxicity. Ear Hear 1999;20:497-505.
19. Cevette M J, Drew D, Webb T & Marion MS. Cisplatina Ototoxicity, Increased DPOAE Amplitudes, and Magnesium Deficiency. J Am Acad Audiol 2000;11:323-329.
20. Allen GC, Tiu C, Koike K, Ritchey K, Kurs-Lasky M & Wax MK. Transient-Evoked Otoacoustic Emissions in Children After Cisplatin Chemotherapy. Otolaryngol Head Neck Surg 1998;118 (5):584-588.
21. Durrant JD, Furman JM & Carr B. DPOAE in Monitoring of Cisplatin Ototoxicity, 1997. Disponível em: URL:HTTP:// www.ausp.memphis.edu/ierasg/ abstract/durrant.txt.
22. Biró K, Baki M, Büki B, Noszek L & Jókúti L. Detection of Early Ototoxic Effect in Testicular Cancer Patients Treated with Cisplatin by Transiently Evoked Otoacoustic Emission: a Pilot Study. Oncology 1997;54:387-399.
23. Ress BD, Sridhar KS, Balkany TJ, Waxman GM, Stagner BB & Lonsbury-Martin BL. Effects of cis-platinum Chemotherapy on Otoacustic Emissions: The Development of na Objective Screening Protocol. Otolaryngol Head Neck Surg 1999;121:693-701.
24. Berg AL, Spitzer JB & Garvin JH. Ototoxicity Impact of Cisplatin in Pediatric Oncology Patients. Laryngoscope 1999;109:1806-1814.
25. Baum ES, Gaynon P, Greenberg L, Krivit W & Hammond D. Phase II Study of cis-Dichlorodiammineplatinum (II) in Childhood Osteosarcoma: Children's Cancer Study Group Report. Cancer Treat Rep 1979;63 (9-10):1621-1627.
[1] Fonoaudióloga Mestre em Distúrbios da Comunicação Humana: campo Fonoaudiológico pela Universidade Federal de São Paulo - Escola Paulista de Medicina.
[2] Professora Adjunto da Disciplina dos Distúrbios da Audição do Departamento de Otorrinolaringologia e Distúrbios da Comunicação Humana da Universidade Federal de São Paulo - Escola Paulista de Medicina.
[3] Professor Adjunto do Departamento de Pediatria, Diretor Geral do Instituto de Oncologia Pediátrica/ GRAAC da Universidade Federal de São Paulo - Escola Paulista de Medicina.
Universidade Federal de São Paulo - Escola Paulista de Medicina.
Endereço para Correspondência: Adriana Pontin Garcia - R. Aníbal dos Anjos Carvalho, 42 Interlagos - Tel (0xx11)5666-2216 - E-mail: apgarcia@osite.com.br


