INTRODUÇÃO Os núcleos cocleares (NNCC) constituem a primeira estação das vias auditivas dentro do sistema nervoso central, abrigando os neurônios ditos "secundários", os quais recebem informações ascendentes das fibras do nervo coclear (NeC)1. Sua posição e organização básica é bastante uniforme entre ratos, gatos, coelhos e camundongos, com diferenças muito pequenas em relação aos primatas2. Localizam-se na borda lateral da junção entre a ponte e o bulbo, no tronco cerebral3. Classicamente, são subdivididos em núcleo dorsal (NCD), núcleo ventral, o qual por sua vez é subdividido em anterior (NCVA) e posterior (NCVP), e núcleo intersticial (NI) ou raiz do nervo coclear. Os axônios do NeC entram pelo NI e se bifurcam em segmentos ascendente e descendente. A subdivisão do núcleo ventral em anterior e posterior é relativa a esse ponto de entrada do NeC. O ramo ascendente penetra no NCVA disposto em fascículos, os quais mantém fixa sua posição relativa entre si. O descendente entra no NCVP, também disposto em fascículos, para em seguida se reunir num feixe único e se dirigir ao NCD3.
A projeção das fibras do NeC, a partir de sua entrada nos NNCC, se faz segundo um esquema regular, dando origem a uma representação cocleotópica, ou seja, respeitando a região de origem da fibra dentro da cóclea e permitindo uma distribuição precisa de frequências dentro dos NNCC4. As fibras nervosas provenientes de neurônios com posição basal na cóclea seguem para regiões mais dorsais dos NNCC. Já as fibras originárias de regiões apicais atingem preferencialmente posições ventrais1,4. Em gatos, a destruição da porção basal da cóclea (sítio de percepção de freqüências agudas) leva à degeneração das porções dorsais do NCV. Destruição da porção apical da cóclea (freqüências graves) leva à degeneração das porções ventrais do mesmo núcleo3.
Os conhecimentos atuais mostram que os NNCC desempenham função altamente diferenciada no tratamento e integração das mensagens auditivas, não podendo ser considerados como simples estações de passagem do sinal. Sua organização estrutural é bastante complexa, contendo distintas populações neuronais, com elevado número de fibras provenientes de regiões centrais da via auditiva e com grande variedade de circuitos intranucleares. Parece haver uma distinção entre as funções dos subnúcleos dorsal e ventral, sendo a do primeiro moduladora sobre a do segundo4,5.
A partir da segunda metade deste século, tem-se tornado cada vez mais conhecida a participação de alguns metais de transição em reações biológicas. Esse metais tomariam parte na estrutura de algumas enzimas e de proteínas não enzimáticas, além de se ligarem a alguns outros tipos de moléculas biológicas. Análises químicas mostraram a presença de metais no sistema nervoso central (SNC), tornando necessário o desenvolvimento de protocolos de investigação para melhor conhecimento de sua distribuição nos tecidos e nas células, utilizando-se, para isso, técnicas histoquímicas. Na metade deste século, estudos utilizando um agente quelante, a ditizona, revelaram a presença do íon zinco no hipocampo. Em 1958, Timm demonstrou o mesmo fato através de uma revelação histoquímica com sulfeto de prata. Outros estudos se seguiram, encontrando-se uma revelação intensa para zinco, particularmente nas fibras musgosas do hipocampo6,7.
Sabe-se hoje que o zinco, além de ser um componente nutricional essencial para o metabolismo vegetal e animal, tem uma função bastante específica na transmissão nervosa central excitatória em mamíferos8. O cátion é encontrado em alguns terminais sinápticos, seqüestrado nos botões axonais, sendo liberado na fenda sináptica em seguida à chegada do impulso elétrico, por um mecanismo provável de exocitose das vesículas que o contém. Esse mecanismo é dependente de cálcio. Inicialmente detectado nas estruturas do sistema límbico (hipocampo e amígdala), hoje é descrito nas camadas 1-3 e 5 do córtex cerebral, na glândula pineal e também nos núcleos cocleares8,9,10.
Seu papel fisiológico não é bem conhecido. Uma vez que as vias neurais onde foi identificado são vias glutamatérgicas, e sabendo-se que o zinco inibe a ligação do glutamato a seus receptores, principalmente o do tipo N-Metil-D-Aspartato (NMDA), acredita-se que tenha um papel na modulação da atividade desse tipo de sinapse9. O aumento na concentração extracelular de zinco, por sucessivas atividades sinápticas excitatórias, levaria a um bloqueio do receptor pós-sináptico, sendo, assim, responsável por um controle funcional do sistema. A função do íon parece ser protetora contra efeitos neuro-excitotóxicos8. Um efeito antagonista do zinco sobre receptores de GABA também foi demonstrado11.
Em algumas regiões, o íon se encontra ligado a pró-proteínas, estabilizando-as. Aparece também ligado a uma substância denominada fator de crescimento neuronal (neuronal growth factor - NGF), principalmente a um complexo armazenador deste, o 7S-NGF. Trata-se de um fator neurotrófico cuja ativação se segue a uma perda de aferências nos sistemas onde é encontrado e está ligada à ocorrência de fenômenos plásticos de brotamentos neuronais. Sabe-se que o hipocampo é uma área rica em NGF e que, nessa estrutura, o zinco parece atuar como um regulador do fenômeno trófico secundário à perda das aferências, além de constituir um bom marcador histoquímico para sua evidenciação9,12.
A localização do zinco nos núcleos cocleares, segundo Frederickson et al. (1988)9 dá-se de duas diferentes formas: o primeiro tipo aparece como uma capa ao longo de toda a superfície do núcleo dorsal, correspondendo à sua camada molecular. No segundo tipo, o zinco é marcado de forma salpicada, nas regiões correspondentes às células granulares. Essa localização bem diferenciada torna o íon um bom marcador para estudos histoquímicos de alterações nos circuitos neurais dos núcleos cocleares. A literatura, entretanto, é falha quanto à demonstração detalhada da distribuição do zinco ao longo da extensão ântero-posterior dos núcleos cocleares e sua correlação com a fisiologia dos sub-núcleos.
Os objetivos do presente trabalho foram:
1. Estudar de forma detalhada a disposição do íon zinco ao longo de toda a extensão dos núcleos cocleares;
2. Comparar essa distribuição com a subdivisão anatômica dos núcleos, estudada pela coloração de Nissl.
MATERIAL E MÉTODOS Onze ratos Wistar albinos, adultos, com 70 dias de vida, foram submetidos ao estudo.
Os animais foram sacrificados por meio de perfusão intracardíaca, seguindo o protocolo específico para a técnica histoquímica de Neo-Timm. Como esse protocolo não entra em conflito com o procedimento da coloração de Nissl, foi possível utilizar os mesmos sujeitos para estudo pelas duas técnicas.
Inicialmente, os animais receberam uma injeção intraperitoneal de solução de selenito de sódio em água destilada, na concentração de 20 mg/ml, na dose de 20 mg/kg. O selenito de sódio possui uma ação quelante sobre o zinco tecidual, precipitando o mesmo e potenciando a evidenciação do íon pelo protocolo de Neo-Timm9. Trinta minutos após a aplicação do selenito, foi realizada a perfusão. Foram perfundidos inicialmente 100 ml de solução de tampão Millonigs 0,12 M, pH 7,4. Em seguida, introduziram-se 100 ml de solução de sulfeto de sódio a 0,1% no mesmo tampão. O sulfeto reage com o zinco, precipitando-o nos tecidos. A seguir, administraram-se 100 ml de glutaraldeído a 3% em água bidestilada e deionizada, para fixação, e novamente sulfeto a 0,1% em Millonigs, no volume de 200 ml. Os cérebros removidos foram estocados durante uma noite em solução de sacarose a 15% em glutaraldeído a 3%. A seguir, foi realizado congelamento com 2-metilbutano a 99,5% (Sigma-Aldrich), a -40ºC.
Os cérebros foram cortados em criostato (Micron-Zeiss), em secções com espessura de 25mm, colocadas sobre lâminas de vidro gelatinizadas. As secções abrangeram a extensão dos núcleos cocleares, entre 11,60 e 9,68 mm no eixo ântero-posterior, a partir do Bregma, de acordo com o atlas estereotáxico de Paxinos e Watson (1986)13. Para cada nível, uma lâmina foi encaminhada para estudo com coloração de Nissl, uma para histoquímica de Neo-Timm e uma para armazenagem.
A revelação da técnica de Neo-Timm é semelhante a uma revelação fotográfica, na qual utiliza-se um banho contendo nitrato de prata6,7. A prata reage com o zinco precipitado nos tecidos pelo sulfeto e pelo selenito, formando um composto visível de coloração marrom, o qual pode variar sua tonalidade de acordo com a quantidade de zinco presente no tecido e com o tempo de exposição do tecido ao banho.
Após montagem e sacagem das lâminas, as mesmas foram estudadas sob microscopia ótica, fazendo-se uma varredura dos NNCC no sentido ântero-posterior, analisando-se a distribuição da marcação para o zinco.
O zinco precipitado nos tecidos, quando revelado pela histoquímica de Neo-Timm, assume uma coloração marrom, sendo sua intensidade diretamente proporcional à concentração do íon. Assim, regiões com grande concentração de zinco coram-se fortemente em marrom. Regiões de baixa concentração exibem coloração tênue. Quando transformadas as imagens para escala de cinzas, permanece essa proporcionalidade da intensidade de cinza com a concentração do íon nos tecidos.
RESULTADOS A distribuição do zinco nos núcleos cocleares, nos diferentes níveis de corte, encontram-se ilustradas nas figuras a seguir.
A Figura 1 mostra o núcleo coclear em sua extremidade posterior, onde se encontra apenas o sub-núcleo dorsal. Vale a pena ressaltar que os sub-núcleos dorsal e ventral não se encontram completamente coincidentes, no plano sagital. O núcleo coclear dorsal localiza-se mais posteriormente, enquanto o ventral é mais anterior. Nota-se na figura que o núcleo coclear dorsal marca intensamente para zinco, principalmente na sua camada mais externa, denominada camada molecular. Na camada molecular encontram-se células pequenas, arredondadas, abundantes, as quais são denominadas células granulares. Esse tipo de célula também é encontrado no cerebelo e no hipocampo, regiões também ricas em zinco.
A Figura 2 mostra cortes intermediários, onde se visualizam os sub-núcleos dorsal e ventral. À medida que os cortes progridem em sentido anterior, o núcleo dorsal diminui sua projeção, enquanto o ventral torna-se mais evidente. Nota-se que a marcação para zinco no núcleo coclear ventral é menos intensa, encontrando-se espalhada de forma tênue pelo interior do núcleo, e formando uma fina camada mais concentrada na periferia do mesmo.
Na Figura 3, vêem-se os cortes mais anteriores, onde se encontra apenas núcleo coclear ventral, com o padrão de marcação histoquímica descrito no parágrafo anterior.
A Figura 4 ressalta o limite entre os sub-núcleos dorsal e ventral, onde pôde-se notar, em todos os cortes estudados, um reforço no padrão de marcação para zinco. Estudando-se essa região com coloração de Nissl, para evidenciação celular, notou-se intensa concentração de células granulares, correspondendo ao mesmo padrão celular das outras regiões ricas em zinco.
LEGENDAS
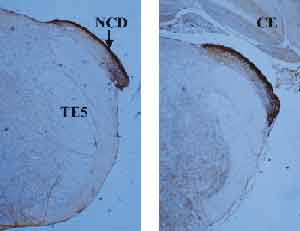
Figura 1. Cortes da extremidade posterior do núcleo coclear, evidenciando apenas o núcleo coclear dorsal, ricamente marcado pela histoquímica para zinco. NCD = núcleo coclear dorsal; CE = cerebelo; PCI = pedúnculo cerebelar inferior; TE5 = trato espinhal do trigêmeo.
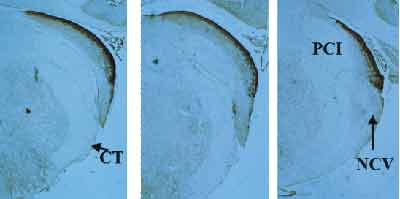
Figura 2. Observa-se o aparecimento gradual do núcleo coclear ventral, à medida que o nível de corte avança em direção anterior, com marcação histoquímica menos intensa do que no dorsal. NCV = núcleo coclear ventral. PCI = pedúnculo cerebelar inferior; CT = corpo trapezóide.
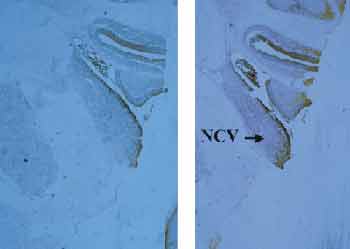
Figura 3. Extremidade anterior do núcleo coclear, onde se encontra apenas sub-núcleo ventral, com coloração mais fraca para zinco, denotando menor concentração do íon nesse nível do núcleo. NCV = núcleo coclear ventral.

Figura 4. Transição entre os núcleos cocleares dorsal e ventral, onde há um reforço do padrão de marcação histoquímica. Observa-se, em B e C, alta concentração de células granulares (setas). B = aumento 40x; C = aumento 100x.
O método de Neo-Timm se mostrou bastante eficiente para uso nos núcleos cocleares. Descrito inicialmente por Timm, em 19586, e posteriormente modificado por Danscher (1981)14, consiste numa revelação do zinco pelo nitrato de prata, formando grânulos escuros visíveis à microscopia óptica. Os primeiros estudos a esse respeito localizaram o zinco nos botões sinápticos terminais de fibras musgosas, que são os axônios das células granulares do giro denteado do hipocampo, porém, estudos subseqüentes comprovaram que o íon está presente em outros sistemas sinápticos, entre eles, os núcleos cocleares6,7. Frederickson et al. (1988)9 descrevem uma distribuição diferenciada da marcação para zinco nos NNCC. A primeira, mais difusa, pontilhada ao longo das regiões de domínio das células granulares; a segunda, mais compacta, localizada na camada molecular, que é a camada mais externa do NCD. O mesmo foi afirmado por Haug (1973)6.
Em nosso estudo, os núcleos cocleares mostraram uma distribuição da marcação para zinco bastante semelhante ao citado acima. No NCD, a marcação é muito intensa, delineando uma camada mais ou menos espessa, na face dorsal do núcleo. Mais internamente, a marcação é de padrão salpicado menos denso. No NCV, o zinco forma uma camada fina em sua superfície dorsal; nas regiões mais anteriores do núcleo, a camada marcada para zinco se volta em direção ventro-medial, acompanhando os contornos do núcleo e delimitando-o com o pedúnculo cerebelar anterior. No interior do NCV, o padrão de marcação também é do tipo pontilhado escasso. Na interface entre os núcleos cocleares dorsal e ventral, há uma invaginação de células granulares, marcando nitidamente o limite entre ambos. Essa região também é intensamente marcada para zinco, conforme mostra a Figura 3.
A origem do zinco evidenciado nos núcleos cocleares não é confirmada. Na camada molecular do NCD, acredita-se que esteja presente nas sinapses originárias das fibras paralelas, que são os axônios das células granulares. Observações prévias em estruturas prosencefálicas localizaram o zinco como co-fator de sinapses glutamatérgicas. Estudos mostram que as células granulares dos núcleos cocleares utilizam glutamato como neurotransmissor15. Sabe-se que as fibras paralelas fazem inúmeras sinapses de passagem ao longo da camada molecular. O padrão de marcação em grânulos pode corresponder a esses pontos de sinapses8,9.
Já o padrão de marcação encontrado no centro dos núcleos e em outras áreas de domínio das células granulares pode representar ou os axônios dessas células ou as chamadas fibras musgosas, que fazem sinapses em glomérulos com os dendritos das células granulares e das células de Golgi a elas associadas. O fato de ser uma marcação mais escassa faz pensar que, caso as fibras musgosas utilizem o zinco como co-fator, isso não se dá na totalidade das mesmas9.
O tipo de aferência recebida pelas células granulares não é totalmente conhecido. Estudos apontam para fibras do feixe olivo-coclear ou de outros feixes descendentes, os quais penetram nos núcleos cocleares e marcam positivamente para acetilcolina; alguns autores apontam essa aferência como sendo a origem das fibras musgosas4,16. Se isso for verdade, então o zinco encontrado esparsamente nas regiões de domínio das células granulares não provém das fibras musgosas, uma vez que essas não utilizam glutamato como neurotransmissor. Mais provavelmente, está localizado nos botões sinápticos dos axônios das células granulares. Também se descreveu a chegada de fibras de neurônios cocleares do tipo II em sinapses com as granulares dos núcleos cocleares17 e, ao que tudo indica, essas sinapses utilizam glutamato como neurotransmissor4.
Parece, portanto, que o zinco participa dos mecanismos de transmissão sináptica relacionados ao funcionamento das células granulares. A maneira como essas células participam da circuitaria da via acústica ainda não é totalmente conhecida. Sabe-se que suas características, à coloração de Nissl, lembram as das células granulares do cerebelo, e acredita-se que possa haver semelhanças entre ambas também do ponto de vista funcional. A distribuição das células granulares no NCD e NCV e a existência das fibras paralelas cruzando a camada molecular do NCD faz pensar numa ação direta desse tipo celular sobre o funcionamento da camada molecular16. Sendo as células granulares interneurônios cujas aferências são recebidas de moduladores do sistema auditivo, podemos talvez afirmar que o íon zinco, sendo ele próprio um modulador sináptico, tem papel fundamental no controle funcional do sistema. Sabe-se, também, que aferências do NCD atingem neurônios do NCV, os quais têm por função conduzir a informação vinda da periferia para estruturas mais rostrais da via auditiva. Neste caso, podemos supor que o NCD exerça, por meio dessas aferências, controle sobre a passagem do sinal encaminhado ao Sistema Nervoso Central. O fato do NCD ser rico em zinco, o qual suspeita-se que tenha um papel modulador de sinapses, e de receber rica inervação do sistema auditivo eferente, contribuem para reforçar esse conceito.
CONCLUSÕES 1. estudo através da coloração de Nissl e da histoquímica de Neo-Timm permitiu evidenciação da estrutura anatômica dos núcleos cocleares dorsal e ventral, bem como da distribuição diferenciada dos sistemas ricos em zinco.
2. A utilização da técnica de Neo-Timm para detecção de zinco nos tecidos permite o estudo da distribuição anatômica de alguns circuitos neurais nos núcleos cocleares, podendo ser utilizado para o estudo dessas estruturas, em condições normais e de rearranjos plásticos.
3. A distribuição diferenciada do zinco entre os núcleos cocleares dorsal e ventral reforça o conceito de que há um papel fisiológico distinto entre ambas as estruturas.
4. A ligação do núcleo dorsal com o sistema auditivo eferente, a presença do íon zinco em grande quantidade, e a existência de fibras que cruzam do núcleo dorsal para o ventral, são fortes evidências de que esse sub-núcleo exerça importante papel modulador sobre o início da via auditiva central.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Rouiller EM. Organisation fonctionnelle des voies auditives. In : Romand, R Le Systeme Auditif Central. Paris: Les Éditions Inserm; 1992. p.1-49.
2. Harrison JM, Warr WB. A study of the cochlear nuclei and ascending auditory pathways of the medulla. J Comp Neurol 1962;119:341-352.
3. Webster WR. Auditoy System. In: Paxinos (Ed). The Rat Nervous System. Academic Press Inc.;1995. p.797-831.
4. Romand R. Aspects anatomo-fonctionnels du noyau cochléaire. In: Romand R. (Ed) Le systeme auditif central. Anatomie et physiologie. Paris: Les Éditions Inserm; 1992. p.51-108.
5. Brawer DK, Kane EC. The neuronal architecture of the cochlear nucleus of the cat. J Comp Neurol 1974;155:251-300.
6. Haug FMS. Heavy metals in the brain. Adv Anat Embryol Cell Biol 1973;47 (4):04-71.
7. Danscher G, Howell G, Pérez-Clausell J, Hertel N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS. Histochemistry 1985;83:419-422.
8. Peters S, Koh J, Choi DW. Zinc selectively blocks the action of N-methyl-D-aspartate on cortical neurons. Science 1987;236:589-593.
9. Frederickson CJ, Howell GA, Haigh MD, Danscher G. Zinc-containing fiber systems in the cochlear nuclei of the rat and mouse. Hear Res 1988;36:203-212.
10. Howell GA, Perez-Clausell J, Frederickson CJ. Zinc containing projections to the bed nucleus of the stria terminalis. Brain Res 1991;562:181-189.
11. Christensen MK, Geneser FA. Distribution of neurons of origin of zinc-containing projections in the amygdala of the rat. Anat Embryol 1995;191:227-237.
12. Stewart GR, Frederickson CJ, Howell GA, Gage FH. Cholinergic denervation-induced increase of chelatable zinc in mossy-fiber region of the hippocampal formation. Brain Res 1984;290:43-51.
13. axinos G, Watson C. The Rat Brain in Stereotaxic Coordinates, Second Edition. Academic Press Inc.; 1986.
14. Danscher G. Histochemical demonstration of heavy metals. A revised version of the sulphide silver method suitable for both light and eletronmicroscopy. Histochemistry 1981;71:1-16.
15. Wenthold RJ, Hunte C, Petralia RS. Excitatory amino acid receptors in the rat cochlear nucleus. In: Merchán M, Juiz J, Godfrey D, Mugnaini E (Eds). The mammalian cochlear nuclei. Organization and function. New York and London: Plenum Press; 1993. p.179-194.
16. Mugnaini E, Warr WB, Osen KK. Distribution and light microscopic features of granule cells in the cochlear nuclei of cat, rat and mouse. J Comp Neurol 1980;191:581-606.
17. Brown MC. Anatomical and physiological studies of type I and type II spiral ganglion neurons. In: Merchán MA, Juiz JM, Godfrey DA, Mugnaini E (Eds). The Mammalian Cochlear Nuclei. New York and London: Plenum Press; 1993. p.43-54.
[1] Professora-Doutora da Disciplina de Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo.
[2] Professor-Doutor, Chefe do Laboratório de Neurofisiologia e Neuroetologia Experimental do Departamento de Fisiologia da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo.
Endereço para Correspondência: Profa. Dra. Maria Cristina Lancia Cury Féres
Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço - Avenida Bandeirantes, 3900 12º andar 14049-900 Monte Alegre Ribeirão Preto SP. Tel (0xx16) 602-2863/ 602-2526 - Fax (0xx16) 602-2860 - E-mail: mcferes@hcrp.fmrp.usp.br
Trabalho apresentado no XXXVI Congresso Brasileiro de Otorrinolaringologia, em Florianópolis, novembro de 2002, na sessão de Temas Livres para Premiação - Suporte financeiro: FAPESP, CAPES, CNPq.


