INTRODUÇÃOA emergência de microorganismos resistentes aos antimicrobianos está diretamente relacionada ao uso excessivo desses fármacos1-3. As infecções de vias aéreas superiores (IVAS) são muito comuns em crianças e os lactentes podem apresentar até 10 a 12 episódios de IVAS por ano4-6.
A maioria das sinusites, otites médias agudas (OMA) e tonsilites têm etiologia viral e curso autolimitado, mas o uso de antibióticos para tratar essas infecções é muito comum, principalmente em três situações: paciente com queixa de dor de garganta; criança que apresenta hiperemia de membrana timpânica ou tosse com secreção e RX de seios da face com velamento. O desconhecimento sobre a evolução natural das IVAS, a pouca valorização das informações obtidas através da anamnese, exame físico e dados epidemiológicos estão associados ao uso excessivo de antibióticos. Não se pode esquecer, entretanto, que existem outros fatores igualmente importantes para o uso abusivo de medicamentos. Dentre eles, destacam-se o baixo valor preditivo dos sinais clínicos para diferenciar tonsilites virais das bacterianas; a ausência de recursos laboratoriais simples e de baixo custo para o diagnóstico etiológico das IVAS; as dificuldades de acesso a serviços médicos, que geram insegurança quanto ao risco de futuras complicações; as falsas expectativas de que a prescrição de antibióticos em IVAS de etiologia viral pode prevenir futuras complicações e as dificuldades na interpretação de exames radiológicos, que não permitem diferenciar sinusites virais das bacterianas e dos processos alérgicos4,5.
Nesta revisão, as autoras fazem uma análise critica dos resultados de estudos randomizados e controlados sobre critérios clínicos e laboratoriais utilizados para diagnóstico e tratamento das tonsilites, sinusites e OMA, identificados através de pesquisa nas bases de dados PUBMED e SCIELO.
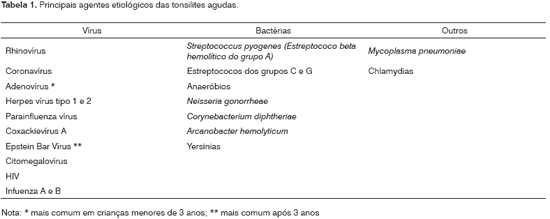
TONSILITEAs tonsilites podem ser causadas por diversos agentes (Tabela 1), mas o
estreptococo beta-hemolítico do Grupo A (EBHGA) ou
Streptococcus pyogenes do Grupo A (GAS) é seu mais importante agente etiológico, pois além de causar complicações supurativas, pode causar complicações não-supurativas como a febre reumática e a glomerulonefrite aguda. Estima-se que 75% dos casos de tonsilite na faixa etária entre dois e 10 anos sejam de etiologia viral, mas a maioria das tonsilites é tratada com esses medicamentos4-6. Possivelmente, o uso excessivo de antibióticos no tratamento das faringotonsilites se deve às dificuldades em diferenciar tonsilites virais das causadas por EBHGA e ao fato de o tratamento com antibióticos prevenir futuras complicações, como a febre reumática4-7.
Uma meta-análise que incluiu 27 estudos, com um total de 2.835 pacientes com queixa de dor de garganta, revelou que o tratamento com antibióticos reduziu em quase 80% o risco de febre reumática (RR = 0,22; 95% CI 0,02 a 2,08) e foi associado a menor risco de glomerulonefrite. As complicações supurativas também diminuíram de forma significativa: OMA (RR 0,30; 95% CI 0,15 a 0,58); sinusite aguda (RR 0,48; 95%CI 0,08 a 2,76); abscesso peritonsilar (RR 0,15; 95% CI 0,05 a 0,47). A redução dos sintomas (dor e febre) só foi notada no grupo tratado com antibióticos após o terceiro dia, quando aproximadamente metade dos pacientes tratados com placebo já estava assintomática. Após uma semana, 90% dos pacientes tratados ou não com antibióticos estavam livres dos sintomas, sendo necessário tratar seis pacientes com antibióticos para obter redução de sintomas em apenas um, após o terceiro dia de tratamento. O impacto dos antibióticos na redução dos sintomas foi maior quando foram analisados apenas os pacientes com swab de orofaringe positivo para estreptococo7.
Os principais objetivos do tratamento das tonsilites agudas com antibióticos é reduzir as chances de complicações supurativas e não-supurativas associadas ao EBHGA e reduzir a transmissão dessa bactéria na comunidade. Embora existam critérios clínicos para diferenciar as tonsilites bacterianas das causadas por vírus (Tabela 2), a sensibilidade desses critérios para identificar tonsilites bacterianas é baixa.

Na Holanda, foram acompanhadas 156 crianças (4 a 15 anos) com pelo menos dois critérios sugestivos de infecção bacteriana e queixa de dor de garganta há menos de sete dias e avaliada a efetividade de 3 ou 7 dias de tratamento com penicilina. O uso de antibiótico não reduziu os sintomas nem número de complicações, independentemente de as crianças terem ou não infecção confirmada pelo EBHGA. Entretanto, nas 96 crianças (60%) que apresentavam cultura de orofaringe positiva para o EBHGA e que não foram tratadas com antibiótico, observou-se maior taxa de recorrência das tonsilites. É possível que a ausência de detecção de complicações tenha sido associada ao pequeno número de crianças incluídas no estudo e à baixa prevalência de cepas nefrogênicas ou associadas à febre reumática naquele país. Portanto, não diagnosticar e tratar adequadamente as tonsilites estreptocócicas pode acarretar sérios riscos em regiões onde existe alta prevalência de febre reumática8.
Um estudo realizado com o objetivo de avaliar os critérios propostos pela OMS para identificar as crianças com tonsilite causada pelo EBHGA, realizado em três países, que incluiu 1.810 crianças, revelou que a proporção de tonsilites pelo EBHGA variou de 25,6%, no Brasil, até 42%, na Croácia. Embora os critérios da OMS tivessem alta especificidade para identificar essa bactéria (94 a 97%), a sensibilidade foi inferior a 12%. Os autores concluíram que há necessidade de critérios mais sensíveis para identificar o EBGH, particularmente em locais onde a incidência de febre reumática é alta9.
Na Suécia, o EBHGA foi identificado em cultura de orofaringe em 53 de 169 (31%) crianças maiores de 4 anos com tonsilite aguda. Entre as crianças que tinham todos os critérios clínicos altamente sugestivos de infecção bacteriana (24%), a sensibilidade, especificidade, valor preditivo-positivo e valor preditivo-negativo do teste rápido para detecção de antígeno foram de 82, 96, 90 e 93%, respectivamente, enquanto para a avaliação clínica positiva, os valores foram 36, 97, 83 e 77%10.
Em um estudo realizado em São Paulo, com o objetivo de comparar cultura, hibridização molecular e teste rápido para detecção de antígeno do EBHGA em 50 crianças com faringotonsilite aguda, na faixa etária de um a 12 anos, a prevalência do EBHGA foi de 34%. O EBHGA foi identificado em 30% das culturas, 25% das amostras testadas pelo método de hibridização molecular e 26% por teste rápido de detecção de antígenos, sem diferenças estatisticamente significativas entre os três métodos11.
Em outro estudo que incluiu 81 indivíduos com mais de 12 anos, a sensibilidade e especificidade do teste rápido foram de 93,9% e 68,7% e os valores preditivo-negativo e positivo foram de 94,2 e 67,4%, respectivamente12.
Embora a cultura da tonsila seja considerada o teste padrão-ouro para o diagnóstico etiológico definitivo de tonsilite por EBHGA, tendo aproximadamente 95% de acurácia; esse exame não é facilmente disponível e seus resultados são bastante demorados. A Academia Americana de Pediatria preconiza o uso de testes diagnósticos de detecção rápida do grupo específico de carboidratos do estreptococo (imunoensaio enzimático e aglutinação com látex) para diferenciar tonsilites virais das bacterianas, pois esses testes dão resultados rápidos e apresentam boa sensibilidade e especificidade para o diagnóstico das tonsilites por estreptococo. Deve-se salientar, entretanto, que nem a cultura de orofaringe nem os testes rápidos para detecção do estreptococo são capazes de diferenciar os doentes dos portadores do EBHGA5,13.
Nos países desenvolvidos, os testes rápidos para detecção de antígenos do estreptococo na orofaringe são cada vez mais utilizados, devido à sua elevada sensibilidade. No Brasil, embora esses testes sejam utilizados em algumas clínicas privadas, eles não estão disponíveis na maioria dos serviços públicos, e o diagnóstico continua a ser feito com base apenas nos critérios clínicos. Devido à baixa sensibilidade dos critérios clínicos para detecção de tonsilite por EBHGA e aos riscos de febre reumática nos países em desenvolvimento, é preciso disponibilizar esses testes para os clínicos que atuam em serviços públicos para evitar o uso excessivo de antimicrobianos4-7.
O tratamento imediato das tonsilites por EBHGA não é essencial para prevenção da febre reumática, pois a incidência dessa complicação é reduzida quando o tratamento é instituído até 9 dias após o início dos sintomas. Apesar de trazer poucos benefícios na redução dos sintomas da tonsilite, o tratamento precoce reduz drasticamente a transmissão das cepas associadas causadoras de febre reumática ou glomerulonefrite aguda. O risco de transmissão do EBHGA em ambientes fechados (casa ou escola) é alto (35%), mas 24 horas após o início do tratamento com penicilina, a transmissão é muito baixa. Por outro lado, o tratamento precoce das infecções estreptocócicas está associado a menor resposta sorológica e maior recorrência da infecção13.
Tão importante quanto diagnosticar as tonsilites por EBHGA é tratá-las de forma adequada. Infelizmente, também não é isso que ocorre na prática. Muitas crianças com queixa de dor de garganta recebem antibióticos inapropriados para erradicar o EBHGA da orofaringe, ou são tratadas por tempo insuficiente ou em doses e intervalos incorretos5,6,13.
Diversos antibióticos são capazes de erradicar o EBHGA e alguns deles podem ser administrados em esquemas mais curtos e em dose única diária, aumentando a adesão ao tratamento; entretanto, o
S. pyogenes permanece altamente sensível às penicilinas e cefalosporinas13-16.
Embora o uso de macrolídeos possa facilitar o tratamento das estreptococcias, esquemas terapêuticos com baixas doses de azitromicina parecem inadequados para tratar as tonsilites por EBHGA e, além disso, a resistência aos macrolídeos está diretamente associada à sua utilização, sendo aconselhável restringir o uso desses medicamentos para os casos de alergia à penicilina ou casos de tonsilite recorrente13.
Em meta-análise que avaliou 19 estudos com um total de 4.626 pacientes, o tratamento com 60 mg/kg de azitromicina foi superior a 10 dias de tratamento com penicilina ou cefalosporinas. As falhas na erradicação do EBHGA foram 5 vezes mais freqüentes com outros antibióticos do que com azitromicina; entretanto, quando a azitromicina foi administrada na dose de 30 mg/kg por tratamento, sua efetividade foi três vezes mais baixa em comparação com tratamento por 10-dias com outros antibióticos. O tratamento da tonsilite com azitromicina, na dose de 60 mg/kg em crianças ou 500 mg/dia, por três dias em adultos é superior a outros antibióticos, como penicilina ou cefalosporinas e, além disso, tem a vantagem de reduzir os problemas de adesão ao tratamento14.
Estudos realizados nos EUA e Europa revelaram que as cefalosporinas são 3 a 4 vezes mais efetivas do que a penicilina oral para erradicação laboratorial do
S. pyogenes15. Uma meta-análise que incluiu 47 estudos com 11.426 pacientes, comparando 10 dias de cefalosporinas vs. 10 dias de penicilina revelou que, na Europa a taxa de falhas bacteriológicas com cefalosporinas foi 4,3 vezes menor e, nos EUA, 2,7 vezes menor. Nos estudos que compararam tratamentos curtos com cefalosporinas (4 a 5 dias) com o tratamento clássico com penicilina oral por 10 dias, também forma encontradas menores taxas de falhas bacteriológicas com as cefalosporinas, mas a redução nas falhas foi menor do que a verificada após o uso de cefalosporinas por 10 dias (1,3 a 2,4)16.
Um estudo realizado em adolescentes e adultos com tonsilite por EBHGA revelou que a clindamicina na dose de 300mg, bid, apresenta a mesma efetividade que a associação amoxicilina/clavulanato17.
Apesar de esses resultados revelarem que alguns novos antibióticos são tão ou mais efetivos que a penicilina no tratamento da tonsilite por EBHGA, é preciso lembrar que eles têm alto custo e que as cefalosporinas e macrolídeos apresentam maior impacto na seleção de cepas resistentes, em comparação com os betalactâmicos18.
Os antibióticos betalactâmicos persistem como primeira opção para tratar as tonsilites bacterianas, tendo em vista a baixa prevalência de S. pyogenes resistentes a esses medicamentos e seu baixo custo13,19-21.
Finalmente, é importante destacar a necessidade de ter cautela com o uso de antiinflamatórios não-hormonais no tratamento de crianças com febre e lembrar que se os sintomas persistirem, deve-se suspeitar de outras causas, como infecção por vírus ou bactérias atípicas22,23.
SINUSITEO resfriado comum é a doença infecciosa mais comum em crianças e adultos e, não raramente, evolui com secreção nasal persiste por mais de sete a 10 dias. A mucosa nasal tem continuidade com a das cavidades paranasais, e nos quadros virais também existe sinusopatia. A suspeita de sinusite bacteriana aguda (SBA), que é uma das complicações mais comuns do resfriado, deve ser feita em crianças com quadro de tosse e secreção nasal purulenta por mais de 10 a 14 dias ou quando houver persistência ou recorrência da febre após o quarto dia de evolução de uma IVAS.
A radiografia simples das cavidades paranasais não tem utilidade para o diagnóstico das SBA, pois tanto o resfriado comum como os quadros alérgicos podem causar velamento ou opacidade das cavidades paranasais indistinguíveis da das alterações radiológicas observadas na SBA. Quando houver suspeita de complicações da SBA ou recorrência freqüente dos sintomas, o exame de imagem mais indicado é a tomografia computadorizada2-6.
Embora muitas crianças com tosse e secreção nasal persistente sejam tratadas com antibióticos, o uso desses medicamentos é pouco efetivo para resolver o problema, sendo necessário tratar oito crianças para obter melhora dos sintomas em uma (95% IC - 5 a 29)24,25.
Em um estudo recente, randomizado e controlado, que incluiu 82 crianças com sintomas nasais e exames de imagem (ultra-som e Raios X das cavidades paranasais) sugestivos de sinusite, a eficácia do tratamento com axetil-cefuroxima (125mg, bid, 10 dias) foi comparada com placebo, não sendo encontradas diferenças significativas na proporção de crianças completamente curadas após duas semanas. A cefuroxemina reduziu os sintomas em apenas 6% (95% IC -16 a 29)26.
Assim como nas tonsilites, a escolha do melhor esquema terapêutico para crianças com suspeita de sinusite bacteriana varia em diferentes locais; enquanto alguns indicam a amoxicilina em doses habituais, outros preconizam antibióticos com maior espectro de ação, como a associação amoxicilina em dose alta com clavulanato, cefalosporinas e macrolídeos.
Uma análise de 33 estudos revelou que, em comparação com amoxicilina e amoxicilina/clavulanato, a claritromicina apresentou pequeno benefício na redução dos sintomas de rinossinusite (OR = 1,12). Apesar de a claritromicina ser efetiva e segura para tratar a rinossinusite, é preciso considerar que seu custo é bem maior do que o dos betalactâmicos. O mesmo é válido para novos medicamentos, como a telitromicina, que tem demonstrado boa eficácia em adultos, na dose de 800mg, uma vez ao dia, por cinco dias27-29.
Outros tratamentos preconizados para tratar a sinusite aguda incluem a solução salina hipertônica e o uso de corticosteróide tópico nasal. A maioria dos estudos comparando esses tratamentos com antibióticos ou placebo foi realizada em grupos selecionados de adultos1,2,5,30,31.
OTITE MÉDIA AGUDAA otite média aguda (OMA) é uma das infecções mais comuns na infância e o principal motivo para uso de antibióticos em crianças, pois praticamente todas têm pelo menos um episódio de OMA antes de completar 3 anos e, dessas, 20% apresentarão múltiplos episódios. Estima-se que, aproximadamente, 80% das OMA em lactentes sejam causadas por bactérias, com destaque para três agentes:
S. pneumoniae, H. influenzae não-tipáveis e
M. catarrhalis32,33.
Considerando-se os princípios de farmacocinética e farmacodinâmica, a amoxicilina tem sido considerada como droga de escolha para tratar a OMA, devido a seu espectro de ação, excelente penetração na orelha média, baixa toxicidade e custo reduzido. Entretanto, devido ao grande número de casos de OMA com resolução espontânea e às preocupações associadas ao uso excessivo de antibióticos, em muitas regiões recomenda-se não tratar as OMA a menos que a criança apresente febre alta ou persistência dos sinais e sintomas após receber analgésicos por 48 a 72 horas32-36.
Na Holanda, apenas 31% das crianças com OMA recebem antibióticos, enquanto nos EUA e Austrália mais de 95% das crianças com OMA são tratadas com antibióticos33.
Em meta-análise de oito estudos, incluindo 2.287 crianças com OMA, o uso de antibióticos não foi superior ao placebo para aliviar os sintomas nas primeiras 24 horas de tratamento, mas reduziu a dor em 30%, após dois a sete dias33. Como 80% das crianças não-tratadas apresentaram resolução espontânea do quadro, o benefício estimado dos antibióticos foi de apenas 7%, estimando-se ser necessário tratar 15 crianças para obter redução dos sintomas em uma33.
Independentemente do tratamento com antibióticos, os sintomas da OMA melhoram após 24 horas em 61% das crianças e, após dois a três dias, em 80%36.
Um dos maiores problemas na avaliação de crianças com queixa de otalgia é diferenciar a OMA da otite média com efusão (OME), que apresenta menor taxa de complicações. Vale lembrar que o diagnóstico de OMA inclui o início abrupto de otalgia e febre associados à presença de fluido na orelha média (abaulamento da membrana timpânica, diminuição ou ausência de mobilidade da membrana timpânica, nível ar/fluído atrás da membrana timpânica ou otorréia aguda) e eritema da membrana. Nem sempre é fácil fazer o diagnóstico diferencial entre OMA e OME, principalmente quando o exame é realizado na criança com IVAS, que apresentam febre, irritabilidade e choro, pois o choro também está associado ao eritema da membrana timpânica5,6.
Além das preocupações quando às conseqüências imediatas da OMA (complicações e recorrência), existem dúvidas se o uso de antibióticos interfere na resolução da efusão na orelha média e se o fato de não tratar as crianças poderia prejudicar a audição, mas a maioria das crianças que apresentam OME após OMA tem boa evolução37,38.
Estima-se que 59% das efusões na orelha média identificadas após episódio de OMA tenham resolução em um mês e 74%, após três meses. Nos casos de OME de duração desconhecida, a resolução após 3 e 6 meses é de 28% e 42%, respectivamente; nos casos de OME crônica, a resolução é um pouco mais lenta, ocorrendo após 6 e 12 meses em 26% e 33%37.
Um estudo randomizado recentemente publicado sobre a evolução da OMA revelou que o desaparecimento da efusão na orelha média em crianças com OMA ocorre, em média, 7,5 dias após o início do tratamento com amoxicilina ou axetil-cefuroxima e que 69% das crianças têm resolução do problema após 14 dias. As crianças com OMA unilateral apresentaram resolução mais rápida da efusão do que aquelas com efusão bilateral (5 vs. 10 dias) e a bilateralidade da OMA foi fortemente associada com maior risco de falha terapêutica após duas semanas, independentemente do antibiótico utilizado38.
Os resultados de um estudo canadense desenhado para comparar a efetividade da amoxicilina (60 mg/kg/dia) com placebo em crianças com OMA revelaram que a resposta após 14 dias de antibiótico foi de 92,8%, enquanto no grupo placebo foi de 84,2%. O tratamento com amoxicilina foi superior ao placebo, mas o tamanho do efeito foi pequeno (8,6%). A maioria das crianças evoluiu bem sem antibióticos, mas o grupo tratado apresentou menor freqüência de dor e febre nos dois primeiros dias.
Estudos recentemente publicados têm demonstrado que é recomendável adotar uma postura mais cautelosa no tratamento das OMA (WASP, wait and see prescription)32-40.
Crianças com idade entre 6 meses e 12 anos com OMA de pouca gravidade foram randomizadas para tratamento imediato com antibióticos (n=112) ou uso de antibiótico somente em caso de persistência dos sintomas (n = 111). Os familiares aceitaram bem os dois tipos de orientação e, no dia 12, 69% das crianças tratadas com antibiótico tinham as membranas timpânicas normais vs 51% no grupo controle; a timpanometria estava normal em 25% no grupo tratado e em 10% no grupo controle. As crianças tratadas imediatamente com antibióticos apresentaram 16% menos falhas, porém, 66% das crianças do grupo controle não necessitaram de antibióticos os custos no grupo tratado foram, em média, $47 dólares vs $11, no grupo controle. As visitas à emergência, absenteísmo escolar ou ao trabalho e recorrências foram idênticas nos dois grupos e os autores concluíram que a orientação para uso de antibióticos somente em casos de persistência de sintomas reduziu em 73% o uso de antibióticos, em comparação com a prescrição imediata. Além disso, o uso imediato de antibióticos aumentou a colonização da orofaringe por cepas multirresistentes de S. pneumoniae, logo após o término do tratamento34.
Os resultados de outro estudo que incluiu 283 crianças com OMA (6 meses e 12 anos), randomizadas para receber antibióticos somente se houvesse persistência ou piora dos sintomas com o uso de ibuprofeno (WASP) ou a orientação clássica para iniciar o tratamento com antibióticos e analgésicos revelaram que, no grupo WASP, 63% das crianças não foram medicadas com antibióticos e nenhuma apresentou complicações. O uso dos medicamentos foi associado à persistência da febre ou otalgia39.
Little et al.40 acompanharam 315 crianças com idade entre 6 meses e 10 anos, randomizadas para tratamento imediato da OMA com antibióticos ou para a conduta mais conservadora (WASP) de só administrar antibióticos se houvesse persistência ou piora dos sintomas após tratamento com analgésicos, durante um ano. A evolução imediata e após três e 12 meses foi semelhante nos dois grupos, com e exceção das crianças que tinham dois ou mais episódios anteriores de OMA. Nesse grupo, houve maior número de recorrências de otalgia dentro de três meses (39% vs 10%), mas o número de seqüelas após um ano não foi diferente em comparação com as tratadas com antibióticos. Esses dados sugerem que a administração imediata de antibióticos não altera a evolução da OMA40.
A Academia Americana de Pediatria (Tabela 3) recomenda o tratamento imediato com antibióticos nas seguintes situações:
1) criança menor de seis meses;
2) criança com idade entre 6 e 24 meses com sinais evidentes de OMA, febre alta e/ou otalgia intensa ou se não for possível reavaliar a criança em caso de piora;
3) crianças com doença de base (imunocomprometidos, com fenda palatina, malformações);
4) crianças maiores de dois anos cujos sintomas não desaparecem após tratamento sintomático por 48 a 72 horas.
Apesar de diversos estudos revelarem que a maioria das crianças com otite não tratada com antibióticos melhora rapidamente e não apresenta complicações, algumas críticas têm sido feitas à conduta mais conservadora:
1) os critérios de inclusão e exclusão adotados nesses estudos nem sempre são claros;
2) muitos estudos incluem pequeno número de crianças menores de dois anos, que são as mais sujeitas às complicações;
3) nem todas as crianças procuram atendimento médico nas primeiras 24 horas após o início dos sintomas, não sendo prudente aguardar mais 48 a 72 horas para introduzir antibióticos nas crianças que já estão sintomáticas;
4) nem sempre é possível garantir o seguimento para reavaliação, principalmente nos serviços de pronto atendimento;
5) alguns estudos indicam que o número de complicações supurativas, como mastoidite, é maior em países onde o uso de antibióticos para tratar OMA é mais restrito e, como essa complicação é rara, é necessário avaliar grande número de crianças antes de assegurar que não existem diferenças na evolução de crianças com OMA tratadas ou não com antibióticos40-43.
A seleção de antibióticos para tratar a OMA também é objeto de controvérsias; enquanto alguns autores propõem tratamentos com doses altas de amoxicilina (80 a 90 mg/kg/dia), outros consideram que as doses habituais (40 a 45 mg/kg/dia) são suficientes para tratar crianças que vivem em comunidades onde a prevalência de S. pneumonia resistentes à penicilina é baixa e em crianças maiores de seis meses que receberam, pelo menos, três doses da vacina conjugada heptavalente contra pneumococo. Em regiões onde é alta a prevalência de cepas resistentes aos antibióticos, o uso de antibióticos com amplo espectro de ação, como cefalosporinas e macrolídeos é cada vez mais comum. As doses e o tempo de tratamento também são variáveis, pois alguns estudos indicam que o uso de cefalosporinas e azitromicina por 3 a 5 dias pode ser tão efetivo quanto 10 dias de amoxicilina, com maior probabilidade de adesão ao tratamento13,44-47. Muitas dessas recomendações têm como base estudos realizados com dupla timpanocentese para avaliar a erradicação das bactérias na orelha média e esses estudos têm sido realizados em países onde a prevalência da resistência bacteriana é elevada.
Infelizmente, na maioria das regiões, os padrões locais de resistência aos antibióticos das cepas que colonizam as vias respiratórias das crianças permanecem desconhecidos, dificultando a seleção do esquema antibiótico mais apropriado para tratar a OMA. Ao optar pelo tratamento com antibióticos, é fundamental lembrar que todos os antibióticos predispõem ao aumento da resistência; entretanto, os de amplo espectro de ação, como macrolídeos e novas cefalosporinas, causam maior impacto ecológico e têm maior custo em relação à amoxicilina18.
Por esses motivos, acreditamos que a melhor opção terapêutica para a OMA é a de restringir o uso de antibióticos nos casos de OMA leve (febre baixa e pouca dor), desde que a criança possa ser reavaliada precocemente, em caso de piora ou persistência dos sintomas e, quando necessário, iniciar o tratamento com amoxicilina, em doses habituais, a menos que a criança tenha risco para infecções resistentes (tratamento recente com antibióticos, otites recorrentes, imunodeficiência).
O uso de outros medicamentos para tratamento da OMA, tais como descongestionantes, antiinflamatórios não-hormonais, corticoesteróides tópicos nasais ou orais, também é controvertido. A maioria desses medicamentos não parece trazer benefícios às crianças com OMA e ainda pode causar eventos adversos48-49. Embora os corticoesteróides tópicos, isolados ou associados aos antibióticos, tenham algum efeito na redução da efusão na orelha média em curto prazo, não há informações suficientes para avaliar sua efetividade em longo prazo, portanto devem ser recomendados apenas para crianças com sinais e sintomas sugestivos de doença atópica50.
CONCLUSÕESA história clínica, o exame físico e os dados epidemiológicos são essenciais para o diagnóstico das tonsilites, sinusites e otites.
Devido à baixa especificidade dos critérios clínicos na diferenciação de tonsilites virais e bacterianas, é necessário disponibilizar os testes rápidos para detecção de antígenos do estreptococo na orofaringe tanto em serviços públicos e privados.
A maioria das SBA e OMA evolui bem sem o uso de antibióticos e a orientação para uso de analgésicos/antitérmicos e higiene nasal deve se a primeira medida para tratar essas infecções. Essa conduta só é válida se a criança tiver mais de seis meses e não apresentar co-morbidades nem sinais e sintomas de doença grave.
É preciso educar os médicos e leigos sobre a evolução natural das IVAS e os riscos do uso abusivo de antibióticos em crianças, mas também é fundamental garantir o acesso da criança para reavaliação caso os sintomas persistam ou haja piora clínica. Nessas situações, o tratamento com antibióticos deve ser imediato.
É necessário implantar um sistema de vigilância capaz de fornecer informações sobre os padrões de resistência das cepas de
S. Pneumoniae e H. Influenzae que colonizam as vias respiratórias e que causam OMA em crianças, pois existem amplas variações locais e sazonais na resistência aos antibióticos.
REFERÊNCIAS BIBLIOGRÁFICAS1. Arroll B, Kenealy T. Antibiotics for the common cold and acute purulent rhinitis. Cochrane Database Syst Rev 2005;(3):CD000247.
2. Arnold SR, Straus SE. Interventions to improve antibiotic prescribing practices in ambulatory care. Cochrane Database Syst Rev 2005;(4):CD003539.
3. Arroll B. Non-antibiotic treatments for upper-respiratory tract infections (common cold). Respir Med 2005;99:1477-84.
4. American Academy of Pediatrics. Group A Streptococcal Infections. In: Pichering LK Ed. Red Book: 2003 Report of the Committee on Infectious Diseases. 26th ed. Elk Grove Village (IL): Am Acad Pediatr;2003:573-84.
5. Sih T. Sih T, Clement PAR. Pediatric Nasal and Sinus Disorders. Taylor and Francis Publishing, Boca Raton, FL; 2005.
6. Bricks LF. Judicious use of medication in children. J Ped (Rio J) 2003;Suppl 1:S107-14.
7. Del Mar CB, Glasziou PP, Spinks AB. Antibiotics for sore throat. Cochrane Database Syst Rev 2006;(4):CD000023.
8. Zwart S, Rovers MM, de Melker RA, Hoes AW. Penicillin for acute sore throat in children: randomised, double blind trial. BMJ 2003;327:1324.
9. Rimoin AW, Hamza HS, Vince A, Kumar R, Walker CF, Chitale RA et al. Evaluation of the WHO clinical decision rule for streptococcal pharyngitis. Arch Dis Child 2005;90:1066-70.
10. Johansson L, Mansson NO. Rapid test, throat culture and clinical assessment in the diagnosis of tonsillitis. Fam Pract 2003;20:108-11.
11. Santos O, Pignatari AC. Detection of Group A beta-hemolytic Streptococcus employing three different detection methods: culture, rapid antigen detecting test, and molecular assay. Bras J Infect Dis 2003;7:297-300.
12. Araujo Filho BC, Imamura R, Sennes LU, Sakae FA. Role of rapid antigen detection test for the diagnosis of group A beta-hemolytic streptococcus in patients with pharyngotonsillitis. Rev Bras Otorrinolaringol 2005;71:168-71.
13. Pichichero ME. Treatment and prevention of streptococcal tonsilopharyngitis. http://www.uptodateonline. Acessado em 26 de outubro 2006.
14. Casey JR, Pichichero ME. Higher dosages of azithromycin are more effective in treatment of group A streptococcal tonsillopharyngitis. Clin Infect Dis 2005;40:1748-55.
15. Casey JR, Pichichero ME. Meta-analysis of cephalosporin versus penicillin treatment of group A streptococcal tonsillopharyngitis in children. Pediatrics 2004;113:866-82.
16. Pichichero M, Casey J. Comparison of European and U.S. results for cephalosporin versus penicillin treatment of group A streptococcal tonsillopharyngitis. Eur J Clin Microbiol Infect Dis 2006;25:354-64.
17. Mahakit P, Vicente JG, Butt DI, Angeli G, Bansal S, Zambrano D. Oral clindamycin 300 mg BID compared with oral amoxicillin/clavulanic acid 1g BID in the outpatient treatment of acute recurrent pharyngotonsillitis caused by group a beta-hemolytic streptococci: an international, multicenter, randomized, investigator-blinded, prospective trial in patients between the ages of 12 and 60 years. Clin Ther 2006;28:99-109.
18. Dagan R, Barkai G, Leibovitz E, Dreifuss E, Greenberg D.Will reduction of antibiotic use reduce antibiotic resistance?: The pneumococcus paradigm. Pediatr Infect Dis J 2006;25:981-6.
19. Wierzbowski AK, Hoban DJ, Hisanaga T, DeCorby. M, Zhanel GG. The use of macrolides in treatment of upper respiratory tract infections. Curr Allergy Asthma Rep 2006;6:171-81.
20. de Melo MC, Sa Figueiredo AM, Ferreira-Carvalho BT. Antimicrobial susceptibility patterns and genomic diversity in strains of Streptococcus pyogenes isolated in 1978-1997 in different Brazilian cities. J Med Microbiol 2003;52:251-8.
21. Mendes C, Marin ME, Quinones F, Sifuentes-Osornio J, Siller CC, Castanheira M, et al. Antibacterial resistance of community-acquired respiratory tract pathogens recovered from patients in Latin America: results from the PROTEKT surveillance study (1999-2000). Bras J Infect Dis 2003;7:44-61.
22. Putto A. Febrile exudative tonsillitis: viral or streptococcal? Pediatrics 1987;80:6-12.
23. Esposito S, Bosis S, Begliatti E, Droghetti R, Tremolati E, Tagliabue C et al. Acute tonsillopharyngitis associated with atypical bacterial infection in children: natural history and impact of macrolide therapy. Clin Infect Dis 2006;43:206-9.
24. American Academy of Pediatrics. Subcommittee on the Management of Sinusitis and Committee on Quality Improvement. Clinical Practice Guideline: Management of Sinusitis. Pediatrics 2001;108:798-808.
25. Arroll B, Kenealy T. Are antibiotics effective for acute purulent rhinitis? Systematic review and meta-analysis of placebo controlled randomized trials. BMJ 2006;333(7562):279.
26. Kristo A, Uhari M, Luotonen J, Ilkko E, Koivunen P, Alho OP. Cefuroxime axetil versus placebo for children with acute respiratory infection and imaging evidence of sinusitis: a randomized, controlled trial. Acta Paediatr 2005;94:1208-13.
27. Abad-Santos F, Galvez-Mugica MA, Espinosa de los Monteros MJ, Gallego-Sandin S, Novalbos J. [Meta-analysis of clarithromycin compared with other antimicrobial drugs in the treatment of upper respiratory tract infections] Rev Esp Quimioter 2003;16:313-24.
28. Roos K, Tellier G, Baz M, Leroy B, Rangaraju M. Clinical and bacteriological efficacy of 5-day telithromycin in acute maxillary sinusitis: a pooled analysis. J Infect 2005;50:210-20.
29. Tellier G, Brunton SA, Nusrat R. Telithromycin for the treatment of acute bacterial maxillary sinusitis: a review of a new antibacterial agent. South Med J 2005;98:863-8.
30. Friedman M, Vidyasagar R, Joseph N. A randomized, prospective, double-blind study on the efficacy of dead sea salt nasal irrigations. Laryngoscope 2006;116: 878-82.
31. Meltzer EO, Bachert C, Staudinger H. Treating acute rhinosinusitis: comparing efficacy and safety of mometasone furoate nasal spray, amoxicillin, and placebo. J Allergy Clin Immunol 2005;116:1289-95.
32. Dagan R, Wald E, Schilder A. A Otite Média Aguda deve ser tratada com antibióticos? In: Sih T, Chinski A, Eavey R, Godinho RN. IV Manual de Otorrinolaringologia Pediátrica da IAPO. São Paulo: Lis Ed. 2006. p. 200-13.
33. American Academy of pediatrics Subcommittee on Management of Acute Otitis Media. Diagnosis and management of acute otitis media. Pediatrics 2004;113:1451.
34. Glasziou PP, Del Mar CB, Sanders SL, Hayem M. Antibiotics for acute otitis media in children. Cochrane Database Syst Rev 2004;(1):CD000219.
35. McCormick DP, Chonmaitree T, Pittman C, Saeed K, Friedman NR, Uchida T, Baldwin CD. Nonsevere acute otitis media: a clinical trial comparing outcomes of watchful waiting versus immediate antibiotic treatment. Pediatrics 2005;115:1455-65.
36. Le Saux N, Gaboury I, Baird M, Klassen TP, MacCormick J, Blanchard C et al. A randomized, double-blind, placebo-controlled noninferiority trial of amoxicillin for clinically diagnosed acute otitis media in children 6 months to 5 years of age. CMAJ 2005;172:335-41.
37. Rosenfeld RM, Kay D. Natural history of untreated otitis media. Laryngoscope 2003;113:1645-57.
38. Renko M, Kontiokari T, Jounio-Ervasti K, Rantala H, Uhari M. Disappearance of middle ear effusion in acute otitis media monitored daily with tympanometry. Acta Paediatr 2006;95:359-63.
39. Spiro DM, Tay KY, Arnold DH, Dziura JD, Baker MD, Shapiro ED. Wait-and-see prescription for the treatment of acute otitis media: a randomized controlled trial. JAMA 2006;296:1235-41.
40. Little P, Moore M, Warner G, Dunleavy J, Williamson I. Longer term outcomes from a randomised trial of prescribing strategies in otitis media. Br J Gen Pract 2006;56:176-82.
41. Bauchner H, Marchant CD, Bisbee A, Heeren T, Wang B, McCabe M et al. Effectiveness of Centers for Disease Control and Prevention recommendations for outcomes of acute otitis media. Pediatrics 2006;117:1009-17.
42. Spurling GK, Del Mar CB, Dooley L, Foxlee R. Delayed antibiotics for symptoms and complications of respiratory infections. Cochrane Database Syst Rev 2004;(4):CD004417.
43. Little P, Watson L, Morgan S, Williamson I. Antibiotic prescribing and admissions with major suppurative complications of respiratory tract infections: a data linkage study. Br J Gen Pract 2002;52:187-90,193.
44. Brook I, Foote PA Jr. Effect of antimicrobial therapy with amoxicillin and cefprozil on bacterial interference and beta-lactamase production in the adenoids. Ann Otol Rhinol Laryngol 2004;113:902-5.
45. Block SL, Cifaldi M, Gu Y, Paris MM. A comparison of 5 days of therapy with cefdinir or azithromycin in children with acute otitis media: a multicenter, prospective, single-blind study. Clin Ther 2005;27:786-94.
46. Guven M, Bulut Y, Sezer T, Aladag I, Eyibilen A, Etikan I. Bacterial etiology of acute otitis media and clinical efficacy of amoxicillin-clavulanate versus azithromycin. Int J Pediatr Otorhinolaryngol 2006;70:915-23.
47. Klein JO, Pelton S. Treatment of acute otitis media. http://www.uptodateonline. Acessado em 26 de outubro 2006.
48. Foxlee R, Johansson A, Wejfalk J, Dawkins J, Dooley L, Del Mar C. Topical analgesia for acute otitis media. Cochrane Database Syst Rev 2006;19:3:CD005657.
49. Flynn CA, Griffin GH, Schultz JK. Decongestants and antihistamines for acute otitis media in children. Cochrane Database Syst Rev 2004:CD001727.
50. Thomas CL, Simpson S, Butler CC, van der Voort JH. Oral or topical nasal steroids for hearing loss associate with otitis media with effusion in children. Cochrane Database Syst Rev 2006;3:CD001935.
1 Professora Doutora do Laboratório de Investigações Médicas (LIM) Número 40, da Faculdade de Medicina da Universidade de São Paulo (FMUSP).
2 Professora Doutora do Departamento de Pediatria da Faculdade de Medicina da Universidade de São Paulo (FMUSP).
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 13 de novembro de 2006. cod. 3514.
Artigo aceito em 5 de abril de 2007.


