INTRODUÇÃOO grande desafio da Otologia neste século é o estudo e o tratamento das disacusias sensoriais, cada vez mais freqüentes, devido à exposição aos ruídos, envelhecimento, provocado por medicamentos etc. Os estudos recentes com plantas medicinas1-3despertaram um grande interesse em nosso grupo na busca de alguma propriedade otoprotetora para atenuar ou bloquear as lesões cocleares.
A Maytenus ilicifolia é uma planta da nativa de muitas partes da América do sul e sudeste do Brasil, com várias possíveis ações medicinais como analgésica, antiinflamatória1, antitumoral, antiulcerosa2 e antioxidante3. Escolhemos a Maytenus ilicifolia para verificar uma possível ação otoprotetora, pelo fato de apresentar propriedades antioxidantes (presença de flavonóides e de agentes alcalóides)4,5, baixo efeito colateral no homem,minimizando ações tóxicas de diversos agentes6-8.
Para provocar as lesões na cóclea, escolhemos a cisplatina, um importante quimioterápico para combate de tumores sólidos, em adultos e crianças, que provoca lesão auditiva, às vezes de modo irreversível, além de ser nefrotóxico9, com efeitos colaterais gastrointestinais e neurológicos importantes10,11. A cisplatina lesa várias estruturas da cóclea, desde as células ciliadas, células de suporte, estria vascular e nervo auditivo12,13. O mecanismo de ação da cisplatina é a produção de radicais livres, interferindo sobre o sistema antioxidanteda célula, acarretando a morte celular14. O grau de lesão depende da dose administrada e de sua via12. Testamos alguns protocolos de ototoxicidade em cobaias15-17. Não observamos o grau de lesão referido em alguns destes17ou houve um alto índice de mortalidadecom as doses propostas para desencadear aototoxicidade16. Por esta razão, desenvolvemos um protocolo original no qual obtivemos lesões nos três giros da cóclea, ratificado pelos exames de produtos de distorção das emissões otoacústica (PDEOA), potencial evocado auditivo de tronco encefálico (PEATE) e microscopia eletrônica de varredura (ME), com menor índice de letalidade. A dose ideal foi de 22,5 mg/kg, intraperitoneal, dividida em 3 doses, com espaço de 5 dias entre a primeira e a segunda dose e de 1 dia entre as últimas doses18.
O objetivo deste estudo foi verificar a possível ação otoprotetora do extrato aquoso da Maytenus ilicifolia em cobaias tratadas com cisplatina por meio de estudos funcionais.
METODOLOGIAEstudo clínico e experimentalcom a aprovação do comitê de ética da universidade (Número 1461/04). Os animais escolhidos foram as cobaias fêmeas albinasentre 3 a 4 meses de vida, pesando entre 350 a 450g. A escolha do peso, da ausência de pigmentação e do gênero, baseou-se na observação clínica e dados da literatura19, relacionados à sensibilidade, à ototoxicidade pela cisplatina, maior sobrevida dos animais e uniformidade nas respostas dos exames. Todos os animais eram saudáveis e com otoscopias normais.
Obtenção do Extrato Aquoso (EA) de Maytenus ilicifoliaA Maytenus ilicifolia foi fornecida pelo Centro de Pesquisas Químicas, Biológicas e Agrícolas onde a espécie é cultivada, pelos Drs. Pedro Mellilo Magalhães e Ílio Montanari Jr., sob condições agronômicas controladas: fertilidade do solo, umidade, radiação solar, temperatura, herbívora e poluição do solo.
O pó das folhas de Maytenus ilicifolia foi extraído por infusão (5%, 50 g/l) em água durante 30 minutos à temperatura de 73ºC. O infuso obtido foi filtrado, concentrado até 150 ml em rota evaporador sob vácuo a 50ºC e liofilizado dando origem EA de Maytenus ilicifolia.
Avaliação da função auditivaTodos os animais foram submetidos aos exames de PEATE e PDEOA com a intenção de se mensurar o limiar auditivo e a integridade das células ciliadas externas (CCEs), realizados com aparelho Bio-logic, modelo Navigator-Pro e Audix. As cobaias foram sedadas com xilazina (10 mg/kg) e cloridrato de ketamina (40 mg/kg).
O ambiente era acusticamente adequado e os eletrodos foram posicionados na região mastóidea de cada orelha a ser examinado e no vértice da cabeça, com os fones de ouvido nas orelhas correspondentes.
O estímulo do PEATE foi do tipo click, monocanal, com filtro entre 0.1 a 1,5 kHz, 10,66ms de janela, duração do click de 100ms, a taxa do estímulo foi de 13,3 vezes por segundo, ganho em média de 50.000, visualizado pelo osciloscópio. As freqüências analisadas foram de 1 a 3 khz. Limiar definido como a menor intensidade que reproduz os traços de deflexão das ondas. As respostas foram determinadas em SPL (nível de pressão sonora).
Utilizamos a PDEOA por ser um exame altamente sensível para lesões em CCEs provocadas pela cisplatina15,16. Analisamos as respostas nas freqüências de 500, 1, 2, 3,4 e 8 kHz, com intensidade de L1 e L2 de 65 a 55 SPL, respectivamente e relação F1/F2 de 1,2. Uma sonda responsável pela emissão dos sons (f1 e f2) posicionada na orelha analisada até obtermos a resposta. Comparamos os parâmetros de ruído de fundo (NF) e a resposta (DP) e analisamos a diferença entre ambos (DP-NF) antes e depois do tratamento.
As cobaias com alterações préviasem algum dos testes foram automaticamente excluídas.
Estudo com microscopia eletrônica de varreduraRealizamos a microscopia eletrônica de varredura nos animais, para exemplificar as lesões provocadas pela cisplatina nas CCEs, principalmente no giro basal16 e observar as possíveis alterações morfológicas naquelas tratadas com o extrato aquoso.
Após o término da medicação, as cobaias foram sacrificadas através da injeção letal de anestésico (ketamina), decapitadas e as cócleas dissecadas por técnica microcirúrgica.
Fixamos a cóclea através da técnica de perfusão, com solução de glutaraldeído 2,5%, tamponado com acetato até pH 7, 4, por 24 hs, sendo injetado também através da janela redonda uma quantidade suficiente para saída da perilinfa pelo ápice. A seguir o material foi colocado em solução tampão de cacodilato de sódio 0,1 M, ph 7,2 por 12 horas. Seguimos para a etapa da desidratação com etanol em aumento gradual de concentração de 50% a 100%, sendo cada etapa com duração de 30 minutos. Realizamos o ponto crítico por 60 minutos e banho de ouro por 1 hora. As amostras foram colocadas nos suportes e fixadas com esmalte e visualizadas no aparelho JEOL modelo 5300 de ME, na magnitude de 1500 a 2000X. Observamos as três camadas de CCEs e uma camada de células ciliadas internas (CCIs), nos três giros e meio, escolhemos as áreas com menos artefato e com menos perda de tecido. Os giros foram colados separadamente e as áreas de difícil visualização foram desprezadas.
TratamentosOs grupos foram divididos conforme o esquema abaixo:
Grupo 1: 10 cobaias (20 orelhas) com 3 doses de cisplatina (7,5 mg/kg/d), no 1º, 5º e 6º dias.
Grupo 2: 10 cobaias (20 orelhas) utilizando somente o EA 3 g/kg/d por 7 dias.
Grupo 3: 10 cobaias (20 orelhas) utilizando 1 g/kg/d do EA por dia por 7 dias e 3 doses de cisplatina.
Grupo 4: 5 cobaias (10 orelhas) utilizando 3 g/kg/d do EA por dia por 7 dias e 3 doses de cisplatina.
Grupo 5: 5 cobaias (10 orelhas) com 3 semanas de EA 1g/kg/d e 3 doses de cisplatina na última semana.
As cobaias foram sacrificadas 24 horas após a última dose da cisplatina. A administração do extrato foi via oral, com jejum prévio de 4 horas, uma vez ao dia, com inícioum dia antes da primeira dose de cisplatina.
Realizou-se o PEATE e o PDEOA antes do inicio da medicação e 24 horas após a última dose administrada. O ganho e a perda ponderal também foram anotados. Comparamos os resultados pré e pós-tratamento.
Metodologia estatísticaAnalisamos os dados de cada orelha de cada cobaia, separadamente, como se fosse um dado isolado e depois os agrupamosem grupos, pois cada uma das orelhas apresentou uma resposta com um valor diferente nos testes, variação interindividual, dentro da normalidade, principalmente no PDEOA.
Aplicamos o teste de ANOVA para analisar os dados dos resultados obtidos no teste de PEATE, com nível de significância de 5%. Para analisar os resultados do teste de PDEOA, utilizamos o teste qui-quadrado com o mesmo valor de significância.
RESULTADOS
PDEOAOs dados das médias das diferenças dos valores do DP antes e após o tratamento, com a aplicação do teste estatístico, estão inseridos na Tabela 1. O grupo tratado somente com o EA (grupo 2) apresentou em todos os valores das freqüências, diferenças estatisticamente significantes (p<0,001) em relação ao grupo tratado somente com cisplatina (grupo 1). Observamos que somente nas freqüências (GM-geometric mean)de 7206, 5434 e 2730 houve diferença estatística entre os grupos tratados com o EA e a cisplatina (grupos 3,4 e 5) emcomparação com o grupo1 (somente cisplatina), porém nas outras 5 freqüências não observamos esta diferença.
PEATEOs resultados dos exames pré e pós-medicação estão inseridos na Tabela 2, considerando a média (M) e o desvio-padrão (DP).
O grupo 1 apresentou um aumento importante dos limiares após a medicação, em comparação com o grupo que somente usou o EA (grupo 2) e este dado foi estatisticamente significante (p<0,001). Analisando os valores das respostas dos grupos 3,4 e 5 (grupos com cisplatina e EA) com o grupo 1 (somente cisplatina), obtivemos o p=0,31, sem diferença estatisticamente significante.
Microscopia eletrônica de varreduraQuanto às alterações morfológicas na microscopia eletrônica de varredura em algumas cobaias, observamos lesões severas (mais de 70% de perda de CCEs)e totais (100% de perda de CCEs),nos giros médio eprincipalmentebasal, nas cobaias que foram tratadas somente com cisplatina (Figura 1). As cobaias tratadas com o EA, independente da dose, apresentaram lesões severas,com conservação de algumas CCEs.
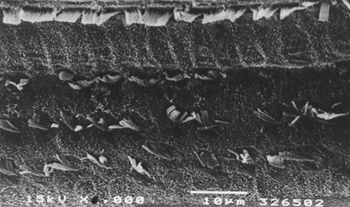
Figura 1. Microscopia eletrônica de varredura de um animal do grupo 1. Observa-se extensa lesão nas CCEs, na porção basal da cóclea. Escala = 10µM. Magnificação de 1500X.
A Figura 1 representa uma foto de ME de uma cobaia do grupo 1 em que se observa uma extensa lesão das CCEs no giro basal. A Figura 2 representa a ME das CCEs de uma das cobaias do grupo 2 em que as estruturas estão preservadas.
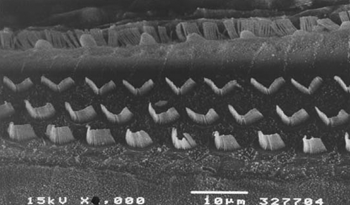
Figura 2. Microscopia eletrônica de varredura de um animal do grupo 2. Observa-se preservação dos cílios das CCEs, na porção basal da cóclea. Escala = 10µM. Magnificação de 2000X.
As Figuras 3, 4 e 5 são imagens das CCEs no giro basal de cobaias dos grupos 3, 4 e 5 com uma grande área de perda de células ciliadas, preservação de algumas células edeformação de suas estruturas.
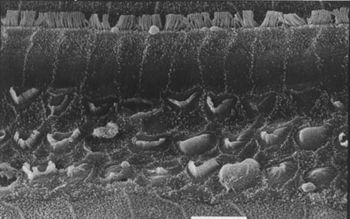
Figura 3. Microscopia eletrônica de varredura de um animal do grupo 3 (tratado com cisplatina e EA), com lesão extensa das CCEs, na porção basal da cóclea. Escala = 10µM. Magnificação de 2000X.
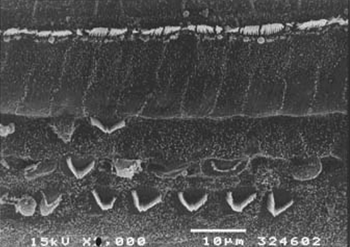
Figura 4. Microscopia eletrônica de varredura de um animal do grupo 4 (tratado com cisplatina e EA- 3g/d), com lesão menos intensa das CCEs, na porção basal da cóclea. Escala = 10µM. Magnificação de 2000XMaytenus ilicifolia na prevenção da ototoxicidade induzida pela cisplatina.
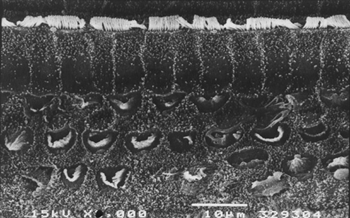
Figura 5. Microscopia eletrônica de varredura de um animal do grupo 5 (tratado com cisplatina e EA por 3 semanas), com lesão extensa das CCEs, na porção basal da cóclea. Escala = 10µM. Magnificação de 2000X.
As cobaias tratadas conjuntamente com EA não ficaram com a pelagem eriçada, não diminuíram a ingesta de água e alimento, eram mais ativas e o aspecto físico final era melhor. A exceção foi observada somente naquelas tratadas por três semanas (Tabela 3).
A mortalidade do grupo que usou somente cisplatina (grupo 1) foi de 50%, os grupos 2, 4 e 5 não apresentaram mortalidade e o grupo 3, 20% dos animais não sobreviveram acima de 5 dias.
DISCUSSÃOA flora brasileira é estimada entre 40.000 a 60.000 espécies de plantas, sendo considerado um país com grande potencial para produzir medicações. A Maytenus ilicifolia é uma destas plantas largamente estudadas, com efeitos medicinais já comprovados20-24.
Mattei e Carlini11 verificaram que o extrato de Maytenus ilicifolia exerce uma importante atividade antioxidante, através do método de inibição do processo de lipoperoxidação "in vitro",por meio da produção de espécies reativas (agentes antioxidantes)em cérebro de ratos.
Oliveira et al.22, através do estudo de hemácias e proteínas do plasma, com tecnécio radioativo, também sugeriram a presença de agentes antioxidantes no extrato da planta.
Melo et al.23 induziram a produção de radicais livres em bactérias do tipo E. Coli após serem tratados com SnCl2 e compararam a Maytenus ilicifolia com a Cymbopogon citratus e a Baccharis genistelloides quanto às suas propriedades antioxidantes. A Maytenus foi superior emrelação as outras plantas.
Neste trabalho, o EA de Maytenus ilicifloiafoi administrado em doses de 1g/d por 8 dias e 3g/d por 8 dias, 24 horas antes e junto com a cisplatina, para verificar a possível ação otoprotetora da planta, através do seu mecanismo de ação antioxidante.
Independente da dose administrada de EA, a medicação não bloqueou a agressivalesãoproduzida pela cisplatinanas CCEs, confirmados pelos testes auditivos. Apesar de os resultados do teste dePDEOA mostrarem respostasestatisticamente significantes emalgumas freqüências,em relação ao grupo de cisplatina, a maioria das freqüências apresentou respostas ruins. Este fato pode ser explicado observando na microscopia de varredura de algumas cobaias,lesões na maioria das CCEs, porém,em algumasfileiras, algumas células estavam conservadasou somente com alterações estruturais, sem perda dos cílios, podendo talvez, gerar uma boa resposta em algumas freqüências nos PDEOA.
O EA também conservou melhor as condições físicas dos animaiscom menor perdade peso e menor letalidade. Mesmo ao utilizarmos o EA previamenteà administração da cisplatina, pensando em um mecanismo de produção de antioxidantes antecedendo a administração do agente ototóxico, não houve uma maiorpreservação da audição (grupo 5).
Algumas hipóteses podem explicar esses resultados. O EA atua, de certa forma, preservando as condições clínicas das cobaias expostasà cisplatina,por meio depossíveis ações antioxidantes nos outros órgãos, pois a perda de peso e a mortalidade foram nitidamente diferentes entre os grupos. Entretanto, o metabolismo nestes órgãos difere do aparelho auditivo e, especificamente neste, a influência da medicação não foi suficiente para bloquear totalmente a ação ototóxica da cisplatina. Uma segunda hipótese seria a de que o EA não ultrapassaria a barreira hematoencefálica para atingir a cóclea, explicando desta forma a atuação somente em alguns órgãos. Uma terceira hipótese seria a de que o mecanismo de bloqueio de radicais livres proporcionado pelo EA seria insuficiente, na dose administrada,para atuar diantedo grau de agressão provocado pela cisplatina no órgão de Corti.
CONCLUSÃOO EA de Maytenus ilicifolia não apresenta efeito otoprotetor suficiente contra as doses de cisplatina administradas neste estudo, porém preserva melhores condições físicas dos animaise diminui a letalidade pelo quimioterápico.
AGRADECIMENTOSEsta pesquisa foi patrocinada pela FAPESP e pela ICAO. A autora Cristiane foi bolsista da CAPES neste período.
REFERÊNCIAS BIBLIOGRÁFICAS1. Pereira MAS, Januário AH, Queiroz MEC, Carvalho D, França SC. Maytenus aquifolia e Maytenus ilicifolia: polimorfismo e perfil químico. XV Simpósio de Plantas Medicinais do Brasil, anais, res. 06.011, 1998, Águas de Lindóia, SP.
2. Macaubas CIP, Oliveira MGM de, Formigoni MLO, Silveira Filho NG da, Carlini EA. Estudo da eventual ação antiúlcera gástrica do Bálsamo (Sedum sp) Folha de Fortuna (Bryophyllum calycinum) Couve (Brassica oleraceae) e de Espinheira-santa (Maytenus ilicifolia) em ratos. Central de Medicamentos (Brasil). Estudo de ação antiúlcera gástrica de plantas brasileiras (Maytenus ilicifolia "espinheira-santa" e outras). Brasília, Central de Medicamentos 1988; p.5-20.
3. Stellfeld CA. A Espinheira-Santa: contribuição ao estudo farmacognóstico. Boletim da Associação Brasileira de Farmácia 1934;15:551-70.
4. Ahmed MS, Fong HHS, Soejarto DD, Dobberstein RH, Waller DP. High performance liquid cromatograph separation and quantitation of maytansinoids in Maytenus ilicifolia. J Cromatography 1981;213:340-4.
5. Xavier HS & D'Angelo LCA. Perfil cromatográfico dos componentes polifenóicos de Maytenus ilicifolia (Celastraceae). XII Simpósio de Plantas Medicinais do Brasil 1992, Curitiba, PR.
6. Pereira MV. Contribuição ao estudo do princípio ativo e outros constituintes básicos do Maytenus ilicifolia. Rev Bras Quim 1962;54(322):416-7.
7. Ohsaki A, Imai Y, Naruse M, Ayabe SI, Komiyama K, Takashima J. Four new triterpenoids from Maytenus ilicifolia. J Nat Prod 2004;67(3):469-71.
8. Mattei R & Carlini EA. Propriedades antioxidantes (lipoperoxidação) da Pfaffia paniculata, Heteropteris aphrodisiaca e Maytenus ilicifolia: estudo in vitro. XV Simpósio de Plantas Medicinais do Brasil 1998, Águas de Lindóia, SP.
9. Ekborn A. Lindberg A. Laurell G. Wallin I. Eksborg S. Ehrsson H. Ototoxicity. nephrotoxicity and pharmacokinetics of cisplatin and its monohydrated complex in the guinea pig. Cancer Chemother Pharmacol 2003;51(1):36-42.
10. Schell MJ, McHaney VA, Green AA. Hearing loss in children receiving cisplatin with or wothout prior cranial irradiation. J Clin Oncol 1989;7:754-60.
11. Faustini SA, Schechter MA, Rapport BZ, Frey MF, Mass RE. Cisplatin ototoxicity:selected case reports. Cancer 1984;53:224-31.
12. Laurell G & Bagger-Sjoback D. Degeneration of organ of Corti following intravenous admininstration of cisplatin. Acta Otolaryngol (Stock) 1991;111:891-8.
13. Hinoja R. Riggs LC, Strauss M et al. Temporal bone histopathology of cisplatin ototoxicity. Am J Otol 1995;16:731-41.
14. Ravi R, Somani SM, Rybak LP. Mechanism of cisplatin ototoxicity: antioxidant system. Pharmacol Toxicol 1995;76:386-94.
15. Hyppolito MA. Oliveira JA. Rossato M. Holanda F. Ototoxicidade da cisplatina e otoproteção pelo extrato de ginkgo biloba às células ciliadas externas: estudo anatômico e eletrofisiológico. Rev Bras Otorrinolaringol 2003;69(4):504-11.
16. Hyppolito MA. Oliveira JA. Lessa RM. Rossato M. Otoproteção da amifostina aos efeitos ototóxicos da cisplatina: estudo em cobaias albinas por emissões otoacústicas produtos de distorção e microscopia eletrônica de varredura. Rev Bras Otorrinolaringol 2005;71(3):268-73.
17. Saito T, Aran JM. Comparative ototoxicity of cisplatin during acute and chronic treatment. ORL 1994;56:320-5.
18. Iha L, Kasse C, Neto OM, Almeida CR, Cruz OLMC. Ototoxicidade induzida pela cisplatina em cobaias: efeito dose-dependente- avaliação funcional. Acta ORL 2007;25:112-8.
19. Schweitzer VG. Cisplatin-induced ototoxicity: the effect of pigmentation and inhibitory agents. Laryngoscope 1993;103:1-52.
20. Lima OG, Coelho JSB, Weigert E, D'Albuquerque IL, Souza MAM. Substâncias antimicrobianas de plantas superiores. Rev Inst Antibiot 1971;11:35-8.
21. Souza-Formigoni ML, Oliveira MG, Monteiro MG, da Silveira-Filho NG, Carlini EA. Antiulcerogenic effect ot two Maytenus species in laboratory animals. J Ethnopharmacol 1991;34:21-7.
22. Oliveira JF, Braga ACS, Oliveira MBN, Ávila AS, de Araújo AC, Cardoso VN, Bezerra RJAC, Bernado-Filho M. Assessment of the effect of Maytenus ilicifolia (espinheira santa) extract on the labelling of red blood cells and plasma proteins with technetium-99m. J Ethnopharmacol 2000;72:179-84.
23. Melo SF, Soares SF, Costa RF, Silva CR, Oliveira MBN, Bezerra RJAC, de Araújo AC, Cardoso VN, Bernado-Filho M. Effect of the Cymbopogon citratus, Maytenus ilicifolia and Baccharis genistelloides extracts against the stannous chloride oxidative damage in Escherichia coli. Mutat Res 2001;496:33-8.
24. Mossi AJ, Cansian RL, Carvalho AZ, Dariva C, Vladimir OJ, Mazutti M, Filho IN, Echeverrigaray S. Extraction and characterization of volatile compounds in Maytenus ilicifolia, using high-pressure CO2. Fitoterapia 2004;75(2):168-78.
1 Mestre e Doutora pela Universidade Federal de São Paulo, UNIFESP-EPM. Professora Pesquisadora da Universidade Bandeirantes, UNIBAN.
2 Prof. Livre docente pela Universidade de São Paulo, USP, Prof. Afiliado da disciplina de Otorrinolaringologia da Universidade Federal de São Paulo, UNIFESP.
3 Mestre pela da Universidade Federal de São Paulo, UNIFESP, Doutorando pela Universidade Federal de São Paulo, UNIFESP.
4 Doutor pela Santa Casa de Misericórdia de São Paulo, Prof. da Santa Casa de Misericórdia de São Paulo.
5 Doutora em farmacologia pela Universidade Federal de São Paulo, UNIFESP, Pesquisadora do Instituto de Ciências Avançadas em otorrinolaringologia, ICAO.
6 Veterinária da Santa Casa de Misericórdia de São Paulo e do Hospital Sírio Libanês. Pesquisadora do Instituto de Ciências Avançadas em otorrinolaringologia, ICAO. Departamento de distúrbios da comunicação humana, disciplina de Otorrinolaringologia, da Universidade Federal de São Paulo (UNIFESP).
Endereço para correspondência: Av. Fagundes Filho 789 apto. 91 V. Monte Alegre São Paulo 04304-011.
E-mail: cristianekasse@yahoo.com.br
FAPESP, CAPES.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 20 de maio de 2007. cod.4533
Artigo aceito em 1 de fevereiro de 2008.


