INTRODUÇÃOO famoso livro de anatomia humana Gardner/Gray/O'Rahilly define que a mímica facial é exercida por 22 grupos musculares derivados do segundo arco branquial1. Todos esses músculos são inervados pela divisão motora do 7º nervo craniano, o facial. A lesão deste nervo acarreta disfunções múltiplas, com impacto cosmético, funcional e psicológico nas pessoas acometidas2-4.
Já na Segunda Grande Guerra do século XX surgiram as primeiras tentativas de se otimizar a regeneração de nervos submetidos à sutura, com o uso da sulfonamida tópica no sítio de lesão5. Em 1951, Levi-Montalcini e Hamburger6 observaram que alguns tumores eram capazes de induzir o crescimento exacerbado de nervos periféricos, sugerindo que os mesmos deveriam produzir substâncias endógenas para tal. Desde então, lesões controladas de nervos são utilizadas em paradigmas experimentais para se estudar o efeito de diversos fatores físicos, químicos e biológicos sobre a sua regeneração. Heifti, em 1994, definiu como fatores neurotróficos as proteínas capazes de regular a sobrevida e a diferenciação de células neurais, o desenvolvimento e a manutenção da integridade do sistema nervoso e a plasticidade neuronal7. Atualmente esta definição está sendo ampliada, uma vez que não só proteínas exercem estas funções, mas se reconhecem outras propriedades destes fatores, como a estimulação do crescimento neural, o auxílio na ramificação nervosa, a indução do anabolismo neuronal e a modulação da neurotransmissão e da condutibilidade elétrica8.
O nucleotídeo cíclico adenosina monofosfato (AMPc), formado pela adenilato ciclase e degradado pela fosfodiesterase, está presente em todas as células eucariotas9, e é considerado hoje a principal molécula que atua como mensageiro intracelular para diversos estímulos celulares9,10. Desde 1955, quando iniciaram se as pesquisas sobre o efeito do glucagon em hepatócitos11, este nucleotídeo intracelular vem sendo responsabilizado por uma série de eventos, desde o controle do tono e inotropismo cardíacos12 até a maturação de células ovarianas e a secreção endócrina de células adrenais9. Tem-se também correlacionado esta molécula à resistência ou susceptibilidade de células tumorais a quimioterápicos13-15, sendo sua manipulação um dos caminhos promissores para otimizar o tratamento de diversos tipos de neoplasias. Tradicionalmente na cultura hindu, o uso da erva Coleus forskohlii é indicado para insônia, convulsão e doenças cardíacas, sendo sua atuação farmacológica explicada através do estímulo da adenilato ciclase16 pelo alcalóide forskolina presente nesta planta.
Diversos estudos vêm esclarecendo o papel do AMPc no sistema neurológico. Clinicamente, está envolvido no crescimento de tumores como astrocitomas, ependimomas e adenomas hipofisários17 e na expressão protéica de neurônios de pacientes com doença de Alzheimer18, entre outros. Um possível papel neurotrófico do AMPc baseia-se em trabalhos utilizando culturas de células, nos quais foi detectado que este nucleotídeo influencia desde a sobrevida e diferenciação neuronal de "PC 12 cells"19-22, até a produção de mielina por células de Schwann23,24. Incluem-se também o estabelecimento de sinapses interneuronais25 e o nível de atividade de células gliais26. Em animais, parece estar ligado à capacidade de resistência à hipóxia dos neurônios das tartarugas durante mergulhos prolongados27 e também à extrema capacidade de regeneração da medula espinal de peixes28. Em ratos, na década de 70 do século passado, foi testado na recuperação de nervos ciáticos, mas com resultados conflitantes29,30. Na década de 80, novos resultados promissores na recuperação de nervos ciáticos são oferecidos pela literatura31,32. Não encontramos, entretanto, trabalhos na literatura que avaliem a influência do AMPc na regeneração de nervos faciais de mamíferos, sendo nossa proposta de trabalho estudá-la.
MÉTODOO projeto de pesquisa deste estudo foi avaliado e aprovado pelo Comitê de Ética em Pesquisa de nossa Instituição sob o número 1708/05. Foram utilizados ratos Wistar, com peso entre 200 e 240g, machos, mantidos em gaiolas adequadas, em sala climatizada e sob ciclo claro-escuro de 12 horas, com livre acesso a água e alimento. Neste estudo foram confeccionados 4 grupos experimentais animais: "AMPc 14D": transecção completa do tronco do nervo facial direito, sutura imediata e exposição do sítio de lesão ao AMPc, com sacrifício em 14 dias; "CTRL 14D": a mesma lesão com exposição a Ringer-lactato (RL) e sacrifício em 14 dias; "AMPc 28D": a mesma lesão com exposição ao AMPc e sacrifício em 28 dias; e "CTRL 28D": a mesma lesão com exposição a RL e sacrifício em 28 dias. A cirurgia inicial para realizar a transecção e sutura do tronco do nervo facial direito obedeceu à descrição do modelo experimental estabelecido por nosso grupo33. Para a liberação do AMPc junto ao sítio de sutura neural, utilizamos bombas osmóticas (Alzet® Mini-osmotic Pump model 2002) acopladas a cateter próprio de polietileno, com um fluxo de 0,5µl/hora por 14 dias. Estas bombas foram posicionadas no subcutâneo dos animais na região interescapular durante a cirurgia inicial, sendo a ponta do cateter fixado com prolene 7-0 a aproximadamente 2mm da sutura neural. Nos grupos expostos ao AMPc, a solução utilizada foi de dibutiril-AMPc 1mM do sal fabricado pela Sigma® ("N6,2´-O-dibutiryladenosine 3´:5´-cyclic monophosphate") diluído em RL. Nos demais grupos, as bombas foram preenchidas apenas com RL.
Em dias alternados à cirurgia, até completar 14 ou 28 dias de acordo com o grupo em questão, os animais foram submetidos à observação comportamental da mímica facial, levando-se em conta a movimentação de vibrissas e o fechamento da rima palpebral. As escalas para esta observação se encontram descritas em Borin et al.33, sendo atribuídos de 0 a 5 pontos para cada quesito, com caráter evolutivo na recuperação dos movimentos.
Após 14 ou 28 dias, os animais foram sacrificados e submetidos a uma nova dissecção do nervo facial direito para a localização da sutura neural prévia, sendo retirado o fragmento distal à sutura para análise histológica. Também se realizou a retirada do tronco do nervo facial contralateral (esquerdo) de todos os ratos, sendo enviados para análise histológica. O material para histologia e obtenção de imagens digitalizadas da microscopia do nervo facial foi processado no Centro de Microscopia Eletrônica (CEME) de nossa Instituição, seguindo protocolo previamente descrito33. Para a análise histológica qualitativa, as fotos foram dispostas seqüencialmente de acordo com o tempo entre lesão e sacrifício do animal e exposição ou não ao AMPc, sendo observada a presença de fibras mielinizadas, seu diâmetro relativo e a uniformidade de sua distribuição no nervo. Para a análise histológica quantitativa (histométrica), foi adotado o procedimento para a contagem de fibras mielinizadas33 dos troncos dos nervos faciais direito e esquerdo de cada rato, obtendo ainda a razão direito/esquerdo. Foi avaliada uma área total de 6399,679µm2 por nervo estudado.
A análise estatística dos dados baseou-se na combinação de dois eventos: intervenção (droga - administração ou não de AMPc) e tempo (período - 14 ou 28 dias). Foram analisados os dados obtidos para cada grupo quanto à:
1) pontuação clínica da movimentação das vibrissas;
2) pontuação clínica do fechamento da rima palpebral;
3) contagem das fibras do nervo facial esquerdo;
4) contagem das fibras do nervo facial direito;
5) razão direito/esquerdo da contagem de fibras. Para a análise comparativa utilizamos o teste de análise de variância (ANOVA), buscando detectar possíveis diferenças nas médias dos grupos, seguido de um teste POST-HOC. O nível de significância adotado foi de 5%.
RESULTADOSForam submetidos à cirurgia inicial 32 animais, sendo designados 8 para cada grupo experimental. Com uma semana de pós-operatório, observamos a ocorrência de uma formação tumoral amolecida envolvendo a bomba osmótica de um animal do grupo AMPc, sendo este sacrificado e detectado a presença de um processo inflamatório encapsulado com conteúdo purulento. Descartamos este animal do estudo e submetemos mais um ao procedimento cirúrgico, completando novamente 8 espécimes por grupo. Utilizamos assim, 33 animais neste estudo.
Durante a realização da eutanásia, tivemos a impressão subjetiva de uma maior "fibrose" durante a dissecção do tronco facial direito nos animais do grupo AMPc 14D e AMPc 28D. Além disso, seus nervos aparentemente apresentavam um "maior diâmetro", sendo estas impressões subjetivas anotadas em suas fichas de observação. Não encontramos dificuldades em localizar o local de sutura epineural realizada anteriormente, retirando com segurança o segmento distal à mesma em todos os animais.
Observação ComportamentalObservamos uma melhora da movimentação das vibrissas e do fechamento da rima palpebral em todos os grupos. As médias (e desvios-padrão) da pontuação clínica estão expressas na Tabela 1, e os Gráficos 1 e 2 são apresentados trazendo o intervalo de confiança da análise. Notamos que, independentemente da exposição ao AMPc, os grupos sacrificados no 28° dia apresentaram resultados superiores aos sacrificados no 14°. Entre os grupos, encontramos superioridade do AMPc 14D em relação ao CTRL 14D no quesito fechamento da rima palpebral, mas não quanto à movimentação de vibrissas.
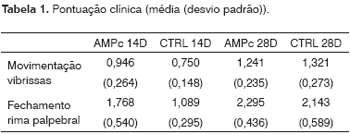
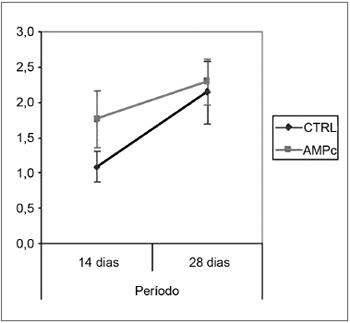
Gráfico 1. Pontuação clínica do fechamento da rima palpebral. Intervalo de confiança para a média: média ± 1,96 * desvio-padrão /
Ö (n-1)
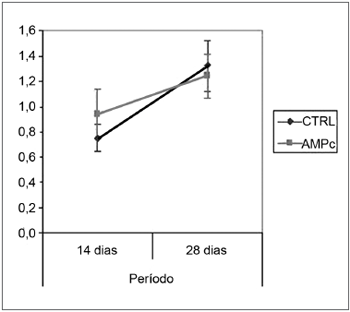
Gráfico 2. Pontuação clínica da movimentação de vibrissas. Intervalo de confiança para a média: média ± 1,96 * desvio-padrão /
Ö (n-1)
Obtivemos um total de 64 imagens, correspondentes aos nervos faciais direito e esquerdo de cada um dos 8 animais de cada grupo. Comparando as imagens correspondentes ao nervo facial esquerdo (sem lesão) de todos os grupos, não notamos diferenças entre elas. Apresentaram distribuição uniforme e homogênea de fibras mielinizadas por toda a imagem, como ilustrado na Figura 1.
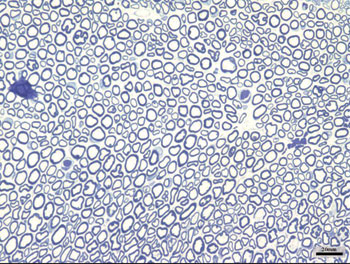
Figura 1. Padrão típico do nervo facial esquerdo (SEM LESÃO) em todos os grupos.
Nos grupos CTRL 14D e AMPc 14D, observando as imagens correspondentes ao nervo facial direito (lado lesado), notamos a presença de pequenas fibras mielinizadas, de diâmetro muito inferior quando comparadas à respectiva imagem contralateral, muitas vezes agrupadas e não distribuídas uniformemente pela imagem. Este aspecto nos pareceu um pouco mais evidente em alguns animais que em outros, sendo também mais presente no grupo AMPc 14D que no CTRL 14D. Apresentamos as Figuras 2 e 3, correspondentes a cada um destes grupos, respectivamente.
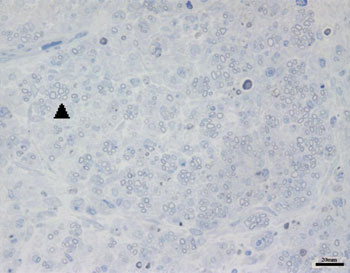
Figura 2. Aspecto típico do nervo facial direito do grupo AMPc 14D. Cabeça de seta exemplificando agrupamento de pequenas fibras mielinizadas
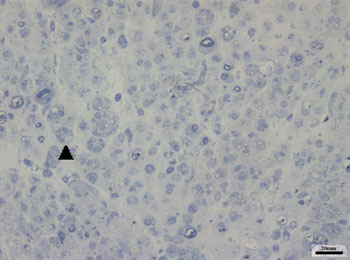
Figura 3. Aspecto típico do nervo facial direito do grupo CTRL 14D. Cabeça de seta exemplificando agrupamento de pequenas fibras mielinizadas
Nos grupos AMPc 28D e CTRL 28D, observadas as imagens correspondentes ao nervo facial direito, notamos um maior número destas pequenas fibras mielinizadas, já não tanto agrupadas, mas ainda variando entre os animais de cada grupo. Notamos ainda a presença de fibras de maior diâmetro, que se assemelhavam mais às do nervo esquerdo. Apresentamos as Figuras 4 e 5, correspondentes a cada um destes grupos respectivamente.
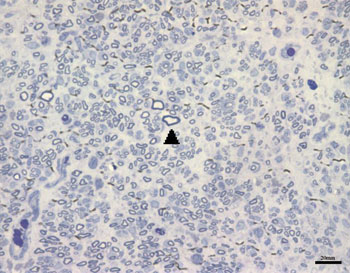
Figura 4. Aspecto típico do nervo facial direito do grupo AMPc 28D. Cabeça de seta exemplificando fibra mielinizada de maior diâmetro
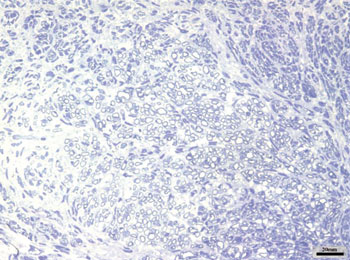
Figura 5. Aspecto típico do nervo facial direito do grupo CTRL 28D
As médias (e desvios-padrão) referentes às contagens de fibras dos nervos esquerdo e direito e à razão direito/esquerdo são apresentadas na Tabela 2, bem como sua análise comparativa nos Gráficos 3 a 5. A contagem dos nervos faciais esquerdos (sem lesâo) não variou entre os quatro grupos. A contagem dos nervos direitos (lesão), bem como a razão direito/esquerdo foi maior no 28° dia em comparação ao 14° independentemente da presença da "droga", indicando uma regeneração ao longo do período. Quando analisamos a presença da droga em 14 dias, foi maior no grupo AMPc 14D (32,6 ±24,2) em comparação ao CTRL 14D (9,4 ±11,5), com uma razão direito/esquerdo de 31% x 9,7%. Já em 28 dias, foi maior no CTRL 28D (123,2 ±16,8) que no AMPc 28D (92,1 ±13,0).
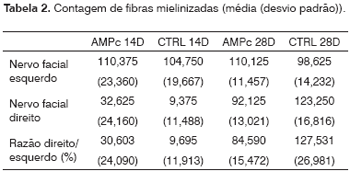
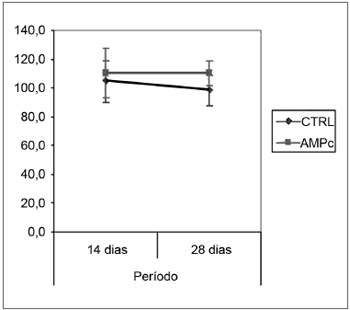
Gráfico 3. Contagem de fibras do nervo facial esquerdo. Intervalo de confiança para a média: média ± 1,96 * desvio-padrão /
Ö (n-1)
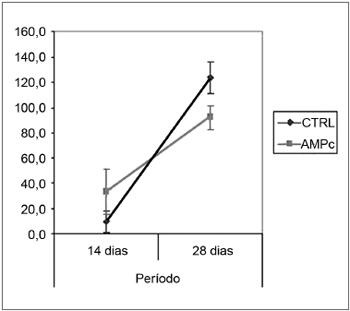
Gráfico 4. Contagem de fibras do nervo facial direito. Intervalo de confiança para a média: média ± 1,96 * desvio-padrão /
Ö (n-1)
Gráfico 5. Razão direito/esquerdo da contagem de fibras. Intervalo de confiança para a média: média ± 1,96 * desvio-padrão /
Ö (n-1)
Em 1972, Appenzeller e Palmer34 identificaram o aumento endógeno do AMPc em nervos durante o processo de regeneração. A partir de então, diversos autores aventaram um possível papel neurotrófico da administração de AMPc baseado em evidências experimentais "in vitro" (cultura celular)23-25. Estudos sobre a influência do AMPc na regeneração do nervo ciático de roedores mostraram resultados variáveis, constatando-se uma ação estimulante em alguns29,31 e ausência do mesmo em outros30,35. Muito desse aparente conflito entre trabalhos pode ser explicado pela metodologia utilizada. O modelo utilizado nestes trabalhos, o do esmagamento do nervo ciático, é, a nosso ver, não homogêneo em relação à lesão, pois o tempo de esmagamento variou de 2 a 30 segundos e não se mensurou a "pressão" utilizada para tanto. O tempo de análise dos resultados também variou, sendo notada uma resposta positiva nos trabalhos de Pichero et al.29 e Gershenbaum e Roisen31 após o 12° dia, enquanto os trabalhos de McQuarrie et al.30 e Black e Lasek35, foram encerrados mais precocemente (9 e 8 dias respectivamente), sem a constatação de efeitos neurotróficos.
Em 1984, Kilmer e Carlsen36 realizaram a aplicação tópica de "forskolin", um estimulador da adenilato ciclase que promove aumentos endógenos de AMPc, com resultados positivos na regeneração do nervo ciático de rã. Já em 1987, os mesmos autores, trabalhando com nervos ciáticos de hamster, propuseram a entrega do AMPc por "pellets" no local da lesão neural, encontrando resultados promissores32. Estudos sobre a influência da administração exógena de AMPc devem garantir a penetração desta substância na célula, já que a mesma não possui receptores extracelulares, sendo exclusivamente de ação intracelular37. Os análogos dibutiril-AMPc e 8-bromo-AMPc são permeáveis à membrana plasmática e se mostram também menos susceptíveis à ação das fosfodiesterases, tendo uma ação mais evidente que o nucleotídeo natural13,38. Consideramos como preferencial a administração tópica de fatores de crescimento já que em um possível uso futuro em humanos, utilizaríamos uma dose menor do que no seu uso sistêmico, tendo assim um menor risco de efeitos colaterais4. Além disso, diversos fatores neurotróficos apresentam ação em outros grupos celulares, o que poderia hipoteticamente estimular o desenvolvimento de tumores quando utilizado sistemicamente, dúvida em muito semelhante ao que acontece na reposição hormonal estrogênica em pacientes com antecedente familiar de câncer de mama. Como outra vantagem para a aplicação tópica, podemos utilizar o nervo contralateral como controle do lado lesado em estudos experimentais4,39.
Na definição de nossa metodologia, optamos por realizar a transecção completa e sutura do nervo por se tratar de uma lesão mais reprodutível, já que esta é sempre grau V na classificação de Suderland39,40, sendo ainda aquela que reproduz melhor a correção cirúrgica realizada em nervos de seres humanos41. Optamos também pela entrega tópica de dibutiril-AMPc pelos motivos acima. Além disto, escolhemos estender nosso trabalho em até 28 dias para garantir uma avaliação mais confiável, e também associar as avaliações comportamentais e histológicas para aumentar a objetividade do mesmo. Uma discussão mais profunda sobre a metodologia adotada pelo nosso grupo de estudo se encontra em Borin et al.33. Porém, como crítica, devemos assumir que nossa sutura representa mais uma aproximação dos cotos neurais que uma sutura epineural microcirúrgica clássica, pela impossibilidade técnica de realizar mais que um ponto no nervo facial dos ratos.
Nossa análise comportamental demonstrou uma recuperação funcional acelerada pelo AMPc quanto ao fechamento da rima palpebral, mas não da movimentação de vibrissas, no 14° dia, sendo este efeito não detectado quando analisados nos animais no 28° dia. Essa observação coaduna com a de outros autores que ressaltam ser o retorno parcial do "blink reflex" o sinal mais precoce de recuperação do nervo facial em roedores42. Komura et al., 19994, pesquisando o efeito do "brain-derived neurotropic factor" (BDNF) na regeneração do nervo facial do rato, vivenciaram uma situação muito semelhante na qual o fator em questão teve um efeito na precocidade da recuperação clínica nos primeiros 14 dias, desaparecendo esta diferença com 23 dias. Assim, parece-nos que o AMPc poderia estimular a precocidade da recuperação, mas não seus resultados finais funcionais, fato que voltaremos a discutir quando abordarmos nossos resultados histológicos. Além disto, é inegável que nossa análise de mímica facial em ratos apresenta uma série de limitações quanto à percepção de nuances de expressões quando comparadas às escalas utilizadas na prática clínica em humanos. Perdemos assim a capacidade de detectar diferenças mais sutis em momentos mais avançados de recuperação da motricidade da face dos ratos.
Poderíamos estranhar que em tão pouco tempo nossos animais já demonstravam movimentação facial. Em nosso estudo metodológico piloto33, já havíamos detectado um retorno de aproximadamente 35% da função facial em 3 semanas e de 60% em 5 semanas. Komura et al.4 também notaram esta recuperação precoce (14 dias) após a transecção completa e sutura de nervos faciais de ratos, e ainda Gershbaum e Roisen31 ficaram surpresos com o fato do nervo ciático de ratos demonstrar atividade clínica após 2 a 3 dias da lesão. Isto poderia representar uma "inervação cruzada" diferente da anatomia humana, refletida na atividade do núcleo facial contralateral como sugerido por alguns autores43-45 e/ou uma taxa de regeneração acentuadamente maior no rato que no homem, como sugerido por outros31.
A contagem de fibras do nervo facial esquerdo (lado não lesado) não variou significativamente nos quatro grupos deste experimento. Isto confirma não só os achados que descrevem a não variabilidade deste critério inter-espécimes, mesmo de pesos e idades diferentes46, como também a possibilidade de utilizar as amostras do lado não lesado como controle do lado lesado em experimentos de regeneração neural39,47,48. Os dados referentes à contagem de fibras mielinizadas do nervo facial direito (lado lesado) no 14° dia demonstraram um aumento significativo da mesma no grupo AMPc quando comparado com o controle, fato este confirmado pelas análises da razão direito/esquerdo. Aparentemente, o AMPc estimulou um início precoce da regeneração neural, acelerando o brotamento axonal a partir do coto proximal. Isto baseado não só na superioridade numérica de fibras encontradas, mas também no aspecto descrito em nossa análise qualitativa da histologia, onde encontramos grupamentos de finas fibras em "blocos", um aspecto que pode corresponder ao corte transversal de "botões de crescimento neurais", constituídos de pequenas fibras imaturas descritos por outros autores30,49-51. Através de microscopia eletrônica, Gershenbaum e Roisen31, descreveram que em modelo de nervo ciático de ratos, o AMPc acelerou o início da degeneração Walleriana no 3° dia pós lesão e também descreveram uma superioridade numérica na contagem de fibras no 10° dia no grupo exposto ao fator quando comparado com salina.
Diversos autores aventam inúmeros mecanismos através dos quais o AMPc tópico e sistêmico poderia ter uma ação estimuladora na regeneração neural, porém esta se mantêm incerta31,32. Influências na expressão gênica14,27 e no citoesqueleto36,38 de diversos grupos celulares envolvidos em regeneração neural já se encontram demonstrados. Acredita-se que o nucleotídeo poderia estimular as populações neuronais em si e também as de "suporte", como a microglia, macrófagos e células de Schwann23-26. Promoveria assim a "limpeza" do sitio de lesão removendo restos celulares, aceleraria a degeneração Walleriana, a mielinização e também o botão de crescimento neuronal, por ação no núcleo celular do neurônio e/ou no sítio de lesão31,32,34,36. Nosso estudo não abrangeu a investigação do mecanismo de ação do AMPc e com isso aceitamos as suposições destes autores.
No 28° dia encontramos uma inversão do achado histométrico anterior, onde a contagem do grupo controle suplantou o grupo exposto ao nucleotídeo, e também ao próprio lado contralateral (razão direito/esquerdo 127%). Este resultado aparentemente conflitante pode ser explicado por diversas hipóteses. Em nosso desenho experimental, o AMPc foi "entregue" pela bomba osmótica apenas nos primeiros 14 dias, ficando as duas semanas seguintes sem ação. Isto poderia sugerir que a ação neurotrófica do nucleotídeo seria garantida apenas na presença do mesmo, desaparecendo no período seguinte, e gerando até uma perda daquelas fibras inicialmente "hiperestimuladas". Além disto, outros autores defendem que o brotamento seria estimulado por fatores locais como o AMPc, enquanto o alongamento axonal seria dependente de mudanças metabólicas no corpo nuclear do neurônio, e que por isso uma entrega tópica poderia perder o efeito no decorrer do tempo32. Quanto ao fato de a contagem do lado direito suplantar a do lado esquerdo no grupo CTRL 28D, McQuarrie et al.30 encontraram que, após a lesão unilateral do nervo ciático, a contagem de fibras do lado lesado suplantou em 40% a do lado não lesado, atribuindo o fato à ocorrência de um múltiplo brotamento a partir de um único axônio do coto proximal. Isto também foi constatado por Byers et al.52 em estudo de regeneração do nervo facial em ratos.
Em culturas celulares, os fatores neurotróficos podem induzir uma diferenciação celular com mudanças fenotípicas, acompanhada de uma queda na contagem numérica das mesmas. Em culturas de células originárias de neuroblastomas, por exemplo, o AMPc aumenta o seu grau de diferenciação (estimulando o surgimento de dendritos) ao mesmo tempo em que diminui o número total de células53. Assim, no nosso estudo poderíamos estar presenciando uma precocidade no brotamento axonal, com um efeito secundário de queda no número total de fibras em regeneração. Caso isto seja verdadeiro, aparentemente não afetaria o resultado funcional final, já que a análise comportamental dos grupos AMPc 28D e CTRL 28D mostraram-se similares.
Outra explicação seria o fato de que no decorrer da regeneração, as múltiplas fibras iniciais presentes nos botões de crescimento vão aos poucos sendo "selecionadas como vencedoras", aumentando em diâmetro e mielinização para melhorar sua capacidade de condução, sendo perdidas outras como ineficientes31,41,48-51. Komura et al. 19994, analisaram a regeneração neural através da expressão de RNAm da proteína GAP43, a qual participa do crescimento axonal. Encontraram no grupo exposto ao BDNF uma recuperação clínica mais acentuada no 14° dia, acompanhada de uma elevação do RNAm GAP43, enquanto que no 28° dia obtiveram um achado comportamental semelhante entre os grupos controle e BDNF, com expressão do RNAm GAP43 mais elevado no grupo controle nesta fase tardia. Atribuíram este achado ao fato do grupo estimulado pelo fator neurotrófico estar numa fase mais "avançada" de regeneração, na qual a expressão desta proteína já estaria baixa. Em similaridade, poderíamos sugerir que o grupo AMPc 28D estaria realmente mais avançado no processo regenerativo, onde já evidenciaríamos uma etapa além da multiplicação do brotamento, enquanto o CTRL 28D estaria numa fase mais inicial, ainda aumentando em número e não em eficiência suas fibras, já que funcionalmente os dois grupos atingiram resultados comportamentais semelhantes.
Infelizmente, nosso paradigma é limitado e não permite refutar ou aceitar nenhuma destas hipóteses. Mudanças metodológicas como o aumento do tempo de exposição ao AMPc, a sua disponibilização direta e/ou sistêmica aos núcleos centrais do facial, análises histológicas em outros períodos como 21° dia e posteriores ao 28°, e a utilização de métodos de para quantificar a mielinização e o diâmetro de fibras seriam indicados para a continuidade deste estudo.
CONCLUSÃOAcreditamos haver encontrado evidências comportamentais e histométricas de um papel neurotrófico do AMPc sobre a regeneração do nervo facial de ratos submetidos à transecção total e aproximação por sutura.
REFERÊNCIAS1. O´Rahilly R. Couro cabeludo e face. In: Gardner E, Gray DJ, O´Rahilly R. Anatomia: estudo regional do corpo humano. 4ª edição. Rio de Janeiro: Guanabara Koogan; 1988. p.642-9.
2. Choi D, Dunn LT. Facial nerve repair and regeneration: an overview of basic principles for neurosurgeons. Acta Neurochir (Wien) 2001;143:107-14.
3. Bento RF, Miniti A. Comparison between fibrin tissue adhesive, epineural suture and natural union in the intratemporal facial nerve of cats. Acta Otolaryngol Suppl 1989;465:1-36.
4. Kohmura E, Yuguchi T, Yoshimine T, Fujinaka T, Koseki N, Sano A, Kishino A, Nakayama C, Sakaki T, Nonaka M, Takemoto O, Hayakawa T. BDNF atelocollagen mini-pellet accelerates facial nerve regeneration. Brain Research 1999;849:235-8.
5. Davis L, Perret G, Carroll W. Surgical principles underlying the use of grafts in the repair of peripheral nerve injuries. Annals of Surg 1945;121(5):686-98.
6. Levi-Montalcini R, Hamburger V. Selective growth stimulating effects of mouse sarcoma on the sensory and sympathetic nervous system of the chick embryo. J Exp Zool 1951;116:321-62.
7. Hefti F. Neurotrophic factor therapy for nervous system degenerative diseases. J Neurobiol 1994;25(11):1418-35.
8. Oliveira JAA, Bernal TMO. Fatores neurotróficos de crescimento. In: Campos CAH, Costa HOO, organizadores. Tratado de Otorrinolaringologia. São Paulo: Rocca, 2002. v.1, c.9, p.137-55.
9. Darnell J, Lodish H, Baltimore D. Molecular cell biology. 2nd edition. New York: Scientific American Books; 1990.
10. Junqueira LC, Carneiro J. Biologia celular e molecular. 6a edição. Rio de Janeiro: Guanabara Koogan; 1997.
11. Rall TW, Sutherland EW, Wosilait WD. Therelationship of epinephrine and glucagon to liver phosphorylase: III. Reactivation of liver phosphorylase in slices and in extracts. J Biol Chem 1956;218:483-95.
12. Katz AM. Interplay between inotropic and lusitropic effects of cyclic adenosine monophosphate on the myocardial cell. Circulation 1990;82(2): I-7-11.
13. Lerner A, Kim DH, Lee R. The AMPc signaling pathway as a therapeutic target in lymphoid malignancies. Leuk Lymph 2000;37(1-2):39-51.
14. Cho-Chung YS, Nesterova M, Becker KG, Srivastava R, Park YG, Lee YN, Cho YS, Kim MK, Neary C, Cheadle C. Dissecting the circuitry of protein kinase A and cAMP signaling in cancer genesis. Ann N Y Acad Sci 2002;968:22-36.
15. Ciardiello F, Tortora G. Interactions between the epidermal growth factor receptor and type I protein kinase A: biological significance and therapeutic implications. Clin Cancer Res 1998;4:821-8.
16. Worley PF, Baraban JM, Snyder SH. Beyond receptors: multiple second-messenger systems in brain. Ann Neurol 1987;21(3):217-29.
17. Woods SA, Marmor E, Feldkamp M, Lau N, Apicelli AJ, Boss G, Gutmann DH, Guha A. Aberrant G protein signaling in nervous system tumors. J Neurosurg 2002;97:627-42.
18. Wolozin B, Lesch P, Lebovics R, Suderland T. Olfactory neuroblasts from Alzheimer donors: studies on APP processing and cell regulation. Biol Psychiatry 1993;34:824-38.
19. Ho PL, Raw I. Cyclic AMP potentiates bFGF-induced neurite outgrowth in PC12 cells. J Cell Physiol 1992;150:647-56.
20. Lambeng N, Michel PP, Agid Y, Ruberg M. The relationship between differentiation and survival in PC12 cells treated with cyclic adenosine monophosphate in the presence of epidermal growth factor or nerve growth factor. Neurosc Lett 2001;297.133-6.
21. Piiper A, Dikic I, Lutz MP, Leser J, Kronenberger B, Elez R, Cramer H, Müller-Esterl W, Zeuzem S. Cyclic AMP induces transactivation of the receptors for epidermal growth factor ande nerve growth factor, thereby modulating activation of MAP kinase, Akt, and neurite outgrowth in PC12 cells. J Biol Chem 2002;15:43623-30.
22. Hong Y, York RD, Misra-Press A, Carr DW, Stork PJS. The cyclic adenosine monophosphate-dependent protein kinase (PKA) is required for the sustained activation of mitogen-activated kinases and gene expression by nerve growth factor. J Biol Chem 1998;273(14):8240-7.
23. Sobue G, Pleasure D. Schwann cell galactocerebroside induced by derivatives of adenosine 3´,5´-monophosphate. Science 1984;224(4644):72-4.
24. Cheng HL, Feldman EL. Insulin-like growth factor-I (IGF-I) and IGF binding protein-5 in Schwann cell differentiation. J Cell Physiol 1997;171:161-7.
25. Nirenberg M, Wilson S, Higashida H, Rotter A, Krueger K, Busis N, Ray R, Kenimer JG, Adler M. Modulation of synapse formation by cyclic adenosine monophosphate. Science 1983;222(4625):794-9.
26. Melcangi RC, Ballabio M, Magnaghi V, Celotti F. Metabolism of steroids in pure cultures of neurons and glial cells: role of intracellular signaling. J Steroid Biochem Molec Biol 1995;53(1-6):331-6.
27. Hochachka PW, Buck LT, Doll CJ, Land SC. Unifying theory of hypoxia tolerance: molecular/metabolic defense and rescue mechanisms of surviving oxygen lack. Proc Natl Acad Sci 1996;93:9493-8.
28. Bhatt DH, Otto SJ, Depoister B, Fetcho JR. Cyclic AMP-induced repair of zebrafish spinal circuits. Science 2004;305:254-8.
29. Pichichero M, Beer B, Clody DE. Effects of dibutyryl cyclic AMP on restoration of function of damaged sciatic nerve in rats. Science 1973;182:724-5.
30. McQuarrie IG, Grafstein B, Gershon MD. Axonal regeneration in the rat sciatic nerve: effect of a conditioning lesion and of dbcAMP. Brain Research 1977;132:443-53.
31. Gershenbaum MR, Roisen FJ. The effects of dibutyryl cyclic adenosine monophosphate on the degeneration and regeneration of crush-lesioned rat sciatic nerves. Neurosc 1980;5:1565-80.
32. Kilmer SL, Carlsen RC. Chronic infusion of agents that increase cyclic AMP concentration enhances the regeneration of mammalian peripheral nerves in vivo. Exp Neurol 1987;95:357-67.
33. Borin A, Toledo RN, Faria SD, Testa JRG, Cruz OLM. Modelo experimental comportamental e histológico da regeneração do nervo facial em ratos. Rev Bras Otorrinolaringol 2006;72(6):776-85.
34. Appenzeller O, Palmer G. The cyclic AMP (adenosine 3´5´-phosphate) content of sciatic nerve: changes after crush. Brain Res 1972;42:521-4.
35. Black MM, Lasek RJ. Slowing of the rate of axonal regeneration during growth and maturation. Exp Neurol 1979;63:108-19.
36. Kilmer SL, Carlsen RC. Forskolin activation of adenylate cyclase in vivo stimulates nerve regeneration. Nature 1984;307:455-7.
37. Rall TW. Formation and degradation of cyclic nucleotides: an overview. In: Nathanson JA, Kebabian JW. Cyclic nucleotides. New York: Springer-Verlag Berlin Heidelberg, 1982. v.58/I, c.1, p.3-16.
38. Roisen FJ, Murphy RA, Braden WG. Neurite development in vitro. I. The effects of adenosine 3´5´-cyclic monophosphate. J Neurobiol 1972;3(4):347-68.
39. Guntinas-Lichius O, Streppel M, Angelov DN, Stennert E, Neiss WF. Effect of delayed facial-facial suture on facial nerve regeneration: a horseradish peroxidase tracing study in the rat. Acta Otolaryngol (Stockh) 1997;117:670-4.
40. Barrs DM. Facial nerve trauma: optimal timing for repair. Laryngoscope 1991;101:835-48.
41. Wong BJF, Mattox DE. The effects of polyamines and polyamine inhibitors on rat sciatic and facial nerve regeneration. Exp Neurol 1991;111:263-6.
42. Jones KJ. Recovery from facial paralysis following crush injury of the facial nerve in hamsters: differential effects of gender and androgen exposure. Exp Neurology 1993;121:133-8.
43. Fernandez E, Pallini R, Marchese E, Lauretti L, Bozzini V, Sbriccoli A. Reconstruction of peripheral nerves: the phenomenon of bilateral reinnervation of muscles originally innervated by unilateral motoneurons. Neurosurg 1992;30(3):364-9.
44. Fernandez E, Pallini R, Marchese E, Lauretti L, La Marca F. Qualitative, morphological, and somatotopic nuclear changes after facial nerve regeneration in adult rats: a possible challenge to the "no new neurons" dogma. Neurosurg 1995;37(3):456-63.
45. Guntinas-Lichius O, Neiss WF, Schulte E, Stennert E. Qualitative image analysis of the chromatolysis in rat facial nerve and hypoglossal motoneurons following axotomy with and without reinnervation. Cell Tissue Res 1996;286:537-41.
46. Semba K, Egger MD. The facial "motor" nerve of the rat: control of vibrissal movement and examination of motor and sensory components. J Comparative Neurol 1986;247:144-58.
47. Yian CH, Paniello RC, Spector JG. Inhibition of motor nerve regeneration in a rabit facial nerve model. Laryngoscope 2001;111:786-91.
48. Chen Y-S, Hsu C-J, Liu T-C, Yanagihara N, Murakami S. Histological rearrangement in the facial nerve and central nuclei following immediate and delayed hypoglossal-facial anastomosis. Acta Otolaryngol 2000;120:551-6.
49. Lewin SL, Utley DS, Cheng ET, Verity AN, Terris DJ. Simultaneous treatment with BDNF and CNTF after peripheral nerve transection and repair enhances rate of functional recovery compared with BDNF treatment alone. Laryngoscope 1997;107:992-9.
50. Hildebrand C, Mustafa GY, Waxman SG. Remodelling of internodes in regenerated rat sciatic nerve: electron microscopic observations. J Neurocytol 1986;15:681-92.
51. Guntinas-Lichius O, Angelov DN, Tomov TL, Dramiga J, Neiss WF, Wewetzer K. Transplantation of olfactory ensheathing cells stimulates the collateral sprouting from axotomized adult rat facial motoneurons. Exp Neurol 2001;172:70-80.
52. Byers JM, Clark KF, Thompson GC. Effect of pulsed eletromagnetic stimulation on facila nerve regeneration. Arch Otolaryngol Head Neck Surg 1998;124:383-9.
53. Friedman DL. Regulation of the cell cycle and cellular prolifaration by cyclic nucleotides. In: Nathanson JA, Kebabian JW. Cyclic nucleotides. New York: Springer-Verlag Berlin Heidelberg, 1982. v.58/II, c.18, p.157.
1 Mestre em otorrinolaringologia, pós-graduando Doutorado.
2 Mestre em otorrinolaringologia, pós-graduando Doutorado.
3 Biólogo e doutor em bioquímica, pesquisador científico do Centro de Biotecnologia do Instituto Butantan.
4 Doutor em otorrinolaringologia, professor adjunto da disciplina de otorrinolaringologia da UNIFESP/EPM.
5 Professor livre-docente, professor afiliado da disciplina de otorrinolaringologia da UNIFESP/EPM.
6 Professor livre-docente, professor da disciplina de otorrinolaringologia da UNIFESP/EPM. Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Universidade Federal de São Paulo.
Endereço para correspondência: Andrei Borin Rua Loefgreen 1587 apto 152 São Paulo SP 04040-032.
E-mail: andreiborin@hotmail.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 18 de abril de 2007. cod. 4460.
Artigo aceito em 4 de agosto de 2007.


