INTRODUÇÃO O desequilíbrio na barreira funcional da mucosa da gengiva bucal desencadeia reações inflamatórias e imunitárias que danificam a estrutura de sustentação dos dentes1,2. Assim, a partir da camada inicial de glicoproteínas, desenvolveram-se bactérias de serotipos espécie-hospedeiro específicos (aeróbias e anaeróbicas), com toxinas determinando mudança de pH potencial, redox e de enzimas proteolíticas e conseqüente aparecimento de placa bacteriana3,4,5. Assim, os produtos originários destes microorganismos e de sua reação com o hospedeiro sintetizam pequenas proteínas que recebem o nome genérico de citocinas (interleucinas, fator de necrose tumoral, fator de crescimento, interferon e outras). Para a plena eficácia das citocinas, é indispensável sua ligação com receptores celulares específicos das próprias células (ação autócrina), células vizinhas (ação parácrina) ou em alvos distantes (ação endócrina). No que diz respeito às suas expressões, estas são reguladas pelo aparecimento de sinais específicos desencadeados após cada nova transcrição do mRNA e conseqüente síntese de novas proteínas. Estas citocinas agem não só como mediadores inflamatórios, como reguladores da divisão e diferenciação celular2,6,7. Ainda que potencialmente todas as células bucais possam produzir citocinas, na fase inicial da invasão bacteriana periodontopática, elas são provenientes da migração de monócitos, macrófagos e linfócitos, embora na gengiva sadia predominem os polimorfonucelares. Assim, surge o Fator de Necrose Tumoral (TNF-a) com concentração muito baixa8,9, que reduz as células competentes à produção das interleucinas 1,6 e 8.
A interleucina 1b(IL-1b) e o TNFa tem potencial de produção de colagenase e reabsorção óssea, fibroblastos, células osteoblásticos e conseqüente produção da IL-6 e IL-11 que por sua vez voltam a mediar a produção de IL-1b e TNF-a6,10,11,12.
Em síntese, a IL1-b em conjunto com o TNF-a devem ser os desencadeadores de reações inflamatórias que podem conduzir à reabsorção e destruição óssea na doença periodontal. Especificamente, a dosagem de IL 1-b demonstra concentrações no fluído gengival variando de 16,5 a 844 ng/ml 13,14,15, permitindo um estudo comparativo entre a mucosa sadia e com doença periodontal através de sua quantificação.
CASUÍSTICA E MÉTODO Foram selecionados 40 pacientes (ordem de chegada) no Ambulatório de Periodontia do Departamento Estomatologia da Universidade Federal do Paraná, durante o mês de novembro de 2001, divididas em 2 grupos: I (20 pacientes com gengivas sadias) e II (20 pacientes adultos com doença periodontal) com bolsas que variaram de 5 a 11 mm de profundidade). Quanto ao gênero, havia 5 mulheres no Grupo I e 3 no Grupo II, com idade de 29 a 37 anos, e 37 homens de 21 a 58 anos. Nenhum dos pacientes haviam sido tratados previamente de doenças periodontal e não eram tabagistas neste período.
Quanto ao método, foram utilizadas:
1) Tiras pré-cortadas e padronizadas de papel-filtro quantitativo (Gramnex 3893 faixa azul).
2) Tampão de fosfato (PBS).
3) Soroalbumina bovina a 0,5% (BSA).
4) Kit comercial para determinação das concentrações de interleucina-1b no fluido gengival - Elisa IL-1b (Easia MedgenixTM Diagnostics S.A. - Zoning Industriel B-6220 Fleurus - Belgique). Quanto à composição do KIT:
a. 1 placa de cloreto de polivinil com microcubas para 96 testes.
b. 06 padrões de curva.
c. controle de 104 pg/ml ± 25 e 480 pg/ml ± 100
d. um frasco com anticorpo anti- IL-1b - HRP.
e. um frasco de substrato TMB (tetrametilbenzidina)
f. um frasco de tampão de lavagem.
g. um frasco de solução bloqueadora (SO4H2).
h. três frascos de substrato tampão.
i. três frascos com solução diluente.
j. água destilada de alta qualidade.
k. pipetas de precisão de 50 ml, 200ml, 1 ml, 10 ml.
l. agitador de Kline (Depron) 700 r.p.m.
m. leitora Hyperion Micro Reoder 3.
Para a seleção de amostras, escolheu-se e isolou-se com algodão o sextante posterior mais acometido para a colheita do fluido gengival. Após determinação da profundidade das bolsas gengivais por sondagem feita 7 dias antes da colheita da amostra para o teste, com jejum prévio de 12 horas, permanecendo neste período sem proceder à higiene bucal, mecânica ou química, foi feita a colheita em um dia. Aspirando-se continuamente a saliva, colhemos o fluido do sulco gengival, mergulhando as tiras pré-cortadas nessas fendas durante 60 segundos, com o menor traumatismo, desprezando-se as amostras com sangue. As tiras foram conservadas em 400 ml de solução tampão fosfato e soroalbumina a 0,5%, a 8ºC, até o início do ensaio realizado 24 horas após a colheita. Analisamos, então, as amostras dos controles e das periodontopatias em duplicatas utilizando o kit Easia (Medgenix IL-1b), que é um teste de imunoensaio enzimático, que combina anticorpos monoclonais com diferentes epítopos de IL-1b. Estes anticorpos (MABs 1) se aderem às paredes dos micropoços da placa, e a eles se acrescentam (MABs 2), marcando-se com peroxidase (HRP) e o seu cromógeno (TMB). Após incubação de 2 horas, houve reação em "sanduíche" MABs1 - IL-1b - MAB s2 - HRP. A seguir, foram pipetados 200 ml em cada orifício de placa de imunoensaio, incubando-a no escuro, em temperatura ambiente, sob a ação do agitador Kline a ± 500 rpm por 15 minutos. Adicionou-se 50 ml de solução bloqueadora aos micropoços nos quais ocorreram as reações cromogênicas e mediu-se a densidade óptica de cada amostra na leitora Hyperion num comprimento de onda de 490 nm (filtro de referência 630 ou 650). Para tanto, construiu-se curva de calibragem entre densidade óptica e concentração de IL-1b dos seis padrões do kit. As concentrações padronizadas foram respectivamente 0, 58, 170, 562, 1119, 2298 pg/ml, com média de densidades ópticas de, respectivamente, 0.007, 0.0695, 0.215, 0.689, 1.296, 2.147 e suas relações foram diretamente proporcionais (r = 0,9999116308; a = -1,7456206 e o coeficiente de regressão b = 816,8842957). Desta forma, determinamos as concentrações da IL-1b por regressão linear, como correlação aos índices de densidade óptica do diluente (3,973). Corrigiram-se os valores calculados pelo grau de diluição das respectivas amostras, expressando-se os valores finais em pg/ml16.
Quanto à análise estatística, comparou-se o grupo I e grupo II pela análise da variância, testou-se a hipótese de que houve diferença entre os 2 grupos pelo teste t de Student, com conclusões decorrentes dos valores de p.
RESULTADOS Nas amostras de fluido gengival das 40 pessoas, encontraram-se níveis indetermináveis de IL-1b em 18 das 20 amostras do grupo I. Considerou-se valor indeterminável sempre que a densidade óptica foi igual ou inferior a 0,007 (valor médio, cujos extremos são: 0,005 e 0,009), porque se mediram esses valores nos padrões sem a interleucina, nos quais somente o fluido de diluição esteve presente. Embora fossem as gengivas desse grupo uniformemente saudáveis, duas das amostras tiveram IL-1b dosável (Tabela 1).
As médias das concentrações corrigidas de IL-1b nas amostras do grupo II são significativamente superiores (p = < 0,05) em relação ao grupo sadio (Tabela 2). Apesar da uniformidade clínica em relação ao grau de periodontite, cerca de 45% das amostras obtidas nos respectivos sulcos gengivais tiveram valores relativamente baixos de IL-1b.
A distribuição dos valores tanto do grupo I quanto do grupo II estão demonstrados na Figura 1.
Tabela 1
Grupo I Densidade Valor da leitura Concentração média óptica corrigida (pg/ml).
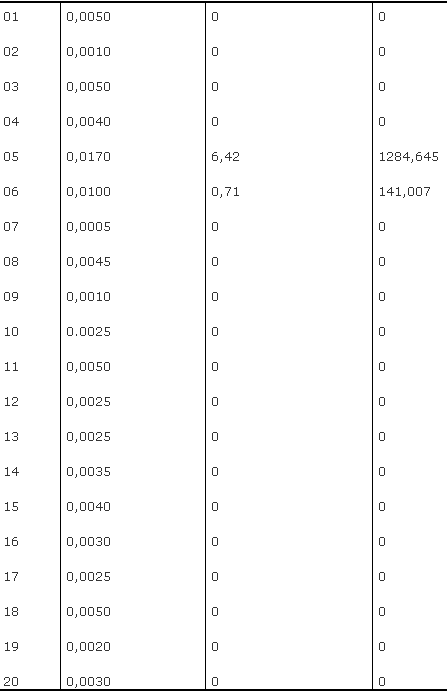
Média e desvio padrão: 71,28 ± 280,05
Variância: 78428,58
Tabela 2
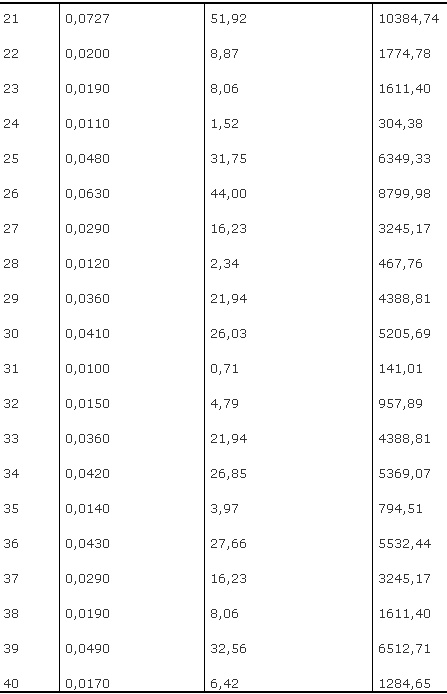
Grupo II Densidade Valor da leitura Concentração média Óptica corrigida (pg/ml)
Média e desvio padrão: 3618,49 ± 2864,75 pg/ml
Variância: 8206813,89
Diferença entre os grupos I e II: p < 0,05
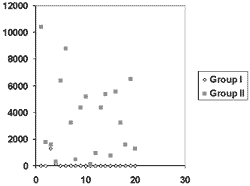
Figura 1. Distribuição dos valores das amostras obtidas nos dois grupos.
No presente estudo, seguem-se todos os detalhes capazes de aumentar a uniformidade na colheita do fluido gengival. Apesar dos cuidados, todavia, no grupo II, a dispersão dos dados foi notável, de 0,141 a 10,385 ng/ml, que se traduz num desvio padrão de 2,865 para 3,619 ng/ml de média aritmética. Da mesma maneira, em circunstâncias clínicas semelhantes, cada autor que utiliza kits comerciais ELISA encontra notável dispersão nos seus dados. Assim, foram surpreendidos níveis de IL-1b que foram da nulidade a 97 ng/ml16,17, bem como valores de 313 ± 192 ng/ml18. Entretanto, valores mais baixos são registrados19 com extremos de 0,04 e 0,240 ng/ml. Deve-se esse comportamento, em alguns grupos, em parte, ao índice de precisão na determinação da IL-1b das amostras. A capacidade de determinação da IL-1b pode ser uma das causas técnicas mais importantes na flutuação das médias dos vários grupos da literatura e na grande dispersão dos seus dados. Pode-se compreender e comparar melhor o exposto quando se transformam os dados da dispersão em percentagem, na forma de coeficiente de variação. Assim, nos grupos de maior índice de determinação da IL-1b nas amostras, o percentual da dispersão variou na literatura de 19% a 25%13,20, crescendo progressivamente até 86%13,15,16,17,18, numa proporção inversa ao índice de recuperação. Exceções existem, porém, encontrando-se coeficiente de variação de 63% em populações com 100% de recuperação, provavelmente por causa dos extremos de 131,8 e 843,818. O mesmo encontramos no grupo II deste estudo, cujo coeficiente de variação foi de 79% para 100% de recuperação, por causa da densidade de valores próximos aos extremos. Encontram-se, assim, em 15% das amostras, concentrações muito baixas de IL-1b, decorrentes de níveis de densidade óptica próximos da faixa entre 0,005 e 0,009 que, na curva de calibragem, correspondem à amostra destituída de IL-1b. A amplitude na flutuação entre esses dois valores está em torno de 45%, significando que, nos extremos inferiores da curva, a precisão diminui excessivamente. Nos demais níveis de densidade óptica, as flutuações das leituras estão entre 0,43% e um máximo de 8,44%. É possível que diluições menores do que as recomendadas pelo fabricante do kit tornem a leitura mais precisa, nas concentrações mais baixas, como aqueles realizados16 em trabalhos16 dentro dos extremos da curva de sensibilidade, que vão de 20 a 1000 pg/ml.
A preocupação com a dispersão das concentrações da IL-1b prende-se a um grau de dificuldade maior que é a sua comparação com os dados clínicos individuais, situação bem exemplificada ao ser demonstrada ausência de correlação entre a IL-1b e a profundidade do sulco gengival, quando se considerou toda a população estudada16. Dessa maneira, pode ser fácil demonstrar as tendências por meio das médias de IL-1b enquanto grupos, mas a discriminação entre saúde e doença, nos vários graus de comprometimento do periodonto, e a presunção evolutiva não são tão fáceis de ser demonstradas na pessoa isolada, ou em cada um dos locais de uma mesma arcada21. No grupo II deste estudo, em que a dispersão na concentração de IL-1b chega a 79% da média, cada valor da interleucina provém do fluido do sulco gengival que, no conjunto, como agrupamento, representa amostragem uniforme, restrita pela sua profundidade, igual ou maior do que 5 mm, aceita como sinônimo de periodontite estável e avançada22, cuja perda óssea estimada se encontra entre 30 e 69%19,20. Apesar do comportamento binário da presente casuística, partilhada por outros20, em que a IL-1b indeterminada ocorre nas gengivas sãs, e elevada, no grupo com periodontite, existe cerca de 30% dos dados que são superponíveis. Significa que, em 70% dos casos, a distinção entre gengiva sã e periodontite é fácil nos casos individuais, mas, em 30% das vezes, a dúvida predomina. Torna-se mais difícil ainda estratificar cada caso, em graus de periodontite, ou avaliar a perda óssea correspondente, somente com a dosagem da IL-1b, como foi observado anteriormente23. É possível que, por essas razões, muitos autores encontrem correlação forte e direta dos vários graus de periodontite somente com dados clínicos isolados, como profundidade do sulco, volume de fluido gengival, perda de aderência periodontal, índice gengival, índice de placa23,24. Certos pesquisadores19,20,25, contudo, correlacionam direta e significativamente a IL-1b, ou seus genótipos correspondentes, com os parâmetros clínicos e o grau de destruição óssea19,20,25 a tal ponto que se atrevem a fazer tabela com seis níveis de IL-1b, entre 50 e 230 pg/ml, e graus correspondentes de perda óssea, entre 0,5 e 3 mm. Outros pesquisadores16,22,26,27 apontam para o aumento da IL-1b como circunstancial por só coincidir com a profundidade do sulco gengival, mas não corresponder ao grau de comprometimento do periodonto. Reforça essa concepção a comprovação de que, quando se trata a periodontite, ocorre a atenuação dos parâmetros clínicos enquanto os níveis da interleucina se mantêm inalterados por cerca de seis meses. A redução dos níveis de IL-1b depois desse período traduz a provável persistência do processo inflamatório residual, parte do processo de reparação ou fruto da associação à placa dental ainda presente24. No sentido contrário, na gengivite experimental humana, ocorre um pico inicial na concentração de IL-1b que continua num nível mais ou menos constante, enquanto progridem a intensidade da inflamação da gengiva e o aprofundamento do seu sulco17. Por isso, pode-se afirmar26 que o nível de IL-1b no fluido gengival avalia o número de células da gengiva que a produzem, pois a sua correlação é forte e direta. No grupo I, em que 18 amostras tiveram IL-1b indeterminável, encontrou-se uma amostra com valor baixo e outra com valor surpreendentemente alto em relação às demais. Não há como precisar as causas deste fato neste estudo, mas, em ambos os casos, os comemorativos indicam forte tendência familiar à afecção: pais e irmãos são portadores de doença periodontal grave, com perda precoce dos dentes. Não se excluem, contudo, outras causas já discutidas e, inclusive, comportamento residual da interleucina, num processo de resolução.
Classificamos os representantes do grupo ll como tendo periodontite, existindo exsudato, em cujos sulcos gengivais, portanto, encontrava-se a contínua migração de neutrófilos, que se dá tanto pela presença de produtos dos microorganismos (fMet-Leu-Phe, LPS e outros) quanto pela presença de IL-8, complemento C5a, LTB4, PGE2, TxB2 e moléculas de adesão auxiliares como ICAM-1 e ELAM-1 e outras adesinas. Essas últimas moléculas contribuem para que os PMNs infiltrem os tecidos da face coronal, juncional e apical, e as demais células imunoinflamatórias permaneçam no tecido28. Nessas circunstâncias, as placas são maiores no sentido apical, onde se desenvolve nicho ambiental de anaerobiose. Alguns macrófagos para aí também migram. Esse infiltrado expande-se lateralmente e em direção ao tecido conjuntivo, onde é maior a densidade de macrófagos, linfócitos e grande é o número de plasmócitos. Nessa fase, os plasmócitos chegam a ocupar 51% nas áreas de maior atividade, enquanto nas regiões de menor atividade chegam a 30% da área do corte. Da mesma maneira, maior infiltrado de linfócitos B corresponde à doença mais ou menos estável, quando o número de células T predomina. Ao mesmo tempo em que aumenta o infiltrado celular no tecido conjuntivo, principalmente na área subepitelial, diminuem o número de fibroblastos e a quantidade de colágeno28,29,30.
CONCLUSÕES Conclui-se que, apesar de se obter concentrações de IL-1b que permitiram a fácil separação do grupo I e do grupo II, e representar o segundo grupo populacional relativamente uniforme, muitos dos valores da citocina superpõem-se a dados do grupo I. Usando-se a concentração de uma só citocina para definir o grau de periodontite, cria-se relação apenas circunstancial com os dados clínicos, sendo a sua contribuição para o diagnóstico, portanto, frágil. É possível que a dosagem concomitante de outros fatores como os produtos que indicam o número de células, por exemplo, mieloperoxidase, b-glicuronidase, ou a sua atividade, como as metaloproteinases, ILs-1, IL-1ra, IL-6, IL-8, prostaglandinas, TGFb ou até de células como as T CD3+ e a proporção de seus subgrupos CD4+ e CD8+ possam contribuir para o detalhamento e a compreensão das várias fases da periodontite. Por essas razões, os estudos devem prosseguir, com mais dados, para que se possa estabelecer ou até criar novos índices que possam tornar mais precisas as classificações e o prognóstico dos vários graus de periodontite. Em síntese, a dosagem de interleucina 1b no fluido do sulco gengival permitiu a distinção entre os grupos com periodonto normal e doente, respectivamente I e II.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Williams DM. Gengivitis and periodontal disease. In: McGee JO', Isaacson PG, Wright NA. (Ed.) Oxford textbook of pathology. Oxford: Oxford University Press; 1992. v.2a., p.1091-96.
2.Abbas AK, Lichtman AH, Pober JS. Cellular and molecular immunology. 2nd. Philadelphia: Saunders; 1994. 457p.
3. Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms. A common cause of persistent infections. Science 1999;284:1318-22.
4. Kadono H, Kdo J-I, Kataoka M, Yamaguchi N, Nagata T. Inhibition of osteoblastic cell differentiation by lipopysaccharide extract from Porphyromonas gigibalis. Infect Immun 1999;67:2841-46.
5. Costerton JW, Stewart PS. Battling biofilms. Scient American 2001;285:61-7.
6. Howells GL. Cytokine networks in destructive periodontal disease. Oral Dis 1995;1:266-70.
7. Hyde RM. Immunology. 3rd. Philadelphia: Williams & Wilkins; 1995. p.316.
8. Matsuki Y, Yamamoto T, Hara K. Localization of interleukin-1 (IL-1) mRNA-expressing macrophages in human inflamed gingiva and IL-1 activity in gingival crevicular fluid. J Periodont Res 1993;28:35-42.
9. Agarwal S, Baran C, Piesco NP, Quintero JC, Langkamp HH, Johns lP, Chandra CS. Synthesis of proinflammatory cytokines by human gingival fibroblasts in response to lipopolysaccharides and interleukin-1b. J Periodont Res 1995;30:382-9.
10. Hillmann G, Hillmann B, Geursten W. Immunohistological determination of interleukin-1 beta in inflamed gingival epithelium. Arch Oral Biol 1995;40:353-9.
11. Yucel-Lindberg T, Lerner UH, Modéer T. Effects and interactions of tumour necrosis factor a and bradykinin on interleukin-1 production in gingival fibroblasts. J Periodont Res 1995;30:186-91.
12. Manolagas SC. Role of cytokines in bone resorption. Bone 1995;17(2):635-75.
13. Payne JB, Reinhardt RA, Masada MP, Dubois LM, Allison AC. Gingival crevicular fluid IL-8: correlation with local IL-1b levels and patient estrogen status. J Periodont Res 1993;28: 451-3.
14. Johnson GK, Poore TK, Squier CA, Wertz PW, Reinhardt RA, Vincent SD. Prostaglandin E2 and interleukin-1 levels in smokeless tobacco-induced oral mucosal lesions. J Periodont Res 1994;29:430-8.
15. Lamster IB, Pullman JR, Celenti RS, Grbic JT. The effect of tetracycline fiber therapy on b-glucoronidase and interleukin1-b in crevicular fluid. J Clin Periodontol 1996;23:816-22.
16. Wilton JMA, Bampton JLM, Griffiths GS, Curtis MA, Life JS, Johnson NW, Powell JR, Harrap GJ, Critchley P. Interleukin-1 beta (IL-1b) levels in gingival crevicular fluid from adults with previous evidence of destructive periodontitis. J Clin Periodontol 1992;19: 53-7.
17. Heasman PA, Collins JG, Offenbacher S. Changes in crevicular fluid leves of interleukin-1b, leukotriene B4, prostaglandin E2, thromboxane B2 and tumour necrosis factor a in experimental gingivitis in humans. J Periodont Res 1993;28:241-7.
18. Preiss DS, Meyle J. Interleukin-1b concentration of gingival crevicular fluid. J Periodontol 1994;65:423-8.
19. Cavanaugh PF, Meredith MP, Buchanan W, Doyle MJ, Reddy MS, Jeffcoat MK. Coordinate production of PGE2 and IL-1b in the gengival crevicular fluid of adults periodontitis. J Periodont Res 1998;33:75-82.
20. Ishihara Y, Nishihara T, Kuroyanagi T, Shirozu N, Yamagishi E, Ohguchi M, Koide M, Ueda N, Amano K, Noguchi T. Gingival crevicular interleukin-1 and interleukin-1 receptor antagonist levels in periodontically healthy and diseased sites. J Periodont Res 1997;32: 524-9.
21. Williams RC, Paquete DW. Avanços no diagnóstico periodontal. In: Lindhe J, Karring T, Lang NP. (Ed.) Tratado de periodontia clínica e implantologia oral. 3.ed. Rio de Janeiro: Guanabara-Koogan; 1999. p. 281-98.
22. Reinhardt RA, Masada MP, Kaldhal WB, Dubois LM, Kornman KS, Choi JI, Kalkwarf KL, Allison AC. Gingival fluid IL-1 and IL-6 levels in refractory periodontitis. J Clin Periodontol 1993;20:225-31.
23. Wollf LF, Koller NJ, Smith QT, Mathur A, Aeppli D. Subjingival temperature. J Clin Periodontol 1997;24: 900-6.
24. Alexander DCC, Martin JC, King PJ, Powell JR, Caves J, Cohen ME. Interleukin-1 beta, prostaglandin E2, and immunoglobulin G subclasses in gingival crevicular fluid in patients undergoing periodontal therapy. J Periodontol 1996;67: 755-62.
25. McDevitt MJ, Wang H-Y, Knobelman C, Newman MG, Di Giovine FS, Timms J, Duff GW, Kornman KS. Interleukin-1 genetic association with periodontitis in clinical practice. J Periodontol 2000;71:156-63.
26. Feldner BD, Reinhardt RA, Garbin CP, Seymour GL, Casey JH. Histological evaluation of interleukin-1b and collagen in gingival tissue from untreated adult periodontitis. J Periodont Res 1994;29:54-61.
27. Shimauchi H, Takayama S, Imai-Tanaka T, Okada H. Balance of interleukin-1b and interleukin recptor agonist in human periapical lesions. J Endodont 1998;24:116-9.
28. Roberts FA, Hockett Jr RD, Bucy RP, Michalek SM. Quantitative assessment of inflammatory cytokine gene expression in chronic adult periodontitis. Oral Microbiol Immunol 1997;12:336-44.
29. Yamazaki K, Nakajima T, Kubota Y, Gemmell E, Seymour GJ, Hara K. Cytokine messenger RNA expression in chronic inflammatory periodontal disease. Oral Microbiol Immunol 1997;12:281-7.
30. Kinane DF, Lindhe J. Patogênese da periodontite. In: Lindhe J, Karring T, Lang NP. (Ed). Tratado de periodontia clínica e implantologia oral. 3ª ed. Rio de Janeiro: Guanabara:Koogan; 1999. p.127-52.
[1] Mestre em Ciências da Saúde, Hospital Heliópolis, Hosphel, São Paulo, SP.
[2] Docente Livre em Cirurgia de Cabeça e Pescoço, Hospital Heliópolis, Hosphel, SP.
[3] Professora do Curso de Especialização em Periodontia da UFPR.
Trabalho realizado no Departamento de Estomatologia da Universidade Federal do Paraná e no Departamento de Cirurgia de Cabeça e Otorrinolaringologia do Hospital Heliópolis, Hosphel, São Paulo.
Endereço para Correspondência: Prof. Dr. Abrão Rapoport - Rua Iramaia nº 136 Jd. Europa 01450-020 - São Paulo SP - Tel (0xx11) 273-8224 - E-mail: cpgcp.hosphel@attglobal.net


