INTRODUÇÃO O conhecimento da flora bacteriana que coloniza as amígdalas palatinas tem se tornado cada vez mais importante, tanto pela sua relação com as infecções de repetição quanto pela possível associação com a hipertrofia amigdaliana1,2. Na população geral, acredita-se que a prevalência do S.pyogenes que coloniza a orofaringe seja ao redor de 25%3. Estudos recentes mostram que esta porcentagem aumenta consideravelmente na vigência de uma faringoamigdalite infecciosa4. Segundo estudo realizado na Universidade Federal de São Paulo em 1966 e 2000, cerca de 30% das faringoamigdalites apresentam positividade para o Streptococcus pyogenes4, que continua sendo o agente etiológico mais importante. Sua importância se baseia principalmente na capacidade destas infecções apresentarem complicações de alto índice de morbidade tais como os abcessos, febre reumática, glomerulonefrite, entre outras5,6,7.
Ainda em relação aos processos infecciosos, acredita-se que os quadros recorrentes e, muitas vezes, a falha no tratamento com penicilina, possam estar relacionados à colonização local por microorganismos produtores de Beta lactamase, que dificultariam tanto a erradicação da S pyogenes quanto o tratamento das infecções3. Embora universalmente o SBHGA (Streptococcus b hemoliticus do Grupo A de Lancefield) seja ainda considerado sensível à penicilina, uma das grandes preocupações em relação às infecções bacterianas de vias aéreas superiores é a mudança na susceptibilidade aos antimicrobianos clássicos apresentada por vários outros microorganismos. Os pneumococos resistentes à penicilina são cada vez mais freqüentes, assim como os Haemophilus influenzae produtores de B lactamase8.
No sentido de estudar a microbiota da orofaringe em crianças, e verificar as diferenças da microflora amigdaliana tanto na superfície quanto no core, assim como sua relação com quadros infecciosos recorrentes ou de hipertrofia, os autores pesquisam e comparam a colonização bacteriana da superfície e core amigdaliano em crianças da nossa população portadoras de faringoamigdalites de repetição e hipertrofia amigdaliana.
CASUÍSTICA E MÉTODOS Noventa pacientes de ambos os sexos, na faixa etária de 02 a 12 anos de idade, sendo 27 portadores de amigdalite de repetição (AR) e 63 com hipertrofia adenoamigdaliana obstrutiva (AO) com indicação cirúrgica, foram avaliados na Disciplina de Otorrinolaringologia Pediátrica do Hospital São Paulo, Universidade Federal de São Paulo, no período de abril de 1999 a janeiro de 2002.
Os pacientes foram divididos em 2 grupos etários: Pré-escolares, 2 a 6 anos de idade, e Escolares, entre 6 a 12 anos.
Coleta do material e processamento:
No momento da cirurgia, com o paciente sob anestesia geral, (entubação oro-traqueal), o material da superfície das 2 amígdalas foi coletado com swab alginatado e imediatamente após semeado em placas de ágar sangue e ágar chocolate suplementado com fatores V e X (base columbia, OXOID, 5% de sangue de carneiro). Após a remoção cirúrgica da primeira amígdala, esta era submetida a um jato de soro fisiológico para retirada do excesso de sangue e a seguir submersa em cloroexidina por três minutos para imediatamente ser semeada em placa de ágar sangue pelo método de rolamento. A próxima etapa consistiu no corte da amígdala com auxílio de bisturi, semeando-se a superfície do core em placas de ágar sangue e chocolate. Na segunda amígdala repetia-se o mesmo procedimento de limpeza e desinfecção, exceto o corte que foi realizado com auxílio de bisturi elétrico. Na segunda amígdala a coleta do material do core foi realizado com swab alginatado deslizado entre as criptas no interior da amígdala, e semeado em placas de ágar sangue e chocolate.
As placas semeadas foram encaminhadas ao Laboratório de Microbiologia do Hospital São Paulo, encubadas em estufa microbiológica com 5% de CO2 por 18 a 24 horas.
Após isolamento bacteriano, a identificação foi realizada segundo as recomendações da Sociedade Americana de Microbiologia.
RESULTADOS Entre as 90 crianças incluídas no estudo, 64,4% eram do sexo masculino e 35,6% do sexo feminino; 66% entre 2-6 e 44% entre 6 e 12 anos de idade.
De uma forma geral, em todos os grupos, tanto nas crianças com amigdalite de repetição (AR), quanto nas crianças com hipertrofia adenoamigdaliana (AO), as porcentagens de bactérias consideradas patogênicas de vias aéreas (Haemophilus sp, S. aureus, S. pyogenes, S pneumoniae e Moraxella) foram altas. A distribuição da freqüência na superfície e core, de acordo com os grupos pode ser observada no Quadro 1. Não houve diferença significativa no isolamento bacteriano na superfície e core amigdaliano.
Tanto nos pré-escolares como nos escolares, o S. aureus foi mais freqüente nas crianças com hipertrofia (AO) em relação às que apresentavam infecções de repetição (AR). Nos escolares, o S. pyogenes foi mais prevalente no grupo AR, e embora presente em pré-escolares do grupo AO, não foi isolado nas crianças com infecção de repetição. O S. pneumoniae só foi isolado em crianças com hipertrofia adenoamigdaliana. Estes dados podem ser observados nos Quadros 2 e 3.
DISCUSSÃO A alta freqüência de faringoamigdalites e hipertrofia adenoamigdaliana na população pediátrica tem sido ao longo dos anos uma das grandes razões para a utilização de antimicrobianos e para cirurgias de remoção das amígdalas palatinas5,9. Alguns autores acreditam que a flora bacteriana que coloniza a amígdalas palatinas esteja intimamente relacionada com os quadros de infecções de repetição, falhas no tratamento e até mesmo com o seu crescimento exagerado1,2,10,11.
Ao longo dos anos, estudos de culturas provenientes de oro e rinofaringe na população infantil tem observado uma diminuição da incidência de S.pyogenes e aumento de S.aureus. Como o S.aureus tem sido freqüentemente isolado na oro e rinofaringe da população em geral na ausência de quadros infecciosos, o seu papel na etiologia das infecções é ainda incerto12, 13.
No nosso estudo, tanto no grupo AO como no AR, a prevalência de bactérias consideradas patogênicas foi alta tanto na superfície quanto no core das amígdalas palatinas, similarmente aos relatos de outros autores2,11,14. Vários pesquisadores têm tentado estabelecer uma correlação entre os microorganismos da superfície amigdaliana com a microflora do core amigdaliano, e embora alguns relatem uma certa discrepância entre as duas bacteriologias, da mesma forma como em nosso estudo, Kielmovitch et al., já em 1989, observavam a concordância entre as duas microfloras.
Segundo os estudos de Brook e Foote, em 1992, a prevalência de microorganismos produtores de beta lactamase tende a ser maior nas crianças com história de amigdalites recorrentes do que em crianças da população em geral, particularmente o S. aureus e H.influenzae11. Também no nosso estudo verificamos haver uma tendência de maior colonização pelo H influenzae nas crianças com história de infecções recorrentes em relação ao grupo AO, particularmente nos pré-escolares, entretanto, o mesmo não ocorreu para o S.aureus, que foi mais prevalente nas amígdalas do grupo AO.
De uma forma geral, independente dos grupos e faixa etária, foi interessante notar que a taxa de colonização do S. pyogenes foi alta, em torno de 10%, embora não tanto como nos relatos internacionais que giram em torno de 25%3.
Nas crianças portadoras de AR, particularmente nas mais jovens, verificamos que a presença do S.pyogenes foi consideravelmente menor quando comparado ao grupo de escolares. Isto demonstra que apesar de as crianças apresentarem infecções de repetição o S. pyogenes não é um colonizante importante nesta faixa etária. Seria o S.pyogenes um agente etiológico pouco freqüente em pré-escolares? Estaria o tratamento das infecções (uso freqüente de antibióticos) sendo efetivo na erradicação deste patógeno? Talvez a chance de reinfecção seja menor em crianças mais jovens.
Verificamos também uma tendência na maior prevalência da Moraxella nos pré-escolares em relação aos escolares. Teriam as bactérias Gram negativas um papel mais importante nas crianças menores?
Em relação ao crescimento das amígdalas palatinas, segundo Barr e Crombie, o tamanho da amígdala palatina parece não ser significantemente diferente entre crianças que apresentam amigdalites de repetição e as crianças com hipertrofia isoladamente10.
Acredita-se que esta hipertrofia poderia estar relacionada à colonização local por microorganismos, que estimulariam a proliferação de elementos linfóides, que por sua vez seria a principal causa da hipertrofia amigdaliana; e não o aumento do tecido estromal. Estes estudos mostram que a quantidade de células T-helper, T-supressor e células B é muito maior em amígdalas hipertróficas em relação aos controles1,14.
Apesar de alguns estudos sugerirem a associação do H.influenzae e a hipertrofia amigdaliana1, no nosso estudo, nas crianças portadoras de hipertrofia adenoamigdaliana, em todas as faixas etárias estudadas, tanto na superfície quanto no core amigdaliano, a presença do S.aureus foi mais importante do que nas crianças que apresentavam infecções de repetição, sugerindo uma associação entre esta bactéria e o crescimento exagerado das amígdalas.
Acreditamos que estudos posteriores da microbiota da orofaringe em crianças da população em geral, sem histórico de infecções recorrentes ou presença de hipertrofia possa ser importante para entender estas diferenças.
CONCLUSÃO Os resultados do nosso estudo sugerem que a flora bacteriana que coloniza a superfície amigdaliana é semelhante à do core amigdaliano; que a prevalência de S. pyogenes colonizante na orofaringe de crianças é alta, em torno de 10%, e que o S. aureus é mais freqüente em crianças portadoras de hipertrofia adenoamigdaliana em relação às que apresentam infeções de repetição.
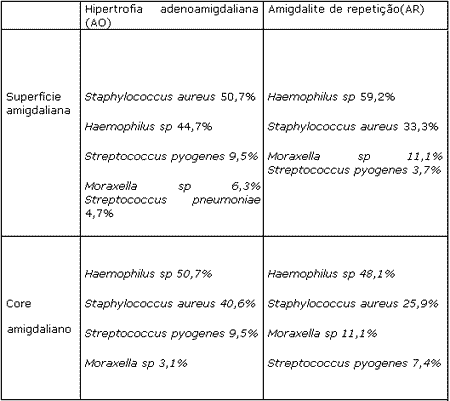
Quadro 1. Distribuição das Bactérias na Superfície e Core Amigdaliano segundo os 2 grupos estudados (AO e AR)
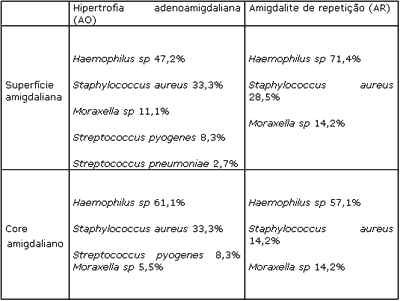
Quadro 2. Freqüência e distribuição das bactérias na superfície e core amigdaliano em pré-escolares (2 a 6 anos de idade), em relação ao grupo AO e AR.

Quadro 3. Freqüência e distribuição das bactérias na superfície e core amigdaliano em escolares (6 a 12 anos) em relação aos grupos estudados AO e AR
1.Brodsky L, Moore L, Stanievich J. The role of Haemophilus influenzae in the pathogenesis of tonsils hipertrophy in children. Laryngoscope 1988;98: 1055-1060.
2. Kielmovitch IH, Keleti G, Bluestone CD, Wald ER, Gonzales C. Microbiology of obstructive tonsillar hypertrophy and recurrent tonsillitis. Arch Otolaryngol Head Neck Surg 1989;115:721-724.
3. Pichichero ME. Group A beta-hemolitic streptococcal infections. Pediatr Ver 1998; 19(9):291-302. Paranasal sinuses and the skull base. Heildelberg: Springer Verlag; 2000; p.357-70.
4. Paes O, Pignatari AC, Weckx LLM, Pignatari SN. Detection of BHSGA by using three different methods: culture, rapid test and molecular biology assay. Otolaryngol Head Neck Surg (special issue). Poster 147 2002;127(2):248.
5. Bluestone CB. Current Indications for tonsillectomy and adenoidectomy. Ann Otol Rhinol Laryngol 1992;101: 58-64;.
6. Weckx LLM, Teixeira MS. Amigdalites: Aspectos Imunológicos, Microbiológicos e Terapêuticos. JBM 1997;73: 94-101.
7. Weckx LLM & Weckx LY. Como diagnosticar e tratar amigdalites. Ver Bras Med 1988;45:27-32.
8. Brandileone MCC, DI Fabio JL, Vieira VSD, Zanella RC, Casagrande ST, Pignatari AC, Tomasz A. Geographic distribution of Penicillin resistance of Streptococcus pneumoniae in Brazil: Genetic relatedness. Microbial Drug Resistance 1998;4:209-217.
9. Brodsky L. Modern Assessment of Tonsils and Adenoids The Pediatric Clinics of North America 1989;36(6): 1551-69.
10. Barr GS, Crombie IK. Comparison of size of tonsils in children with recurrent tonsillitis and in controls. BMJ 1989;298:804.
11. Brook I, Foote PA. Comparison of the microbiology of recurrent tonsillitis. Arch Otolaryngol Head Neck Surg 1992;118: 507-508.
12. Brandão KG, Pereira RCC, Bordasch A, Pignatari SSN. Bacteriologia da hipertrófica e normal em crianças. Rev Paul Ped 1996;14: 37-42.
13. Brodsky L, Koch RJ. Bacteriology and Immunology of normal and diseased adenoids in Children. Arch Otolaryngol Head Neck Surg 1993;119:821-9.
14. François M, Bingen E, Soussi Th. Bacteriology of tonsils in children: Comparison between Recurrent Acute Tonsillitis and tonsils hypertrophy. Adv Otorhinolaryngol Baser 1992;47:146-150.
15. Kertesz DA, DI Fabio JL, Brandileone MCC et al. Invasive Streptococcus pneumoniae infection in Latin America children: results of the Pan American Health Organization Surveillance Study. Clin Infect Dis 1998;16;1355-61.
[1] Aluno do sexto ano de Graduação Médica- Universidade Federal de São Paulo/Escola Paulista de Medicina (UNIFESP/EPM).
[2] Microbiologista da Disciplina de Otorrinolaringologia Pediátrica da UNIFESP/EPM.
[3] Professor Livre Docente, Chefe da Disciplina de Otorrinolaringologia Pediátrica da UNIFESP/EPM.
[4] Professora Adjunta da Disciplina de Otorrinolaringologia Pediátrica da UNIFESP/EPM.
Endereço para correspondência: Dra. Shirley S. N. Pignatari - Rua Vergueiro, 3645 apto 808 - Vila Mariana São Paulo SP 04101-300 - Tel (0xx11)5579-4502 - E-mail: pigna@terra.com.br


