INTRODUÇÃOA cavidade laríngea é dividida em três compartimentos: supraglote, glote e subglote. Na região supraglótica pode-se encontrar as pregas vestibulares (PV)1-3. As PV são duas lâminas espessas, sagitalmente orientadas, com mucosa de tamanho duplicado que surge dentro da parede supraglótica1. Essas têm por função lubrificar e isolar as pregas vocais verdadeiras para permitir sua vibração. Acredita-se que atuem, também, como uma barreira contra a passagem de agentes infecciosos para as vias aéreas inferiores2,3, devido à ação dos seus folículos linfóides (FL).
O papel dos FL encontrados próximos às mucosas é o de produzir substâncias que irão ativar na mucosa a resposta imune contra agentes infecciosos4-6. As citocinas produzidas nos FL irão levar à diferenciação plasmocitária e à produção de anticorpos que no caso do trato respiratório é principalmente do tipo IgA, que irão ser excretadas na secreção das células da mucosa4-6, inclusive nas PV7.
Em pacientes imunocompetentes a literatura demonstra o papel dos FL encontrados nas PV como protetores das vias aéreas superiores do mesmo modo que o tecido linfóide associado a mucosas2,7-10.
Em indivíduos infectados pelo vírus HIV, ocorre uma série de alterações, tais como a disfunção e diminuição dos linfócitos T CD4. Há relatos de que nos indivíduos imunodeprimidos as demais células do sistema imune serviriam como reservatório para o vírus e, assim, os tecidos linfóides, incluindo o encontrado na região da laringe, serviriam como estruturas de replicação viral11,12. Outros estudos relatam, ainda, que ocorre um aumento dos linfócitos T CD8, embora ocorra um decréscimo no número total das células responsáveis pela resposta imune9. No entanto, não encontramos na literatura relatos sobre o fenótipo das células que formariam os órgãos linfóides localizados na mucosa das PV.
Sabe-se que o tecido linfóide associado à mucosa secretor de IgA é o principal mecanismo local de proteção do trato respiratório e a sua ativação é o objetivo das vacinas que visam desenvolver a imunidade nas vias aérea superiores como forma de prevenir infecções respiratórias4-6.
Em pacientes portadores do HIV as infecções respiratórias são as principais causas de mortalidade e morbidade13,14. Logo, o entendimento da natureza das células que formam os FL encontrados nas PV é o primeiro passo para o entendimento de como poderá ser usado o sistema imune localizado na mucosa como proteção contra as doenças infecciosas respiratórias em pacientes com SIDA.
O objetivo deste estudo foi caracterizar a população de células nos folículos linfóides localizados nas PV de adultos autopsiados com SIDA com e sem infecções respiratórias associadas.
MATERIAL E MÉTODOSFoi realizado um estudo retrospectivo transversal de 285 autópsias de adultos realizadas no período de 1993 a 2003. Os pacientes foram divididos em dois grupos. No primeiro grupo foram incluídos todos os pacientes com SIDA que tiveram as laringes coletadas durante a autópsia com prontuários e laudos de autópsia completos, sendo obtido um total de 46 casos. No grupo controle foram incluídos os pacientes sem SIDA, pareados pela faixa etária com os pacientes com SIDA, sendo excluídos os casos em que os prontuários ou os laudos estavam incompletos e aqueles em que a laringe não foi coletada durante a autopsia, sendo obtido um total de 18 casos. Dos prontuários foram coletados as doenças de base, o sexo e a idade e, dos laudos de autópsias, as causas de morte. As 64 autópsias avaliadas foram divididas de acordo com a causa de morte em pacientes com e sem infecção respiratória. Este trabalho foi aprovado pelo comitê de ética em pesquisa (CEP) em 25/06/2004 sob o protocolo 481.
As laringes foram coletadas durante as autópsias de rotina e fixadas em formaldeído 4%. Posteriormente, foram seccionadas em pontos acima e abaixo da cavidade glótica numa distância de 3cm de um ponto a outro. Este fragmento, contendo as PV, sofreu cortes frontais paralelos sendo processado para inclusão em parafina.
Para a análise morfométrica realizou-se imunohistoquímica para linfócitos B e T, macrófagos e células dendríticas foliculares, que foram quantificados através do programa KS300 (KONRON-ZEISS, Alemanha). Para os métodos imunohistoquímicos foram utilizados os anticorpos primários Anti-B-Cells (Biogenex, EUA), Anti-CD3 (Dako, EUA), Anti-CD68 (Dako, EUA) e Anti-Follicular Dendritic Cells (Dako, EUA). As lâminas foram desparafinizadas em xilol e hidratadas em escalas decrescentes de álcoois. Na recuperação antigênica utilizou-se tampão citrato a 97°C para os anticorpos Anti-B-Cells, Anti-CD68 e Anti-Follicular Dendritic Cells e Tripsina à temperatura ambiente para o anticorpo Anti-CD3. A lavagem das lâminas foi feita com o tampão PBS 0,05M + Triton X-100 0,05%. Todos os anticorpos foram incubados por um tempo médio de 12 horas e o anticorpo secundário, por cerca de duas horas. O complexo Avidina-Biotina (Dako, EUA) permaneceu em contato com os cortes por trinta minutos. O material foi incubado com a 3'3 Diaminobenzidina (DAB) para revelação e após contra coloração pela Hematoxilina as lâminas foram montadas em meio sintético com entelan.
Para análise estatística utilizou-se o programa Sigmastat. Na comparação entre dois grupos, quando as variáveis foram normais utilizou-se o teste "t" de Student e quando as variáveis foram não-normais o teste de Mann-Whitney. Foram consideradas estatisticamente significantes as diferenças em que a probabilidade de rejeição da hipótese de nulidade foi menor que 5% (0,05).
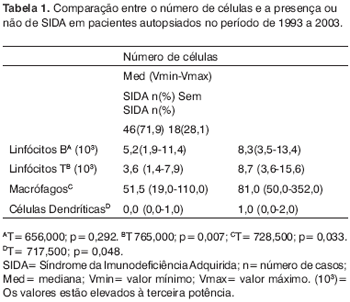
RESULTADOSForam analisadas 64 PV de adultos autopsiados. Dentre os pacientes estudados, 46 (71,87%) apresentaram diagnóstico de SIDA. Neste grupo 33 (51,6%) apresentaram como causa de morte infecção das vias aéreas superiores. Dos pacientes do grupo controle, 18 (28,1%) casos, 10 (15,6%) apresentaram como causa de morte infecção das vias aéreas superiores.
Ao se relacionar o número das células imunes entre os grupos de pacientes com SIDA e grupo controle, os pacientes com SIDA apresentaram menor número de linfócitos B (p=0,292) (Figuras 1 e 2), de linfócitos T (p=0,007) (Figuras 3 e 4), de macrófagos (p=0,033) (Figuras 5 e 6) e de células dendríticas (p=0,048) (Figuras 7 e 8) (Tabela1).
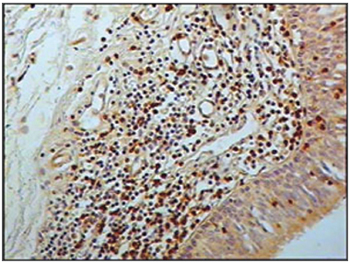
Figura 1 - Imunohistoquímica para linfócitos B nas pregas vestibulares - Paciente sem SIDA causa de óbito peritonite (PAP, 200X)
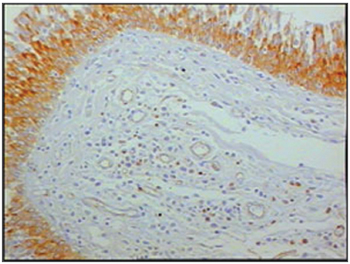
Figura 2 - Imunohistoquímica para linfócitos B nas pregas vestibulares - Paciente com SIDA com causa de óbito endocardite (PAPX200)
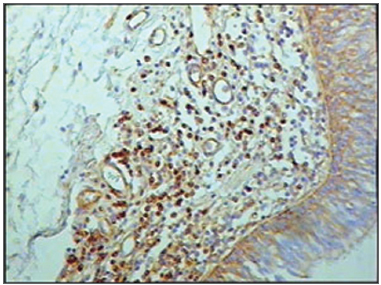
Figura 3 - Imunohistoquímica para linfócitos T nas pregas vestibulares - Paciente sem SIDA com causa de óbito peritonite (PAP X 200)
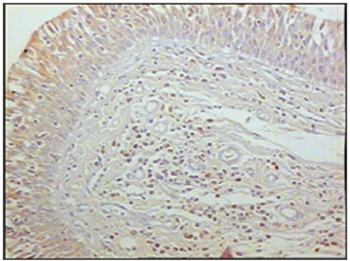
Figura 4 - Imunohistoquímica para linfócitos T nas pregas vestibulares - Paciente com SIDA com causa de óbito endocardite (PAP X200)
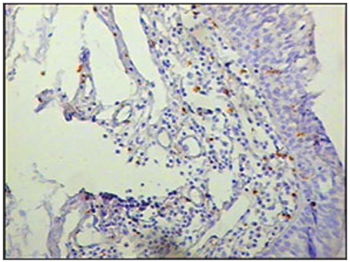
Figura 5 - Imunohistoquímica para macrófagos (CD68) nas pregas vestibulares - Paciente sem SIDA com causa de óbito peritonite (PAP X200)
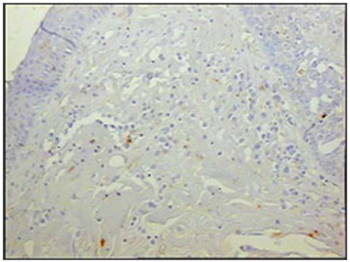
Figura 6 - Imunohistoquímica para macrófagos (CD68) nas pregas vestibulares - Paciente com SIDA com causa de óbito endocardite (PAP X200)
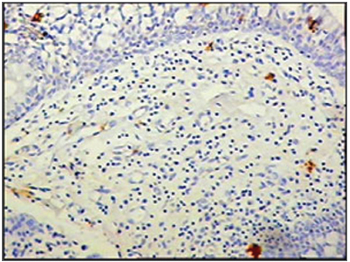
Figura 7 - Imunohistoquímica para células dendríticas foliculares (anti-FDC) nas pregas vestibulares - Paciente sem SIDA com causa de óbito peritonite (PAP X200)
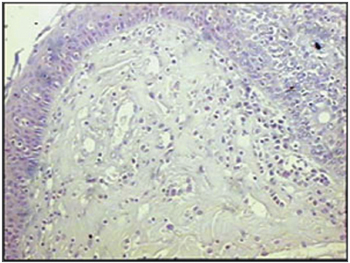
Figura 8 - Imunohistoquímica para células dendríticas foliculares (anti-FDC) nas pregas vestibulares - Paciente com SIDA com causa de óbito endocardite (PAP X200)
Nos pacientes com SIDA e com infecção respiratória o número de células mononucleares foi menor em comparação com os pacientes sem SIDA e com infecção respiratória. Em relação aos linfócitos T esta diferença foi estatisticamente significante (p=0,024) (Tabela 2).
Os pacientes com SIDA e com infecção respiratória apresentaram menor número de todos os tipos celulares quando comparados com pacientes com SIDA e sem infecção respiratória, sendo que esta diferença foi estatisticamente significante em relação aos linfócitos T (p=0,019) (Tabela 3).
DISCUSSÃOA SIDA se caracteriza por gradual depleção e disfunção de linfócitos T CD4 com conseqüente declínio da imunocompetência12,15. Neste estudo caracterizou-se imunohistoquimicamente a população de células mononucleares nos FL nas PV de adultos autopsiados tendo como doença de base SIDA.
Neste estudo observou-se que nos pacientes com SIDA o número de macrófagos, células dendríticas foliculares e linfócitos T e B estão diminuídos nos FL das PV comparados aos pacientes sem SIDA. O vírus da SIDA possui tropismo não só por linfócitos T, mas também por macrófagos, células de Langherans, células dendríticas foliculares e células endoteliais localizadas nos órgãos linfóides. A depleção destas células aumenta com a gravidade da infecção pelo vírus. Em estudos realizados em órgãos linfóides de pacientes com SIDA, em fase mais grave da doença, os FL e as amígdalas apresentavam acentuada depleção linfocitária e centros germinativos muito pouco evidentes ou inexistentes, estando estes achados de acordo com os encontrados neste estudo. Vários autores sugerem a possibilidade de ser o centro germinativo uma estrutura fundamental de replicação viral. A destruição das células dendríticas foliculares é um aspecto constante imunoarquitectural da linfadenopatia relacionada com a SIDA11,12. Este mesmo aspecto se repete neste estudo, mas desta vez nos FL das PV.
Em pacientes imunocompetentes as infecções pulmonares estão relacionadas com um aumento de células T e B nos FL nas PV16. No presente estudo os pacientes com SIDA, com infecção respiratória associada, apresentaram menor número total de células mononucleares quando comparados com os pacientes sem SIDA e quando comparados com pacientes com SIDA e sem infecção respiratória. Os linfócitos e as células do sistema mononuclear representam a principal reserva do vírus HIV. Estas células servem de reservatório para a persistência do vírus e sua transmissão11,12,17. Com a progressiva imunossupressão os centros germinativos desaparecem, aumentando a imunodepressão dos pacientes e ao mesmo tempo produzindo um aumento do vírus circulante com um agravamento da infecção de outros órgãos em pacientes com estágios avançados da doença9. Desta forma, a diminuição de células inflamatórias nos FL das PV em pacientes com infecção respiratória indica que as infecções associadas ocorrem nos pacientes com quadro de imunodepressão mais grave e que, por isto já apresentaram depleção de células nos FL das PV.
CONCLUSÃOEm nosso estudo demonstramos que os FL das PV são afetados pela infecção viral e representam com fidedignidade o estado imunológico de imunodepressão destes pacientes.
REFERÊNCIAS BIBLIOGRÁFICAS1. Kutta H, Steven P, Tillman BN, Kohla G, Paulsen FP. The human false vocal folds - an analysis of antimicrobial defense mechanisms. Anat Embryol 2002;205:315-23.
2. Kutta H, Steven P, Tillman BN, Tsokos M, Paulsen FP. Region-specific Immunological response of the different laryngeal compartments: Significance of larynx associated lymphoid Tissue. Cell Tissue Res 2003;311:365-71.
3. Kutta H, Steven P, Varoga, Paulsen FP. TFF peptides in the human false vocal folds of the larynx. Peptides 2004;25:811-8.
4. Mestecky J. The Common mucosal immune system and current strategies for induction of immune responses in external secretions. J Clin Immunol 1987;7(4):265-76.
5. McGhe JR, Mestecky J. In defense of mucosal surfaces. Development of novel vaccines for IgA responses protective at the portals of entry of microbial pathogens. Infect Dis Clin North Am 1990;4(2):315-41.
6. Mestecky J, McGhee JR. Prospects for human mucosal vaccines. Adv Exp Med Biol1992;327:13-23.
7. Kutta H, Steven P, Varoga, Paulsen FP. TFF peptodes in the human false vocal folds of the larynx. Peptides 2004;25:811-18.
8. Kracke A, Hiller AS, Tschernig T, Kasper M, Kleemann WJ, Troger HD, et al. Larynx-associated lymphoid Tissue (LALT) in Young Children. Anat Rec 1997;248(3):413-20.
9. Shacklett BL, Cox CA, Sandberg JK, Stollman NH, Jacobson MA, Nixon DF. Trafficking of human Immunodeficiency Virus 1-Specific CD8+ T cells to gut-associated lymphoid tissue during chronic infection. J Virology 2003;77(10):5621-31.
10. Dietrich C, Jecker P, Tschernig T, Mann WJ. Presence of dendritic cells, T lymphocytes, macrophages, B lymphocytes and glandular tissue in the human fetal larynx. Acta Otolaryngol 2004;124(7):833-8.
11. Lacerda MJF. Estudo do antígeno p24 em biópsias ganglionares de doentes infectadas pelos vírus da imunodeficiência humana HIV-1 e HIV-2. Rev FML 1999;4:81-6.
12. Navarrete ML, Ruiz JG, Pollan C, Céspedes R, Calderon R, Garcia M. Cambios morfológicos em el tejido adenoamigdalar como manifestación inicial de HIV em pacientes asintomáticos. Acta Otorrinolaringol Esp 2001;52:336-40.
13. Wolff AJ, O'Donnell AE. HIV- related pulmonary infections: a review of the recent literature. Curr Opin Pulm Med 2003 Mar;9(3):210-4.
14. Boytron RJ. Infections lung complications in patients with HIV/AIDS. Curr Opin Pulm Med 2005 May;11(3):203-7.
15. Cloyd MW, Chen JJY, Wang l. How does HIV cause AIDS? The homing theory. Mol Med Today 2000;6:108-11.
16. Rossi RC. Análise morfológica dos processos patológicos gerais nas pregas vestibulares [dissertação]. Uberaba (MG): Universidade Federal do Triângulo Mineiro; 2006.
17. Orenstein JM, Feinberg M, Yoder C, Schrager L, Mican J, Schwartzentruber DJ, et al. Lymph node architecture preceding and following 6 months of potent antiviral therapy: follicular hyperplasia persists in parallel with p24 antigen restoration after involution and CD4 cell depletion in an AIDS patient. Off J Inter Aids Soc 1999;13:2219-29.
1 Graduado em Biomedicina, Aluno de Pós-graduação em Nível de Mestrado.
2 Mestre em Patologia Geral, Aluno de Pós-graduação em Nível de Doutorado.
3 Doutora em Patologia Geral, Professor Adjunto do Departamento de Enfermagem da Universidade Federal de Goiás.
4 Doutora em Patologia Geral, Professor Adjunto da Disciplina de Patologia Geral da Universidade Federal do Triângulo Mineiro.
5 Doutor, Professor Titular da Disciplina de Patologia Geral da Universidade Federal do Triângulo Mineiro.
6 Pós-doutorado, Professor Adjunto da Disciplina de Patologia Geral da Universidade Federal do Triângulo Mineiro.
Universidade Federal do Triângulo Mineiro.
Endereço para correspondência: Eumenia Costa da Cunha Castro - Departamento de Ciências Biológicas Disciplina de Patologia Geral - Rua Frei Paulino 30 Centro Uberaba MG 38025-180.
Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG).
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 15 de fevereiro de 2007. cod 3676.
Artigo aceito em 23 de abril de 2007.


