INTRODUÇÃOO teste denominado detecção de gap é um método psicoacústico relativamente simples que mede a resolução temporal1-7. A habilidade auditiva de resolução temporal consiste no tempo mínimo requerido para segregar ou resolver eventos acústicos8,9.
No que se refere à localização do mecanismo fisiológico da resolução temporal, alguns autores sugeriram que as fibras do nervo auditivo teriam uma grande participação no processo5,10,11. Contudo, outros estudos revelaram que este processamento seria mais central12-26.
A resolução temporal depende da segregação de diferentes estímulos auditivos e o papel do início do estímulo e da precisão de codificação desta resposta é crucial19,24.
Os neurônios do córtex auditivo são particularmente sensíveis a estes estímulos iniciais transitórios, incluindo o início de eventos periódicos, a modulação incidente de outros sinais periódicos ou os eventos acústicos que ocorrem naturalmente nas vocalizações12.
Os neurônios do córtex auditivo primário respondem brevemente e transitoriamente ao início dos sons, independente da duração do sinal. São sensíveis à freqüência do som, bem como ao seu tempo de surgimento (ataque), o qual contribui significantemente para o espectro de curto-termo do início do sinal. A brevidade da resposta ao início do som é delineada pela resposta inibitória pós-início e pela adaptação neural15.
A precisão do primeiro disparo neural que responde ao início do som é proporcional à latência de resposta neural. Em um estudo com gatos, Phillips e Hall13 verificaram uma latência tão curta quanto 0,45 - 1,5ms para o primeiro disparo neural no córtex auditivo destes animais. Estes valores estão muito próximos aos observados no nervo coclear e núcleo coclear, indicando que a fidelidade temporal para respostas transitórias é preservada na via auditiva aferente até o córtex auditivo primário17,22.
Este grau de precisão no tempo de resposta dá suporte à resolução temporal nos limites da performance comportamental, sendo o córtex auditivo importante para esta tarefa. Além disso, este grau de precisão é capaz de representar o tempo de componentes foneticamente importantes dos sinais de fala13,16.
O córtex auditivo de humanos está localizado no lobo temporal. Ele é organizado com uma região central (core) de citoarquitetura koniocortical (células pequenas em todas as camadas; região altamente granular e altamente mielinizada), circundada por campos auditivos corticais menos granulares (belt). Esta região central constitui o córtex auditivo primário, que fica na região do giro transverso ou giro de Heschl, na face superior do lobo temporal27.
A região do giro de Heschl é altamente variável ao longo dos indivíduos e entre os dois hemisférios. Pode conter de um a três giros por hemisfério e o número de giros não é, necessariamente, igual em ambos os hemisférios28.
O córtex auditivo primário fica, aproximadamente, na metade do primeiro giro ou na metade do primeiro giro e parte do segundo giro; ele cobre, aproximadamente, os dois terços centrais do giro de Heschl25,28-30.
Muitos estudos evidenciaram a assimetria existente entre os giros de Heschl direito e esquerdo. O giro esquerdo é maior que o direito e, assim, o córtex auditivo primário esquerdo também é maior que o direito. Este aumento de volume no lado esquerdo é causado por um volume maior de substância cinzenta e de substância branca deste mesmo lado28,31,32.
O maior substrato neural (mais neurônios e mais interconexões intra e interhemisféricas) nestas estruturas anatômicas do hemisfério esquerdo provê a base para um melhor desenvolvimento de linguagem que as áreas menores do lado direito32.
A especialização do hemisfério esquerdo para a fala pode estar relacionada com a identificação de parâmetros acústicos específicos para a discriminação dos sons de fala. A capacidade de codificar e analisar aspectos temporais da informação acústica pode ter relação com a contribuição do hemisfério esquerdo para as funções de linguagem28.
Numerosos achados indicaram o papel preferencial do hemisfério esquerdo na análise dos aspectos temporais do estímulo acústico e é possível que as diferenças estruturais observadas entre os dois hemisférios delineiem esta capacidade diferencial28,33.
O trabalho de Zatorre e Belin33 investigou as diferenças funcionais entre os hemisférios direito e esquerdo, no que se refere ao córtex auditivo. Métodos de neuroimagem evidenciaram uma maior ativação do giro de Heschl em ambos os hemisférios, mas com maior resposta do lado esquerdo para tarefas temporais, enquanto mudanças espectrais causaram uma maior ativação do giro temporal superior em ambos os lados, com maior resposta do lado direito. Estas diferenças foram explicadas por meio de diferenças anatômicas. A maior mielinização do hemisfério esquerdo permite uma condução mais rápida, tornando este hemisfério mais sensível para mudanças acústicas rápidas. Ao mesmo tempo, um espaçamento maior das colunas corticais e conexões altamente intrínsecas no hemisfério esquerdo permitiriam uma integração ao longo das áreas organizadas tonotopicamente, levando a uma resolução espectral mais pobre. O inverso se aplica ao hemisfério direito, uma vez que os padrões estruturais favoreceriam uma alta resolução de freqüência, mas uma transmissão mais lenta.
Utilizando um teste de detecção de gap, Brown e Nicholls34 avaliaram a resolução temporal em adultos, bem como a assimetria perceptual entre as orelhas. O estímulo acústico foi composto por ruído de banda larga (74 dB NPS) de duração de 300ms. Quatro diferentes intervalos de gap foram inseridos: 2, 4, 6 e 8ms. Os autores encontraram respostas mais rápidas e acuradas na orelha direita (hemisfério esquerdo) do que na orelha esquerda.
Um estudo de Sulakhe et al.35 obteve resultados semelhantes. Foram usados dois tipos de ruído (branco e de banda estreita). A duração do estímulo foi de 300ms e os gaps de 3, 4 ou 5ms. Os autores observaram assimetria hemisférica com vantagem da orelha direita para o ruído branco e simetria hemisférica para ruído de banda estreita. A explicação para estes achados foi que as diferenças obtidas (simetria versus assimetria) seriam atribuídas aos parâmetros diversos dos estímulos empregados.
No entanto, outros autores não verificaram presença de assimetria perceptual entre as orelhas direita e esquerda, ou seja, não observaram vantagem da orelha direita sobre a esquerda em tarefas de processamento auditivo temporal/ resolução temporal36-38.
Sendo assim, o objetivo do presente trabalho foi determinar se existem diferenças de resposta (limiares de detecção de gap e porcentagem de acertos) entre as orelhas direita e esquerda para um teste de detecção de gap.
MATERIAL E MÉTODOO estudo foi aprovado pela Comissão de Ética para Análise de Projetos de Pesquisa (CAPPesq) (Nº protocolo 113/02 de 13/03/2002).
SujeitosForam avaliados 100 indivíduos adultos (de 18 a 31 anos), sendo 50 do gênero masculino (média de 24,72 anos) e 50 do gênero feminino (média de 23,77 anos). No que se refere à idade mínima, o sujeito mais novo do grupo masculino tinha 18 anos e do grupo feminino, 18,16 anos. Já a idade máxima foi de 31,5 anos para o grupo masculino e 31,83 anos para o grupo feminino (p=0,176).
A amostra não foi dividida com base na destreza manual, uma vez que existe prevalência de, aproximadamente, 90% de indivíduos destros na população. Além disso, sabe-se que 95% dos destros possui especialização hemisférica esquerda para a linguagem, assim como 70% dos canhotos39. Desta forma, mesmo que existissem na amostra indivíduos com especialização hemisférica direita, este número não seria suficiente para contaminar os resultados.
Material e ProcedimentosTodos os participantes foram informados sobre o caráter voluntário da investigação, sobre os objetivos da pesquisa, sobre os exames que seriam feitos e sobre a ausência de quaisquer riscos à saúde, durante os procedimentos, bem como sobre a divulgação dos resultados da pesquisa no meio científico. Caso concordassem com os itens expostos acima, deveriam, então, assinar o termo de consentimento para participação no estudo.
Após o consentimento para participar da pesquisa, foram realizados os seguintes procedimentos com todos os indivíduos: anamnese, audiometria tonal limiar, imitanciometria e teste dicótico de dígitos (como triagem básica do processamento auditivo40). Todos os sujeitos apresentaram limiares auditivos menores do que 20 dBNA em todas as freqüências avaliadas (0,25 a 8 KHz)41; curva timpanométrica tipo A e presença de reflexos acústicos ipsi e contralaterais42,43; acertos maiores ou iguais a 95% em cada orelha, no teste dicótico de dígitos44.
Em seguida, foi realizado o teste GIN, desenvolvido por Musiek em 200338,45. O teste foi aplicado por meio do audiômetro Interacoustic AC 40 acoplado a um CD player Sony, em cabina acústica, numa intensidade de 50 dB NS (de acordo com a média dos limiares auditivos em 500, 1000 e 2000 Hz de cada orelha). A condição de apresentação do teste foi sempre monoaural.
O teste GIN é composto por vários segmentos de ruído branco de 6 segundos, os quais contêm de 0 a 3 intervalos de silêncio (gaps) cada. Cada segmento de ruído é separado de outro por 5 segundos de silêncio (intervalo entre os estímulos) e as durações dos gaps apresentados são 2, 3, 4, 5, 6, 8, 10, 12, 15 e 20ms. Tanto a duração quanto a localização dos gaps dentro dos segmentos de ruído são pseudo-randomizados em relação à sua ocorrência. Existem dez itens para prática, que precedem o início dos itens para o teste. Cada um dos gaps de durações diferentes aparece por seis vezes em cada faixa-teste. O teste todo é composto por quatro faixas-teste38.
Cada orelha é avaliada separadamente e por duas vezes (duas faixas-teste aplicadas na orelha direita e duas na orelha esquerda). Para cada uma das faixas-teste, duas medidas são determinadas: limiar de detecção de gap (menor gap percebido pelo paciente, em pelo menos 50% das vezes em que foi apresentado, ou seja, três vezes, uma vez que cada gap aparece seis vezes em cada faixa-teste); e porcentagem de acertos por faixa-teste, ou seja, calcula-se quantos gaps, no geral, foram detectados.
A fim de descartar uma possível influência relacionada à orelha testada, os sujeitos foram divididos da seguinte forma: 50% realizaram o GIN iniciado pela orelha direita (25 sujeitos do gênero feminino e 25 do gênero masculino); e 50% realizaram o GIN iniciado pela orelha esquerda (25 sujeitos do gênero feminino e 25 do gênero masculino).
A análise estatística foi feita pelo teste ANOVA. O nível de significância assumido foi 0,05.
RESULTADOSSerão apresentados os resultados referentes às orelhas direita e esquerda dos 100 sujeitos, independente da orelha de início do teste. Como cada orelha foi avaliada por duas vezes, serão exibidas as 400 amostras coletadas, ou seja, 200 de orelha direita e 200 de orelha esquerda (Figura 1 A e B).

Figura 1. Limiares de detecção de gap das 400 amostras (em ms) - (A) orelha direita (B) orelha esquerda.
Nota-se, com base na Figura 1 A e B, que os limiares de detecção de gap foram muito semelhantes para ambas as orelhas. Além disso, observa-se que a maioria dos limiares apresentados ficou em torno de 4ms para ambas as orelhas.
Estes resultados ficam mais evidentes quando se aplica a análise estatística - ANOVA (Tabela 1).
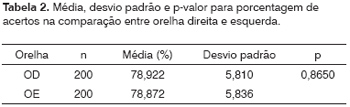
O mesmo padrão foi observado para a porcentagem de acertos, ou seja, semelhança dos resultados para orelha direita e esquerda (Figura 2 A e B; Tabela 2).
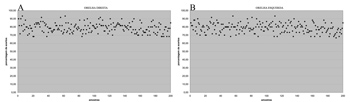
Figura 2. Porcentagem de acertos das 400 amostras (em %) - (A) orelha direita (B) orelha esquerda.
Na Figura 3, somente foram considerados os acertos em cada orelha para os intervalos de gap de 2 a 8ms. Pode-se notar que as porcentagens de acertos para estes intervalos de gap são semelhantes nas duas orelhas, não havendo prevalência de mais acertos em uma ou em outra orelha. A porcentagem de acertos para o intervalo de gap de 2ms ficou próxima a 4%. Para 3ms, esta porcentagem já ficou em torno de 20%. Em 4ms, os acertos aumentaram consideravelmente, chegando ao redor de 70%. Para intervalos de gap de 5 e 6ms, a porcentagem de acertos ultrapassou 90%, chegando em 100% para intervalos de gap de 8ms ou mais.
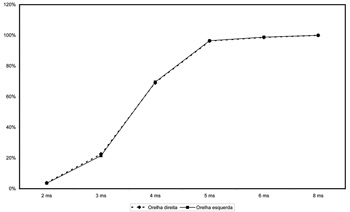
Figura 3. Porcentagem de acertos por intervalo de gap em cada orelha - (em %).
Com base nos resultados apresentados, pôde-se observar ausência de vantagem de uma orelha sobre a outra em todas as análises feitas (limiares de gap, porcentagem de acertos ou porcentagem de acertos por intervalo de gap).
Estes resultados não concordam com outros estudos da literatura, que apontam uma vantagem da orelha direita (hemisfério esquerdo) em tarefas de resolução temporal34,35. No entanto, concordam com os trabalhos de Efron et al.36, Baker et al.37 e Musiek et al.38, que não reportaram assimetria perceptual entre as orelhas para procedimentos de detecção de gap. Além disso, Baran e Musiek46 ressaltaram que testes monóticos são úteis para detectar alterações na via auditiva, mas não para localizar, uma vez que há a participação das vias ipsi e contralaterais, resultando em desempenho semelhante das orelhas direita e esquerda, nestes testes.
Muitos autores sugeriram o papel preferencial do hemisfério esquerdo na análise dos aspectos temporais do estímulo acústico28,33.
O presente estudo não constatou vantagem de nenhuma orelha (ou nenhum hemisfério) na tarefa de detecção de gap. Entretanto, algumas considerações devem ser feitas.
Os trabalhos de Brown e Nicholls34 e de Sulakhe et al.35 reportaram vantagem da orelha direita sobre a esquerda, enquanto os trabalhos de Efron et al.36, Baker et al.37 e Musiek et al.38 não encontraram assimetria entre as orelhas.
Brown e Nicholls34 e Sulakhe et al.35 utilizaram como forma de análise o tempo de reação à presença do gap. Além disso, o primeiro estudo avaliou a taxa de falso-alarme e o segundo, a porcentagem de acertos. O tempo de reação não foi testado no presente estudo e nem nos estudos de Efron et al.36 e Baker et al.37 e este fato pode explicar, em parte, a diferença entre os achados. Se o hemisfério esquerdo possui maior substrato neural32, então pode-se esperar que a resolução temporal seja mais rápida na orelha direita, como verificado pelos autores citados.
A forma de resposta utilizada nos referidos estudos foi o procedimento "sim ou não", enquanto Efron et al.36 e Baker et al.37 usaram o procedimento 2AFC (two-alternative forced-choice, ou escolha forçada entre dois estímulos), além de parâmetros de análise diferentes, a função psicométrica (porcentagem de acertos por intervalo de gap), que também foi empregada no presente estudo.
Talvez os limiares de gap e a porcentagem de acertos mascarem a vantagem da orelha direita sobre a esquerda e esta característica fique mais evidente na análise do tempo de reação.
Em resumo, os diferentes parâmetros aplicados em todas estas investigações, incluindo a atual, podem explicar os achados diversos sobre a assimetria perceptual entre orelhas direita e esquerda para a resolução temporal. Porém, isto não significa que não haja vantagem do hemisfério esquerdo para tarefas deste tipo, mas sim que alguns procedimentos são insuficientes para avaliar esta diferença. Além disso, deve-se considerar que, em situações de avaliação monótica, as vias ipsi e contralaterais são ativadas e, portanto, não deve existir vantagem de nenhuma orelha.
É importante comentar também que outras áreas corticais, além do córtex auditivo primário, podem participar do processamento auditivo de estímulos rápidos e, sem investigações mais detalhadas sobre o assunto, conclusões mais definitivas não podem ser feitas47,48.
CONCLUSÃONão houve diferença entre as orelhas direita e esquerda, com relação aos limiares de detecção de gap e à porcentagem de acertos, para este teste de detecção de gap (GIN - Gaps In Noise).
REFERÊNCIAS BIBLIOGRÁFICAS1. Phillips DP, Taylor TL, Hall SE, Carr MM, Mossop JE. Detection of silent intervals between noises activating different perceptual channels: some properties of "central" auditory gap detection. J Ac Soc Am 1997;101(6):3694-705.
2. Schulte-Körne G, Deimel W, Bartling J, Remschmidt H. Role of auditory temporal processing for reading and spelling disability. Perc Motor Sk 1998;86:1043-7.
3. Phillips DP, Hall SE, Harrington IA, Taylor TL. "Central" auditory gap detection: a spatial case. J Acoust S Am1998;103(4):2064-8.
4. Wiegrebe L, Krumbholz K. Temporal resolution and temporal masking properties of transient stimuli: data and an auditory model. J Acoust S Am1999;105(5):2746-56.
5. He N, Horwitz AR, Dubno JR, Mills JH. Psychometric functions for gap detection in noise measured from young and aged subjects. J Acoust S Am1999 106(2):966-78.
6. Florentine M, Buus S, Geng W. Psychometric functions for gap detection in a yes-no procedure. J Acoust S Am1999;106(6):3512-20.
7. Oxenham AJ. Influence of spatial and temporal coding on auditory gap detection. J Acoust S Am2000;107(4):2215-23.
8. Irwin RJ, Ball AKR, Kay N, Stillman JA, Rosser J. The development of auditory temporal acuity in children. Child Dev 1985;56(3):614-20.
9. Shinn JB. Temporal processing: the basics. Hear J 2003;56(7):52.
10. Giraudi-Perry DM, Salvi RJ, Henderson D. Gap detection in hearing-impaired chinchillas. J Acoust S Am 1982;72(5):1387-93.
11. Snell KB, Hu H. The effect of temporal placement on gap detectability. J Acoust S Am 1999;106(6):3571-7.
12. Phillips DP. Effect of tone-pulse rise time on rate-level functions of cat auditory cortex neurons: excitatory and inhibitory processes shaping responses to tone onset. J Neurophysiol 1988;59(5):1524-39.
13. Phillips DP, Hall SE. Response timing constraints on the cortical representation of sound time structure. J Acoust S Am 1990;88(3):1403-11.
14. Phillips DP, Sark S. A. Separate mechanisms control spike numbers and inter-spike intervals in transient responses of cat auditory cortex neurons. Hear Res 199;53:17-27.
15. Phillips DP. (1993a) Neural representation of stimulus times in the primary auditory cortex. An NY Acad Sci 1993;682:104-18.
16. Phillips DP. (1993b) Representation of acoustic events in the primary auditory cortex. J Exp Psychol 1993;19(1):203-16.
17. Phillips DP. Central auditory processing: a view from auditory neuroscience. Am J Otol 1995;16(3):338-52.
18. Eggermont JJ. Firing rate and firing synchrony distinguish dynamic from steady state sound. Neuroreport 1997;8(12):2709-13.
19. Horikawa J, Hosokawa Y, Nasu M, Taniguchi I. Optical study of spatiotemporal inhibition evoked by two-tone sequences in the guinea pi auditory cortex. J Comp Physiol 1997;181:677-84.
20. Kilgard MP, Merzenich MM. Distributed representation of spectral and temporal information in rat primary auditory cortex. Hear Res 1999;134:16-28.
21. Eggermont JJ. Neural responses in primary auditory cortex mimic psychophysical, across-frequency-channel, gap-detection thresholds. J Neurophysiol 2000;84:1453-63.
22. Heil P. Representation of sound onsets in the auditory system. Audiol Neurootol 2001;6:167-72.
23. Rupp A, Gutschalk A, Hack S, Scherg M. Temporal resolution of the human primary auditory cortex in gap detection. Neuroreport 2002;13(17):2203-7.
24. Sugimoto S, Hosokawa Y, Horikawa J, Nasu M, Taniguchi I. Spatial focusing of neuronal responses induced by asynchronous two-tone stimuli in the guinea pig auditory cortex. Cortex Cerebral 2002;12(5):506-14.
25. Hall DA, Hart HC, Johnsrude IS. Relationships between human auditory cortical structure and function. Audiol Neurootol 2003. 8(1):1-18.
26. DeWeese MR, Wehr M, Zador AM. Binary spiking in auditory cortex. J Neurosci 2003;23(21):7940-9.
27. Hackett TA, Preuss TM, Kaas JH. Architectonic identification of the core region in auditory cortex of macaques, chimpanzees, and humans. J Comp Neurol 2001;441:197-222.
28. Penhune VB, Zatorre RJ, MacDonald JD, Evans AC. Interhemispheric anatomical differences in human primary auditory cortex: probabilistic mapping and volume measurement from magnetic resonance scans. Cereb Cortex 1996;6(5):661-72.
29. Rupp A, Hack S, Gutschalk A, Schneider P, Picton TW, Stippich C, Scherg M. Fast temporal interactions in human auditory cortex. Neuroreport 2000;11(17):3731-6.
30. Kass JH, Hackett TA. Subdivisions of auditory cortex and processing streams in primates. Proc Nat Acad Sci USA 2000;97(22):11793-9.
31. Rubens AB. Anatomical asymmetries of human cerebral cortex. Em: Harnad S, Doty RW, Goldstein L, Jaynes J, Krauthamer G. Lateralization in the nervous system. New York: Academic Press; 1977. p. 503-16.
32. Musiek FE, Reeves AG. Asymmetries of the auditory areas of the cerebrum. J Am Acad Audiol 1990;1:240-5.
33. Zatorre RJ, Belin P. Spectral and temporal processing in human auditory cortex. Cereb Cortex 2001;11(10):946-53.
34. Brown S, Nicholls MER. Hemispheric asymmetries for the temporal resolution of brief auditory stimuli. Percep Psychophys 1997;59(3):442-7.
35. Sulakhe N, Elias LJ, Lejbak L. Hemispheric asymmetries for gap detection depend on noise type. Brain Cogn 2003. 53(2):372-5.
36. Efron R, Yund EW, Nichols D, Crandall PH. An ear asymmetry for gap detection following anterior temporal lobectomy. Neuropsychol 1985. 23(1):43-50.
37. Baker RJ, Rosen S, Godrich A. No right ear advantage in gap detection. Speech, Hearing and Language (UCL work in progress) 2000. 12:57-69.
38. Musiek FE, Shinn JB, Jirsa R, Bamiou DE, Baran JA et al. GIN (Gaps-In-Noise) Test Performance in Subjects with Confirmed Central Auditory Nervous System Involvement. Ear Hear 2005;26 (6):608-18.
39. Previc FH. A general theory concerning the prenatal origins of cerebral lateralization in humans. Psychol Rev 1991;98(3):299-334.
40. Jerger J, Musiek FE. Report of the consensus conference in the diagnosis of auditory processing disorders in school-aged children. J Am Acad Audiol 2000;11(9):467-74.
41. Yantis PA. Avaliação dos limiares auditivos por via aérea. Em:Katz J. Tratado de Audiologia Clínica. São Paulo: Ed. Manole; 1999. Capítulo 7.
42. Hall JW, Chandler D. Timpanometria na audiologia clínica. Em: Katz J. Tratado de Audiologia Clínica. São Paulo: Ed. Manole; 1999. Capítulo 20.
43. Northen JL, Gabbard SA. Reflexo acústico. Em: Katz J. Tratado de Audiologia Clínica. São Paulo: Ed. Manole; 1999. Capítulo 21.
44. Santos MFC. Processamento auditivo central: teste dicótico de dígitos em crianças e adultos normais [tese]. São Paulo:Escola Paulista de Medicina (Unifesp); 1998.
45. Musiek FE, Zaidan EP, Baran JA, Shinn JB, Jirsa RE. Assessing temporal processes in adults with LD: the GIN test. Em: Convention of American Academy of Audiology. 2004 March - April, Salt Lake City. Annals... Salt Lake City: AAA, p. 203, 2004.
46. Baran J, Musiek FE. Behavioral Assessment of the Central Auditory System. Em: Musiek FE, Rintelmann W (eds.) Contemporary Perspectives on Hearing Assessment. Boston: Allyn & Bacon; 1999. Capítulo 13.
47. Temple E, Poldrack RA, Protopapas A, Nagarajan S, Salz T, Tallal P, Merzenich MM. Disruption of the neural response to rapid acoustic stimuli in dyslexia: evidence from functional MRI. Proc Nat Acad Sci USA 2000;97(25):13907-12.
48. Buonomano DV, Karmarkar UR. How do we tell time? The Neuroscientist 2002;8(1):42-51.
1 Doutora em Ciências pela FMUSP, Docente do Curso de Fonoaudiologia da Universidade Guarulhos.
2 Livre-Docente, Docente do Curso de Fonoaudiologia da FMUSP.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 27 de dezembro de 2006. cod.3570
Artigo aceito em 29 de janeiro de 2007.


