INTRODUÇÃOO trato respiratório é constantemente exposto a diferentes tipos de agentes nocivos que entram em contato direto com a mucosa respiratória, como microorganismos e poluentes atmosféricos. Para a manutenção da homeostasia deste delicado e complexo sistema, o trato respiratório dispõe de um sofisticado mecanismo de defesa: o "aparelho mucociliar"1.
A mucosa das vias aéreas, desde as cavidades nasais até os bronquíolos respiratórios, é constituída de um epitélio pseudo-estratificado, cilíndrico ciliado, entremeado por glândulas submucosas e células caliciformes, que são os elementos celulares responsáveis pela produção do muco respiratório. Na cavidade nasal as glândulas seromucosas situam-se na submucosa e são as principais responsáveis pela produção de muco. Nos seios paranasais predominam as células caliciformes2.
O aparelho mucociliar tem como principal função a remoção de partículas ou substâncias potencialmente agressivas ao trato respiratório através do transporte pelos cílios, ou alternativamente, pela tosse e espirro, nos quadros de hiperprodução de muco, como rinite alérgica, rinossinusites, bronquite crônica, fibrose cística, e asma1.
Os cílios são os propulsores do transporte mucociliar. O número de cílios por célula varia de 50 a 100, sofrendo influência da idade e posição no trato respiratório. São compostos de um axonema clássico de nove pares de microtúbulos periféricos (A) e um central (B). Os pares periféricos são conectados aos pares vizinhos por dois braços de dineína, um interno e outro externo e conectado ao par central, também por meio de proteínas contráteis. A conexão entre o microtúbulo A e B, através dos braços internos e externos, mediada por ATP, provoca o deslocamento dos cílios e conseqüentemente o batimento ciliar. Em condições normais, os cílios da mucosa septal e dos cornetos inferiores batem a uma freqüência de 12-15 Hz (batimentos/segundo). O batimento ciliar apresenta uma seqüência coordenada, produzindo uma onda metacrônica, cujo mecanismo de controle permanece desconhecido. Esta onda metacrônica dirige o fluxo do muco nas cavidades nasais em direção à nasofaringe, posteriormente à orofaringe e hipofaringe, onde as secreções são deglutidas3.
Alterações ultra-estruturais dos cílios, como ausência dos braços internos ou externos de dineína, deleção ou transposição de pares de microtúbulos centrais ou periféricos, produzem alterações significativas na freqüência e padrão do batimento ciliar, as quais geram estase de secreções e infecções respiratórias de repetição, a exemplo das discinesias ciliares primárias4.
O batimento ciliar é extremante influenciado e dependente das propriedades viscoelásticas e de transporte do muco respiratório. O tapete que reveste o epitélio ciliado é composto pelo muco respiratório e fluido periciliar. O muco possui duas camadas: fase sol (aquosa) inferiormente e fase gel (viscosa) superiormente, com espessura variando entre 0.5 e 2.0µm. O fluido periciliar basicamente é composto por água cuja concentração é determinada por transporte ativo de Na e Cl através do epitélio respiratório. O batimento ciliar em sua fase inicial possui o componente de ação, onde o cílio passa pela fase sol com certa facilidade e posteriormente com a ponta do cílio, existe uma interação com fase gel, onde é proporcionado o estímulo mecânico para o transporte da camada de muco. Na fase de recuperação, o cílio dobra-se lateralmente voltando a sua posição original pela fase sol a fim de reiniciar um novo ciclo de batimento ciliar1. Existem na literatura, porém evidências de que o batimento dos cílios possa simplesmente ser realizado no sentido antero-posterior, ao contrário da teoria que os cílios dobram-se lateralmente na fase de recuperação4. O tapete de muco renova-se a cada 20 a 30 minutos, com velocidade média de 6mm/min, porém estes valores são muito variáveis mesmo em indivíduos normais3.
O muco nasal é uma complexa mistura de secreções provenientes das células caliciformes, glândulas submucosas, lacrimais e água. É ainda composto por células inflamatórias como macrófagos, basófilos, mastócitos e eosinófilos, cujas concentrações variam nos diferentes estados patológicos3. Também fazem parte da composição do muco nasal proteínas como a albumina, lactoferrina, glicoproteínas (mucinas de alto peso molecular), lisozimas e todas as principais imunoglobulinas. A IgA secretora e IgG correspondem a 50% do total das proteínas do muco nasal. Outras substâncias como eletrólitos, citocinas, interferons, leucotrienos, histamina, substância P e bradicinina também fazem parte da composição do muco nasal. Em condições patológicas existe uma intensa modificação na composição do muco, afetando de forma direta e indireta a função mucociliar, principalmente devido a alterações nas propriedades viscoelásticas do muco respiratório3.
O principal mecanismo de controle da secreção nasal é autonômico sendo que a estimulação parassimpática aumenta o volume das secreções. Apesar de este mecanismo ser basicamente mediado pela acetilcolina, a presença do peptídeo intestinal vasoativo (VIP) sugere a existência de mecanismos não mediados por acetilcolina3.
Em virtude da importância que as alterações no transporte mucociliar produzem na fisiologia das vias aéreas, torna-se fundamental o desenvolvimento e utilização de métodos que permitam análise tanto experimental como com aplicabilidade clínica dos três principais componentes do transporte mucociliar:
1) freqüência e padrão de batimento ciliar,
2) propriedades físicas e de transportabilidade do muco respiratório,
3) interação entre os cílios e camada de muco sobrejacente.
REVISÃO DA LITERATURA
Métodos de estudo da freqüência e padrão de batimento ciliar
Técnica VideoscópicaConsiste em uma modificação da técnica inicialmente descrita por Braga et al.5, na qual objetiva-se a aferição da freqüência do batimento ciliar (FBC) em preparações experimentais "ex vivo". Com auxílio de um microscópio óptico no aumento de 100 vezes, conectado a uma câmara e a um monitor de vídeo, foca-se um grupo de células ciliadas que se deseja estudar. Uma luz estroboscópica é colocada em frente ao epitélio ciliado, emitindo flashes de luz com freqüência variando de 0-30 Hz. A luz incidente emitida pela fonte de luz é refletida pelo epitélio ciliar e a fina cada de muco que o reveste. Esta reflexão é cíclica, em virtude das mudanças de direção dos cílios. Por controle manual é possível definir a FBC quando a freqüência de disparos dos flashes torna-se idêntica a FBC, não se podendo mais identificar a movimentação na superfície do epitélio.
A técnica videoscópica tem aplicabilidade em preparações "ex vivo", como o palato de rã, ou fragmentos de espécimes cirúrgicos de mucosa respiratória de seres humanos. O emprego da luz estroboscópica em broncoscópios para análise da FBC "in vivo" já foi tentado por alguns autores6, porém tiveram pouca aplicabilidade clínica em virtude de dificuldades técnicas. Apresenta como desvantagem a necessidade de avaliação em parte subjetiva da FBC.
VideomicroscopiaA análise de FBC "ex vivo" também pode ser realizada através da avaliação de gravações de microscopias ópticas de fragmentos de epitélio ciliado, com câmeras de vídeo de alta velocidade (Digital High Speed Video - DSHV), que proporcionam a obtenção de centenas de poses por segundo. Chilvers et al.4 desenvolveram a medida da FBC com auxílio de uma câmera capaz de captar 400 poses por segundo que proporciona a visualização do epitélio em visão superior, anterior e lateral, ao contrário dos métodos anteriormente desenvolvidos, que permitiam apenas uma visão superior do epitélio. Conseguiram através deste método não somente mensurar a FBC, como verificar o padrão de batimento em diversas alterações do axonema ciliar nas discinesias primárias. Constitui um método mais confiável de análise da FBC, já que em alterações como a transposição de pares de microtúbulos, os cílios possuem FBC normal, porém com padrão de batimento circular, ineficaz para o clearance das secreções, que poderiam ser ignoradas pelos métodos videoscópicos.
Estudo do muco - Coleta do muco nasalA primeira dificuldade no estudo do muco respiratório é a falta de métodos simples e pouco invasivos que proporcionem a obtenção de quantidades suficientes das secreções respiratórias. Podemos obter amostras do muco da cavidade nasal por meio de sondas de aspiração traqueal, cuidadosamente posicionadas junto ao assoalho ou próximas a parede lateral. Devemos utilizar o mínimo de vácuo possível, que permita a coleta das amostras com pouca agitação do muco, no intuito de prevenir a desnaturação das proteínas e incorporação de bolhas de ar7. Ainda podemos utilizar escovas de citologia esfoliativa, que apresentam como desvantagem a coleta de pequenas quantidades de muco8.
Amostras também podem ser obtidas com paciente sob anestesia geral, antes da realização de procedimentos cirúrgicos, o que proporciona a coleta de maiores quantidades de muco sem desconforto ao paciente. É necessária a verificação da não utilização de medicações anticolinérgicas como a atropina, que alteram as propriedades do muco respiratório.
PROPRIEDADES FÍSICAS DO MUCO
ReologiaO muco respiratório é um fluido não-newtoniano e suas propriedades mecânicas mudam de acordo com a intensidade e freqüência da força aplicada. Sendo assim, torna-se de fundamental importância a análise da influência da freqüência dos estímulos sobre as amostras de muco. Estímulos de baixa freqüência (1 e 10 radianos/segundo) refletem como o muco reage ao ser transportado pelo cílio, e estímulos de alta freqüência (100 radianos/segundo) simulam o estímulo pela tosse e espirro. O microrreômetro magnético descrito por King e Macklem9 e modificado por Silveira et al.10 representa um elegante método desenvolvido para análise de micro-amostras de muco (Figura 1). É baseado na medida do deslocamento de uma pequena esfera de aço imersa em uma amostra de muco, que se move sob a influência de um campo eletromagnético de padrão oscilatório sinussoidal. A amostra de muco é colocada em um porta-espécime de vidro, que é posicionado em um vão existente na toróide eletromagnética do microrreômetro, montado em uma plataforma de um microscópio de projeção. A sombra da esfera de aço em movimento é projetada sobre um par de fotocélulas fornecendo um sinal elétrico proporcional ao deslocamento da esfera. Os sinais elétricos da corrente alternada da toróide e do par de fotocélulas são captados por um osciloscópio digital e analisados "off-line" por um microcomputador compatível com sistema IBM1.
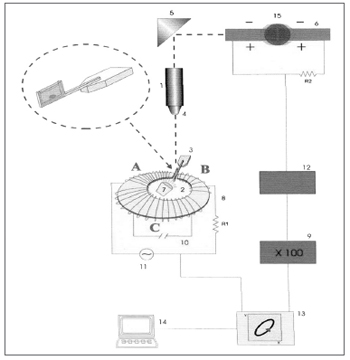
Figura 1. Representação esquemática do microrreômetro magnético. 1) Fonte de luz, 2) Toróide, 3) Porta Espécime, 4) Objetiva do microscópio, 5) Jogo de espelhos, 6) Par de fotocélulas, 9) Amplificador, 13) Osciloscópio, 14) Microcomputador, 15) Microesfera de aço em movimento. Fonte: Nakagawa et al., 2000.
A esfera em movimento inserida na amostra de muco age como um probe reológico, já que o seu movimento é oposto por forças elásticas e viscosas. Determinando-se o lapso de tempo entre a aplicação da força e deformidade resultante é possível à decomposição da impedância total do sistema em elementos elásticos e viscosos separadamente.
Os resultados da análise reológica são expressos em logG*, que representa a soma vetorial da viscosidade e elasticidade, refletindo a impedância total do sistema e tandel, representando a razão entre viscosidade e elasticidade. G* e tandel afetam o transporte do muco de maneira diferente. Em termos gerais, a transportabilidade das amostras diminui com o aumento do logG* (impedância total)11-13. Existe um valor ótimo para a tandel, como atestado por Puchelle et al.14, onde o transporte das secreções é realizado de forma mais otimizada.
Adesividade e HidrofobicidadeAlém das propriedades reológicas, outras características como a adesividade e hidrofobicidade, representam propriedades físicas fundamentais para o transporte do muco, principalmente pelos estímulos de alta freqüência, como a tosse e espirro.
A adesividade caracteriza as forças de atração entre uma superfície aderente e um sistema adesivo1. No sistema respiratório, o transporte mucociliar envolve a interação de superfícies do epitélio respiratório e da camada de muco, sendo que durante a tosse estas forças de atração somadas às forças de interface entre a fase sol e gel do muco respiratório controlam a eficácia do transporte mediado pela tosse. Em outras palavras, a adesividade corresponde à força necessária para se alcançar à separação entre o fluido adesivo (muco) e a superfície aderente (epitélio respiratório).
A hidrofobicidade caracteriza a habilidade de fluido em se espalhar em uma superfície plana sólida e lisa e isenta de cargas eletrostáticas. Este fenômeno ocorre devido à existência de uma interação finita entre a superfície sólida e as moléculas do fluido. O grau de hidrofobicidade pode ser determinado pela medida do "ângulo de contato" entre a tangente da interface líquido/ar e o plano horizontal14.
O ângulo de contato é visualizado por meio de uma lupa com aumento de 25 vezes, acoplada a um goniômetro com escala angular de 0 a 180o (Figura 2). A superfície de medida é tratada com ácido sulfocrômico que remove as cargas eletrostáticas e o sistema é mantido umidificado com vapor de água a 37º C.
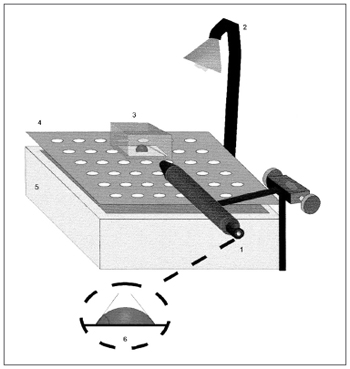
Figura 2. Representação esquemática da medida do ângulo de contato. 1) Lupa acoplada ao goniômetro, 2) Fonte de Luz, 3) Câmara de acrílico, 4) Plataforma fenestrada, 5) Reservatório de água, 6) Representação da medida do ângulo de contato. Fonte: Nakagawa et al., 2000.
Amostras de muco com um baixo ângulo de contato tendem a apresentar um melhor transporte pela tosse15.
Análise da composição bioquímica do mucoA composição bioquímica do muco respiratório pode alterar de maneira significativa suas características viscoelásticas, sendo que em condições normais o organismo tende a produzir um muco com viscoelasticidade ótima para ser transportado16.
A concentração de mucinas ou glicoproteínas do muco como a fucose, produzidas pelas glândulas submucosas e células caliciformess, e da IgG, derivada em parte de produção local e outra da porção sérica, parecem ser o principal fator determinante tanto da viscosidade quanto da elasticidade das amostras. Correspondem a aproximadamente 73% da variação dos parâmetros reológicos na rinossinusite crônica. Já na bronquite crônica e fibrose cística os principais responsáveis pelo aumento da viscoelasticidade são o DNA derivado dos neutrófilos e a Actina-F. Apesar de não se conhecer exatamente os mecanismos como a IgG aumenta a viscoelasticidade, o controle de processos inflamatórios diminui a viscoelasticidade em paralelo à queda dos níveis de IgG no muco17.
As glicoproteínas do muco são formadas por associação término-terminais ligadas por pontes de dissulfeto, tornando-se macro-moléculas muito grandes. Outras ligações intermoleculares como pontes iônicas, pontes de hidrogênio e forças de Van der Waal's contribuem para a formação de redes de glicoproteínas que também participam na determinação das propriedades viscoelásticas do muco respiratório. Porções de moléculas de DNA também podem se ligar as glicoproteínas através destas pontes, fazendo com que a viscoelasticidade seja determinada não somente pela quantidade de glicoproteínas, mas também por outras estruturas conectadas a elas através de diferentes ligações intermoleculares18.
A quantificação das glicoproteínas e seus subtipos, como descrito por Majima et al.18, pode ser feita através da utilização de radioimunoensaio (ELISA), onde seu grupo desenvolveu anticorpos específicos para cada subtipo de glicoproteínas, derivada das diferentes células produtoras de muco.
Diferença de potencial elétrico transepitelial (DP)O transporte ativo de íons através do epitélio respiratório possui um importante papel na composição e volume do fluido periciliar. A secreção e absorção de água através do epitélio respiratório ocorrem de maneira passiva através de difusão, em resposta aos gradientes osmóticos locais criados por transporte ativo de íons. A secreção de Cl e absorção de Na gera uma diferença de potencial elétrico entre a superfície do epitélio e a submucosa podendo sob certas condições, levar ao deslocamento do fluido para o lúmen da via aérea ou em direção ao interstício respectivamente. A secreção ativa de íons age basicamente regulando a altura e composição do fluido periciliar permitindo que o batimento ciliar atinja o máximo de efetividade no transporte das secreções. A diferença de potencial elétrico entre a superfície da mucosa e a submucosa, representa a resultante do transporte iônico transepeitelial. Quedas no PD podem representar alterações neste transporte ou perda integridade do epitélio19.
Experimentalmente, a medida da diferença do potencial elétrico transepitelial, pode ser determinada utilizando-se uma preparação com traquéia de cão, onde um eletrodo posicionado na submucosa e o outro na superfície epitelial aferem a diferença de potencial, que geralmente situa-se ao redor de 30 mV (lúmen negativo)20.
Análise ex vivo do transporte mucociliar - Preparação do palato de rãA preparação do palato de rã constitui um conveniente sistema para o estudo do transporte mucociliar e da interação muco-cílio (Figura 3). A rã possui em seu palato um epitélio ciliado similar ao encontrado nas vias aéreas de mamíferos, podendo ser utilizado como método de estudo de transporte de diferentes amostras de muco ou medidas de ativação ou inibição ciliar1.

Figura 3. Representação esquemática da preparação do palato de rã: 1) Lupa, 2) Fonte de luz, 3) Suporte para o palato da rã, 4) Nebulizador Ultrassônico, 5) Câmara acrílica, 6) Visão do palato de rã sob a objetiva reticulada. Fonte: Nakagawa et al., 2000.
A velocidade de transporte de uma amostra de muco posicionada sobre a superfície lisa e plana do palato da rã é medida com o auxílio de um microscópio estereoscópico com objetiva reticulada21,22. A velocidade de transporte das amostras testadas é posteriormente comparada com a do muco da própria rã, e os resultados são expressos em termos de velocidade relativa (muco testado/muco da rã). Os experimentos são realizados à temperatura ambiente (20ºC), com os espécimes mantidos em uma câmara acrílica com 100% de umidade. Sob estas condições experimentais, a preparação do palato de rã é considerada ideal tendo como variáveis relevantes apenas propriedades físicas do muco1.
Análise in vivo do transporte mucociliar - Teste da sacarinaAs primeiras tentativas de se mensurar a função mucociliar nasal in vivo foram realizadas por Martius em 1884 através de estroboscopia. Porém, não obteve muita aplicabilidade clínica em virtude da dificuldade de manuseio do equipamento.
Na tentativa de simplificar a análise do clearance mucociliar, Hilding23 e Tremble24 nas décadas de 30 e 40, respectivamente, introduziram corantes nas fossas nasais de pacientes e mediram o tempo em que o mesmo era visualizado na orofaringe. Como em muitos casos a visualização dos corantes não era fácil, Andersen25 em 1974 desenvolveu o teste da sacarina associado a corantes de alimentos, com o intuito de aumentar as sensibilidade do teste. Nesta preparação, uma pequena partícula de sacarina sódica em conjunto com o corante era colocada atrás da cabeça do corneto inferior e o paciente informava quando sentia o sabor doce ou era visualizado o corante na faringe. Contudo, como a sacarina sódica é altamente solúvel em água, Deitmer26 afirmou que a mesma poderia interferir na composição do fluido periciliar, alterando o clearance do muco. Na tentativa de anular este fator de erro, associaram a sacarina a uma resina aniônica, diminuindo sua solubilidade na água. Em indivíduos normais, os valores do teste variaram de 3 min e 30s a 19 min e 15s, com valor médio de 10 min e 12,5s.
Em virtude da subjetividade do teste de sacarina, métodos mais sofisticados foram desenvolvidos. Proctor e Wagner em 196527 utilizaram o I131 como marcador e mensuraram o seu deslocamento pela cavidade nasal através de uma gama-câmara, contudo Harper28 notou que o Tecnécio99m foi o isótopo radioativo mais adequado para o cálculo do transporte mucociliar.
Transporte pela tosse e espirro - Máquina simuladora de tosse e espirroEm indivíduos saudáveis o muco é primariamente transportado pelos cílios, porém em vários estados patológicos onde existe uma hiperprodução de muco, o clearance pela tosse e espirro assume um papel fundamental.
A tosse é caracterizada por uma inspiração de aproximadamente 2 litros de ar, com um rápido fechamento da glote e aumento da pressão pleural para 100cm H2O ou mais. Com a abertura da glote ocorre a liberação de um fluxo de ar bifásico com componente inicial rápido com duração de aproximadamente 30-50ms seguido de um componente mais lento, que viaja ao longo da traquéia parcialmente colapsada. O gás expirado atinge a camada de muco e transfere parte de sua energia cinética causando a movimentação do muco em direção a glote1.
A análise "in vitro" do transporte pela tosse e espirro utiliza um equipamento denominado "máquina simuladora de tosse", adaptado de King et al.29. É constituído de um reservatório de ar comprimido, que provê o fluxo de ar controlado por uma válvula solenóide, que é seguida por uma resistência que proporciona um fluxo turbulento semelhante à tosse e ao espirro1.
A traquéia é simulada por um cilindro acrílico com 4mm de diâmetro interno e 133mm de comprimento. A amostra de muco é posicionada com o auxílio de um estilete no início do tubo que é conectado ao sistema, sendo o seu deslocamento medido em milímetros com o auxílio de uma régua (Figura 4).
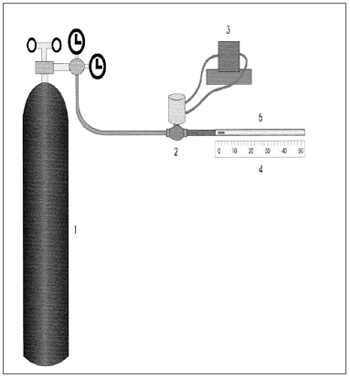
Figura 4. Representação esquemática da máquina simuladora de tosse e espirro: 1) Reservatório de ar comprimido, 2) Válvula solenóide, 3) Controlador da válvula solenóide, 4) Régua milimetrada, 5) Cilindro Acrílico. Fonte: Nakagawa et al., 2000.
O estudo do transporte mucociliar e interpretação dos testes previamente descritos requerem à compreensão que o transporte das secreções depende basicamente de três parâmetros:
1) Freqüência e padrão de batimento ciliar,
2) Propriedades viscoelásticas e de transportabilidade do muco respiratório, e
3) Interação entre o muco-cílio1. A avaliação do transporte mucociliar sem o conhecimento e consideração destes três parâmetros pode levar a conclusões equivocadas e mesmo a tratamentos inadequados quando os resultados obtidos são extrapolados para a prática clínica cotidiana.
O estudo da FBC através dos métodos videoscópicos e videomicroscópicos utiliza fragmentos de biópsias ou de esfregaços de células do epitélio respiratório realizando a mensuração de maneira "ex vivo". A técnica videoscópica se utiliza do princípio de que quando a freqüência dos disparos da luz estroboscópica se torna igual ao da FBC não se visualiza mais o movimento ondulatório na superfície do epitélio. É um método reproduzível, contudo depende de análises relativamente subjetivas, já que a mensuração depende da observação pessoal5,6. As técnicas de videomicroscopia avaliam a FBC de maneira mais precisa e propiciam a avaliação não somente da freqüência como do padrão de batimento ciliar4. Exigem equipamento caro e sofisticado ainda sendo restrito a protocolos de pesquisa. São técnicas que não avaliam a FBC "in vivo" e "in situ", não considerando os fatores locais e características do organismo a ser analisado como um todo.
As dificuldades da análise do muco respiratório já começam pela coleta do muco respiratório. A obtenção de secreções brônquicas através de broncoscópios ou sondas de aspiração traqueal requer procedimentos invasivos e necessidade de equipamento e pessoal especializado, além de constituírem fator considerável de morbidade ao paciente. Estas dificuldades fizeram com que a maioria dos estudos utilizasse o muco obtido por escarro, que possui como inconveniente à mistura das secreções com saliva da faringe e cavidade oral e a dificuldade na obtenção de controles que normalmente não apresentam expectoração espontânea de muco1.
A obtenção de muco nasal é mais simples de ser conseguida, porém apresenta problemas comuns ao da via aérea inferior como a dificuldade de coleta de amostras em quantidades suficientes principalmente de controles. A utilização de sondas de aspiração requer manuseio criterioso, já que pressões de sucção elevadas podem levar a desnaturação das proteínas do muco e alteração no comportamento biológico das amostras. Utilização de escovas de citologia pode ser uma alternativa, porém apresentam como inconveniente à obtenção de pequenas quantidades de muco.
No intuito de contornar as dificuldades do estudo do muco em humanos, o desenvolvimento de modelos animais tornou-se fundamental. Com a utilização de técnicas adequadas, ratos Wistar podem ser utilizados como excelente modelo animal, pois notoriamente são propensos ao desenvolvimento de uma doença inflamatória das vias aéreas, o que não se observa em ratos criados sob condições assépticas (Specific Patogen Free - SPF), proporcionando um modelo de estudo do muco respiratório sob condições normais e de doença30.
Dentre as medidas das propriedades físicas do muco respiratório, a análise reológica é a mais completa, pois informa os valores da viscoelasticidade das amostras, que são variáveis que influem tanto no transporte pelo cílio como pela tosse. Contudo, a análise reológica exige pessoal altamente especializado já que se trata de uma técnica de difícil realização, com equipamentos complexos, de difícil manuseio, cujas medidas de uma única amostra podem levar várias horas. Além disto, a interpretação dos resultados obtidos é um tanto complexa e depende da compreensão da mecânica de fluidos.
A medida do ângulo de contato traz como principal informação uma estimativa de como a amostra de muco avaliada será transportada pela tosse. Amostras com um baixo ângulo de contato tendem a ser mais bem transportada pela tosse com pouca influência no clearance pelo cílio. O ângulo de contato tem como correspondente reológico a medida da Tandel 100, já que amostras com valores elevados deste parâmetro apresentam menor ângulo de contato e maior deslocamento pela tosse1,14.
A análise dos componentes bioquímicos do muco respiratório tem ganhado destaque, devido à observação de que a presença e concentração de diferentes elementos, principalmente as glicoproteínas e imunoglobulinas, influem diretamente nas características reológicas e de transportabilidade das amostras. Estas observações abrem espaço para o desenvolvimento de novas drogas para o tratamento de quadros de hipersecreção de muco e melhor compreensão das ações farmacológicas das já existentes16-18.
A medida da diferença de potencial elétrico transepitelial reflete o grau de integridade do epitélio respiratório e possui aplicabilidade experimental, na pesquisa de como fatores agressores, tais como poluentes atmosféricos ou agentes infecciosos, interferem na homeostasia do mesmo. Apresenta resultados reprodutíveis e simplicidade de manejo do equipamento1.
A preparação do palato de rã constitui um excelente método de estudo do transporte do muco pelo cílio, devido à facilidade de realização da técnica e simplicidade do equipamento utilizado. A análise dos resultados proporciona obtenção de informações importantes e oferece uma estimativa de como determinadas amostras de muco são transportadas pela ação ciliar. Além disso, possui estreita correlação com parâmetros reológicos, principalmente com o LogG* 1 rad/s, que, segundo Puchelle22, reflete o modo como as amostras comportam-se no transporte pelo cílio. Contudo possui algumas limitações. Não avalia fatores presentes na situação "in vivo" que podem influir no transporte pelos cílios, como alterações anatômicas e composição do fluido periciliar. Com o intuito de se eliminar estes vieses, o desenvolvimento de testes "in vivo", como o da sacarina, associados ou não a corantes, e mesmos os com radioisótopos não se mostraram como a solução dos problemas. Apresentam ampla faixa de variabilidade no padrão de normalidade e dependem de avaliação subjetiva do paciente e do examinador, ou de equipamentos caros e com difícil aplicabilidade clínica. Apesar dos problemas apontados, possuem aplicabilidade clínica. São utilizados como triagem na pesquisa de discinesias ciliares, porém com sensibilidade e especificidade reduzidas, devendo sempre ser associados a métodos de análise da FBC e da ultra-estrutura do axonema ciliar para a confirmação diagnóstica23-28.
A "máquina simuladora de tosse e espirro", utilizada para o estudo do transporte do muco por estímulos de alta freqüência, constitui um método de realização simples e com resultados reprodutíveis. Além de informar como o muco testado é transportado pela tosse ou espirro, nos fornece estimativas relevantes do comportamento biológico destas amostras, quando submetidas à análise de suas propriedades físicas. O transporte pela tosse possui correlação positiva com a analise reológica da tandel 100 rad/s e negativa com a medida do ângulo de contato. Em outras palavras, quanto maior for a tandel 100 rad/s e menor o ângulo de contato, mais facilmente o muco é transportado pela tosse e espirro1,29.
COMENTÁRIOS FINAISAs disfunções no transporte mucociliar trazem desde queda na qualidade de vida dos pacientes, como nas rinites e rinossinusites crônicas, até graves conseqüências com risco de seqüelas irreversíveis e mesmo letais como nos casos de fibrose cística e das discinesias ciliares primárias. Desta forma, quando estivermos frente a um paciente com suspeita de distúrbios do clearance mucociliar torna-se fundamental o conhecimento do funcionamento normal do aparelho mucociliar e de como alterações em seus componentes (cílio, muco-fluido periciliar e interação dinâmica entre ambos) afetam o transporte das secreções respiratórias.
Os métodos citados nesta revisão nos fornecem informações valiosas sobre os diferentes aspectos do transporte mucociliar, sendo alguns de extrema facilidade de realização, já outros apresentam apenas aplicabilidade em protocolos de pesquisa em virtude de dificuldades técnicas e limitações financeiras. Há que se considerar ainda a inexistência de métodos que avaliem ambulatorialmente a FBC "in vivo" e "in situ", o que facilitaria os diagnósticos das discinesias ciliares evitando a realização de procedimentos mais invasivos para a sua confirmação diagnóstica.
Existem ainda muitas questões a serem respondidas em relação aos transtornos do transporte mucociliar, contudo os conhecimentos já adquiridos em virtude dos progressos científicos proporcionaram uma melhor compreensão de como os pacientes adoecem e favoreceram a instituição de tratamentos mais racionais dos distúrbios relacionados ao transporte mucociliar.
REFERÊNCIAS BIBLIOGRÁFICAS1. Machione M, Guimarães ET, Saldiva PH, Lorenzi Filho G. Methods for studying respiratory mucus and mucus clearance. Braz J Med Biol Res 1995;28:1347-55.
2. Jeffery PK, Gaillard D, Moret S. Human airway secretory cells during development and in mature airway epithelium. Eur Resp J 1992;5:93-104.
3. Lund VJ. Nasal physiology: Neurochemical receptors, nasal cycle, and ciliary action. Allergy Asthma Proc 1996;17(4):179-84.
4. Chilvers MA, Rutman A, O' Callaghan. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. J Allergy Clin Immunol 2003;112(3):518-24.
5. Braga PC, Allegra L, King M. Mathematically Analysis of Dynamic Measures. In: Gabelnick HL, Litt M (eds.). Rheology of Biological Systems. IL: Thomas Springfield; 1973, p. 119-57.
6. Wong LB, Miller IF, Yeates DB. Stimulation of Ciliary Beat Frequency by Autonomic Agonists: in vivo. J Appl Phisiol 1988;65:971-81.
7. Nakagawa NK, Macchione M, Petrolino MS, Guimarães ET, King M, Saldiva PH, Lorenzi-Filho G. Effects of a heat and moisture exchanger and heated humidifier on respiratory mucus in patients undergoing mechanical ventilation. Crit Care Med 2000;28:312-7.
8. Bossi R. Methods for Collecting and Measuring Mucus in Humans. In:Bragga PC, Allegra L (eds). Methods in Bronchial Mucology. New York: Raven Press; 1988. p. 13-20.
9. King M, MacKlem PT. Rheological properties of microliter quantities of normal mucus. J Appl Physiol 1977;42:797-802.
10. Silveira PS, Böhm GM, Yang HM, Wen CL, Guimarães ET, Parada MA, King M, Saldiva PH. Computer-assisted rheological evaluation of microsamples of mucus. Comput Methods Programs Biomed 1992;39:51-60.
11. Macchione M, King M, Lorenzi Filho G, Guimaraes ET, Zin WA, Bohm GM, Saldiva PH. Rheological determinants of mucociliary transport in the nose of the rat. Respir Physiol 1995;99:165-72.
12. King M. Interrelation between mechanical properties of mucus and mucociliary transport: effect of pharmacologic interventions. Biorheology 1979;16:57-68.
13. Lorenzi G, Böhm GM, Guimarães ET, Vaz MA, King M, Saldiva PH. Correlation between rheological properties and in vitro ciliary transport of rat nasal mucus. Biorheology 1992;29:433-40.
14. Puchelle E, Zahm JM, Jaquot J, Plotkowski C, Duvivier C:A simple technique for measuring adhesion properties of human bronchial secretions. Eur J Respir Dis 1987;71:281-2.
15. Albers GM, Tomkiewicz RP, May MK, Ramirez OE, Rubin BK. Ring distraction technique for measuring surface tension of sputum: relationship to sputum clearability. J Appl Physiol 1996;81:2690-5.
16. Shinogi J, Harada T, Nonoyama T, Kishioka C, Sakakura Y, Majima Y. Quantitative Analysis of Mucin and Lecitin in Maxillary Sinus Fluids in Patients with Acute and Chronic Sinusitis. Laryngoscope 2001;111:240-5.
17. Majima Y, Harada T, Shimizu T. Effect of Biochemical Components on Rheological Properties of Nasal Mucus in Chronic Sinusitis: American J Respir Crit Care Med 1999;160:421-6.
18. Majima Y. Mucoactive Medications and Airway Disease. Paediatric Resp Reviews 2002;3:104-9.
19. Boucher RC. Human Airway Ion Transport. American J Respir Crit Care Med 1994;150:271-81.
20. Knowles MR, Carson JL, Collier AM, Gatzy JT, Boucher RC. Measurements of Nasal Transepithelial Electric Potential Difference in Normal Human Subjects in vivo. Am Rev Respir Dis 1981;124:484-90.
21. Rubin BK, Ramirez O, King M. Mucus-depleted frog palate as a model for the study of the mucociliary clerance. J Appl Physiol 1990;69:424-9.
22. Puchelle E, Zahm JM, Sadoul P. Mucociliary frequency of frog palate epithelium. Am J Physiol 1990;242:31-5.
23. Hilding A. Ciliary Activity and Course of Secretion Currents in the Nose. Proc Mayo Clin 1931; 6:825.
24. Tremble GE. Clinical Observations in The Movement of Nasal Cilia. An Experimental Study. Laryngoscope 1948;58:206.
25. Andersen I, Lundqvist G, Proctor DF. Human Nasal Function in a Controlled Climate. Archs Envir Hlth 1971;23(6):408-20.
26. Deitmer TH. A Modification of The Saccharine Test for Nasal Mucociliary Clearance. Rhinology 1986;24:237-40.
27. Proctor DF, Wagner HN Jr. Clearance of Particles from the Human Nose. Archs Envir Hlth 1965;11:366.
28. Harper PV, Andros G, Lathrop KA. Preliminary Observations on the Use of the Six-Hours 99mTechnetium as a Tracer in Biology and Medicine. Argonne Cancer Research Hosp 1962;18:76.
29. King M, Brock G, Lundell C. Clearance of mucus by stimulated cough. J Appl Physiol 1985;58:1776-82.
30. Broderson JR, Lindsey JR, Crawford JE. The Role of Environmental Ammonia in Respiratory Mycoplasmosis of Rats. Am J Pathol 1976;85(1):115-30.
1 Pós-graduando, nível doutorado, Divisão de Clínica Otorrinolaringológica Hospital das Clínicas - Faculdade de Medicina da Universidade de São Paulo, Médico Otorrinolaringologista- Hospital do Servidor Público Estadual de São Paulo e Hospital Estadual de Bauru.
2 Professor Livre-Docente do Departamento de Otorrinolaringologia da Faculdade de Medicina de Universidade de São Paulo - FMUSP, Professor Associado do Departamento de Otorrinolaringologia da Faculdade de Medicina de Universidade de São Paulo - FMUSP. Chefe do grupo de Alergia em Otorrinolaringologia.
3 Doutor em Otorrinolaringologia pela Faculdade de Medicina de Universidade de São Paulo - FMUSP, Professor Doutor Colaborador - Departamento de Otorrinolaringologia da Faculdade de Medicina de Universidade de São Paulo - FMUSP. Grupo de Alergia em Otorrinolaringologia.
4 Doutor - Departamento de Cardiopneumologia, Disciplina de Pneumologia da Faculdade de Medicina de Universidade de São Paulo - FMUSP, Professor Doutor Colaborador - Departamento de Cardiopneumologia, Disciplina de Pneumologia da Faculdade de Medicina de Universidade de São Paulo - FMUSP.
5 PhD, Pesquisadora do Laboratório de Poluição Atmosférica Experimental, LIM-05 - Faculdade de Medicina da Universidade de São Paulo.
6 PhD,Pesquisadora do Laboratório de Poluição Atmosférica Experimental, LIM-05 - Faculdade de Medicina da Universidade de São Paulo.
7 Professor Titular do Departamento de Patologia da Faculdade de Medicina de Universidade de São Paulo - FMUSP.
Trabalho realizado na divisão de Clínica Otorrinolaringológica do Hospital das Clínicas da FMUSP, Laboratório de Poluição Atmosférica Experimental - FMUSP e Disciplina de Pneumologia do Hospital das Clínicas, FMUSP.
Endereço para correspondência: Dr. Sergio Henrique Kiemle Trindade - Rua Juréia 394 apto. 192 Chácara Inglesa São Paulo SP 04140-110.
Tel. (0xx11) 5572-3163 - E-mail: sktrindade@uol.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 10 de abril de 2006. cod. 1837.
Artigo aceito em 23 de junho de 2007.


