INTRODUÇÃOA otite média (OM) é definida como um processo inflamatório, infeccioso ou não, localizado focal ou generalizadamente na fenda auditiva1. É uma das doenças infecciosas mais comuns, com conseqüências relevantes para a saúde pública. Seu processo inflamatório pode levar à perda auditiva funcional, podendo gerar complicações graves2.
A classificação dos processos inflamatórios da orelha média, proposta por Bluestone & Kenna, em 1988, divide a otite média em supurativa e não-supurativa, sendo subdivididas, respectivamente, em aguda ou crônica e em serosa ou secretora3.
A otite média crônica (OMC) é definida como um processo inflamatório crônico, localizado na fenda auditiva, associado ou não a uma perfuração da membrana timpânica e otorréia. As alterações associadas a essa patologia podem ser resumidas em perfuração da membrana timpânica, alterações ossiculares, tecido de granulação, colesteatoma, granuloma de colesterol e timpanoesclerose1.
A OMC é classificada em otite média crônica colesteatomatosa (OMCC) e não-colesteatomatosa (OMCNC). A timpanomastoidectomia é o tratamento de escolha para esta doença podendo ser subdividida em timpanomastoidectomia de cavidade fechada e timpanomastoidectomia de cavidade aberta, sendo esta última geralmente utilizada para o tratamento das OMCC e algumas vezes para o tratamento de OMCNC por recidiva de tecido de granulação4.
Com a finalidade de assegurar-se o sucesso cirúrgico nas timpanomastoidectomias de cavidade aberta propõe-se a ampliação da abertura do intróito da orelha, permitindo um amplo acesso a neocavidade aberta, através da realização de uma generosa meatoplastia, que permitirá a ventilação, a fácil visualização e a limpeza da cavidade5-7.
A cavidade recém-criada através das timpanomastoidectomias de cavidade aberta geralmente é preenchida com tecido de algodão (gaze, cadarço ou fita cardíaca) untado em pomada antibiótica. Este tampão será removido em duas semanas, período no qual se estenderá a cobertura antibiótica sistêmica4. Este método de preenchimento da neocavidade com tecido de algodão foi por nós utilizado por vários anos. No início usávamos cadarço e nos últimos anos vínhamos sistematicamente utilizando a fita cardíaca. O grande problema da utilização da fita cardíaca ou similares acontecia no momento da sua remoção, pois na maioria das vezes observava-se a aderência do algodão à áreas cruentas de tecido ao nível do rebordo da meatoplastia ou da superfície óssea da neocavidade.
Propomos, assim, a utilização de um novo material biossintético, a biomembrana de látex natural, para forrar completamente toda a extensão da neocavidade, servindo como uma interface biocompatível entre a área cruenta de osso da neocavidade e o tecido de algodão utilizado para seu tamponamento. Este material biocompatível, que é retirado da seringueira Hevea brasiliensis, vem sendo pesquisado no departamento de Bioquímica da Faculdade de Medicina de Ribeirão Preto-USP desde 1994. Após a coleta, o látex é submetido à centrifugação visando diminuir a quantidade de proteínas nele presentes naturalmente, muitas delas responsáveis por reações alérgicas. Em seguida, adiciona-se uma suspensão de 4% de enxofre e 2% da resina polivinilmetiléter com o objetivo de conferir ao composto final elasticidade e resistência. A solução homogênea, assim formada, é colocada em placas de Petri, de vidro ou acrílica, previamente limpas e secas, onde se espalha o composto de látex até formar uma fina camada recobrindo a superfície da placa. Esse processo é desenvolvido sobre uma mesa plana e nivelada para evitar a formação de irregularidades no líquido que forra a placa. Em seguida, as placas são levadas à estufa equilibrada a uma temperatura de 60 graus centígrados por um período de 20 minutos, e, posteriormente, são esterilizadas em óxido de etileno. Assim, é formada uma membrana estéril que poderá ser utilizada em diferentes situações.
A biomembrana de látex possui uma estrutura similar às membranas celulares, sendo produzida quimicamente pela indução da polimerização do poli-isopreno endógeno na emulsão aquosa láctea por evaporação a baixa temperatura, onde ocorre a preservação da conformação nativa da proteinase uma reorganização dos constituintes fosfolipídios e protéicos do látex. Os cuidados especiais tomados na polimerização fazem com que a biomembrana adquira uma microarquitetura particular, com uma superfície natural, que permite aderência celular e estimula os vários tipos celulares, especialmente os polimorfonucleares envolvidos nos processos de cicatrização de feridas.
Essa biomembrana com tais características, pode ser fabricada na forma laminar (utilizada como curativo) (Figuras 1a e 1b) ou em vários formatos, como próteses, preparados a partir de moldes especiais8,9. Mrué evidenciou ser esse material um importante indutor de cicatrização de paredes esofágicas lesadas de cães experimentais, além de neoangiogênese, epitelização (epitélio pseudoestratificado), neoformação glandular submucosa e de fibras musculares10. A biomembrana foi utilizada, com sucesso, inicialmente em um estudo para o tratamento de úlcera venosa crônica, no qual observaram-se sinais evidentes de estímulo à granulação11. Oliveira et al. descreveram a utilização deste material em miringoplastias12.
Figuras 1a e 1b. Aspecto macroscópico da biomembrana de látex.


Figuras 1a e 1b. Aspecto macroscópico da biomembrana de látex.
Os objetivos do presente trabalho são estudar o desempenho da biomembrana de látex como uma interface biocompatível entre a superfície cruenta óssea da cavidade recém criada nas timpanomastoidectomias de cavidade aberta e o tecido de algodão utilizado para seu tamponamento e analisar o seu papel no processo de cicatrização (epitelização) da neocavidade.
MATERIAL E MÉTODOOs pacientes selecionados para este estudo foram acompanhados no Serviço de Otorrinolaringologia da Associação Paparella no Hospital Santa Lydia de Ribeirão Preto. O estudo foi submetido e foi aprovado pela comissão de ética do Hospital Santa Lydia de Ribeirão Preto (protocolo nº 14/2002) e todos os pacientes autorizaram a utilização do material em estudo, o armazenamento dos dados e a utilização dos mesmos em pesquisas.
Foram analisadas 64 orelhas de pacientes de ambos os sexos, de 8 a 78 anos, submetidos à timpanomastoidectomia de cavidade aberta com meatoplastia para o tratamento da OMC colesteatomatosa ou por recidiva de tecido de granulação, no período de Janeiro de 2002 a Junho de 2004. Em 54 das 64 orelhas operadas, após a realização da mastoidectomia com o rebaixamento satisfatório da parede posterior do canal auditivo externo até o nível do muro do facial e a confecção da microcaixa, recobrimos a neocavidade com a biomembrana de látex, realizando incisões de alívio quando necessário para facilitar a sua colocação por toda a extensão da superfície da neocavidade. Extremo cuidado foi tomado para não se deixar nenhuma área de exposição óssea que pudesse entrar diretamente em contato com a fita cardíaca untada com pomada antibiótica, que será gentilmente acomodada sobre a biomembrana de látex, cobrindo completamente a neocavidade criada. Nas outras 10 orelhas operadas, que nos serviu de grupo controle, realizamos o tamponamento da maneira clássica, ou seja, utilizando-se somente a fita cardíaca untada em pomada antibiótica sem a interface da biomembrana de látex.
Após duas semanas de pós-operatório, removemos a fita cardíaca das 10 orelhas do grupo controle. Nas 54 orelhas onde o novo método foi utilizado removemos a fita cardíaca e, em seguida, a biomembrana de látex, também após duas semanas de pós-operatório. Em ambos os métodos (64 orelhas), após a remoção do tampão, preenchemos completamente a neocavidade com uma pomada à base de oxitetraciclina e hidrocortisona, que será retirada 15 dias após (30º dia de pós-operatório). Após a remoção desta pomada o paciente é orientado a não deixar entrar água na neocavidade.
O aspecto da neocavidade das 64 orelhas operadas foi avaliado no 14º, 30º e 60º dias de pós-operatório. As intercorrências na remoção do tampão (sangramento e dor ou desconforto), o tempo gasto para sua retirada e o status cicatricial da neocavidade foram analisados através de um protocolo que reunia alguns critérios adotados para esta finalidade (Quadro 1).
Quadro 1. Protocolo de avaliação pós-operatória.

A avaliação do status cicatricial da neocavidade sempre foi feita pelo mesmo examinador. Esta análise era realizada sem que o examinador soubesse se a biomembrana de látex havia ou não sido utilizada.
RESULTADOSForam analisadas 54 orelhas de pacientes portadores de OMC submetidos à timpanomastoidectomia de cavidade aberta e meatoplastia com a colocação da biomembrana de látex para forrar a neocavidade. Estas 54 orelhas foram comparadas às 10 orelhas do grupo controle, nas quais se utilizou somente a fita cardíaca untada em pomada antibiótica para tamponar a neocavidade, sem a interface da biomembrana de látex.
O aspecto da neocavidade foi analisado em três momentos distintos: por ocasião da remoção do curativo tampão no 14º, no 30º e no 60º dia de pós-operatório (Figuras 2, 3, 4 e 5).
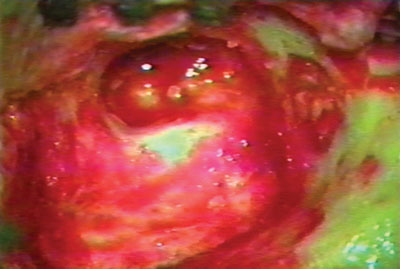
Figura 2. Aspecto da cavidade aberta ao final da timpanomastoidectomia.
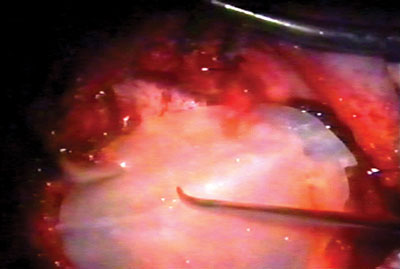
Figura 3. Biomembrana de látex sendo colocada sobre a neocavidade.
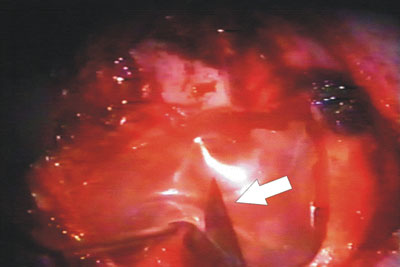
Figura 4. Incisão de alívio na biomembrana para melhor acomodação na cavidade.
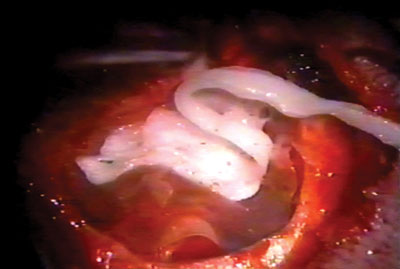
Figura 5. Colocação da fita cardíaca sobre a biomembrana.
Por ocasião da remoção do tampão das 54 orelhas onde se utilizou a biomembrana de látex, 3 orelhas (5,5%) apresentaram sangramento ao nível do rebordo da meatoplastia e 52 (94,5%) não apresentaram qualquer sangramento. A remoção do tampão causou dor ou desconforto somente nestas 3 orelhas que apresentaram sangramento. Nas 10 orelhas do grupo controle todas (100%) exibiram algum grau de sangramento, de menor ou maior proporção, sendo, algumas vezes, necessária a cauterização química para o seu controle. Todos os pacientes do grupo controle referiram dor ou desconforto para a remoção do tampão.
Em todas as 54 orelhas onde se utilizou a biomembrana de látex gastou-se no máximo 1 minuto para a remoção do tampão. Das 10 orelhas do grupo controle em 2 delas o tempo para a remoção do tampão foi menor do que 1 minuto, em 7 gastou-se entre 1 e 3 minutos e em 1 orelha este tempo foi maior do que 3 minutos.
Após a remoção da pomada da neocavidade no 30º dia de pós-operatório observou-se a presença de tecido de granulação em 8 (14,8%) das 54 orelhas onde se utilizou a biomembrana de látex. Nas 10 orelhas do grupo controle observou-se a presença de tecido de granulação em 6 delas (60%).
No 60º dia de pós-operatório 5 (9,3 %) das 54 orelhas ainda apresentavam áreas de tecido de granulação sobre a superfície da neocavidade. No grupo controle observava-se tecido de granulação em 2 (20%) das 10 orelhas operadas. A queixa de otorréia sero-sanguinolenta ou purulenta, neste momento do pós-operatório, ocorreu em 6 (11,1%) das 54 orelhas onde se utilizou a biomembrana de látex e em 3 (30%) das 10 orelhas do grupo controle.
Na primeira análise (14º dia de pós-operatório) observava-se a presença de uma tênue camada de fibrina sobre a superfície da neocavidade, que era visualizada após a remoção da biomembrana de látex (Figura 6 e 7). No grupo controle, esta superfície mostrava-se sanguinolenta e muitas vezes já apresentando áreas de tecido de granulação após a remoção da fita cardíaca. No 30º e 60º dia de pós-operatório era nitidamente melhor a qualidade da epitelização da neocavidade nos pacientes nos quais utilizamos a biomembrana (Figura 8), quando comparados com o grupo controle. Observou-se que os pacientes nos quais utilizou-se o material biocompatível houve uma epitelização mais precoce da neocavidade, quando comparado com as orelhas nas quais utilizávamos tão somente a fita cardíaca com pomada para o preenchimento da neocavidade.
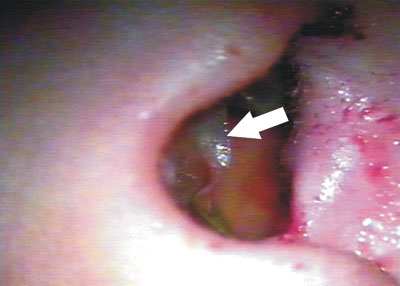
Figura 6. Biomembrana de látex sendo removida da neocavidade no 14º dia de P.O.
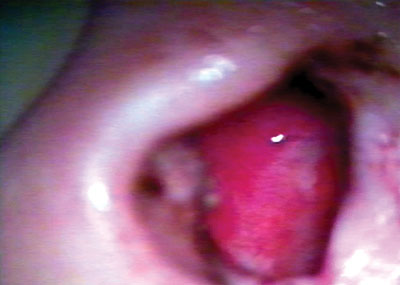
Figura 7. Aspecto da superfície da neocavidade mostrando tênue camada de fibrina após a remoção da biomembrana de látex no 14º dia de P.O.
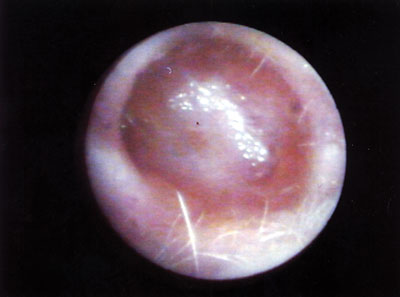
Figura 8. Aspecto da neocavidade totalmente epitelizada no 60º dia de P.O.
Durante mais de duas décadas nos deparamos com dificuldade em escolher a melhor maneira de preenchermos as cavidades recém-criadas nas timpanomastoidectomias de cavidade aberta. Utilizamos Gelfoam®, gaze, cadarço e mais recentemente fita cardíaca untada com pomada antibiótica para este fim. Nestas condições não era incomum a necessidade de uma toalete freqüente da neocavidade para a remoção de tecido de granulação e debris, que às vezes culminava com a necessidade de vir a revesti-la com retalhos livres de pele removidas do antebraço, método proposto por Ollier-Thiersch13,14.
Cabe salientar que a remoção do tampão, que ocorre no 14º dia de pós-operatório, já se constitui procedimento que gera, para o paciente, dor e desconforto e para o médico, uma maior demanda de tempo, em função da aderência do material utilizado no tampão a áreas de tecido de granulação da neocavidade. Muitas vezes, esta remoção culminava em sangramentos difusos que requeriam cauterização da superfície da neocavidade.
Em virtude destas dificuldades para a remoção do curativo tampão, julgamos útil forrar toda a extensão da neocavidade com uma interface feita de um material biocompatível, a biomembrana de látex, que é colocada entre o cadarço de algodão (fita cardíaca) e a superfície da cavidade representada pelo osso cruento, retalhos de pele e o Gelfoam®, que recobre o enxerto da microcaixa.
Ao removermos o cadarço e, em seguida, o látex da cavidade das 54 orelhas onde se utilizou o novo método, a biomembrana deslizava suavemente sobre uma delgada superfície de fibrina, que servia de berço para o crescimento do epitélio de revestimento. Durante esta remoção, não observamos nenhum sangramento ou desconforto para o paciente, fato que não ocorreu nos casos do grupo controle. Nestes casos, muito provavelmente, o sangramento e o tecido de granulação foram responsáveis pelo atraso do processo de epitelização da neocavidade.
O fato de não traumatizarmos a superfície da neocavidade, ao removermos a fita cardíaca, que não se aderiu à superfície óssea cruenta se deve à proteção oferecida pela biomembrana. Isto diminuiu de maneira relevante o sangramento e a formação de tecido de reparação propiciando, desta maneira, uma superfície mais propícia para o inicio do processo de epitelização desta recém criada cavidade aberta.
Decidimos lançar mão da biomembrana de látex para servir como uma interface que vai proteger a superfície da neocavidade e, provavelmente, tornar mais precoce o seu processo de epitelização, devido à sua propriedade neoangiogênica e cicatrizante. Vários artigos foram publicados a respeito de sua aplicabilidade especialmente para o tratamento de úlceras das pernas8,9,11.
Convém lembrar que a remoção do tampão (fita cardíaca e biomembrana) e o acesso pleno à neocavidade somente será possível através da abertura criada durante a meatoplastia, daí a importância da suficiência deste meato. Acreditamos que, ao criarmos uma cavidade aberta, seja imprescindível confeccionarmos um meato de tamanho adequado, que nos possibilite abordar esta cavidade em toda sua extensão.
As dificuldades com as quais se depara o otorrinolaringologista utilizando-se somente do tecido de algodão para forrar a neocavidade, como a sua aderência à superfície da neocavidade, sangramento, dor, desconforto para o paciente e a maior demanda de tempo para o controle destas intercorrências ocorreram em muito menor proporção com o grupo de pacientes que utilizou a biomembrana de látex.
A epitelização da neocavidade ocorreu com sucesso na grande maioria dos pacientes nos quais o novo método foi utilizado. Isto pode ser explicado pelo fato de que o biomaterial utilizado é estimulante da neovascularização e do crescimento tecidual organizado em diferentes órgãos e tecidos, sendo um material inócuo e de não rejeição pelo organismo.
Acreditamos que a utilização da biomembrana de látex nas timpanomastoidectomias de cavidade aberta seja um detalhe da técnica cirúrgica que pode facilitar o trabalho do cirurgião nos cuidados dispensados à neocavidade no pós-operatório, além de provavelmente promover um processo de epitelização mais rápido desta cavidade.
CONCLUSÃOA utilização da biomembrana de látex, nas timpanomastoidectomias de cavidade aberta, revelou-se método de grande eficácia como uma interface biocompatível, com capacidade de neoangiogênese e cicatrização entre a superfície óssea cruenta e o tecido de algodão utilizado para o tamponamento da neocavidade, facilitando a remoção do tampão e a epitelização da neocavidade.
REFERÊNCIAS BIBLIOGRÁFICAS1. Costa SS, Paparella MM, Cruz OLM. Otite Média. In: Costa S, Cruz O, Oliveira J, editors. Otorrinolaringologia. Princípios e Prática. Porto Alegre: Editora Artes Médicas; 1994. p. 120-2.
2. Meyerhoff WL, Kim CS, Paparella MM. Pathology of chronic otitis media. Ann Otol Rhinol Laryngol 1978;87(6 Pt 1):749-60.
3. Bluestone CD, Kenna MA. Workshop on chronic suppurative otitis media: etiology and management - Proceedings. Ann Otol Rhinol Laryngol 1988;97(131):1-48.
4. Cruz OLM, Costa SS. Mastoidectomia. In: Cruz OLM, Costa SS, editors. Otologia. Clínica e Cirúrgica. Rio de Janeiro: Editora Revinter; 2000. p. 271-87.
5. Sousa LCA, Piza MRT, Costa SS. Meatoplastia. In: Cruz OLM, Costa SSd, editors. Otologia Clínica e Cirúrgica. Rio de Janeiro: Revinter; 2000. p. 289-91.
6. Sousa LCA. Meatoplasty. Operative Techniques in Otolaryngology-Head Neck Surg 1996;7(1):78-81.
7. Sousa LCA, Piza MRT, Andrade MJ, Jaeger WL, Nascimento JMN. Meatoplastia: Indicações, Vantagens e limitações. Rev Bras Otorrinolaringol 1996;62(1):5-8.
8. Frade MAC, Cursi IB, Andrade FF, J C-N, Foss NT. Stimulation of diabetic wound healing by natural latex biomembrane (NLB). Annales de dermatologie et de vénéréologie (20th World Congress of Dermatology) 2002:1S823.
9. Frade MAC, Cursi IB, J C-N, Foss NT. Induction of leg wound healing by natural latex biomembrane (NLB). Annales de dermatologie et de vénéréologie (20th World Congress of Dermatology) 2002:1S823.
10. Mrué F. Substituição do esôfago cervical por prótese biossintética de látex: Estudo experimental em cães [Mestrado]. Ribeirão Preto: Universidade de São Paulo; 1996.
11. Frade MAC, Valverde RV, J C-N, Foss NT. Chronic phlebopathic cutaneous ulcer: a therapeutic proposal. Int J Dermatol 2001;40(3):234-40.
12. Oliveira J, Hyppolito MA, Coutinho-Netto J, Mrué F. Miringoplastia com a utilização de um novo material biossintético. Rev Bras Otorrinolaringol 2003;69(5):649-55.
13. Ollier LXEL. Greffes cutanées ou autoplastiques. Bulletin de l'Académie de médecine 1872;2(1):243-50.
14. Thiersch K. Ueber die feineren anatomischen Veränderungen bei Aufheilung von Haut auf Granulationen. In: Verhandlungen der deutschen Gesellschaft für Chirurgie. Berlin; 1874. p. 69-75.
1 Doutor em Neurocirurgia pelo Departamento de Cirurgia, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Professor de Otorrinolaringologia - Faculdade de Medicina de Ribeirão Preto - UNAERP Diretor Presidente da Associação Paparella de Otorrinolaringologia.
2 Mestre em Otorrinolaringologia pelo Departamento de Oftalmo-Otorrino, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo; Ex-Fellow da International Hearing Foundation, Universidade de Minnesota, EUA., Médico da Associação Paparella de ORL.
3 Professor Associado, Professor do Departamento de Bioquímica e Imunologia, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo.
4 Estagiária de 3º ano, Serviço de ORL da Associação Paparella de ORL, Hospital da Sociedade Portuguesa de Beneficência de Ribeirão Preto.
5 Estagiária de 2º ano, Serviço de ORL da Associação Paparella de ORL, Hospital da Sociedade Portuguesa de Beneficência de Ribeirão Preto.
Este trabalho foi realizado com apoio da Associação Paparella de Otorrinolaringologia, Serviço de Otorrinolaringologia da Faculdade de Medicina da Universidade de Ribeirão Preto-UNAERP.
Endereço para correspondência: Luiz Carlos Alves de Sousa Rua Bernardino de Campos 1503 Ribeirão Preto SP 14015-130.
Fone/Fax: (0xx16) 3610-6755 3610-6515 - E-mail: lcarlos@clinicapaparella.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 10 de maio de 2005. cod. 306.
Artigo aceito em 23 de abril de 2007.


