INTRODUÇÃOHipócrates (460-370 a.C.) foi quem empregou pela primeira vez o termo "aphta" (aphtodea)1, originária da palavra grega a p t e i n (ARTEIV), traduzida como "colocar fogo"2. Ainda hoje, a etiologia das ulcerações aftosas recorrentes (UAR) permanece desconhecida, embora os indícios de sua base etiológica repousem sobre a susceptibilidade genética, os agentes infecciosos e as alterações dos mecanismos imunológicos.
Já o sistema de proteção das mucosas da boca é bem conhecido e congrega um grande número de substâncias responsáveis pela sua homeostasia3.
O mediador humoral mais importante para a imunidade da mucosa é a IgA secretora4,5, por cooperar com uma variedade de mecanismos de proteção6, por apresentar maior resistência à degradação proteolítica que outras imunoglobulinas7 e por localizar-se especialmente nos tratos digestório e respiratório que estão em íntimo contato com o meio ambiente8, impedindo a absorção de uma vasta quantidade de antígenos e prevenindo uma sobrecarga ao sistema imune9.
As imunoglobulinas A secretoras da saliva mostram-se como um excelente indicador do status imune da mucosa bucal10-12, no entanto, comparações clínico-laboratoriais das ulcerações aftosas recorrentes e os mecanismos protetores locais envolvidos indicam a necessidade de estudos elucidativos, pela raridade de trabalhos publicados e seus resultados contraditórios.
MATERIAL E MÉTODOEste estudo, aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Odontologia da Universidade Federal dos Vales do Jequitinhonha e Mucuri, contou com a participação de vinte pacientes com história de ulcerações aftosas recorrentes atendidos no serviço de Estomatologia desta instituição. Os pacientes foram selecionados independentemente do sexo, idade, raça ou de suas condições sócio-econômicas, mas que preenchessem pré-requisitos (critérios de inclusão) como a ausência de doenças sistêmicas crônicas, de terapia medicamentosa na semana do exame e de tratamento odontológico recente. Todos os pacientes receberam informações dos procedimentos antes de suas adesões à pesquisa, assinando um termo de consentimento livre e esclarecido.
Para obtenção de uma amostra padronizada de saliva total, os pacientes foram instruídos a não ingerirem alimentos ou bebidas (exceto água), no período mínimo de 1 hora e a higienização bucal de no mínimo 2 horas antes do procedimento previsto. O enxágüe da boca com água pura foi aplicado momentos antes do início das coletas (entre as 8 e as 10 horas da manhã). As amostragens não excederam 15 minutos.
A saliva total não-estimulada e depositada no assoalho da cavidade bucal foi coletada com pipetas descartáveis, esterilizadas do tipo Pasteur. Após a coleta, 1,5mL de cada amostra foi estocado em tubos Eppendorf codificado e em seguida centrifugado, com a finalidade de reduzir as bolhas e a espuma, e armazenado em um sistema refrigerado (freezer a -20ºC). Todos os pacientes participaram de dois momentos na pesquisa. No primeiro momento, com lesão ativa de afta e, no segundo momento, sem a detecção clínica das lesões (período quiescente).
Análises BioquímicasUtilizou-se a Nefelometria para avaliação quantitativa das IgAs salivares (Behring Nephelometer II, Behring, USA) com reagentes e calibradores fornecidos pelo próprio fabricante. Para a avaliação das proteínas totais utilizou-se o vermelho de Pirogalol (Sensiprotò) com leitura feita por um analisador semi-automático (550 Express da CIBA - Corningò).
Após as coletas, foram feitas medidas do fluxo salivar não estimulado (fluxo em repouso) nos períodos de lesão ativa e quiescente. Durante esta avaliação, todos os pacientes mantiveram-se sentados e relaxados, com a cabeça abaixada e os lábios ligeiramente abertos de modo que a saliva escorresse passivamente por sobre o lábio inferior sendo recolhida em um béquer graduado e de peso conhecido. O tempo para cada amostragem foi de 5 minutos. Determinou-se o fluxo salivar pela análise gravimétrica13,14.
Análise EstatísticaAs comparações entre os pacientes do sexo masculino e feminino, para cada um dos momentos (Com e Sem afta) em relação às medidas das variáveis: fluxo salivar, IgA-s salivar e concentração de proteínas totais salivares foram realizadas utilizando-se o teste de Kruskal-Wallis. Este teste compara duas ou mais amostras independentes em relação a uma variável de interesse.
Com o objetivo de se compararem as amostras (nos momentos Com e Sem afta) por sexo, em relação às medidas das variáveis: taxa de fluxo salivar, IgA-s e concentração de proteínas totais salivares (e independentemente do sexo no que tange ao fluxo salivar e à IgA-s salivar), utilizou-se o teste não-paramétrico de Wilcoxon de amostras pareadas.
Todos os resultados foram considerados significativos para uma probabilidade de significância inferior a 5% (p<0,05) tendo, portanto, pelo menos 95% de confiança nas conclusões apresentadas.
RESULTADOSDos pacientes selecionados, 12 (60%) eram do sexo feminino e 8 (40%) do sexo masculino, numa faixa etária compreendida entre os 07 e os 54 anos, com prevalência da 3ª década de vida (dos 21 aos 30 anos). Quanto à idade, não existiram diferenças significativas (p> 0,05) entre o sexo dos pacientes, ou seja, as idades destes dois grupos de pacientes foram semelhantes.
As lesões variaram de 1 a 4mm de diâmetro e predominaram na língua, sulco gengivo-labial e lábio superior, com uma média de 2 (duas) lesões por paciente.
Os fatores predisponentes relatados foram: estresse; alimentos; alterações gastrointestinais; ciclo menstrual; história familiar e em alguns não foi possível notar qualquer relação com fatores que os predispusessem (sem causa aparente).
Os resultados da avaliação do fluxo salivar e dos níveis de IgA-s dos pacientes nos momentos com e sem afta, independentemente do sexo, estão agrupados na (Tabela 1). Nota-se que não houve diferença estatisticamente significativa entre as médias do fluxo de saliva dos pacientes nos momentos de lesão ativa e quiescente. Quanto aos valores das proteínas totais nos dois momentos, relacionados ao sexo, verificamos que no sexo masculino os valores foram estatisticamente mais altos (Tabela 2). Por outro lado, as concentrações de proteínas totais não diferiram entre os dois momentos (atividade e quiescência) das ulcerações aftosas recorrentes (Tabela 3). Já os níveis de IgA-s salivar nossos resultados mostraram-se aumentados significativamente nos momentos de atividade destas lesões quando comparamos com os de quiescências (Tabela 3).
Tabela 1. Análise descritiva e comparativa do fluxo de saliva, IgA Salivar entre os pacientes com e sem afta independentemente de sexo.
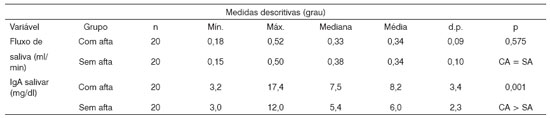
Nota: O valor de p refere-se ao teste de Wilcoxon Pareado
Legenda: CA a Com afta SA a Sem afta
Tabela 2. Análise descritiva e comparativa das variáveis fluxo de saliva, IgA Salivar e Nível de proteínas totais salivares entre os sexos em relação aos pacientes Com afta.
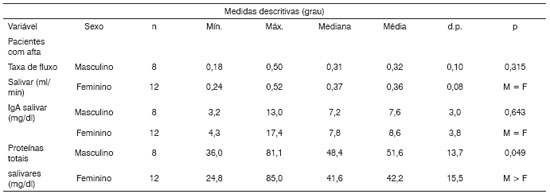
Nota: O valor de p refere-se ao teste de Kruskal-Wallis
Legenda: Sexo: M a Masculino F a Feminino
Tabela 3. Análise descritiva e comparativa das variáveis fluxo de saliva, IgA Salivar e concentração de proteínas totais salivares entre os sexos em relação aos pacientes e Sem aftas.
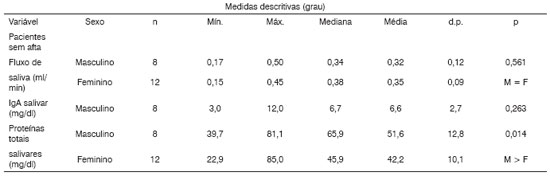
Nota: O valor de p refere-se ao teste de Kruskal-Wallis
Legenda: Sexo: M a Masculino F a Feminino
O termo "afta" tem sido empregado tanto pelos profissionais da saúde quanto pelos leigos para designar qualquer lesão bucal caracterizada por dores semelhantes àquelas de uma queimadura2.
Neste trabalho, a denominação de ulcerações aftosas recorrentes (UAR) foi empregada para se evitar a confusão com outras entidades semelhantes.
O diagnóstico das UAR é puramente clínico, levando-se em conta suas características semiológicas e sua história evolutiva15. O estudo histopatológico dessas ulcerações não demonstra especificidade, sendo utilizado apenas para eliminar o que não é afta7, já que representa um quadro histopatológico de um processo inflamatório inespecífico16.
As ulcerações aftosas recorrentes são normalmente classificadas nos tipos: maior, menor e herpertiforme, de acordo com as suas manifestações clínicas como número, localização e gravidade17. Na casuística deste trabalho o tipo que prevaleceu em todos os pacientes consultados foi o menor, com uma média de 5 dias de instalação.
A saliva não estimulada foi preferida à estimulada por já haver dados na literatura sobre o "fluxo em repouso" e por representar maior confiabilidade da situação fisiológica das secreções bucais, sem a interferência de fatores externos.
Apesar da pequena quantidade, as substâncias orgânicas são moléculas responsáveis por grande parte das funções biológicas da saliva18, fazem parte do sistema imune e podem, até certo ponto, operar independentemente do sistema imune geral4.
A imunoglobulina A secretora (IgA -s) é um importante parâmetro para se avaliar o status imune da mucosa com a vantagem de ser mensurável por métodos não-invasivos e sem desconforto para o paciente19,20. Ela é a principal classe de imunoglobulina encontrada nas secreções mucosas e é responsável por uma barreira contra uma infinidade de agentes infecciosos, alérgenos ambientais e substâncias carcinogênicas19, além de cooperar com vários mecanismos de proteção inatos8.
A IgA representa a segunda imunoglobulina mais abundante do soro e predomina na saliva sob a forma dimérica (IgA-s) que resiste melhor à proteólise de ambientes como a boca21.
A deficiência da IgA é o mais comum defeito imune humoral em humanos e causa, em uma grande parcela, infecções gastrointestinais e respiratórias22,23.
Se a imunidade tem algum efeito regulador sobre o desenvolvimento das úlceras aftosas recorrentes, o esperado é que a IgA-s seja a imunoglobulina que proporcione proteção, considerando-se o seu papel em outras partes do corpo.
Neste estudo, propôs-se verificar se as concentrações de IgA-s e de proteínas totais encontradas na saliva total não-estimulada diferiam nos períodos de quiescência e de atividade das ulcerações aftosas recorrentes.
Como medida para se verificar a variação do fluxo salivar, o que poderia influenciar os níveis de IgA-s e proteínas totais, adotou-se a aferição de fluxo em repouso de saliva total. Nossos resultados mostraram que não houve diferenças estatísticas entre as medias dos fluxos nos períodos de lesão ativa e de quiescência (Tabela 1). Resultados semelhantes foram obtidos em pacientes com UAR comparados a indivíduos sem histórias dessas lesões24.
Também não se observou diferença estatística entre as concentrações de proteínas totais em pacientes com e sem aftas.
Já as concentrações de proteínas totais não sofreram variações quando foram comparados os pacientes nos momentos Com e Sem lesão (Tabela 3). Análises em amostras de saliva total estimulada e não-estimulada demonstraram que o fluxo de saliva era mais baixo e as concentrações de proteínas totais mais elevadas no sexo feminino do que no masculino13. No presente trabalho, ao compararmos proteínas totais, encontramos concentrações mais altas (p < 0,05) nos dois momentos (Com e Sem aftas) nos pacientes do sexo masculino. Por outro lado, a média do fluxo salivar não mostrou diferença significativa entre os sexos (conforme Tabela 2). É interessante observar que, apesar de pacientes do sexo masculino apresentarem concentrações mais altas de proteínas totais do que no sexo feminino, verificamos que tanto para homens quanto para as mulheres as concentrações de proteínas totais são semelhantes em momentos com aftas e sem aftas. Não existe diferenças significativas (p>0.05) entre esses dois momentos (Tabelas 4 e 5).
Tabela 4. Análise descritiva e comparativa das variáveis fluxo de saliva, IgA Salivar e Nível de proteínas totais salivares entre os pacientes Com e Sem aftas no que diz respeito ao sexo Masculino.
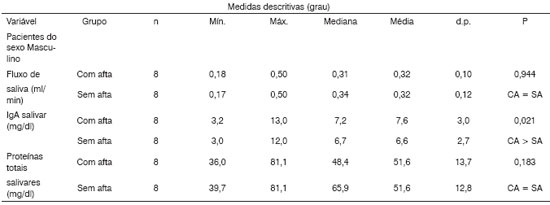
Nota: O valor de p refere-se ao teste de Wilcoxon
Legenda: CA a Com afta SA a Sem afta
Tabela 5. Análise descritiva e comparativa das variáveis Fluxo de saliva, IgA Salivar e Nível de proteínas totais salivares entre os pacientes Com e Sem aftas no que diz respeito ao sexo Feminino.
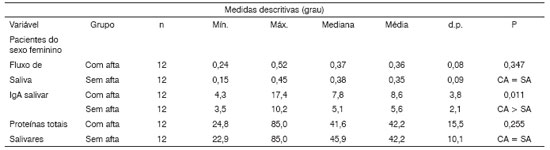
Nota: O valor de p refere-se ao teste de Wilcoxon
Legenda: CA a Com afta SA a Sem afta
Quanto aos valores de IgA-s salivares, existe uma diferença significativa (p<0,05) nos valores, notadamente mais elevados nos momentos de vigência das lesões que nos períodos intercríticos (sem lesão), conforme a Tabela 1. Além disso, a Tabela 3 evidencia uma confirmação deste resultado, isto é, tanto para o sexo masculino quanto para o sexo feminino a variável fluxo de saliva em pacientes com e sem afta não difere estatisticamente, enquanto para os níveis de IgA-s salivar foi estatisticamente mais altos nos pacientes com afta. Estes dados são semelhantes aos dados encontrados em indivíduos com aftas e indivíduos sem história de lesão25,26.
Estudo realizado sobre os níveis de IgA-s salivares em pacientes com UAR nos períodos de lesão incipiente, aguda, regressão e de cura completa, comprovou aumento da IgA-s, no período agudo, e sua diminuição nos períodos de regressão e cura, e para o grupo de mulheres do estudo foi notado resultados muito discrepantes, em algumas delas os níveis de IgA-s salivar eram influenciados pelo ciclo menstrual e em outras não havia qualquer relação parecida27. O que leva à correlação não confiável dos níveis de IgA-s salivar e o período menstrual, mesmo naquelas com associação entre o ciclo menstrual e as ocorrências de ulcerações aftosas recorrentes28. A casuística deste trabalho aponta apenas uma mulher (do grupo de 12 mulheres) que relatava o surgimento das ulcerações aftosas no período menstrual.
CONCLUSÃONossos resultados sugerem forte correlação entre IgA-se e os mecanismos de lesões nas ulcerações aftosas recorrentes, podendo ser utilizada como parâmetro na avaliação do status imune da mucosa.
REFERÊNCIAS BIBLIOGRÁFICAS1. Tommasi AF. Ulceração aftosa recorrente, um estudo sobre hereditariedade realizado com 151 famílias. Ass Curandi em Odontologia 1975;2(2):32-4.
2. Pedersen A, Madsen HO, Vestergaard B, Ryder LP. Varicella - zoster virus DNA in recurrent aphthous ulcers. Scand J Dent Res 1993;101(1):311-3.
3. Nidr - Nacional Institute of Dental Research. Saliva: A promising diagnostic and monitoring toal. JADA - J Am Dent Assoc 1974;125(1):867-8.
4. Vetvik H, Grewal HMS, Haugen IL, Ahren C, Haneberg B. Mucosal antibodies can be measured in air-dried samples of saliva and feces. J Immunol Methods 1998;215(1):163-72.
5. Segal AL, Katcher AH, Brightman VJ, Miller MF. Recurrent herps labialis, recurrent aphthous ulcers and the menstrual cycle. J Dent Res 1979;53(4):797-803.
6. Brandtzaeg P. Molecular and cellular aspects of the secretory immunoglobulin system. APMIS - Acta Pathol Microbiol Immunol Scand 1995;103(1):1-19.
7. Stanley HR. Aphthous Lesions. Oral Surg Oral Med Oral Pathol 1972;33(3):407-16.
8. Lamm ME, Nedrud JG, Kaetzel CS, Mazanec MB. IgA and mucosal defense. APMIS - Acta Pathol Microbiol Immunol Scand 1995;103(4):241-6.
9. Slavkin HC. Protecting the mouth against microbial infections. J Am Dent Assoc 1998;129(7):1025-30.
10. Smith OJ, King JV, Gilbert JV, Taubman MA. Structural integrity of infant salivary immunoglobulin A (IgA) in IgA 1 protease - rich environments. Oral Microbiol Immunol 1998;13(5):278-85.
11. Hucklebridge F, Clow A, Evans P. the relationship between salivary secretory immunoglobulin A and cortisol: neuroendocrine response to awakening and the diurnal cycle. Int J Psychoplysiol 1998;31(1):69-76.
12. Externest D, Meckelein B, Schmidt MA, Frey A. Correlations between antibody immune responses at different mucosal effector sits are controlled by antigen tipe and dosage. Elsevier Science 2000;68(7):3830-9.
13. Banderas - Tarabay J A, Begner MG, Garnuño AS, Cortez EM. Flujo y concentración de proteínas en saliva total humana. Salud Publica Mex 1997;39(5):1-17.
14. Bretz WA, Valle EV, Jacobson JJ, Marchi F, Mendes S, Nor JE, Cançado MF. Unstimulated salivary flow rates of Young children. Oral Surg Oral Med Oral Pathol 2001;21(5):541-5.
15. Békourian F. I'utilisation du zinc dans I'aphtose buccale. ActualOdontostomatol (Paris) 1995;189(1):73-85.
16. Cawson RA. Oral ulceration - clinical aspects. Oral Surg Oral Med Oral Pathol 1972;33(6):912-21.
17. Cawson RA, Odelle EW. Diseases of the Oral mucosa: Non-infective estomatites. In: Essentials of Oral Pathology and Oral Medicine. 6th ed. Toronto: Churchill Livingstone; 1998. p. 183-7.
18. Sreebny LM, Banoczy J, Baum BJ, Edgar WM. Saliva: its role in health and disease. Int Dent J 1992;42(4):291-331.
19. Kilian M, Reinholdt J, Lomholt T, Poulsen K, Frandsen EV. Biological significance of IgA1 proteases in bacterial colonization and pathogenesis: critical evaluation of experimental evidence. APMIS - Acta Pathol Microbiol Immunol Scand 1996;104(5):321-38.
20. Hucklebridge F, Lambert S, Clow A, Warburton DM, Evans PD, Sherwood N. Modulation of secretory immunoglobulin A in saliva; response to manipulation of mood. Biol Psychol 2000;53(1):25-35.
21. Miletic ID, Schiffman SS, Miletic VD, Miller EAS. Salivary IgA secretion rate in Young and elderly persons. Physiol Behav 1996;60(1):243-8.
22. Truedsson L, Baskin B, Pan Q, Rabbani H, Vorechovsky I, Smith CI. Genetics of IgA deficiency. Acta Pathol Microbiol Immunol Scand 1995;103(12):833-72.
23. Voltz JM, Mole C, Aubin F, Gibey R, Faivre B, Seilles E, Humbert P. Immunoglobulines a serigues et salivaires dans la Lermatite Atopique: etudi prospective et comparative temoins - Malades. Ann Dermatol Venereol 1998;125(2):100-4
24. Ben-Aryed H, Malberger E, Gutman D, Szargel R, Anavi Y. Salivary IgA and serum IgG and IgA in recurrent aphthous stomatitis. Oral Surg Oral Med Oral Pathol 1976;42(6):746-52.
25. Sistig S, Vucicevic-Boras V, Lukac J, Kusic Z. Salivary IgA and IgG subclasses in oral mucosal diseases. Oral Disease 2002;8 (6):282-6.
26. Brozovic S, Vucicevic, Boras V, Bukovic D. Serum IgA, IgG, IgM and salivary IgA in recurrent aphthous ulceration. Coll Anthropology 2001;25(2):633-7.
27. Kakizawa T, Nona H, Omori K. The Evaluation of secretory IgA in human saliva. Bull Tokyo Dent Coll 1973;14(3):125-39.
28. Seidel BM, Schulze B, Kiess W, Vogtmann C, Borte M. Determination of secretory IgA and albumin in saliva of newborn infants. Biol Neonate 2000;78(3):186-90.
1 Mestre, Professor de Ciências Morfológicas da Universidade de Uberaba.
2 Doutor, Professor do Departamento de Odontologia Restauradora da Faculdade de Odontologia da UFMG.
3 Doutor, Pró-Reitor de Pesquisa, Pós-Graduação e Extensão da Universidade de Uberaba.
Universidade de Uberaba, Uberaba MG.
Endereço para correspondência: Dr. José Bento Alves - Av. Nenê Sabino 1801 Bairro Universitário Uberaba MG 38055-500.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 5 de maio de 2006. cod. 1900.
Artigo aceito em 2 de agosto de 2006.


