INTRODUÇÃOPotenciais Evocados (PEs) são manifestações elétricas cerebrais em resposta a estímulos externos. A utilidade clínica destes potenciais é baseada na capacidade de: demonstrar função anormal do sistema sensorial; revelar disfunções do sistema sensorial em doenças desmielinizantes; auxiliar na definição da distribuição anatômica de doenças e monitorar objetivamente alterações nas condições clínicas de pacientes1. Os PEs são pequenas variações características do eletroencefalograma, relacionadas com estímulos sensorial, motor ou cognitivo, constituindo-se em um indicador neurofisiológico1,2.
Os PEs podem ser classificados em sensoriais ou exógenos e endógenos ou cognitivos1,2. Os potenciais exógenos são determinados pelas características físicas e temporais dos estímulos e estão diretamente relacionados com eles. Os endógenos dependem do indivíduo, da tarefa realizada, do conteúdo dos estímulos e são correlacionados com as atividades do processamento cerebral3.
Avanços recentes sobre o funcionamento cerebral e o desenvolvimento de técnicas de localização anatômica da atividade cerebral em seres humanos que realizam tarefas específicas permitiram a introdução de novas aplicações clínicas para os PEs cerebrais4.
Um componente dos PEs, denominado de Mismatch Negativity (MMN)5 permitiu o desenvolvimento de procedimentos objetivos para avaliações fisiológicas de grande interesse em neurologia, psiquiatria e otorrinolaringologia4.
O MMN é um componente endógeno dos PEs, obtido quando se apresenta a um sujeito ou paciente um bloco de centenas de estímulos idênticos (padrões) que são aleatoriamente substituídos por estímulos acusticamente diferentes (desviantes). Estes estímulos, padrões e desviantes devem conter discretas diferenças nas características acústicas como: duração, freqüência, intensidade, localização espacial ou ainda pela utilização de fonemas ou notas musicais. Para a obtenção do MMN, é necessário que a atenção aos estímulos acústicos seja desviada por uma tarefa de distração visual.
Obtém-se o MMN subtraindo as respostas eliciadas pelos estímulos padrões das respostas dos estímulos desviantes, registrando-se uma onda negativa que, dependendo da amplitude do estímulo desviante, surge entre 100 e 250 milissegundos (ms) após o início do estímulo.
Esta negatividade é gerada por mudanças no processo de discriminação que ocorrem no córtex auditivo e reflete a memória sensorial auditiva. Pode ser utilizada como indicador do estado funcional do córtex, das capacidades sensoriais e perceptuais, como índice do processamento auditivo e da plasticidade neural do sistema auditivo6.
O MMN é um potencial replicável7, é eliciado quando existe uma diferença entre os estímulos padrões e os desviantes na freqüência, na duração, na intensidade, na localização espacial, nas características fonéticas, rítmicas e no padrão temporal. Estas diferenças entre os estímulos não devem ser grandes8, podendo alterar a latência e a amplitude do MMN9,10. A duração11 e a intensidade12 dos estímulos podem interferir no estabelecimento da representação neuronal devendo ser bem controlados.
A Esclerose Múltipla (EM) é uma doença inflamatória, imunomediada, desmielinizante que acomete o sistema nervoso. É predominantemente encontrada em adultos jovens, no gênero feminino, apresentando com mais freqüência períodos de exacerbação e remissão dos sintomas específicos. As alterações são freqüentes no nervo óptico, na medula espinhal, no tronco encefálico e nas regiões periventriculares. O diagnóstico é clínico, baseado na dispersão espacial e temporal das lesões no sistema nervoso central. O diagnóstico de EM clinicamente definida de acordo com os critérios de Poser é a ocorrência de pelo menos dois ataques e evidência clínica de duas lesões separadas ou dois ataques e evidência clínica de uma lesão e evidência paraclínica de outra. Estes dois ataques devem envolver diferentes partes do sistema nervoso central, separadas por um período de um mês e cada uma durar no mínimo 24 horas13. Os exames complementares de auxílio ao diagnóstico clínico são: imagem por ressonância nuclear magnética, exame do líquor para a pesquisa de bandas oligoclonais, da taxa de formação de imunoglobulina G no líquido cefalorraquidiano, potenciais evocados visuais, somatossensitivos e auditivos.
A avaliação de portadores de EM com os potenciais evocados auditivos de longa latência14 já revelou alterações na morfologia e latência das ondas15,16, assim como sua correlação com testes neuropsicológicos alterados17.
Alterações cognitivas podem acometer pacientes com EM. Estudos neuropsicológicos indicam que disfunções cognitivas ocorrem em 54 a 65%18 e que podem alterar a memória, a atenção, a fluência verbal, a execução de tarefas, a percepção visual19. A Medida Funcional Composta para a Esclerose Múltipla - MSFC20 foi desenvolvida a partir de testes psicométricos em portadores de EM constando dos seguintes testes: Caminhada Cronometrada de 25 Pés, Teste de 9 Pinos no Buraco e o Teste Auditivo Compassado de Adição Seriada (Paced Auditory Addition Test - PASAT)21.
Os testes neuropsicológicos são de grande utilidade na determinação da função cognitiva, dentre estes, o Teste Auditivo Compassado de Adição Seriada - PASAT21 é um teste sensível e prático para avaliação do comprometimento cognitivo na EM. Os escores dos resultados do PASAT de cada portador de EM são comparados com um grupo controle pareado em idade, média de escolarização e nível sócio econômico22.
OBJETIVOSOs objetivos deste estudo, empregando-se o MMN em pacientes portadores de EM clinicamente definida, foram: avaliar se o MMN pode ser utilizado como um índice funcional do córtex auditivo supratemporal e analisar se alterações do MMN correlacionam-se com o comprometimento cognitivo avaliado pelo Teste Auditivo Compassado de Adição Seriada - PASAT.
MATERIAL E MÉTODOSO comitê de ética em Pesquisa da Universidade Federal de São Paulo/Hospital São Paulo analisou e aprovou o projeto Contribuição do Mismatch Negativity na avaliação cognitiva de indivíduos portadores de esclerose múltipla, protocolo nº 0638/03.
Participaram deste estudo 40 sujeitos do gênero feminino e 20 do masculino, separados em 2 grupos: grupo controle e grupo com diagnóstico de EM, que leram os termos de esclarecimento e assinaram o termo de consentimento, aprovados pelo Comitê de Ética em Pesquisa.
Para o grupo com diagnóstico de EM, foram selecionados pacientes de ambos os gêneros: 30 mulheres, com idades de 26 a 58 anos, média de 43,1 anos e 10 homens, de 29 a 57 anos, média de 39,4 anos. Todos os pacientes deste grupo apresentavam diagnóstico de Esclerose Múltipla Clinicamente Definida, segundo os critérios de Poser, não apresentavam sinais de exacerbação da EM no momento dos testes e do registro do MMN ou distúrbios visuais que pudessem interferir na tarefa de distração visual. Todos os pacientes foram submetidos a exame otorrinolaringológico, audiometria tonal para avaliação dos limiares tonais nas freqüências de 500, 1000 e 2000 Hz.
Para o grupo controle, foram selecionados sujeitos de ambos os gêneros, com idade pareada ao grupo de EM: 10 mulheres, com idade entre 27 e 50 anos, média de 40,1 anos e 10 homens, entre 25 e 55 anos, média de 37,9 anos, sem história pregressa de doenças neurológicas e/ou otorrinolaringológicas. Todos foram submetidos a exame otorrinolaringológico, apresentando otoscopia sem alterações e limiares a audiometria tonal menores ou iguais a 25 dB NA nas freqüências de 500, 1000 e 2000 Hz. Nenhum deles usava de drogas que pudessem ter efeito no sistema nervoso central.
Para o registro do MMN utilizou-se de um bloco de estímulos com variação de duração e outro com variação de freqüência, apresentados por meio de fones supraurais TDH-39.
No bloco de estímulos com variação de duração, utilizaram-se tons em intensidade de 55 dB nível de audição (NA), com apresentação binaural, em um total de 1000 tons, 80% de estímulos padrões e 20% de estímulos desviantes, com freqüência de 750 Hz, sendo os estímulos padrões com duração de 75ms e os estímulos desviantes com duração de 25ms. Os tons desviantes foram distribuídos pelo computador aleatoriamente entre os tons padrões. Como ritmo de estimulação, foram utilizados 1,1 estímulos por segundo (/s). Os tons padrões utilizados foram com tempo de ascendência e descendência linear de 10ms com platô de 55ms. Os tons desviantes foram com 5ms de tempo de ascendência e descendência linear com 15ms de plateau.
No bloco de estímulos com variação de freqüência utilizaram-se tons em intensidade de 55 dB NA, com apresentação binaural, em um total de 1000 tons, 80% de estímulos padrões e 20% de estímulos desviantes, com duração de 50ms, sendo os estímulos padrões com
freqüência de 1000 Hz e os estímulos desviantes com freqüência de 1500 Hz. Os tons desviantes foram distribuídos pelo computador aleatoriamente entre os tons padrões. Como ritmo de estimulação, foram utilizados 1,1 estímulos /s. Os tons padrões e desviantes foram com 10ms de tempo de ascendência e descendência linear com 30ms de plateau, ambos os tons com rampa linear.
As aquisições foram realizadas em ambiente acusticamente tratado, com os sujeitos confortavelmente acomodados em decúbito dorsal, com cabeceira elevada em 45º e a cabeça apoiada para relaxamento da musculatura cervical, utilizando-se como tarefa visual de distração, um filme sem som, legendado, projetado em uma tela de vídeo. Todas as aquisições foram realizadas no mesmo horário, no período da manhã.
Utilizou-se, para a pesquisa, um equipamento de potenciais evocados da marca Biologic® de dois canais, com os registros gravados por meio de eletrodos de prata, posicionados na linha média na região frontal e central, nas derivações Fz e Cz, utilizando-se, como referência, os lobos das orelhas e, como terra, um eletrodo na ponta do nariz, fixos em fita adesiva, após a escarificação da pele e a colocação de pasta eletrolítica. As impedâncias dos eletrodos foram mantidas sempre abaixo de 5 Kohms.
Utilizou-se tempo de análise de 512ms, filtros de passa alta em 0,1 Hz e passa baixa em 100 Hz.
O início da aquisição dos sinais foi ajustado com o início exato da estimulação auditiva.
O MMN foi considerado como o pico máximo negativo entre 100 e 250ms, em Fz e Cz, obtido pela curva de diferença, subtraindo-se as curvas de resposta ao estímulo padrão das curvas de resposta ao estímulo desviante. Foram analisadas a morfologia, as latências e as amplitudes negativas das ondas de diferença medidas emms e µV. Foram analisadas também a presença ou a ausência do MMN após a subtração das ondas.
O grupo portador de EM foi submetido à Medida Funcional Composta para a Esclerose Múltipla - MSFC, sendo que o Teste Auditivo Compassado de Adição Seriada (Paced Auditory Addition Test) - PASAT foi utilizado como um índice do comprometimento cognitivo. O PASAT foi realizado na versão com intervalos interestímulo de 3 segundos por meio da apresentação de estímulos que eram algarismos de 1 a 9 em seqüência pseudo-aleatória gravados em Compact Disk. A tarefa do sujeito era adicionar os algarismos dois a dois, somá-los e dizer o resultado. Ao ouvir o próximo algarismo, o terceiro, somá-lo com aquele imediatamente anterior de acordo com a versão para o português brasileiro disponibilizada por Haase et al.14. O escore bruto do PASAT foi definido pelo número de acertos das somas.
A presença de comprometimento ao PASAT foi definida como um escore bruto igual ou inferior 27. Acima deste valor, foi considerado com ausência de comprometimento ao PASAT.
A presença ou ausência do MMN, nos dois protocolos de estimulação auditiva, foi comparada com a presença do comprometimento cognitivo avaliado pelo PASAT.
As médias das idades foram comparadas pelo teste de Análise de Variância (ANOVA) entre os gêneros e os grupos controle e de EM.
O teste de ANOVA foi aplicado para comparar as latências e as amplitudes das negativas do MMN entre o grupo controle e o grupo de EM, entre os gêneros e entre as derivações de registro (Fz e Cz).
Aplicou-se o teste de Fischer para comparar a presença ou ausência do MMN com a presença do comprometimento cognitivo avaliado pelo PASAT.
Para ambos os testes, foi adotado o nível de significância de 5%.
RESULTADOSA Tabela 1 mostra as comparações e análise estatística das médias das idades entre os gêneros e os grupos.
O MMN foi registrado em 60% dos pacientes no protocolo com variação de duração e em 45% dos pacientes no protocolo com variação de freqüência no grupo de EM. Nestes não houve diferenças estatisticamente significantes nas latências e amplitudes negativas do MMN entre o grupo de EM e o grupo controle em ambos os gêneros e em ambas as derivações (Tabelas 2 a 5).
As Tabelas 6 e 7 mostram as comparações e análises estatísticas entre a presença ou ausência do MMN e a ocorrência do comprometimento cognitivo avaliado pelo PASAT no grupo de EM.
As Figuras 1 a 5 mostram exemplos de ondas dos potenciais de longa latência e do MMN nos grupos controle de grupo de esclerose múltipla.
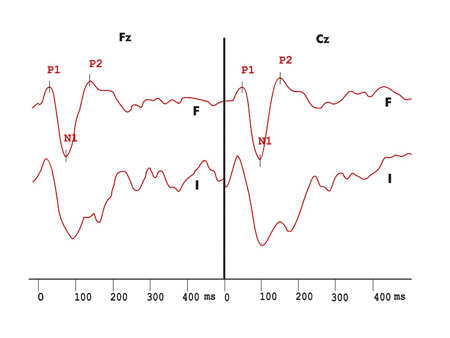
Figura 1. Registro dos potenciais evocados auditivos de longa latência exógenos no protocolo com variação de duração do grupo controle. F - registro em resposta aos estímulos freqüentes I - registro em resposta aos estímulos infreqüentes
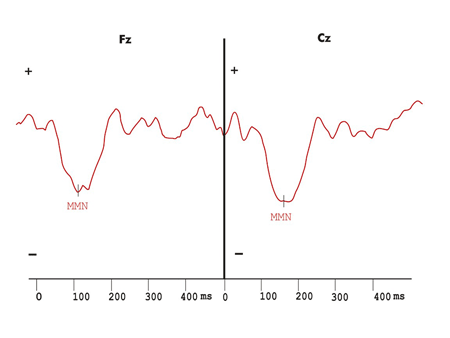
Figura 2. Mismatch Negativity evidenciado pela onda de diferença obtida com os estímulos infreqüentes e freqüentes no protocolo de estimulação auditiva com variação de duração do grupo controle.
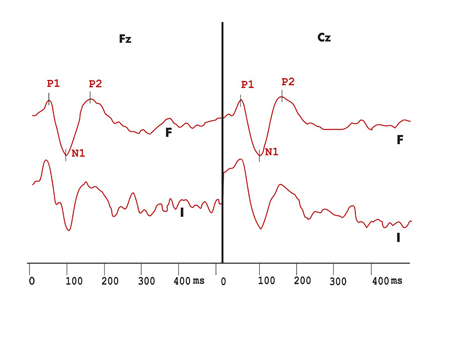
Figura 3. Registro dos potenciais evocados auditivos de longa latência exógenos no protocolo com variação de duração do grupo Esclerose Múltipla. F - registro em resposta aos estímulos freqüentes I - registro em resposta aos estímulos infreqüentes
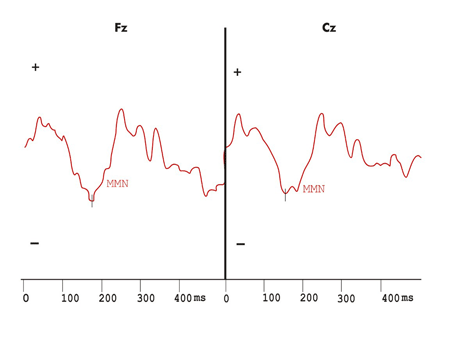
Figura 4. Mismatch Negativity evidenciado pela onda de diferença obtida com os estímulos infreqüentes e freqüentes no protocolo de estimulação auditiva com variação de duração do grupo Esclerose Múltipla.
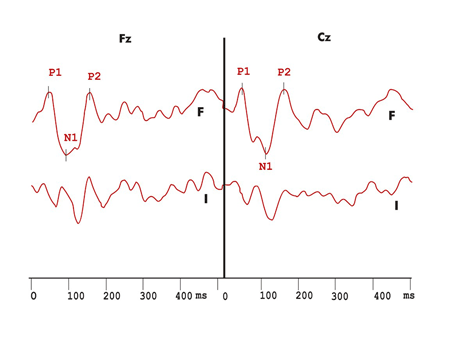
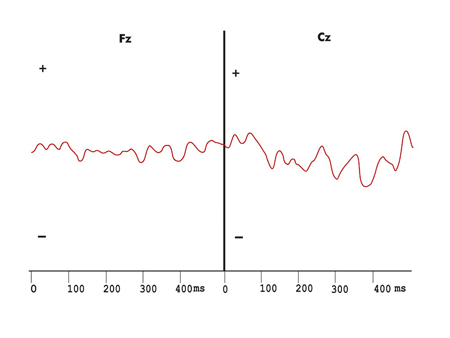
Figura 5. Registro dos potenciais evocados auditivos de longa latência exógenos e da onda de diferença obtida com os estímulos infreqüentes e freqüentes, com ausência do Mismatch Negativity no protocolo com variação de duração do grupo Esclerose Múltipla.
O MMN, descrito por Näätänen et al.5, é um potencial eliciado com a apresentação de estímulos auditivos de baixa probabilidade que constituem uma mudança física em relação a uma estimulação padrão repetitiva. É gerado automaticamente, independente da atenção do sujeito, cada vez que um estímulo aferente não coincidir com a representação sensorial, das características físicas da estimulação repetitiva. O processo gerador do MMN é de característica pré-atencional, com contribuições neuroelétricas do córtex frontal, que participa de mecanismos voluntários e involuntários da atenção.
A grande vantagem dos potenciais evocados, quando comparados a outros métodos neurocognitivos, é que permitem registrar a ativação neuronal associada ao processamento cerebral, tornando possível avaliar áreas cerebrais, ativadas durante tarefas cognitivas de processamento. Com o MMN também é possível estimar a duração da memória ecóica. Vários estudos sugerem a origem endógena deste potencial.
O objetivo de estudos clínicos, utilizando-se potenciais evocados relacionados a eventos, é demonstrar a ausência ou a presença de respostas que sejam diferentes de sujeitos normais.
Para um indivíduo reconhecer um estímulo acústico complexo como semelhante a um previamente conhecido, a representação sensorial deste estímulo prévio deve ativar correntes aferentes6. Quando a diferença acústica entre os tons padrões e os desviantes é pequena, se torna mais fácil para o sujeito ignorar a estimulação auditiva. Näätänen5 considera que desvios de até 10% são eficazes na produção de um MMN puro. Lang et al.8 relatam que, com uma grande diferença entre os estímulos, os neurônios ativados no córtex auditivo pelos estímulos desviantes não são os mesmos ativados pelos estímulos padrões, recomendando que sejam evitadas grandes diferenças entre os estímulos. Neste estudo, o protocolo com estímulos com variação de duração a diferença entre os estímulos foi adequada para eliciar o MMN. Näätänen5 relata que quando esta diferença excede um limite crítico, um componente P3a pode se sobrepor à resposta, comprometendo o registro do MMN. Sams et al.9 descreveram uma diminuição na latência e um aumento na amplitude do MMN, com o aumento na diferença da freqüência entre os estímulos. Böttcher-Gandor e Ullsperger10 utilizaram tons padrões de 1000 Hz e tons desviantes de 1500 Hz, identificando o MMN com traçados e amplitudes características. Nosso protocolo de estímulos com variação de freqüência, utilizando estas mesmas freqüências, foi capaz de eliciar o MMN sem a ocorrência do P300 ou do seu subcomponente P3a.
A duração dos tons para serem utilizados em blocos para eliciar o MMN deve ser suficiente para estabelecer a representação neuronal dos estímulos padrões. Paavilainen et al.11 relataram que a duração dos estímulos pode ser pequena, com 50ms ou menos, se a intenção é de registrar um MMN com variação de freqüência. Também recomendam que a duração mínima do estímulo para a representação neural seria de, pelo menos, 20 a 30ms. Neste estudo, as durações dos estímulos padrões e desviantes foram 75ms e 25ms respectivamente, no protocolo com variação de duração e de 30ms no protocolo com variação de freqüência. Estes estímulos eliciaram o MMN em ambos os grupos.
Segundo Schröger12, a influência da intensidade do estímulo na geração do MMN, eliciado por outras alterações, como freqüência ou duração, ainda não foi determinada. O MMN pode ser registrado mesmo com baixas intensidades de estímulo, quando os estímulos padrões e os desviantes são discerníveis, em 30 dB NPS. Escera e Grau7 comprovaram a replicabilidade do MMN, utilizando estímulos com intensidade de 85 dB NPS, com fones supraurais. Neste estudo, optou-se pelo uso dos estímulos, tanto no protocolo de variação de freqüência, quanto no de variação de duração, com intensidade de 55 dB NA, tornando-se possível o registro nos sujeitos do grupo controle e no grupo de EM.
Grau et al.7, utilizando estímulos padrões de 75ms de duração (probabilidade =0,83) e estímulos desviantes de 25ms (probabilidade = 0,17), com 700 Hz e 85 dB NPS de intensidade, com apresentação binaural e intervalos interestímulo de 0,4 s e 4,0s em diferentes blocos de estimulação, observaram os PEs em resposta aos estímulos padrões com uma morfologia típica caracterizada por ondas P1, N1 e P2. Estes potenciais exógenos são sensíveis às características físicas da estimulação. O MMN foi evidenciado em resposta aos dois blocos de estimulação, caracterizando a natureza endógena deste potencial. No presente estudo, o protocolo com variação de duração, utilizando-se estímulos padrões de 75ms de duração (probabilidade = 0,80) e estímulos desviantes de 25ms (probabilidade = 0,20), com 750 Hz e 55 dB NA de intensidade, com apresentação binaural e a manutenção de intervalos interestímulo constantes, foi capaz de eliciar os potenciais exógenos P1, N1 e P2, e o MMN em todos os sujeitos do grupo controle.
O MMN esteve presente em 60% dos indivíduos no grupo de EM no protocolo de estimulação auditiva com variação de duração, e em 45% no protocolo de estimulação auditiva com variação de freqüência. Nestes registros, não houve diferença estatisticamente significante na latência e na amplitude negativa do MMN, quando comparado ao grupo controle. Estes achados confirmam a preservação da memória ecóica neste grupo de portadores de EM, nos quais foram registrados o MMN, uma vez que não diferiram, estatisticamente, nas latências e amplitudes negativas, do grupo controle.
Na EM, as avaliações eletrofisiológicas da função do SNC, realizadas pelos potenciais evocados visuais, auditivos de curta latência e somatossensitivos, já estão bem estabelecidas. Já os PEs, relacionados a eventos, têm sido amplamente estudados devido à sua correlação com aspectos cognitivos, indicando uma integridade das vias neurofisiológicas, relacionadas com a informação sensorial exógena. Os potenciais evocados endógenos, ditos relacionados a eventos, são correlacionados com a função cognitiva. As alterações encontradas nestes potenciais são definidas pelo prolongamento das ondas ou pela ausência de formação dos picos característicos.
As alterações observadas neste estudo, no grupo de EM, foram as ausências de respostas que ocorreram em 40% dos indivíduos no protocolo de estimulação auditiva com variação de duração, e em 55% no protocolo de estimulação auditiva com variação de freqüência. Newton et al.14 encontraram uma incidência de 57% de alterações nos potenciais cognitivos que incluíam atraso nas latências das ondas e ausência de morfologia característica. Dijk et al.15 não encontraram diferenças nos potenciais evocados relacionados a eventos em um grupo de 30 portadores de EM, com uma incidência de 15,6% de ausência de picos das ondas de todos os potencias avaliados.
A diminuição da função cognitiva é uma manifestação comum na EM. As mais freqüentes são as alterações na memória, na atenção, na velocidade de processamento e na fluência verbal. Ainda podem ocorrer alterações de percepção visual e de linguagem. Alguns autores sugerem que os padrões de alterações cognitivas na EM se assemelham com aquelas encontradas em outras doenças que acometem estruturas subcorticais.
Os testes neuropsicológicos constituem o padrão ouro na determinação da função cognitiva na EM. O neuropsicólogo possui uma bateria de testes para avaliar as funções mais comumente afetadas.
A MSFC, desenvolvida por Cutter et al.20, a partir de uma análise de testes psicométricos em portadores de EM, constitui-se de três medidas: a capacidade de deambulação, a destreza manual e a avaliação da função cognitiva que é realizada pelo PASAT. Haase et al.22 desenvolveram uma versão brasileira da MSFC, constando dos seguintes testes: caminhada cronometrada de 25 pés, teste dos 9 pinos no buraco e teste auditivo compassado de adição seriada - PASAT. Estes autores concluíram que a velocidade de processamento é uma das funções envolvidas no PASAT e que está comprometida na EM.
Sendo o PASAT considerado um teste prático e sensível do comprometimento cognitivo na EM, este estudo objetivou correlacionar alterações no registro do MMN com o comprometimento da função cognitiva em um grupo de portadores de EM. A média do escore do PASAT, no gênero masculino foi de 27,8 e, no feminino, foi de 28,43. Os escores iguais ou menores ao percentil 25 foram considerados como presença de comprometimento cognitivo avaliado pelo PASAT. Pelo estudo de Haase et al.22 este percentil foi definido por um grupo controle com idade, média de escolarização e nível sócio-econômico pareados com portadores de EM.
Comparou-se, então, neste trabalho, a presença ou ausência do MMN com a presença de acometimento cognitivo, medido pelo PASAT, analisando-se qualitativamente estes dados. Encontrou-se uma correlação, estatisticamente significante, entre a ausência da onda do MMN com a presença de comprometimento cognitivo.
Rao et al.18 avaliaram a função cognitiva na EM com uma bateria de testes neuropsicológicos, encontrando 25% de alterações nos testes de avaliação da atenção, medido pelo teste PASAT e pelos testes de fluência verbal, sem associação com a diminuição da função cognitiva e com a duração da EM, da ocorrência de depressão, do curso da doença ou uso de medicação. Neste estudo encontraram-se 57,5% de portadores de EM com alteração no PASAT. A ocorrência de depressão, o curso da EM ou o uso de medicação, não foram consideradas, sendo que nenhum sujeito encontrava-se em período de exacerbação da EM. Giesser et al.16 encontraram latências dos potenciais N100, P200 e P300 maiores nos portadores de EM com demência, e a associação de uma pior performance nos testes neuropsicológicos com aumento na latência do P300.
Gil et al.17 tentaram correlacionar o aumento da latência do P300 com alterações nos testes neuropsicológicos em portadores de EM. Não encontraram diferenças nas latências e amplitudes de P200, N200 e P300 entre os subgrupos classificados pelos critérios de McAlpine. Neste estudo, foi possível correlacionar alterações em um teste neuropsicológico com o MMN.
Newton et al.14 relataram que a geração dos potencias evocados, relacionados a eventos, estariam em parte dependentes da integridade da substância branca, e que pequenos graus de disfunção cognitiva nem sempre seriam detectados por testes de avaliação da capacidade intelectual, fazendo com que a possibilidade de testes objetivos, realizados por meio de potenciais evocados, relacionados a eventos, se tornem um instrumento útil na prática clínica.
CONCLUSÕESDo estudo, empregando-se o MMN em pacientes portadores de EM clinicamente definida, é lícito concluir que: quando presente na EM, o MMN pode ser utilizado como um índice funcional do córtex auditivo supratemporal e a sua ausência se correlaciona com a presença de comprometimento cognitivo, encontrado pelo Teste Auditivo Compassado de Adição Seriada - PASAT.
Estudos futuros são necessários para um melhor conhecimento do MMN e da sua distribuição topográfica no crânio em portadores de EM, permitindo avaliar, de forma objetiva, a atenção e a cognição, possibilitando melhor reabilitação e acompanhamento clínico destes pacientes.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Chiappa KH. Principles of evoked potentials. In: Chiappa KH. Evoked Potentials in Clinical Medicine. Philadelphia: Lippincott -Raven Publishers; 1997. p.1-30.
2. Donchin E, Ritter W, McCallum WC. Cognitive psychophysiology: the endogenous components of the ERPs. In: Callaway AE, Tueting P, Koslow SH. Event - related potentials in man. New York: Academic Press; 1978. p.349-441.
3. Hillyard AS, Picton TW. Electrophysiology of cognition. In: Plum F. Handbook of Physiology. Maryland: Betmesda; 1987. p.519-84.
4. Escera C. Nuevas aplicaciones clínicas de los potenciales evocados cerebrales: Mismatch Negativity (MMN). Med Clin (Barc) 1997;108:701-8.
5. Näätänen R, Gaillard AWK, Mäntysalo S. Early selective-attention effect on evoked potential reinterpreted. Acta Psychologica 1978;42:313-29.
6. Näätänen R. The Mismatch Negativity: a powerful tool for cognitive neuroscience. Ear and Hearing 1995;16:6-18.
7. Grau C, Escera C, Yago E, Polo MD. Mismatch Negativity and auditory sensory memory evaluation: a new faster paradigm. Cognitive Neuroscience 1998;9:2451-6.
8. Lang AH, Eerola O, Korpilahti P, Holopainen I, Salo S, Aaltonen O. Practical issues in clinical application of Mismatch Negativity. Ear and Hearing 1995;16:118-30.
9. Sams M, Paavilainen P, Alho K, Näätänen R. Auditory frequency discrimination and event-related potentials. Eletroenceph Clin Neurophysiol 1985;62:437-48.
10. Böttcher-Gandor C, Ullsperger P. Mismatch Negativity in event-related potentials to auditory stimuli as a function of varying interstimulus interval. Psychophysiology 1992;29(5):546-50.
11. Paavilainen P, Jiang D, Lavikainen J, Näätänen R. Stimulus duration and sensory memory trace: an event-related potential study. Biological Psychology 1993;35:139-52.
12. Schröger E. Measurement and interpretation of the Mismatch Negativity. Behavior Research Methods, Instruments & Computers 1998;30:131-45.
13. Poser CM, Paty DW, Scheinberg L, McDonald I, Davis FA, Ebers GC, Johnson KP, Sibley WA, Silberberg DH, Tourtellotte WW. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Annals of Neurology 1983;13(3):227-31.
14. Newton MR, Barret G, Callanan MM, Towell AD. Cognitive event-related potentials in multiple sclerosis. Brain 1989;112:1637-960.
15. Dijk JG, Jennekens-Schikel A, Caekebeke JFV, Singh A, Zwinderman AH. What is the validity of an "abnormal" evoked or event-related potential in MS. The J Neurol Sci 1992;109:11-7.
16. Giesser BS, Schroeder MM, LaRocca NG, Kurtzberg D, Ritter W, Vaughan HG, Scheinberg LC. Endogenous event-related potentials in multiple sclerosis patients. Eletroenceph Clin Neurophysiol 1992;82:320-29.
17. Gil R, Zai L, Neau JP, Jonveaux T, Agbo C, Rosolacci, T, Burbaud P, Ingrand P. Event-related auditory evoked potentials and multiple sclerosis. Eletroenceph Clin Neurophysiol 1992; 88:182-7.
18. Rao SM, Leo GJ, Bernardin L, Unverzagt F. Cognitive dysfunction in multiple sclerosis. Neurology 1991;41:685-91.
19. Fischer JS. Cognitive impairment in Multiple Sclerosis. In: Handbook of Multiple Sclerosis. New York: Marcel Dekker, Inc; 2001.p.233-55.
20. Cutter RG, Baier ML, Rudick RA, Cookfair DL, Fisher JS, Petkau J, Syndulko K, Weinshenker BG, Antel JP, Confavoreux C, Ellison GW, Lublin F, Miller AE, Rao SM, Reingold S, Thompson A, Willoughby E. Development of a multiple sclerosis functional composite as a clinical trial outcome measure. Brain 1999;122:871-82.
21. Gronwall DMA. Paced auditory addition task: a measure of recovery from concussion. Percep Motor Skills 1977;44:367-73.
22. Haase VG, Lima EP, Lacerda SS, Lana-Peixoto MA. Desenvolvimento da versão brasileira da multiple sclerosis functional composite measure (MSFC-BCTRIMS). Arq Neuropsiquiatr 2004;62(2-A):363-70.
1 Doutor em Ciências pelo Programa de Pós-graduação em Otorrinolaringologia e Cirurgia de Cabeça em Pescoço - Universidade Federal de São Paulo - UNIFESP - Escola Paulista de Medicina, Médico Otorrinolaringologista.
2 Professor Livre-Docente da Universidade Federal de São Paulo, UNIFESP.
3 Doutor em Neurologia, Professor Adjunto de Oftalmologia e Neurologia da Faculdade de Medicina da UFMG.
4 Doutor em Psicologia Médica, Médico Neurologista Professor Adjunto do Departamento de Psicologia da UFMG.
5 Mestranda em Psicologia do Desenvolvimento - UFMG, Psicóloga.
6 Mestre em Fonoaudiologia pela Pontifícia Universidade Católica de São Paulo, Professora Assistente do Curso de Fonoaudiologia Universidade Federal de Minas Gerais.
Disciplina de Otoneurologia - Universidade Federal de São Paulo UNIFESP - Escola Paulista de Medicina Centro de Investigação em Esclerose Múltipla de Minas Gerais - CIEM-MG - Universidade Federal de Minas Gerais Serviço de Otorrinolaringologia da Faculdade de Medicina da Universidade Federal de Minas Gerais.
Endereço para correspondência: Rua dos Otoni 927/501 Bairro Santa Efigênia Belo Horizonte Minas Gerais 30150-270
Telefax: (0xx31) 3222-1019/32747375 - E-mail: marcoarsantos@uol.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 11 de fevereiro de 2006. cod. 1720.
Artigo aceito em 7 de agosto de 2006.


