INTRODUÇÃOA paralisia facial periférica traumática (PFPT) é uma afecção freqüente na atualidade em decorrência do alto número de acidentes automobilísticos, atropelamentos, ferimentos por projéteis de arma de fogo1-4.
O tratamento para os casos de secção completa do nervo facial tem sido aprimorado com o desenvolvimento de técnicas de reparo neural microcirúrgico. Porém, nas lesões incompletas do nervo, a terapêutica é clínica e depende da pesquisa de novas drogas ou de métodos que auxiliem no processo de regeneração neural5.
Na busca do modelo mais adequado para pesquisa experimental de substâncias sistêmicas que atuem na regeneração pós-traumática do nervo facial, encontra-se na literatura grande diversificação metodológica (espécies animais, sítio e método de lesão, tempo de evolução, e meios de análise funcional e histológica).
Existe um modelo experimental padronizado para pesquisas em nervo periférico com a utilização de nervo ciático de ratos6-12; porém, o nervo facial não responde à reparação de modo semelhante aos nervos periféricos13-19.
É importante estudar a regeneração específica do nervo facial, e não apenas transpor resultados de pesquisas em nervos periféricos para as lesões deste nervo craniano. Não existem trabalhos na literatura em que se tenha realizado a contagem do número de axônios mielinizados do tronco do nervo facial em coelhos na avaliação da regeneração neural.
O objetivo deste trabalho é o estudo da regeneração pós-traumática do nervo facial de coelhos, por meio de avaliação funcional da movimentação da face e por análise histológica qualitativa e quantitativa do nervo facial traumatizado comparado ao nervo facial normal.
MATERIAL E MÉTODOSO presente estudo foi submetido e aprovado pela Comissão de Ética Médica para procedimentos em animais de experimentação da Santa Casa de São Paulo, protocolo nº 69.
Realizou-se lesão por compressão do tronco extratemporal do nervo facial esquerdo de 20 coelhos adultos machos jovens da raça Nova Zelândia, pesando em média 2000g (1800 a 2500g). Após 2, 4 e 6 semanas do trauma, fez-se o sacrifício dos animais e a ressecção bilateral do tronco extratemporal do nervo facial para estudo histológico. De cada animal, analisou-se o nervo obtido do lado lesado - segmento distal à lesão (subgrupo L) - e o nervo facial contralateral não lesado (subgrupo N).
Obtivemos os seguintes grupos para análise:
N= normais, obtidos após duas, quatro e seis semanas
AL= lesados, obtidos após duas semanas
BL= lesados, obtidos após quatro semanas
CL= lesados, obtidos após seis semanas
Os animais foram anestesiados com ZoletilÒ (cloridrato de tiletamida, cloridrato de zolazepam, 0,4mg/kg) e InovalÒ (citrato de fentanila e droperidol, 0,3mg/kg) intramuscular. Procedeu-se à tricotomia na região cervical, antissepsia e assepsia. Realizou-se incisão arciforme na pele da região cervical esquerda, do processo mastóideo à metade do corpo mandibular, seguindo-se à exploração do nervo no espaço anatômico compreendido entre o arco da mandíbula e o processo mastóideo (Figura 1a e 1 b).
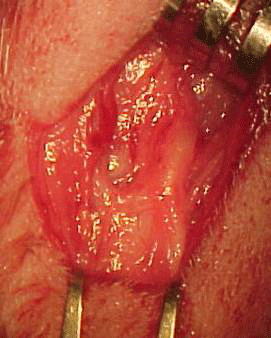
Figura 1a. Tronco extratemporal do nervo facial esquerdo de coelho.
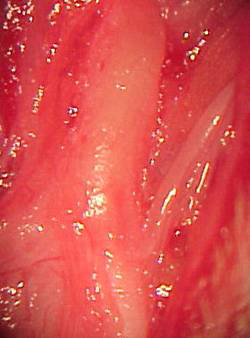
Figura 1b. Tronco extratemporal do nervo facial esquerdo de coelho (ampliado).
Após o isolamento do tronco extratemporal do nervo facial, realizou-se lesão por compressão, aproximadamente a 0,2cm de sua emergência no forame estilomastóideo, com pinça microcirúrgica (Dietrich bulldog clamp - Codman®, com força de preensão de 150g). A pinça foi mantida na posição de esmagamento transversal do nervo por 60 segundos5.
Os animais foram mantidos em gaiolas individuais, alimentados com ração padrão e água ad libitum, em condições ambientais adequadas.
Decorrido o período de 2, 4 ou 6 semanas após a lesão do nervo, procedeu-se à ressecção do nervo facial para estudo histológico e o sacrifício do animal. A anestesia e os passos iniciais de exploração do nervo seguiram a mesma técnica empregada para sua lesão. Procedeu-se à fixação do nervo in situ ainda com o animal vivo (profundamente anestesiado) com glutaraldeído 2% e paraformaldeído 1%, tamponado com tampão de fosfato de sódio 0,1molar a pH=7,3. Os animais foram sacrificados por injeção intracardíaca de cloreto de potássio, e retirou-se a porção neural do local do esmagamento até 0,5cm distal a este (biselou-se a parte distal do fragmento para identificação).
Executou-se a pós-fixação do material em ósmio a 2%, desidratação (banhos gradativos de etanol), infiltração com óxido de propileno e inclusão com resina EpoxiÒ até a polimerização. Foram feitos cortes transversais de 1m de espessura, corados com azul de toluidina a 1%.
Estudo HistológicoA observação histológica foi efetuada por microscopia de luz, com microscópio da marca Nikon modelo Eclipse E 600. As lâminas foram fotografadas com a câmera fotográfica digital da marca Nikon modelo Coolpix E 955, gravadas em CD e transportadas para o computador, utilizando-se o software Sigma Scan Pro 5.0, específico para contagem celular.
Na análise qualitativa, foram observados os seguintes parâmetros: arquitetura geral do nervo, padrão de organização tecidual e grau de remielinização.
Fez-se avaliação quantitativa do número de fibras mielínicas do nervo facial lesado na área distal à lesão, e também do nervo facial normal (contralateral). Foram realizados: a) contagem total do número de axônios, b) contagem de axônios por campo (4 campos homogêneos de 1000X), c) medida da área total de corte transversal do nervo, d) medida da área parcial de corte transversal do nervo (4 campos de 1000X).
Os valores obtidos na análise histológica quantitativa possibilitaram o cálculo de densidade total dos axônios (número total de axônios dividido pela área total de corte transversal do nervo), bem como o cálculo de densidade parcial (contagem de axônios por campo dividida pela área parcial de corte transversal do nervo).
Avaliação FuncionalA avaliação clínica foi procedida de acordo com o método utilizado por Jones (1993)20, semanalmente. Eram observados os seguintes parâmetros: tonicidade e movimentação da musculatura facial, reflexo de piscar e movimentação das vibrissas do lado acometido comparado com o lado normal. Tais fatores eram quantificados de + a +++ (- = ausente).
Estudo EstatísticoOs dados relativos à densidade foram submetidos à avaliação estatística pela análise de variância seguida por comparações múltiplas pelo método de Tukey (dados de densidade transformados em log), sendo um valor p menor ou igual a 0,05 aceito como significativo.
RESULTADOSDois coelhos morreram entre o 3º e 5º dia pós-operatório por motivo ignorado, e um nervo foi excluído do estudo por má qualidade do material histológico obtido. Todos os outros animais mantiveram-se saudáveis durante o estudo, não tendo sido observada infecção da ferida cirúrgica, nem a presença de úlceras neuro-distróficas.
Avaliação Clínica FuncionalOs parâmetros de recuperação funcional encontram-se esquematizados no Quadro 1.
Análise Histológica QualitativaOs nervos analisados eram compostos por um a cinco fascículos, envoltos por epineuro com células de perfil fusiforme.
Nos nervos normais, os axônios eram regularmente arranjados e de diâmetros similares. A mielina era densa, sem deterioração. As células de Schwann eram bem distribuídas, e seus núcleos celulares praticamente idênticos em forma e tamanho. O perineuro apresentava-se como uma condensação de tecido conjuntivo frouxo (Figura 2 e 3).
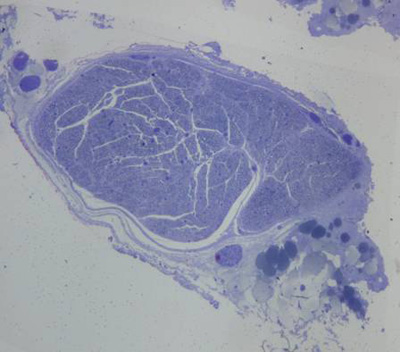
Figura 2. Corte histológico corado com azul de toluidina 1% de nervo facial normal de coelho(50X).
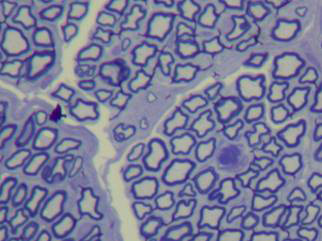
Figura 3. Corte histológico de nervo facial normal de coelho (1000X).
Os nervos lesados de duas semanas apresentaram epineuro e perineuro menos espessos, quando comparados ao nervo normal, dentro dos quais observou-se pequena quantidade de axônios mielinizados (em sua maioria, em fase inicial de mielinização). A bainha de mielina que envolvia os axônios era fina, e estes apresentavam um diâmetro bem menor do que num nervo normal. O estroma era pouco denso, com pequena quantidade de fibras colágenas. Observou-se neoangiogênese moderada (Figura 4 e 5).
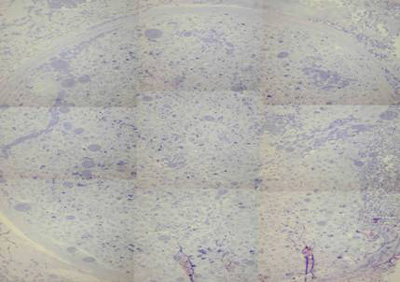
Figura 4. Corte histológico de nervo facial após duas semanas de lesão (50X).
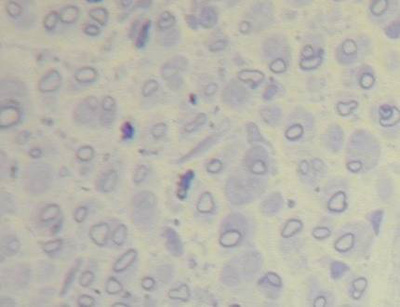
Figura 5. Corte histológico de nervo facial após duas semanas de lesão (1000X).
Nos nervos lesados de quatro semanas, evidenciou-se a presença de maior número de axônios mielinizados e seu grau de mielinização, embora variável, era também superior em relação ao identificado no tempo de sobrevida de duas semanas. Os diâmetros axonais eram maiores, as bainhas de mielina mais espessas, porém foram observados axônios ainda de forma irregular e diâmetros variados (correspondendo a diferentes graus de mielinização). As células de Schwann, em maior quantidade, tinham núcleos pequenos e densos e tamanhos inconsistentes. Observou-se maior quantidade de fibroblastos do que nos nervos normais e lesados de duas semanas. Havia intensa neoangiogênese; e maior densificação do estroma quando comparados aos nervos lesados de duas semanas. O epineuro e perineuro encontravam-se bem mais espessos do que nos nervos normais (Figura 6 e 7).
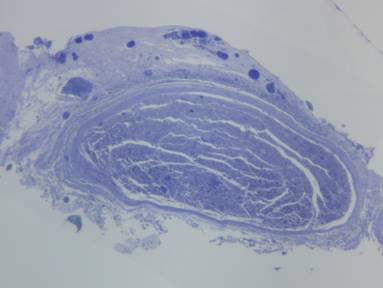
Figura 6. Corte histológico de nervo facial após quatro semanas de lesão (50X).
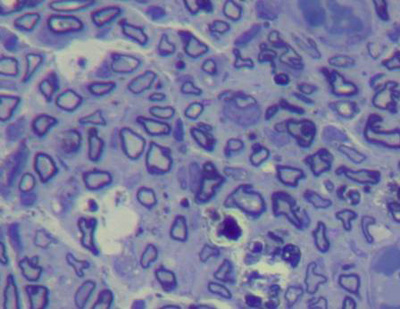
Figura 7. Corte histológico de nervo facial após quatro semanas de lesão (1000X).
Nos nervos lesados de seis semanas, observou-se nítido aumento na compactação dos elementos celulares e fibras colágenas no interior dos fascículos, maior diâmetro axonal, bainhas de mielina mais espessas, axônios de característica mais homogênea e contorno próximo ao regular. Verificou-se menor quantidade de vasos sangüíneos e epineuro mais fino em relação aos nervos lesados de quatro semanas, além de menos fibroblastos e células de Schwann (Figura 8 e 9).
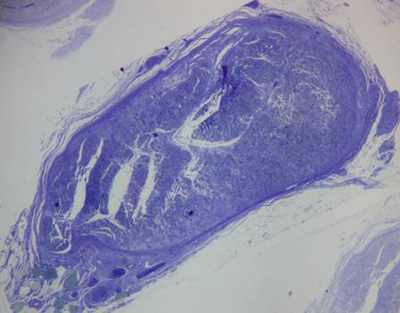
Figura 8. Corte histológico de nervo facial após seis semanas de lesão (50X).
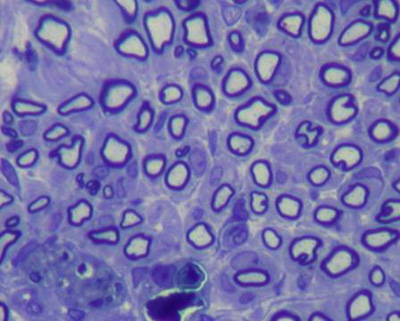
Figura 9. Corte histológico de nervo facial após seis semanas de lesão (1000X).
Os nervos de duas semanas foram excluídos da análise por baixa casuística. Não se deu continuidade ao estudo do grupo AL por dificuldade em se quantificar os axônios.
A Tabela 1 representa os valores de média e desvio padrão do número total de axônios, número parcial de axônios, área transversal total do nervo e área transversal parcial do nervo nos grupos N, BL e CL.
A Tabela 2 e a Figura 10 demonstram a densidade de axônios mielinizados em relação à área total dos nervos estudados nos grupos N, BL e CL.
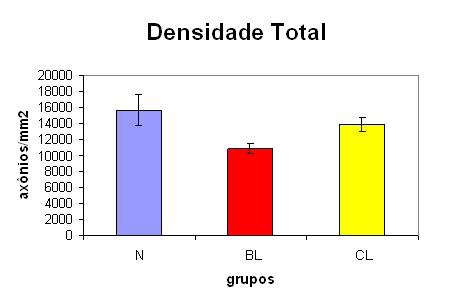
Figura 10. Densidade total de axônios mielinizados em relação aos diferentes grupos (N=normal; BL= lesado com 4 semanas; CL= lesado com 6 semanas).
Na comparação entre os grupos, com relação à densidade total (axônios/mm2), os nervos normais (4 e 6 semanas) apresentaram uma densidade maior que os lesados, e a densidade dos nervos lesados com seis semanas mostrou-se maior do que dos lesados com quatro semanas. O grupo BL obteve 68,88% da densidade do grupo N, e o grupo CL, 88,63% da densidade do grupo N (Tabela 2). Todos os dados foram significativos estatisticamente.
A Tabela 3 e a Figura 11 apresentam a densidade de axônios mielinizados em relação à área parcial estudada (4 campos de 100X).
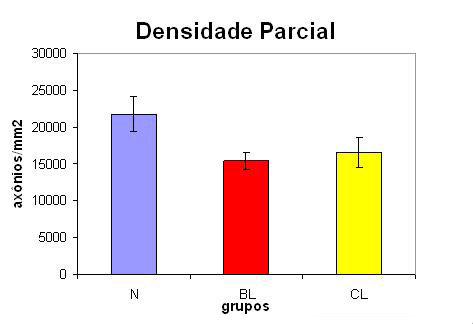
Figura 11. Densidade parcial de axônios mielinizados em relação aos diferentes grupos (N=normal; BL= lesado com 4 semanas; CL= lesado com 6 semanas).
Comparando-se a densidade parcial (axônios/mm2), o padrão gráfico observado foi semelhante. Os nervos normais mostraram uma densidade significativamente maior que os lesados. Porém, não houve diferença estatística entre os nervos lesados com quatro e seis semanas. O grupo BL apresentou 70,37% da densidade do grupo N e o grupo CL, 76,10% da densidade do grupo N (Tabela 3).
As densidades parcial e total entre os nervos normais com quatro e seis semanas não foram diferentes estatisticamente. Deste modo, pôde-se agrupá-los no grupo N.
DISCUSSÃOUtilizou-se o coelho como animal de experimentação com base em estudos anteriores, que verificaram uma cromatólise marcante e uma recuperação completa dos neurônios em poucas semanas após lesões neurais por compressão, em contraste com camundongos, que apresentaram reação axonal pós-traumática atípica21,22. As características anatômicas do nervo facial do coelho assemelham-se às do ser humano23,24.
O tronco do nervo facial foi o local de escolha para a lesão por apresentar menor variação anatômica comparativamente com seus ramos17 e por sua maior proximidade ao neurônio nutriente, portanto, maior velocidade de regeneração em relação a porções mais distais25; também possibilita avaliação clínica da função, sem a necessidade de aparelhos sofisticados.
Observa-se que os sinais de recuperação funcional da movimentação da face, em nosso estudo, ocorrem nas primeiras semanas de evolução em concordância com outros autores, que utilizaram metodologia semelhante22,18,20.
O mecanismo usado em nosso trabalho para produzir a lesão por compressão foi previamente estabelecido por Cai et al. (1998)5, cujo método determina uma lesão grau II na classificação de Sunderland (1978)27. Evitou-se um modelo com secção e sutura por possibilidade de diferenças na técnica cirúrgica e grande número de sincinesias interferirem nos resultados26.
A análise histológica com contagem do número de axônios mielinizados, método amplamente utilizado na literatura mundial em coelhos, ratos, hamsters, é considerado pela maioria dos autores um método objetivo no estudo da regeneração neural16-18,28,29. Porém, alguns definem uma área neural constante17,18,28 e outros comparam apenas o número total de axônios dos nervos16,19.
Neste estudo compararam-se as densidades de número de axônios em relação à área total do nervo, e também em uma área parcial neural definida. Não há relato na literatura onde se realizou contagem dos axônios do tronco do nervo facial em coelhos, não existindo parâmetros em relação aos números absolutos observados. Na análise comparativa entre a contagem total do número de axônios e a contagem parcial, a total mostrou-se mais fidedigna entre os nervos lesados de quatro e seis semanas. A contagem parcial é, sem dúvida, mais prática, embora deva-se lembrar que há possibilidade de se analisar uma área menos afetada pela lesão, o que poderia influenciar os resultados obtidos.
Cai et al. (1998)5 realizaram análise neural qualitativa para comparação histológica entre vários tipos de lesão neural. Tal análise detectou apenas o aspecto geral do tecido estudado, com relação à conservação da estrutura anatômica e grau de processo inflamatório após lesão, sem quantificar o grau de degeneração e regeneração.
Neste estudo associou-se tal método à análise quantitativa. Assim obteve-se não só a qualidade do tecido neural regenerado, como também aferiu-se com maior precisão a quantidade de regeneração em relação ao tempo.
Baseando-se em estudo anterior, que inferiu a relação entre fibras mielínicas e amielínicas de acordo com o tempo de evolução da lesão, resolveu-se verificar no presente trabalho os intervalos deste processo regenerativo, em seu início aproximado (duas semanas) e em dois períodos evolutivos (quatro e seis semanas)17.
Em seis semanas, observou-se praticamente 90% de axônios mielinizados nos nervos lesados em relação aos nervos normais (quase todo o processo regenerativo). Isto é muito importante para o estudo de drogas que interferem na regeneração neural. Sabendo que, neste modelo, o processo de regeneração se inicia aproximadamente em duas semanas, após degeneração significativa; e que após quatro semanas há regeneração parcial e, após seis semanas, regeneração praticamente total, saber-se-á, ao utilizar uma droga sistêmica, em qual período do processo haverá interferência de tal fator.
CONCLUSÕESApós um trauma por compressão, no tronco do nervo facial extratemporal de coelhos, observou-se perda da atividade da musculatura facial, que teve recuperação parcial após duas semanas e completa após cinco semanas da lesão.
Na análise histológica qualitativa do tronco do nervo facial extratemporal, observou-se com duas semanas de lesão um padrão degenerativo axonal com um processo inflamatório tecidual mais intenso. Após quatro semanas da lesão, foram observados sinais evidentes de regeneração do tecido neural, a qual se tornou quase completa após seis semanas da lesão neural. Na análise histológica quantitativa, os nervos faciais normais apresentaram uma densidade axonal transversal total maior que os lesados e a densidade dos nervos lesados com seis semanas mostrou-se maior do que dos lesados com quatro semanas.
Os nervos normais mostraram uma densidade axonal transversal parcial significativamente maior que os lesados. Porém, não houve diferença estatística entre os nervos lesados com quatro e seis semanas. A densidade axonal transversal total do nervo revelou-se um método analítico mais fidedigno para estudo da regeneração neural do que a densidade axonal parcial nas lesões traumáticas de tronco extratemporal do nervo facial de coelho.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Bento RF, Miniti A, Ruocco JR. Traumatic peripheral facial palsy. In: Portmann M: Facial Nerve. Paris 1985;299-303.
2. Conly J. New concepts in facial palsy. In: Portmann M: International Symposium On The Facial Nerve, 5. Proceedings. New York: Masson; 1985. p.564-66.
3. May M. Differential diagnosis by history, physical findings, and laboratory results. In: The Facial Nerve. New York, Thieme Inc 1986b; 81-219.
4. Labella T. Etiology and pathogens of facial palsy. In: Kugler & Ghedini - World Congress Of Otorhinolaryngology, Head And Neck Surgery, 14. Proceedings. Amsterdam: Sacristian 1990; 655-7.
5. Cai Z, Yu G, Ma D, Tan J, Yang Z, Zhang X. Experimental studies on traumatic facial nerve injury. J Laryngol Otol 1998;112:243-7.
6. Seckel BR, Chiu TN, Nyilas E, Sidman Rl. Nerve regeneration through synthetic biodegradable nerve guides: regulation by the target organ. Plast Reconstr Surg 1984;74:173-81.
7. Buttermeyer R, Rao U, Jones NF. Peripheral nerve allograft transplantation with FK 506 functional, histological, and immunological results before and after discontinuation of immunosuppresion. Ann Plast Surg 1995; 35:396-401.
8. De Medinaceli L & Seaber AV. Experimental nerve reconnection: importance of initial repair. Microsurg 1989;10:56-70.
9. Wang MS, Zeleny-Pooley M, Gold BG. Comparative dose-dependence study of FK 506 and cyclosporine a on the rate of axonal regeneration in the rat sciatic nerve. J Pharmacol Exp Ther 1997; 282:1084-8.
10. Costa MP. Emprego do tubo de ácido poliglicólico como substituto de enxerto de nervo: estudo experimental em ratos. São Paulo, 1998 (Tese - Mestrado - Universidade de São Paulo).
11. Mohammad J, Shenaq J, Rabinovsky E, Shenaq S. Modulation of peripheral nerve regeneration: a tissue-engineering approach. The role of amnion tube nerve conduit across a 1- centimeter nerve gap. Plast Reconstr Surg 2000;105:660-3.
12. Costa MP. Tubo de ácido poliglicólico e FK506 na regeneração de nervos periféricos: estudo experimental em ratos. São Paulo, 2001 (Tese - Doutorado - Universidade de São Paulo).
13. McGovern FH. The return of function after damage to the facial nerve. Eye Ear Nose Throat Mon 1970;49:451-4.
14. Mccoy EG & Boyle WF. Reinnervation of the nerve resection. Laryngoscope 1971;81:1-7.
15. Labelle Jl & Allen DE. The peripheral nerve repair. A review. J Maine Med Assoc 1972; 63:164-6.
16. Szal GJ & Miller T. Surgical repair of facial nerve branches. An analysis of different sheating and suturing techniques. Arch Otolaryngol 1975;101:160-5.
17. Spector JG, Lee P, Derby A, Frierdich GE, Neises G, Roufa DG. Rabbit facial nerve regeneration in NGF-containing silastic tubes. Laryngoscope 1993;103:548-58.
18. Spector JG, Lee P, Derby A. Rabbit facial nerve regeneration in autologous nerve grafts after antecedent injury. Laryngoscope 2000;110:660-7.
19. Vasconcelos BCE & Gay-Escoda C. Facial nerve repair with expanded plytetrafluoroethylene and collagen conduits: an experimental study in the rabbit. J Oral Maxillofac Surg 2000;58:1257-62.
20. Jones KJ. Recovery from facial paralysis following crush injury of the facial nerve in hamsters: differential effects of gender and androgen exposure. Exp Neurol 1993;121:133-8.
21. Torvik A. Phagocytosis of nerve cells during retrograde degeneration. An electron microscopic study. J Neuropath Exp Neurol 1972;31:132.
22. Torvik A & Sã-Reide AJ. Nerve cell regeneration after axon lesions in newborn rabbits. J Neuropath Exp Neurol 1972;31:683.
23. Kozma C, Macklin W, Cummings LM, Mauer R. Anatomy, physiology and biochemistry of the rabbit. In: Weisbroth SH, Flatt RE, Kraus AL: The biology of the laboratory rabbit. Academic 1974;50-5.
24. Shek JW, Wen GY, Wismewski HM. Atlas of the rabbit brain and spinal cord. Karger 1986;3-8.
25. Colli BO. Aspectos gerais das lesões traumáticas agudas nos nervos periféricos. Arq Bras Neurocirurg 1993;12:171-200.
26. Ochi M, Noda M, Nakamitsu K, Deie M, Ikuta Y, Maki Y, Awaya A. Promotion of sciatic nerve regeneration in rats by a new neurotrophic pyrimidine derivative MS-430. Gen Pharmac 1995;26:59-64.
27. Sunderland S. Nerve and nerve injuries, 2 ed. London, Churchill-Livingston 1978.
28. Lewin Sl, Utley DS, Cheng ET, Verity NA, Terris DJ. Simultaneous treatment with BDNF and CNTF after peripheral nerve transection and repair enhances rate of functional recovery compared with BDNF treatment alone. Laryngoscope 1997;107:992-9.
29. Neherer-Tairych GV, Kamolz Ml, Deutinger M, Stã-Hr HG, Frey M. The influence of the donor nerve on the function and morphology of a mimic muscle after cross innervation: an experimental study in rabbits. Br J Plast Surg 2000;53:669-75.
1 Especialista em ORL pela Sociedade Brasileira de ORL; Mestre em ORL pela FCM Santa Casa de São Paulo; Doutoranda do Depto. ORL da FCM Santa Casa de São Paulo; Professora Assistente do Hospital Universitário da Faculdade de Medicina da USP.
2 Professor livre-docente da Faculdade de Ciências Biomédicas da Universidade de São Paulo.
3 Mestrando do Depto ORL Cab/pesc da Universidade Federal de São Paulo
4 Doutor em Otorrinolaringologia pela Faculdade de Medicina da Universidade de São Paulo, Professor assistente do Departamento de Otorrinolaringologia da Santa Casa de Misericórdia de São Paulo, professor de pós-graduação da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
Santa Casa de São Paulo.
Endereço para correspondência: Heloisa Juliana Zabeu Rossi Costa - Rua Gabriel dos Santos 759 12o. andar Higienópolis São Paulo SP 01231-011.
Tel: (0xx11) 3825-5946/9964-1683
Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq - Brasil (proc. 131879/2001-4) e Fundo de Amparo à Pesquisa da Fundação Arnaldo Vieira de Carvalho.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 11 de maio de 2005. cod. 309
Artigo aceito em 2 de junho de 2006.


