INTRODUÇÃOO sétimo nervo craniano, o nervo facial (NF), desempenha um papel muito importante em diversas funções do organismo. É o grande responsável pela motricidade da hemiface homolateral, desempenhando ainda um papel na motricidade de músculos cervicais, na eferência do reflexo estapediano, na sensibilidade de parte da orelha externa, na capacidade gustativa e no controle autonômico de glândulas exócrinas. Uma lesão do NF apresenta um impacto importante no bem estar do paciente, já que acarreta prejuízos cosméticos, funcionais e psicológicos1-3.
Desde o século XVII, a literatura médica já apresenta tentativas de reparação do NF lesado4, mas é só em 1927 que Bunnel reporta um caso de sucesso do mesmo5. Na Segunda Grande Guerra do século XX, aproveitando a infinidade de pacientes gerados nos campos de batalha, iniciaram-se esforços para a recuperação de lesões neurais, os quais culminaram em 1942 na divulgação do "Senior Consultant in Neurologic Surgery to the European Theater of Operations"6, no qual já se defendia uma sutura precoce e sem tensão para um melhor resultado de recuperação funcional. Porém, ainda hoje os resultados de recuperação do NF lesado se apresentam ímpios1,2,7,8. Diversos estudos vem sendo publicados quanto às influências de inúmeros fatores no resultado final da recuperação do NF, abordando técnica cirúrgica2, administração de substâncias neurotróficas1,7,9 e até exposição à pulsos eletromagnéticos10. E todos estes esforços envolvem a obtenção de um modelo experimental para isto.
Objetivamos com este trabalho o estabelecimento de um paradigma experimental de lesão completa do NF, de fácil obtenção e que permita uma análise temporal da regeneração do mesmo, visando implementar futuros estudos sobre a utilização de fatores neurotróficos.
MÉTODOO projeto de pesquisa deste estudo foi avaliado e aprovado pelo Comitê de Ética em Pesquisa da UNIFESP/EPM sob o número 0418/05.
Foram utilizados ratos Wistar, adultos, com peso entre 200 e 300g, machos, mantidos em gaiolas adequadas, em sala climatizada e sob ciclo claro-escuro de 12 horas, com livre acesso à água e alimento. Foram confeccionados 6 grupos de estudo com lesão e sutura do NF, com sacrifício e análise histológica do nervo imediata e com 1, 3, 5, 7 e 9 semanas. O Grupo de 9 semanas (9 SEM) obedeceu ao seguinte algoritmo:
D0 D01 D07 D14 D21 D28 D35 D42 D49 D56 D63
|____________|____|____|____|____|____|____|____|____|______|
cirurgia inicial observação comportamental sacrifício
* lesão nervo e sutura * histologia do nervo
OBS: D01 (primeiro dia pós operatório), D07 (sétimo dia pós operatório), D14 (décimo quarto dia pós-operatório)...
Já os demais grupos (0 SEM, 1 SEM, 3 SEM, 5 SEM e 7 SEM) tiveram a observação comportamental suspensa e sacrífício dos animais estabelecidos no D0, D7, D21, D35 e D49, respectivamente. No "D0" os animais foram submetidos ao procedimento cirúrgico inicial utilizando-se microscópio cirúrgico DF-Vasconcelos® M90, seguindo os seguintes passos:
1) anestesia intraperitonial com cloridrato de xilasina 2% (0,5 ml/Kg de peso) e cloridrato de ketamina 10% (0,9 ml/Kg de peso);
2) tricotomia retroauricular direita;
3) incisão vertical retroauricular interessando pele, subcutâneo e platisma;
4) dissecção romba e identificação da margem tendinosa do músculo clavotrapeziano, do tronco e bifurcação do nervo facial direito e da veia jugular externa;
5) secção completa do nervo facial com microtesoura à aproximadamente 3mm de sua emergência (entre margem tendinosa do clavotrapeziano e veia jugular externa) e imediata sutura com nylon 9-0;
6) fechamento da pele e subcutâneo em pontos separados com nylon 4-0.
Nos respectivos dias destinados à observação clínica, os animais foram submetidos à observação da mímica facial espontânea para observação do movimento das vibrissas, comparando o lado direito (lesado) ao lado esquerdo (não-lesado) durante o movimento típico do rato ao explorar o ambiente. Levando-se em conta o posicionamento, amplitude e a freqüência do movimento das vibrissas, foi dado um valor numérico conforme a escala do Quadro 1.
Nestes mesmos dias, observamos também o fechamento ocular dos animais mediante estimulo de jato de ar, produzido pela compressão rápida do êmbolo de uma seringa de 20 ml direcionado contra cada globo ocular. Aqui, não comparamos o lado direito (lesado) ao lado esquerdo (não-lesado) já que o posicionamento lateralizado dos globos oculares nestes animais não permite o estimulo bilateral simultâneo. Levando-se em conta o fechamento da rima ocular observado, foi dado um valor numérico conforme a escala do Quadro 2.

Em cada dia definido para o sacrifício, de acordo com o grupo em questão, os animais foram sacrificados através da superdosagem dos mesmos anestésicos utilizados na cirurgia inicial. Nova dissecção do nervo facial direito permitiu a localização da sutura neural prévia, sendo retirado o fragmento imediatamente distal ao ponto de sutura para análise histológica. Os fragmentos de nervo foram colocados em frascos individuais com solução fixadora Karnovsky modificada (glutaraldeído 2,5% e paraformaldeido 2%, tamponados com cacodilato de sódio 0,1M pH 7,4), sendo então processados para análise histológica no CEME (Centro de Microscopia Eletrônica) da UNIFESP/EPM, seguindo o protocolo: quatro lavagens sucessivas em solução tampão cacodilato de sódio (0,1M pH 7,4), sendo que as duas primeiras lavagens em temperatura ambiente por 15 minutos; a terceira à 4º C por 12 horas; a quarta à temperatura ambiente por 15 minutos. Pós-fixação com tetróxido de ósmio 2% em solução tampão cacodilato de sódio (0,1 M pH 7,4) por uma hora, seguidas por duas lavagens rápidas (1 minuto) e sucessivas com água destilada. Imersão em solução aquosa de acetato de uranila 0,5% por 30 minutos, seguidas de duas lavagens rápidas (1 minuto) e sucessivas com água destilada. Desidratação em banhos de imersão sucessivos em concentrações crescentes de etanol: 70% por 30 minutos (1 vez), 90% por 30 minutos (1 vez) e 100% por 20 minutos (2 vezes). Dois banhos de imersão consecutivos em óxido de propileno por 20 minutos cada. Infiltração em mistura de resina tipo Araldite 502®:óxido de propileno em concentrações de 1:3, 1:2 e 1:1 por 60 minutos cada, agitando-se por rotação e em temperatura ambiente. Após, colocação em resina pura por quatro a cinco horas em vácuo. Transferidos para moldes de inclusão e orientados horizontalmente para obtenção de cortes transversais dos nervos, seguido de polimerização da resina em estufa a 60º C por 72 horas. Os blocos obtidos após este preparo foram aparados e cortados em ultramicrótomo Leica Reichert Ultracuts®, com navalhas de vidro, obtendo cortes semifinos de 0,3 ?m de espessura. Em seguida, os cortes foram colocados em lâminas de vidro e corados com azul de toluidina 1%.
Os cortes foram visibilizados em microscópio óptico Nikon Optiphot II® acoplado a um sistema analisador de imagem Leica Quantimet 500 QWIN®, com imagens digitalizadas através de câmera Sony XC 003P®. Foram obtidas imagens com objetiva de 40 vezes e aumento total de 860 vezes na imagem digitalizada. Estas imagens foram impressas em papel fotográfico no formato 10 x 15cm para a realização de uma análise qualitativa e quantitativa histométrica da regeneração neural através da análise das fibras mielinizadas.
Para a análise qualitativa, as fotos foram dispostas seqüencialmente de acordo com o tempo entre lesão e sacrifico do animal e observado a presença de fibras mielinizadas, seu diâmetro relativo e a uniformidade de sua distribuição no nervo.
Para a análise quantitativa, foi confeccionado uma "máscara" de 10 x 15cm em uma folha de acetato transparente, na qual foram desenhadas 18 "janelas" de 1,5 x 1,5cm, numeradas de 1 a 18, distribuídas uniformemente em 3 linhas (6 "janelas" por linha). Aproveitamos a Figura 4, que será apresentada nos resultados, para realizar uma fotomontagem para exemplificar a confecção destas "janelas". Através de um sorteio randomizado, foram escolhidas 3 "janelas" por linha para se realizar uma contagem de fibras mielinizadas, num total de 9 "janelas" por foto. Esta contagem obedeceu ao método histométrico clássico11 de considerar "válidos" os elementos que estavam totalmente "inclusos" na área da janela e os só parcialmente inclusos, mas que foram interceptados pelas arestas superior e esquerda. Foram desconsideradas nas contagens aqueles só parcialmente inclusos interceptados pelas arestas inferior e direita. As contagens de cada uma destas nove "janelas" foram somadas, obtendo a contagem total para cada rato. Durante a contagem, se alguma das "janelas" foi considerada como inadequada, seja por não estar totalmente sobre a área neural (englobando bainha e/ou tecidos adjacentes), ou as fibras estarem cortadas obliquamente, ou ainda por problemas quanto à coloração (depósitos homogênios de azul de toluidina), a "janela" em questão foi substituída pela sua sucessora na mesma linha. Caso esta nova "janela" já houvesse sido selecionada para a contagem durante o sorteio inicial, a janela sucessora a esta foi escolhida. Em caso de necessidade de substituir as janelas 6, 12 ou 18 (finais das linhas), optamos pela 1, 7 e 13 (iniciais das linhas).
RESULTADOSForam utilizados dois animais para cada grupo de estudo, num total de 12 ratos. Os resultados da observação comportamental destes animais se encontram apresentados na Tabela 1. Os pontos obtidos por cada rato relativos à movimentação das vibrissas e ao fechamento da rima ocular foram somados e realizamos a média dos dois animais pertencentes a cada grupo, confecionando o Gráfico 1. Neste, podemos inferir uma recuperação temporal dos animais ao longo das nove semanas de observação clínica. Análises estatísticas não foram realizadas por termos uma amostra de apenas dois animais por grupo, mas nota-se uma clara tendência de recuperação clínica, saindo de uma média de 2 pontos no grupo 1SEM para 7,5 pontos no grupo 9SEM. Uma "linha de tendência" foi calculada e inserida no mesmo para facilitar a percepção deste fato.
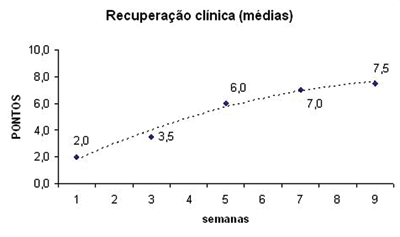
Gráfico 1. Médias de recuperação clínica após transecção e sutura do nervo facial.
Apresentamos as 12 fotos obtidas para cada um dos animais (Figuras 1 a 12). Utilizando estas imagens na análise histológica qualitativa, podemos notar que no grupo 0 SEM (Figuras 1 e 2) observamos a presença de fibras regulares, de forma circular, distribuídas homogeneamente por todo o campo. No grupo 1 SEM (Figuras 3 e 4) notamos a quase que total ausência de fibras mielinizadas, sendo que na Figura 4 notamos um depósito do corante em parte do campo observado. No grupo 3 SEM, observando a Figura 5 (rato VII), notamos a presença de fibras mielinizadas de pequeno diâmetro agrupadas em algumas áreas do nervo; já na Figura 6 (rato VI), observamos um aspecto muito semelhante ao grupo 1 SEM. No grupo 5 SEM, na Figura 8 (rato X), notamos uma "retração" do material, o que impossibilitou uma análise qualitativa; já na Figura 7, observamos uma acentuação da presença de pequenas fibras mielinizadas por toda a área neural. Nos grupos 7 SEM (Figuras 9 e 10) e 9 SEM (Figuras 11 e 12), essa presença vai se acentuando ainda mais, já com algumas fibras "grandes", semelhantes ao grupo 0 SEM, sobretudo na Figura 12 (rato IX).
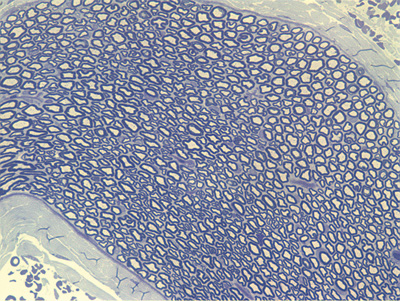
Figura 1. Microscopia do tronco do nervo facial sem lesão (RATO II)
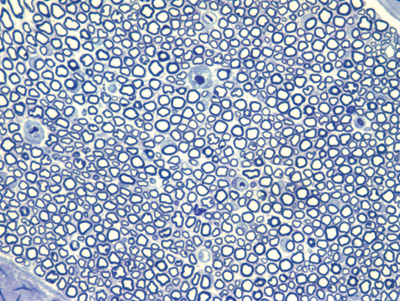
Figura 2. Microscopia do tronco do nervo facial sem lesão (RATO III)
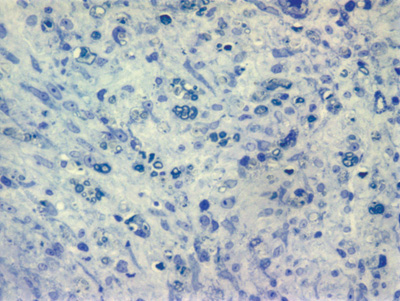
Figura 3. Microscopia do tronco do nervo facial após 1 semana de transecção e sutura (RATO I)
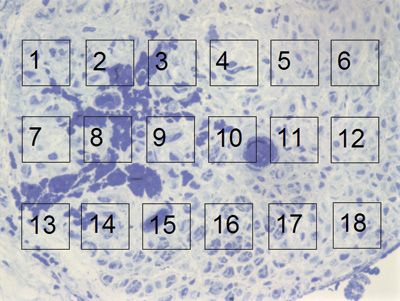
Figura 4. Microscopia do tronco do nervo facial após 1 semana de transecção e sutura (RATO XII); e simulação de "máscara" de contagem de fibras mielinizadas.
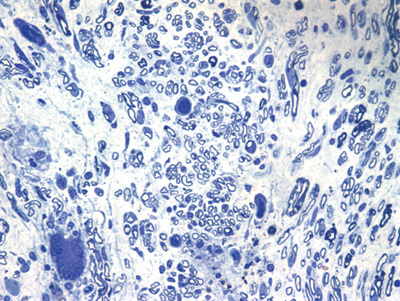
Figura 5. Microscopia do tronco do nervo facial após 3 semanas de transecção e sutura (RATO VII)
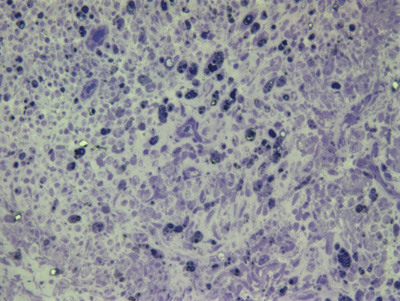
Figura 6. Microscopia do tronco do nervo facial após 3 semanas de transecção e sutura (RATO VI)
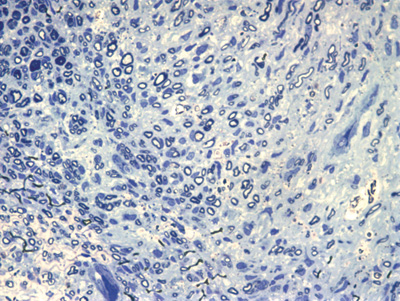
Figura 7. Microscopia do tronco do nervo facial após 5 semanas de transecção e sutura (RATO IV)
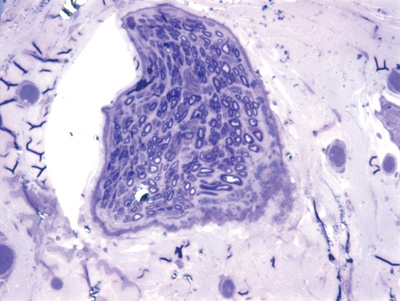
Figura 8. Microscopia do tronco do nervo facial após 5 semanas de transecção e sutura (RATO X)
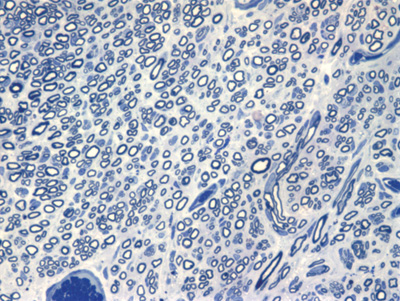
Figura 9. Microscopia do tronco do nervo facial após 7 semanas de transecção e sutura (RATO V)
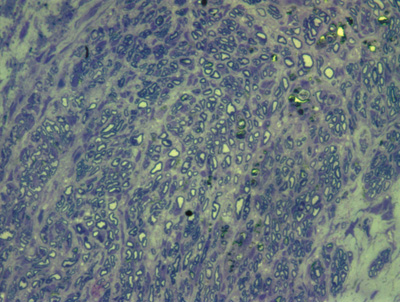
Figura 10. Microscopia do tronco do nervo facial após 7 semanas de transecção e sutura (RATO VIII)
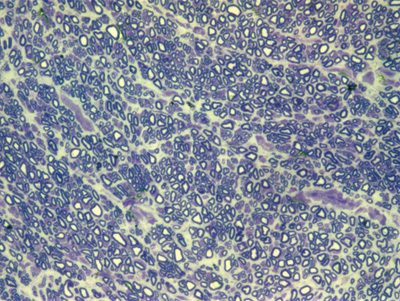
Figura 11. Microscopia do tronco do nervo facial após 9 semanas de transecção e sutura (RATO XI)
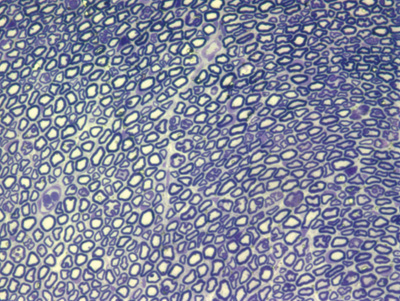
Figura 12. Microscopia do tronco do nervo facial após 9 semanas de transecção e sutura (RATO IX)
Na análise histológica quantitativa, tivemos problemas em duas imagens. Na Figura 4, devido ao depósito de corante já relatado anteriormente, foi necessária a "mudança" de três das nove janelas sorteadas para a realização da contagem. Na Figura 8, a "retração" do material impossibilitou também a análise quantitativa do mesmo. Apresentamos os dados da análise histométrica na Tabela 2, compilando a contagem em cada um das nove "janelas" sorteadas para cada rato, a contagem total de cada animal e a média de cada grupo. Notamos o incremento temporal do número de fibras mielinizadas, sendo que no grupo 7 SEM obtivemos valores muito próximos ao grupo 0 SEM, sendo este suplantado no grupo 9 SEM. O Gráfico 2 ilustra o fato. Aqui também não foram realizadas análises estatísticas por termos uma amostra de apenas dois animais por grupo.
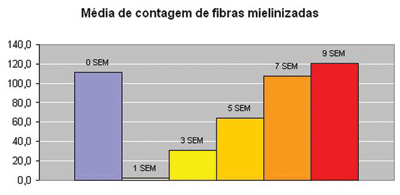
Gráfico 2. Médias de contagem de fibras mielinizadas.
Procurando observar a correlação entre os resultados da observação clínica e da contagem de fibras mielinizadas, apresentamos a Tabela 3 e o Gráfico 3 que correlacionam estas duas séries de resultados. Organizamos os ratos em uma série crescente de resultados na contagem de fibras mielinizadas, excluindo o rato X desta análise já que não obtivemos uma análise histométrica do mesmo, como já relatado. Em seguida listamos seus resultados na observação clínica e notamos uma correlação direta entre os dois resultados, sobretudo nos grupos 1 SEM, 3 SEM e 5 SEM, nos quais uma maior contagem de fibras indicou uma maior pontuação clínica. Já nos grupos 7 SEM e 9 SEM, uma maior contagem não indicou um melhor resultado clínico diretamente proporcional.
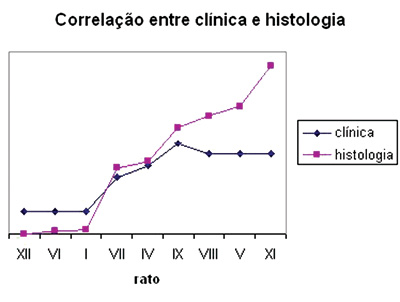
Gráfico 3. Correlação entre resultados de clínica e contagem de fibras.
O estabelecimento de um paradigma experimental de lesão do NF é o passo inicial e fundamental para o estudo da ação de possíveis fatores neurotróficos. Apesar de concordarmos que ainda não há um modelo experimental perfeito12, este deveria apresentar as características mínimas de ser prático e facilmente reprodutível, permitindo a análise temporal e objetiva do processo de regeneração neural. Diversos animais se prestam ao estabelecimento de modelos experimentais para estudos sobre o NF, como o gato2, o coelho13, o hamster14, o camundongo15, o "guinea pig"16 e o porco17. Optamos por utilizar o rato Wistar porque, além de ser um animal já utilizado em estudos semelhantes na literatura18-25, é facilmente obtido no biotério desta Instituição, tem um manejo relativamente fácil podendo ser mantidos em gaiolas coletivas, é facilmente anestesiado e o animal com paralisia facial não apresenta grande morbidade para se alimentar, mesmo quando esta é bilateral12. Optamos por padronizar o modelo com animais do sexo masculino porque há relatos sobre a influência do gênero na regeneração neural, sendo naturalmente maior em fêmeas de hamster14, e para que não houvesse necessidade de controle do ciclo hormonal dos animais. A anatomia do NF extratemporal do rato também já está descrita na literatura, sendo que o seu tronco, de aproximadamente 6mm, é fácil e constantemente acessado por uma incisão retroauricular simples, variando em menos de 2,1% em contagens de fibras mielínicas seriadas, não sofrendo influencias quanto ao peso e idade do animal12,26. Quanto às desvantagens deste animal, citariamos o fato do tronco do NF do rato ser monofascicular, o que difere do ser humano12, além da pequena expressão de mímica facial deste animal, o que dificulta o estabelecimento de escalas visuais de recuperação de motricidade.
Uma vez estabelecido o animal, procuramos escolher o tipo de lesão neural. Diversos estudos vem utilizando o "esmagamento" do NF8,21,27,28, porém optamos pela secção completa do mesmo por se tratar de uma lesão mais reprodutível já que é sempre grau V na classificação de Suderland17,18. Na reparação de uma lesão completa do NF poderíamos optar por utilizar tubos de silicone, bastões de colágeno, cola de fibrina, fáscia temporal ou enxertos livres neurais ou de músculo1,2,7,13. Optamos pela sutura epineural, pois além de ser bem estabelecida na literatura12,16,18,19,20,24,25,29,30, ela reproduz melhor a correção cirúrgica realizada em nervos de seres humanos31, sendo relativamente fácil a obtenção de um bom alinhamento e com pouca tensão dos cotos com apenas 1 ponto, no caso do rato1,7.
Diversos métodos para avaliar a regeneração neural em animais já foram propostos. Escalas comportamentais8,28,32,33, análises eletrofisiológicas2,10,19,32, análises de fibras musculares19,20,29, análises de núcleos centrais18,19,21-23,30,34-36 e análises de axônios2,10,16,19,31-33 já foram utilizadas na literatura. Optamos por realizar uma análise comportamental porque esta não reflete apenas um aspecto anatômico e sim o aspecto primordial da regeneração que é a recuperação da funcionalidade do movimento facial37. Outros autores, utilizando estudos de lesão do NF em roedores já haviam utilizado escalas clínicas de observação do movimento de vibrissas, em muito semelhantes ao nosso8,28. Procurando incrementar a análise comportamental, associamos a observação do fechamento da rima ocular baseado na experiência de outros autores com animais como o gato2. Porém é inegável que esta medida comportamental tem um grande componente de subjetividade e menor reprodutibilidade. Optamos então por associar uma avaliação histométrica, por microscopia óptica das fibras mielinizadas do axônio, que além de ser a mais utilizada na literatura, apresenta um custo aceitável16,19,31,32,37-39. Algumas limitações desta técnica merecem destaque. Ela não permite aferir a presença de fibras amielínicas - só visibilizadas por microscopia eletrônica, metodologia ainda de alto custo para aplicação em grandes séries13,37 - e não avalia o diâmetro e espessura da bainha mielínica, quesitos que seriam interessantes para acompanhar a regeneração. Tentamos avaliar estes dois últimos quesitos através de análises automatizadas de áreas capturadas por sistemas de matizes de cores, porém os dados não se mostraram reprodutíveis e confiáveis, pois existe grande dificuldade em conseguir corar a mielina com um tom específico, problema já relatado por outros autores37.
Uma vez estabelecido o modelo, passamos a discussão de nossos resultados comparados às observações de outros autores na literatura. Quanto à escala de observação comportamental, obtivemos resultados que demonstraram uma recuperação temporal da movimentação facial, o que corresponde bem ao resultado de outros autores que utilizaram modelos semelhantes em roedores27,28. Em uma escala máxima de 10 pontos, nossos animais estabeleceram uma recuperação de 50% da função entre a 3ª e a 5ª semanas e de 75% na 9ª semana, quando encerramos o experimento. O fechamento da rima ocular nos pareceu o parâmetro mais precoce e facilmente observável para esta análise, enquanto o retorno do movimento das vibrissas foi mais lento. Essa observação coaduna com a de outros autores que ressaltam ser o retorno parcial do "blink reflex" o sinal mais precoce de recuperação neural em roedores28.
Quanto à nossa análise qualitativa da histologia, observamos o surgimento de pequenos grupamentos de fibras mielinizadas, sobretudo após a 3ª semana, processo intensificado nas semanas seguintes, acompanhado de um aumento no diâmetro das mesmas, sobretudo na 7ª e 9ª semanas. Esta observação encontra correspondente na literatura em trabalhos com ratos em NF19,33 e em nervo ciático38-40, nos quais os autores evidenciam um aumento gradual em número e diâmetro das fibras mielinizadas ao longo da regeneração neural. Isto seria o reflexo do processo inicial de brotamento múltiplo de fibras do coto proximal que invadem o coto distal e que ao longo do tempo vão aumentando em diâmetro, refletindo uma maior capacidade de condução neural. O tempo em que iniciamos a percepção da regeneração neural também coaduna com as observações clássicas já descritas na literatura, onde a degeneração walleriana se completaria em torno da 2ª semana e o surgimento do brotamento das fibras do coto proximal e o início da "invasão" do coto distal, em torno do 10º dia1,7,41.
Quanto a nossa análise quantitativa histométrica, observamos que a partir da 3ª semana ocorreu um aumento gradativo na contagem de fibras mielinizadas, atingindo um valor muito próximo do normal na 7ª semana e suplantando este na 9ª semana. Este fato também já encontra similaridade na literatura, onde diversos autores relatam um aumento progressivo no número de fibras mielínicas ao longo do processo de regeneração38-40. O fato da contagem da 9ª semana suplantar a do grupo controle (OSEM), ao nosso ver é decorrente do menor diâmetro que as fibras deste grupo apresentam em relação ao controle, fibras as quais seriam mais "imaturas" que as de maior diâmetro. Tanto isto nos parece verdade, que o rato IX-9SEM (Figura 9), que foi o que apresentou maior semelhança qualitativa de fibras em relação ao grupo O SEM, e também uma melhor pontuação clínica, apresentou uma quantidade de fibras menor que os ratos XI-9SEM, V-7SEM e VIII-7SEM. Porém, como realizamos apenas 2 animais por grupo, uma comparação estatística entre eles não se mostraria adequada.
Quando comparamos os resultados de nossa análise de comportamento clínico e histométrico (Gráfico 3), podemos observar que uma maior pontuação clínica é acompanhada por uma maior contagem de fibras, sobretudo até um "platô" constituído pelos animais dos grupos 7SEM e 9SEM, onde a contagem permanece ascendente e a melhora clínica praticamente se estabiliza. Essa "dissociação" mais tardia entre os dois parâmetros de regeneração neural, que ocorreu nas últimas semanas, nos parece decorrente de dois fatos. Primeiro, que nossa escala de avaliação clínica é um tanto que limitada, já que como ressaltamos anteriormente, o rato não nos oferece uma expressão facial com movimentos muito refinados disponíveis para a mesma. Segundo, que um aumento apenas em número das fibras não necessariamente reflete uma melhora da função final de movimentação, fato também já ressaltado na literatura1,7,37,42.
CONCLUSÃOConcordamos que não existe um paradigma experimental perfeito para o estudo da recuperação de lesão do NF, porém acreditamos ter estabelecido um método adequado através de análises comportamental e histométrica.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Choi D, Dunn LT. Facial nerve repair and regeneration: an overview of basic principles for neurosurgeons. Acta Neurochir (Wien) 2001;143:107-14.
2. Bento RF, Miniti A. Comparison between fibrin tissue adhesive, epineural suture and natural union in the intratemporal facial nerve of cats. Acta Otolaryngol Suppl 1989;465:1-36.
3. Khomura E, Yuguchi T, Yoshimine T, Fujinaka T, Koseki N, Sano A, Kishino A, Nakayama C, Sakaki T, Nonaka M, Takemoto O, Hayakawa T. BDNF atelocollagen mini-pellet accelerates facial nerve regeneration. Brain Research 1999;849:235-8.
4. Gluck T. Ueber Transplantation, regeneration und entzündliche neubildung. Berl Klin Wochenschr 1881;18:529-31.
5. Bunnell S. Suture of the facial nerve within the temporal bone with a report of the first successful case. Surg Gynec Obst 1927;45:7-12.
6. Davis L, Perret G, Carroll W. Surgical principles underlying the use of grafts in the repair of peripheral nerve injuries. Annals of Surg 1945;121(5):686-98.
7. Toriumi DM, Wollford TJ, Teitlebaum B, Sabnani K, O'Grady K. Growth factors in nerve regeneration. Facial Plastic Surg Clin North Am 1997;5(3):289-302.
8. Gilad VH, Tetzlaff WG, Rabey JM, Gilad GM. Acclerated recovery following polyamines and aminoguanidine treatment after facial nerve injury in rats. Brain Research 1996;724:141-4.
9. Lindsay RM. Neuron saving schemes. Nature 1995;373:289-90.
10. Byers JM, Clark KF, Thompson GC. Effect of pulsed eletromagnetic stimulation on facila nerve regeneration. Arch Otolaryngol Head Neck Surg 1998;124:383-9.
11. Abercrombie M. Estimation of nuclear population from microtome sections. Anatomical Record 1946;94(2):239-46.
12. Mattox DE, Felix H. Surgical anatomy of the rat facial nerve. Am J Otol 1987;8(1):43-7.
13. Spector JG, Lee P, Derby A, Roufa DG. Early stages of facial nerve regeneration through silicone chambers in the rabbit. Laryngoscope 1991;101:1109-23.
14. Kinderman NB, Jones KJ. Axotomy-induced changes in ribossomal RNA levels in female hamster facial motoneurons: differential effects of gender and androgen exposure. Exp Neurol 1994;126:144-8.
15. Fawcett JP, Bamji SX, Causing CG, Aloyz R, Ase AR, Reader TA, McLean JH, Miller FD. Functional evidence that BDNF is an anterograde neural trophic factor in the CNS. J Neurosc 1998;18(8):2808-21.
16. Yuh-Shyang C, Chuan-Jen H, Tien-Chen L, Yanagihara N, Murakami S. Histological rearrangement in the facial nerve and central nuclei following immediate and delayed hypoglossal-facial anastomosis. Acta Otolaryngol 2000;120:551-6.
17. David DM. Facial nerve trauma: optimal timing for repair. Laryngoscope 1991;101:835-48.
18. Guntinas-Lichius O, Streppel M, Angelov DN, Stennert E, Neiss WF. Effect of delayed facial-facial suture on facial nerve regeneration: a horseradish peroxidase tracing study in the rat. Acta Otolaryngol (Stockh) 1997;117:670-4.
19. Guntinas-Lichius O, Effenberger K, Angelov DN, Klein J, Streppel M, Stennert E, Neiss WF. Delayed rat facial nerve repair leads to accelerated and enhanced muscle reinnervation with reduced collateral axonal sprouting during a definitive period using a cross-anastomosis paradigm. Exp Neurol 2000;162:98-111.
20. Jergovic D, Stal P, Lindman D, Lindvall B, Hildebrand C. Changes in a rat facial nerve after facial nerve injury and repair. Muscle Nerve 2001 Sept;1202-12.
21. Terao E, Janssens S, Aguilar VDB, Portier MM, Klosen P. In vivo expression of the intermediate filament peripherin in rat motoneurons: modulation by inhibitory and stimulatory signals. Neurosc 2000;101(3):679-88.
22. Hol EM, Schwaiger FW, Werner A, Schmitt A, Raivich G, Kreutzberg GW. Regulation of the lim-type homebox gene islet-1 during neuronal regeneration. Neurosc 1999;88(3):917-25.
23. Hass CA, Donath C, Kreutzberg GW. Differential expression of immediate early genes after transection of the facial nerve. Neurosc 1993;53(1):91-99.
24. Fernandez E, Pallini R, Marchese E, Lauretti L, La Marca F. Qualitative, morphological, and somatotopic nuclear changes after facial nerve regeneration in adult rats: a possible challenge to the "no new neurons" dogma. Neurosurg 1995;37(3):456-63.
25. Guntinas-Lichius O, Neiss WF, Schulte E, Stennert E. Qualitative image analysis of the chromatolysis in rat facial nerve and hypoglossal motoneurons following axotomy with and without reinnervation. Cell Tissue Res 1996;286:537-41.
26. Semba K, Egger MD. The facial "motor" nerve of the rat: control of vibrissal movement and examination of motor and sensory components. J Comparative Neurol 1986;247:144-58.
27. Jones KJ, Brown TJ, Damaser M. Neuroprotective effects of gonadal steroids on regenerating peripheral motoneurons. Brain Res Review 2001;37:372-82.
28. Jones KJ. Recovery from facial paralysis following crush injury of the facial nerve in hamsters: differential effects of gender and androgen exposure. Exp Neurology 1993;121:133-8.
29. Constantinidis J, Akbarian A, Steinhart H, Iro H, Mautes A. Morphological changes of denervated and reinnervated rat facial muscle. Acta Otolaryngol 2001;121:763-7.
30. Fernandez E, Pallini R, Marchese E, Lauretti L, Bozzini V, Sbriccoli A. Reconstruction of peripheral nerves: the phenomenon of bilateral reinnervation of muscles originally innervated by unilateral motoneurons. Neurosurg 1992;30(3):364-9.
31. Wong BJF, Mattox DE. The effects of polyamines and polyamine inhibitors on rat sciatic and facial nerve regeneration. Exp Neurol 1991;111:263-6.
32. Yian CH, Paniello RC, Spector JG. Inhibition of motor nerve regeneration in a rabbit facial nerve model. Laryngoscope 2001;111:786-91.
33. Guntinas-Lichius O, Angelov DN, Tomov TL, Dramiga J, Neiss WF, Wewetzer K. Transplantation of olfactory ensheathing cells stimulates the collateral sprouting from axotomized adult rat facial motoneurons. Exp neurol 2001;172:70-80.
34. Dauvergne C, Pinganaud G, Buisseret P, Buisseret-Delmas C, Zerari-Mailly F. Reticular premotor neurons projecting to both facial and hypoglossal nuclei receive trigeminal afferents in rats. Neurosc Lett 2001;311:109-12.
35. Sendtner M, Kreutzberg GW, Thoenen H. Ciliary neurotrophic factor provents the degeneration of motor neurons after axotomy. Nature 1990;345:440-1.
36. Mattsson P, Aldskogius H, Sevensson M. Nimodipine-induced improved survival rate of facial motor neurons following intracranial transection of the facial nerve in the adult rat. J Neurosurg 1999;90:760-5.
37. Frykman GK, McMillan PJ, Yegge S. A review of experimental methods measuring peripheral nerve regeneration in animals. Orthop Clin North Am 1988;19(1):209-19.
38. Lewin SL, Utley DS, Cheng ET, Verity AN, Terris DJ. Simultaneous treatment with BDNF and CNTF after peripheral nerve transection and repair enhances rate of functional recovery compared with BDNF treatment alone. Laryngoscope 1997;107:992-9.
39. Gershenbaum MR, Roisen FJ. The effects of dibutyryl cyclic adenosine monophosphate on the degeneration and regeneration of crush-lesioned rat sciatic nerves. Neurosc 1980;5:1565-80.
40. McQuarrie IG, Grafstein B, Gershon MD. Axonal regeneration in the rat sciatic nerve: effect of a conditioning lesion and of dbcAMP. Brain Research 1977;132:443-53.
41. Terenghi G. Peripheral nerve regeneration and neurotrophic factors. J Anat 1999;194:1-14.
42. Guntinas-Lichius O, Irintchev A, Streppel M, Lenzen M, Grosheva M, Wewetzer K, Neiss WF, Angelov DN. Factors limiting motor recovery after facial nerve transection in the rat: combined structural and functional analyses. Eur J Neurosc 2005;21:391-402.
1 Mestre em otorrinolaringologia pela UNIFESP/EPM, pós-graduando/ Doutorado.
2 Mestre em otorrinolaringologia pela UNIFESP/EPM, pós-graduando/ Doutorado.
3 Mestre em otorrinolaringologia pela UNIFESP/EPM, médica.
4 Doutor em otorrinolaringologia pela UNIFESP/EPM, professor adjunto da disciplina de otorrinolaringologia da UNIFESP/EPM.
5 Professor livre-docente pela FMUSP, professor afiliado da UNIFESP/EPM.
Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Universidade Federal de São Paulo.
Endereço para correspondência: Andrei Borin - Rua Loefgreen 1587 apto. 152 V. Clementino São Paulo SP 04040-032.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 2/5/2006 e aprovado em 20/6/2006.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 2 de maio de 2006. Cod. 1891.
Artigo aceito em 20 de junho de 2006.


