INTRODUÇÃOO ameloblastoma é uma neoplasia benigna comum nos ossos maxilares, originada de remanescentes da lâmina dentária. Histologicamente, ocorre em vários padrões, incluindo os tipos folicular, plexiforme, acantomatoso, de células granulosas, de células basais e desmoplásico. Este último descrito inicialmente por Eversole et al.1, em 1984, caracteriza-se, de modo geral, por uma pronunciada colagenização do estroma, o qual se encontra permeado por pequenas ilhas e cordões de epitélio tumoral odontogênico. Apresenta também um aspecto radiográfico incomum e uma marcante diferença na localização anatômica em comparação com o ameloblastoma convencional.
Nos últimos anos, a literatura tem descrito "lesões híbridas" de ameloblastoma desmoplásico e ameloblastoma convencional, que se caracterizam microscopicamente por apresentarem áreas de ameloblastoma folicular ou plexiforme coexistindo com áreas de ameloblastoma desmoplásico2,3.
Em adição, diversos estudos têm demonstrado a importância da matriz extracelular (MEC) na modulação do comportamento das células neoplásicas e nos aspectos histomorfológicos das células tumorais4. Sendo assim, o presente trabalho propõe-se a relatar um caso de "lesão híbrida" de ameloblastoma desmoplásico (AD) e convencional em mandíbula, destacando os achados imuno-histoquímicos relativos à expressão das proteínas tenascina, fibronectina, e colágeno I no estroma da lesão.
APRESENTAÇÃO DO CASOUm homem de 36 anos procurou atendimento odontológico com a queixa de aumento de volume, indolor. O exame clínico extra-oral revelou um ligeiro aumento de volume do lado direito da mandíbula. Intraoralmente, foi observado um aumento de volume de consistência dura estendendo-se do canino inferior à região de pré-molar recoberto por mucosa de aspecto usual. As unidades dentárias envolvidas apresentavam-se ligeiramente deslocadas, com discreta mobilidade e sem comprometimento pulpar. O exame radiográfico revelou uma área radiolúcida de limites pouco nítidos na região entre as unidades 33 e 37. Sob a suspeita clínica de ameloblastoma foi realizada uma biópsia incisional cujo diagnóstico histopatológico foi confirmado. A lesão foi então cirurgicamente removida com ressecção em bloco, preservando-se a borda inferior da mandíbula. No exame histopatológico subseqüente foi estabelecido o diagnóstico de lesão híbrida de ameloblastoma desmoplásico e folicular.
Para a técnica imuno-histoquímica foram preparadas secções de 3µm, submetidas ao método streptavidina-biotina. Os anticorpos utilizados neste estudo, suas fontes, diluições e protocolos estão listados na Tabela 1. Os cortes foram submetidos à recuperação antigênica, utilizando-se pepsina 1% (1,0 g de pepsina em 100ml de solução de ácido clorídrico 10% em pH 1,8 por 2 horas a 37oC) e calor provocado por vapor. Foram incluídos também controles positivos e negativos apropriados. A diaminobenzidina foi utilizada como cromógeno e os cortes contracorados com hematoxilina de Mayer.
Achados histopatológicosO exame histopatológico mostrou áreas de ameloblastoma desmoplásico e folicular. No primeiro, foram observadas ilhas epiteliais tumorais dispersas em estroma conjuntivo densamente colagenizado (Figura 1). Estas ilhas tumorais, que pareciam estar comprimidas, eram compostas por células cuboidais ou fusiformes exibindo periferia celular em paliçada ausente. O segundo subtipo histológico era representado por ilhas epiteliais cujas células periféricas distribuíam-se em paliçada semelhantes aos ameloblastos do órgão do esmalte (Figura 1). As células da região central eram semelhantes ao retículo estrelar do órgão do esmalte. Por vezes, esses arranjos celulares exibiam degeneração cística e, eventualmente, metaplasia escamosa. O estroma era menos denso e composto por escassos linfócitos.
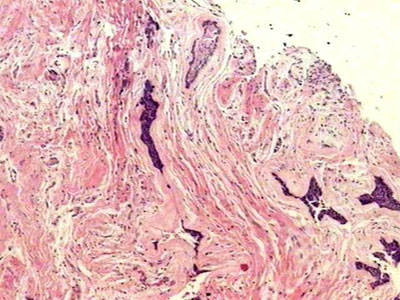
Figura 1. Estroma conjuntivo densamente colagenizado permeado por ilhas epiteliais neoplásicas comprimidas, bem como por ilha epitelial com células periféricas dispostas em paliçada (H/E, 40x).
O padrão de marcação da tenascina foi do tipo fibrilar com intensidade variando de fraca a moderada no estroma correspondente ao ameloblastoma folicular. Já no estroma correspondente ao AD, não foi observada imunomarcação para esta proteína da MEC (Figura 2). Nas ilhas tumorais do ameloblastoma folicular que exibiam degeneração cística, foi observada uma intensa e homogênea imunomarcação, às vezes linear contornando os espaços císticos. Por vezes, as ilhas tumorais exibindo metaplasia escamosa também encontravam-se imunomarcadas.
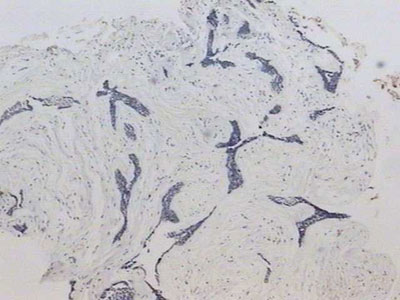
Figura 2. Ausência de imunomarcaão para tenascina no estroma da lesão (streptavidina biotina, 40x).
Toda a extensão do estroma tumoral, quer seja do ameloblastoma folicular ou desmoplásico, exibiu uma forte imunomarcação distribuída em padrão fibrilar (Figura 3). Na interface epitélio/mesênquima, observou-se forte marcação sob a forma linear, principalmente nas áreas correspondentes ao ameloblastoma convencional. Algumas células epiteliais nas ilhas tumorais em degeneração cística também expressaram esta proteína.
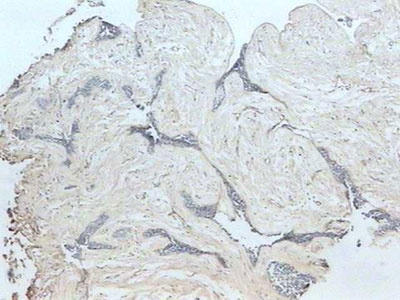
Figura 3. Padrão fibrilar da fibronectina no estroma do tumor (streptavidina biotina, 40x).
Semelhante à fibronectina, toda a extensão do estroma tumoral da lesão híbrida do ameloblastoma desmoplásico exibiu, também, uma forte imunomarcação para esta proteína da MEC, em padrão fibrilar envolvendo as ilhas tumorais (Figura 4). Por vezes, na interface epitélio/mesênquima, observou-se intensa imunomarcação linear, especialmente nas áreas correspondentes ao ameloblastoma convencional. Em adição, foi observada ausência do colágeno I no interior das ilhas tumorais.
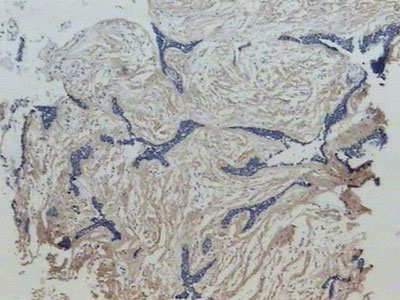
Figura 4. Forte marcação para o colágeno I em padrão fibrilar no estroma desmoplásico da lesão (streptavidina biotina, 40x).
Na literatura, verifica-se que o AD representa o tumor odontogênico de menor incidência. Entre 89 casos de ameloblastomas estudados por Takata et al.5, sete (7,9%) foram diagnosticados como AD, e apenas um (1,1%) como "lesão híbrida". No Japão, o AD contabilizou 5,3% de todos os casos de ameloblastoma intra-ósseos diagnosticados em 27 anos6. Os aspectos clínicos relatados no presente caso enquadram-se naqueles citados na literatura, onde o AD apresenta-se como um aumento de volume da face, indolor e com uma sutil predileção pelo sexo masculino5,7.
Radigraficamente, o AD apresenta aspectos distintos do ameloblastoma convencional, caracterizando-se como uma lesão radiolúcida de limites pouco nítidos, com aspectos de bolha de sabão7. Em muitos casos, a lesão aparece como uma área radiolúcida contendo radiopacidades mimetizando lesões fibro-ósseas8.
Por apresentar características clínicas e radiográficas próprias, o ameloblastoma desmoplásico (AD) tem sido considerado, por alguns autores, como uma entidade cllinicopatológica distinta2,5. Isto foi recentemente confirmado pela Organização Mundial da Saúde (OMS), cuja classificação organizou os ameloblastomas em sólido, extraósseo, desmoplásico e unicístico9.
As características histopatológicas descritas para o presente caso estão de acordo com os critérios diagnósticos estabelecidos para uma "lesão híbrida" de ameloblastoma desmoplásico e convencional conforme apontam Waldron e El-mofty2. Destarte, tal lesão caracteriza-se por conter áreas de AD em associação com áreas típicas de ameloblastoma folicular. As áreas correspondentes à variante desmoplásica caracterizam-se por pequenos ninhos e cordões de epitélio tumoral odontogênico, dispostos em um abundante estroma densamente colagenizado, o que faz com que estas ilhas tumorais pareçam estar comprimidas. As células periféricas perdem aquela característica semelhante a ameloblastos com inversão de polaridade. Em adição, a porção central das ilhas tumorais pode apresentar uma hipercelularidade, com ocasional metaplasia escamosa e focos centrais de queratinização8. Neste último caso, deve-se incluir no diagnóstico diferencial o tumor odontogênico escamoso9. Outros tumores, como o fibroma odontogênico, também devem ser considerados no diagnóstico diferencial do AD7.
No presente caso, não foi observada reação inflamatória exuberante3,5, muito embora uma das alternativas para justificar a desmoplasia seriam os fenômenos decorrentes da inflamação.
Sabe-se que a característica mais importante do AD é a extensa colagenização presente no estroma da lesão, também denominada de desmoplasia1,2,5,10. Tem sido proposto que este fenômeno tem origem a partir de uma nova síntese de proteínas da matriz extracelular11. Tais componentes desempenham um papel fundamental na sustentação, adesão, proliferação, migração e diferenciação das células tumorais, interferindo no comportamento e modulação das células tumorais12,13. Sendo assim, investigamos a distribuição da tenascina, fibronectina e colágeno I no caso aqui relatado.
A tenascina é uma proteína da matriz extracelular com um padrão de distribuição bem mais restrito. É expressa durante a embriogênese, principalmente nas áreas de interação epitélio-mesênquima14. Em casos de ameloblastoma e de tumor odontogênico adenomatóide, a tenascina está principalmente localizada na interface parênquima-estroma, sugerindo uma participação importante dessa proteína na relação entre as células tumorais e o tecido conjuntivo adjacente12,13. No caso aqui relatado, o aparecimento da tenascina apenas nas áreas correspondentes ao ameloblastoma folicular poderia explicar o comportamento mais agressivo deste padrão histológico, uma vez que a proteína tenascina tem sido observada em ambientes instáveis como aqueles apresentados pelas neoplasias4. As ilhas tumorais também mostraram-se positivas para a tenascina, especialmente naquelas áreas que exibiam degeneração cística. Este achado também foi observado por Mori et al.12 e Medeiros13, os quais atribuem a imunolocalização desta proteína ao mecanismo de formação e expansão dos espaços císticos.
A fibronectina representa uma proteína adesiva de alto peso molecular, cuja distribuição segue a mesma do tecido conjuntivo frouxo. Sua presença tem sido associada a funções celulares como adesão, migração, proliferação e diferenciação, estando relacionada com momentos importantes da embriogênese, desenvolvimento tecidual e cicatrização. Durante a odontogênese, interfere na diferenciação e maturação dos odontoblastos14.
Nos ameloblastomas, a fibronectina é produzida pelas células presentes no estroma tumoral14. Sua distribuição é relativamente uniforme no estroma de vários tipos histológicos do ameloblastoma, com maior intensidade na interface epitélio-mesênquima, exceto na variante desmoplásica, provavelmente devido à ausência de semelhança com os pré-ameloblastos por parte das células epiteliais periféricas13. Aspecto semelhante também foi demonstrado no presente caso, onde a fibronectina apresentou-se fortemente marcada na interface epitélio-mesênquima nas áreas tumorais correspondentes ao ameloblastoma folicular.
A tenascina tem sido descrita como capaz de modular a ação de outras moléculas da matriz extracelular, afetando a forma da célula e bloqueando a fibronectina4. No presente trabalho, este aspecto não foi observado, tendo em vista que a fibronectina foi observada nas áreas também imunomarcadas pela tenascina.
O colágeno I constitui a principal estrutura da pele, tendões e ossos, além de ser o maior constituinte orgânico da dentina15. No ameloblastoma desmoplásico, há intensa imunopositividade desta proteína em comparação aos demais subtipos histológicos13. De forma semelhante, o colágeno tipo I apresentou uma forte imunomarcação no estroma do presente caso, refletindo um alto teor desta proteína no AD.
COMENTÁRIOS FINAISApesar da tenascina, fibronectina e colágeno I participarem da modulação tumoral da "lesão híbrida" de ameloblastoma desmoplásico e folicular, o mecanismo biológico da desmoplasia suscita novas investigações a respeito de outros constituintes da matriz extracelular, bem como de outros métodos de estudo, na tentativa de compreender a conspícua colagenização estromal e a sua relação com o componente epitelial da lesão.
REFERÊNCIAS BIBLIOGRÁFICAS1. Eversole LR, Leider AS, Hansen LS. Ameloblastomas with pronounced desmoplasia. J Oral Maxillofac Surg 1984;42:735-40.
2. Waldron CA, El-Mofty SM. A histopathologic study of 116 ameloblastomas with special reference to desmoplastic variant. Oral Surg Oral Med Oral Pathol 1987;63:441-51.
3. Takata T, Ogawa I, Zhao M, Kudo Y, Sato S, Takekoshi T et al. So-called "hybrid" lesion of desmoplastic and conventional ameloblastoma: report of a case and review of the literature. Pathol Int 1999;49:1014-8.
4. Chiquet-Ehrishman R, Mackie EJ, Pearson CA, Sakakura T. Tenascin: an extracellular matrix protein involved in tissue interactions during fetal development and oncogenesis. Cell 1986;47:131-9.
5. Takata T, Miyauchi M, Ito H, Ogawa I, Kudo Y, Zhao M et al. Clinical and histopathological analyses of desmoplastic ameloblastoma. Pathol Res Pract 1999;195:660-75.
6. Kishino M, Murakami S, Fukuda Y, Ishida T. Pathology of the desmoplastic ameloblastoma. J Oral Pathol Med 2001;30:35-40.
7. Lam KY, Chan ACL, Wu PC, Chau KY, Tiedman H, Wei W. Desmoplastic variant of ameloblastoma in Chinese patients. B J Oral Maxillofac Surg 1998;36:129-34.
8. Phillipsen HP, Ormiston IW, Reichart PA. The desmo- and osteoplastic ameloblastoma Histologic variant or clinicopathologic entity? Case reports. J Oral Maxillofac Surg 1992;21:352-7.
9. Philipsen HP, Reichart PA, Slootweg PJ, Slater LJ. In: Barnes L, Eveson JW, Reichart P, Sidransky S. World Health Organization Classification of Tumours, Pathology & Genetics. Head and Neck and Tumours. 1st ed. Lyon: IARC Press; 2005. p. 285-6.
10. Phillipsen HP, Reichart PA, Takata T. Desmoplastic ameloblastoma (including "hybrid" lesion of ameloblastoma) Biological profile based on 100 cases from the literature and own files. Oral Oncol 2001;37:455-60.
11. Beckley MI, Farhood V, Helfend LK, Alijanian A. Desmoplastic ameloblastoma of the mandible: a case report and review of the literature. J Oral Maxillofac Surg 2002;60:194-8.
12. Mori M, Yamada T, Doi T, Ohmura Y, Takai Y, Shrestha P. Expression of tenascin in odontogenic tumours. Oral Oncol Eur J Cancer 1995;31B:275-9.
13. Medeiros AMC. Expressão da fibronectina tenascina e colágeno I em ameloblastoma e no tumor odontogênico adenomatóide (Tese de Doutorado). Natal, Universidade Federal do Rio Grande do Norte, 2001.
14. Heikinheimo K, Morgan PR, Happonem R-P, Stenman G, Virtaneu I. Distribution of extacellular marix proteins in odontogenic umours and developing teeth. Virchows Arch B Cell Pathol 1991;61:101-9.
15. Slavkin HC. Molecular determinants during dental morphogenesis and cytodifferentiation: a review. J Craniofac Genet Dev Biol 1991;11:338-49.
1 Doutor em Patologia Bucal, Professor Adjunto da Faculdade de Odontologia da Universidade Federal da Bahia.
2 Mestre em Odontologia, Professora Assistente do Curso de Odontologia da Universidade Estadual do Sudoeste da Bahia.
3 Doutor em Odontologia, Professor Adjunto da Faculdade de Odontologia da Universidade Federal da Bahia.
4 Doutora em Estomatologia, Professora Adjunta da Faculdade de Odontologia da Universidade Estadual de Feira de Santana.
5 Doutora em Patologia Bucal, Professora Adjunta da Faculdade de Odontologia da Universidade Federal do Rio Grande do Norte.
Universidade Federal da Bahia.
Endereço para correspondência: Jean Nunes Santos - Av. Araújo Pinho 62 Canela Salvador BA 40140150
Tel/Fax: (0xx71) 336 4343 - E-mail: jeanunes@ufba.br
Agradecemos à FAPESB (convênios 032299, 200/04) pelo apoio financeiro.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 1 de junho de 2006. Cod. 2046.
Artigo aceito em 2 de julho de 2006.


