INTRODUÇÃODiversos biomateriais estão sendo testados por apresentar habilidade de regeneração óssea tais como: hidroxiapatita de cálcio e fosfato tricálcico1. Todos esses substituintes porosos sintéticos compartilham vantagens em relação aos auto e alo-enxertos, incluindo sua fácil esterilização e armazenamento além de sua ilimitada disponibilidade. Já as suas desvantagens incluem: delicado manuseio, graus variáveis de reabsorção, pobre performance em defeitos diafisários, potenciais efeitos adversos no remodelamento ósseo2.
A Hidroxiapatita sintética, [CaIO(PO4)(OH)], consiste em um material inorgânico comumente usado em falhas ósseas e constituinte da fase mineral dos tecidos calcificados. Possui propriedades de biocompatibilidade e de osteocondução que o coloca entre os mais importantes substitutos ósseos da atualidade. Pode ser utilizada em defeitos ósseos sem carga ou em falhas em que cargas, estresses torcionais ou cisalhamentos são neutralizados por implantes rígidos, como placas e parafusos3.
A regeneração óssea promovida pela hidroxiapatita tem sido estudada em diversos modelos animais e humanos. Sua primeira implantação em modelos animais foi em defeitos de tíbia proximal canina. Observou-se rápida incorporação do enxerto após seu implante, ausência de efeitos adversos, promovendo uma alta regeneração óssea4.
A Submucosa do Intestino Delgado (SID) Porcina é uma camada multilaminar acelular composta principalmente por colágeno que tem demonstrado possuir características que a tornam um material adequado na bioengenharia de tecidos em variados sítios anatômicos5.
Segundo vários autores, a SID apresenta como vantagem a propriedade de ser composta por 90% de colágeno do tipo I, fibronectinas, fatores de crescimento, glicosaminoglicanos, protaminoglicanos e glicoproteinas6. Sendo um tecido acelular, a fibronectina é o elemento responsável pela indução de celularidade local7.
Em relação às reações imunológicas desencadeadas pela SID porcina, Metzger et al. concluíram que esta membrana induz a uma resposta imune em ratos, ativando as células T helper-28. Ocorreu ainda, um decréscimo de níveis de citocinas inflamatórias, assim como de fator de necrose tumoral alfa, interleucina I e VI. Os autores concluíram que a SID porcina não promove reação de rejeição ao ser implantada.
Hodde et al. sustentam que essa capacidade se deve à presença de glicosaminoglicanos na SID, que têm a propriedade de ativar diversas citocinas e fatores de crescimento que participam no processo de cicatrização e revascularização, graças à presença de fator de crescimento do endotélio vascular (VEGF), que têm a capacidade de induzir a formação de estruturas similares a capilares fenestrados na matriz de fibrina9.
O objetivo do presente estudo consiste em avaliar a regeneração óssea em defeito criado na mandíbula de ratos comparando dois biomateriais, a hidroxiapatita de cálcio sintética e a submucosa de intestino delgado porcina.
MATERIAL E MÉTODONa realização deste estudo foram respeitadas as normas do Colégio Brasileiro de Experimentação Animal (COBEA). Foram utilizados 24 ratos da linhagem Wisthar-Furth, adultos, pesando entre 180-220 gramas. Estes foram mantidos em ambiente adequado, com temperatura e luminosidade naturais e alimentados com ração e água ad libitum.
Os animais foram anestesiados por via intramuscular sendo utilizados Ketamina 40 mg/kg, Diazepam 2 mg/kg e Butorfanol 2 mg/kg. Realizou-se uma incisão de aproximadamente 3cm em região inferior de mandíbula para expô-la. Um defeito ósseo de 0,75cm x 1,5cm no corpo de cada mandíbula foi realizado em todos os animais com broca esférica de baixa rotação nº 7,5 Sorensen®.
Os animais foram divididos em dois grupos: o grupo I, onde realizou-se o preenchimento com 15 microgramas de hidroxiapatita cálstica na hemimandíbula esquerda, e o grupo II, onde preencheu-se o defeito ósseo à esquerda com submucosa de intestino delgado porcina (figura 1).
Realizou-se a antibioticoprofilaxia no ato operatório com uma dose de cefazolina 0,01 ml/kg. Tais animais permaneceram em gaiolas unitárias, com luminosidade controlada e dieta ad libitum. A eutanásia foi realizada no 40° dia de pós-operatório.
A análise macroscópica foi efetuada mensurando o diâmetro dos calos ósseos. Para análise microscópica, as peças então foram enviadas para fixação em parafina sendo posteriormente processadas conforme técnicas histológicas convencionais, depois coradas em hematoxilina-eosina. Para avaliação morfométrica foram realizadas 6 medidas em 6 campos microscópicos diferentes. Esta avaliação foi realizada com o software Image Pro-Plus acoplado a uma câmera de vídeo da marca Sony e microscópio BX 50, calibrado em aumento para uma objetiva de 10 vezes, utilizando o aplicativo de morfometria de área através da diferença de coloração entre o tecido ósseo e o tecido conjuntivo evidenciado pela coloração, sendo avaliados neoformação óssea, porosidade da área, quantidade de osso maduro e osso imaturo.
Para a avaliação estatística das variáveis macroscópicas (diâmetro), adotou-se o teste não paramétrico de Wilcoxon. E para análise histológica (percentual de porosidade, percentual de neo-osso formado, percentual de osso maduro, percentual de osso imaturo) aplicou-se o teste binomial. Fixou-se em 5% (p< 0,05) o nível de rejeição da hipótese de nulidade.
RESULTADOSEm relação à análise clínica, todos os animais permaneceram hígidos e não apresentaram intercorrências em sua evolução em seu pós-operatório, com exceção de apenas um animal do grupo I e dois animais do grupo II que apresentaram infecção óssea, o que forçou a sua exclusão do estudo.
Na análise macroscópica, evidenciou-se uma maior formação de calo ósseo nos grupos em que se implantou hidroxiapatita quando comparada ao grupo da submucosa de intestino delgado. O comprimento médio em milímetros das hemimandíbulas do grupo hidroxiapatita foi de 3,75; do grupo submucosa de intestino delgado foi de 3,03; e o do grupo controle foi de 2,63 (p: 0,0022). Os grupos I e II tiveram resultados melhores quando comparados ao grupo controle, sem colocação de enxertia alguma.
Em relação à morfometria de área, encontrou-se no grupo controle (sem enxertia) uma neoformação óssea em 28,40% e persistia a porosidade em 71,59%.
Já no grupo com hidroxiapatita, a neoformação óssea perfez uma área correspondente à 76,64% do total (p: 0,0022). Desse osso neoformado 83,77% já era um osso maduro. Nesse mesmo estágio de evolução do grupo controle se encontravam apenas 24,88% (Figura 2).
No grupo com SID Porcina, a neoformação óssea perfez uma área correspondente à 63,64% do total (p: 0,0022). Desse osso neoformado, 63,77% já era um osso maduro e nesse mesmo estágio de evolução do grupo controle se encontravam apenas 36,23% (p: 0,0025).
DISCUSSÃORecentemente, a literatura tem demonstrado resultados promissores com o uso de enxertos de SID de porco em diversas estruturas anatômicas como a bexiga, uretra, tendões, ossos, esôfago, artérias, veias, parede abdominal10,11.
Após a sua implantação ocorre rápida neovascularização, infiltração e organização espacial. Isso pode ser demonstrado no estudo de Sanduski et al., onde sete dias após o implante de SID em carótidas caninas observaram cobertura de fibrina e neointima no enxerto e, no nonagésimo dia de pós-operatório, o local de implante da SID igualava-se ao de artéria normal12,13.
Sobre as reações imunológicas desencadeadas pela SID porcina, Metzger et al. (1997) concluíram que esta membrana induz à resposta imune e ativam as células T helper-2 em ratos e houve constatação de um decréscimo de níveis de citocinas inflamatórias, assim como, de fator de necrose tumoral alfa e interleucina 1 e 6. Os autores concluíram que a SID porcina não promove reação de rejeição na vigência de seu implante7.
Badylak el al. (1995), em um estudo experimental, realizando infecção intencional com Staphylococcus aureus, para comparar SID e politetrafluoretileno, obtêm como resultado 56% de infecção em próteses sintéticas e 0% de infecção em SID porcina15-17.
Segundo Hodde et al., a submucosa de intestino delgado porcina (SID) é indutora de condução óssea, permitindo a facilitação de um preenchimento de um defeito ósseo cirurgicamente criado. Apresenta-se como um ótimo material reparador e atua como indutor de surgimento de células medulares na neoformação óssea do enxerto, promovendo também uma rápida formação de cartilagem9.
A hidroxiapatita é liberada para uso em humanos pela Food and Drug Administration (FDA) somente em defeitos traumáticos metafisários. Entretanto, já tem sido utilizada na prática médica diária em diversas situações18.
A incorporação de enxertos ósseos apresenta 5 estágios: 1) inflamatório, promovendo uma resposta celular do hospedeiro; 2) revascularização do tecido; 3) osteocondução, na qual o enxerto tem a função de arcabouço para o crescimento de vasos e formação de osso; 4) osteoindução, em que as células mesenquimais do hospedeiro são induzidas por proteínas (BMP) encontradas no enxerto a se transformarem em osteoblastos e 5) remodelação óssea com características de formação e reabsorção contínua de osso5.
Kühne et al. avaliaram radiológica e histologicamente os implantes de hidroxiapatita porosa de coral em um estudo experimental em coelhos. Os implantes foram realizados nos côndilos femorais para a reparação óssea de cavidades vazias, comprovando a integração óssea ao utilizar hidroxiapatita porosa19.
Uchida et al. realizaram estudo experimental em coelhos implantando cerâmicas replicadas de coral marinho em defeito ósseo padrão, comprovando a integração óssea do implante. No presente estudo, verificou-se uma formação de calo ósseo macroscopicamente superior no grupo hidroxiapatita, visualizando-se a integração enxerto-implante20.
Bucholz et al. compararam a aplicabilidade de hidroxiapatita porosa de coral ou enxerto ósseo autógeno para o tratamento de fraturas tibiais em humanos, não encontrando diferenças significativas entre os dois grupos, comprovando a possibilidade de aplicação da hidroxiapatita em defeitos ósseos2. Yamamoto et al. utilizaram a hidroxiapatita no preenchimento de defeitos após excisão de tumores ósseos benignos e obtiveram radiograficamente incorporação total do enxerto após 3 meses de seu implante21.
Karabatsos et al. implantaram hidroxiapatita em fêmur de um modelo canino e obtiveram significativa aposição óssea na interface enxerto-implante4.
A análise microscópica procurou avaliar a morfometria de área da região onde criou-se o defeito ósseo observando-se uma neoformação óssea abundante em 76,64% das hemimandíbulas em que utilizou-se hidroxiapatita, assim como um grau de maturação óssea avançado já que 83,77% do osso neoformado tinham características de osso maduro. A SID porcina também se mostrou um bom osteocondutor, porém o grau de neoformação óssea foi maior no grupo hidroxiapatita.
Observou-se a integração satisfatória da hidroxiapatita porosa ao osso mandibular nesse modelo experimental. Sendo os resultados macroscópicos e radiológicos e microscópicos superiores com a utilização desse enxerto quando comparado ao grupo de submucosa. Entretanto os dois enxertos tiveram resultados de indução óssea claramente superiores quando comparados ao grupo controle.
Futuros experimentos nessa mesma linha de pesquisa devem ser implementados, utilizando outros modelos animais que permitam criar um defeito ósseo anatomicamente maior e manter um tempo pós cirúrgico mais prolongado.
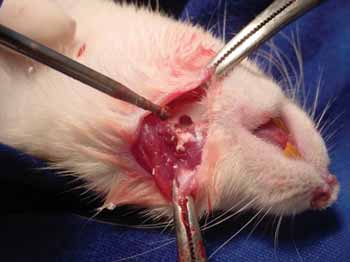
Figura 1a. Realização de perfuração em mandíbula de rato - Observa-se a perfuração mandibular realizada com broca Sorense baixa rotação número 7,5.

Figura 1b. Preenchimento do defeito ósseo criado com hidroxiapatita cálstica.
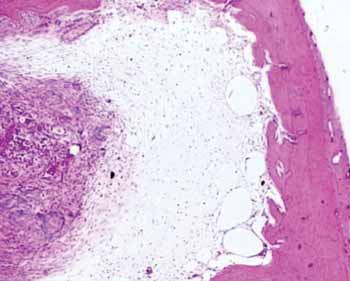
Figura 2a. Lâmina de hematoxilina e eosina em peça do grupo controle.
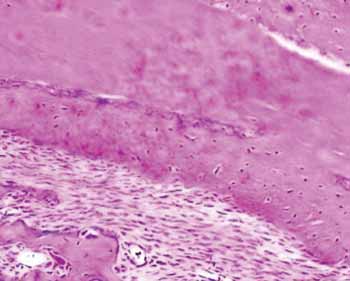
Figura 2b. Lâmina corada em HE do grupo hidroxiapatita - Observa-se a neoformação óssea.
A SID demonstrou facilitar o preenchimento do defeito cirúrgico criado em mandíbula de ratos. Estudos adicionais são necessários para definir com maior profundidade a base celular para esta atividade, bem como para a avaliação das aplicações potenciais da SID em enxertos para a substituição de falhas ósseas em seres humanos.
A hidroxiapatita porosa de coral integrou-se ao osso receptor no modelo experimental, proporcionando uma neoformação óssea precoce e adequada.
Quando comparados os dois bioenxertos, a hidroxiapatita coral obteve melhores resultados.
REFERÊNCIAS BIBLIOGRÁFICAS1. Chiroff RT, White EW, Weber JN, Roy DM. Tissue ingrowth of replamineform implants. J Biomed Mater Res Symp 1975;6:29-45.
2. Bucholz RW, Carlton A, Holmes R. Interporous hydroxyapatiteas a bone graft substitute in tibial plateau fractures. Clin Orthop Rel Res 1989;240:53-62.
3. Burchardt H. Biology of bone transplantation. Orthop Clin North Am 1987;18:187-96.
4. Karabatsos B, Myerthall ST, Fornasier V, Maistrelli G. Osseointegration of hydroxyapatite porous-coated femoral implants in a canine model. Clin Orthop Rel Res 2001:442-9.
5. Fry DE, Milholen L, Harbrecht PT. Iatrogenic ureteral injury, options in management. Arch Surg 1986;118(4):454-7.
6. Schmidt CE, Baier JM. Acellular vascular tissue: natural biomaterials for tissue repair and tissue engineering. Biomaterials 2000;21: 2215-31.
7. McPherson TG, Badylak SF. Characterization of fibronectin derived from porcine small intestinal submucosa. Tissue Engineering 1998;4:75-83.
8. Murata K, Sekino T, Ikeda T et al. Glycosaminoglycan components in duodenum with advancing age and in patients with progressive systemic sclerosis. Digestion 1995;56(3):230-6.
9. Hodde JP, Badylak SF, Brightman AO et al. Glycosaminoglycan content of small intestine submucosa: A bioscaffold for tissue replacement. Tissue Engineering 1996;2:209-17.
10. Owen TJ, Lantz GC, Hiles MC, Martin BR, Geddes LA. Calcification potential of small intestinal submucosa in a rat subcutaneous model. J Surg Res 1997; 179-86.
11. Peel SAF, Chen H, Renlund R et al. Formation of a SIS-cartilage composite graft in vitro and its use in the repair of articular cartilage defects. Tissue Engeneering 1998;4(2):143-55.
12. Sandusky GE, Badylak SF, Morff RJ, Johnson WD, Lantz GC. Histologic findings after in vivo placement of small intestine submucosal vascular grafts and saphenous vein grafts in the carotid artery in dogs. Am J Pathol 1992; 42:317-24.
13. Sandusky GE, Lantz GC, Badylak SF. Healing comparison of small intestine submucosa and PTFE grafts in canine carotid artery. J Surg Res 1995;58:415-20.
14. Bandylak SF, Kropp B, Mcpherson T, Liang H, Snyder, PW. Small intestine submucosa: a rapidly resorbed bioscaffold for augmentation cytoplasty in a dog model. Tissue Engnr 1998;4: 379-87.
15. Bandylak SF, Lantz GC, Coffey A, Geddes LA. Small intestinal submucosa as a large diameter vascular graft in the dog. J Surg Res 1989;47:74-8.
16. Bandylak SF, Lantz GC, Coffey A, Geddes LA, Tacker WA. Comparison of the resistence to infection of intestinal mucosa arterial autografts versus polytetrafluoretilene arterial protheses in a dog model. J Vasc Surg 1994;465-72.
17. Bandylak SF, Tullis R, Kokini K. The use of xenogeneic small intestine submucosa as a biomaterial for Achilelles tendon repair in a dog model. J Biomed Mater Res 1995;29:977-85.
18. Hahmer R, Mooney V, Bucholz R, Tencer A. A coralline hidroxyapatite bone graft substitute. Clin Orthop 1986;188:252-62.
19. Kühne JH, Bartl R, Frisch B, Hammer C, Jansson V, Zimmer M. Bone formation in coralline hydroxyapatite: effects of pore size studied in rabbits. Acta Orthop Scand 1994;65(3):246-54.
20. Uchida A, Nade SML, McCartney ER, Ching W. The use of ceramics for bone replacement: a comparative study of three different porous ceramics. J Bone Joint Surg 1984 ;66-B:269-75.
21. Yamamoto T, Onga T, Marui T, Mizuno K. Use of hydroxyapatite to fill cavities after excision of benign bone tumors. J Bone Joint Surg 2002 ;82-B:1117-20.
22. Holmes RE, Bucholz RW, Mooney V. Porous hydroxyapatite as a bone-graft substitute in metaphyseal defects: a histometric study. J Bone Joint Surg 1986;68-A:904-11.
23. Robert W, Bucholz MD. Nonallograft osteoconductive bone graft substitutes. Clin Orthop Rel Res 2002;202:44-52.
Trabalho premiado no IV Congresso Triológico de 2005
1 Aluna do 6° ano de Medicina. Residente em Otorrinolaringologia do Hospital de Clínicas do Paraná.
2 Doutorando em Clínica Cirúrgica, Médico Otorrinolaringologista, Professor da Universidade Federal do Paraná.
3 Professora Doutora Adjunta da Disciplina de Patologia da UFPR.
4 Do 6° ano do curso de Medicina da Pontifícia Universidade Católica do Paraná.
5 Professora Doutora Adjunta da Disciplina de Patologia Básica da UFPR.
6 Mestrando em Biotecnologia na Universidade Federal do Paraná. Médico Ortopedista.
7 Professor Doutor Titular da Disciplina de Otorrinolaringologia da UFPR. Chefe do Serviço de Otorrinolaringologia do Hospital das Clínicas da Faculdade de Medicina da Universidade Federal do Paraná.
Universidade Federal do Paraná.
Endereço para correspondência: Andrea Soccol - Rua Pedro Demeterco 1020 Jardim das Américas Curitiba PR 81530-320.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 29 de agosto de 2005.
Artigo aceito em 13 de setembro de 2005.


