INTRODUÇÃOA versatilidade da voz humana permite variações em intensidade, pitch e qualidade, viabilizando assim a capacidade que temos em expressar emoções e pensamentos1. Entre as alterações que desafiam os laringologistas, a incompetência ou insuficiência glótica figura entre as mais importantes. É um problema que leva à disfonia e pode ser causada por: alterações da mobilidade, cicatrizes, atrofias ou "arqueamento" das pregas vocais2. Entre as causas citadas, a cicatriz ou fibrose talvez seja a que mais se caracteriza pelo impacto social negativo e pela carência de tratamentos efetivos3.
O principal componente do tecido cicatricial ou fibrótico é o colágeno. Após a instalação do dano tecidual, sua síntese inicia-se logo no terceiro dia4 e atinge seu pico máximo entre 3 e 6 semanas seguindo-se a um período de remodelação. O colágeno tipo III é inicialmente sintetizado e depositado, sendo substituído por tipo I à medida que ocorre maturação do tecido cicatricial5.
Vários enxertos sintéticos ou biológicos foram utilizados na tentativa de restaurar a relação corpo-cobertura da prega vocal, quando a lâmina própria está alterada. A injeção de Teflon, muito utilizada no passado, foi abandonada pelo risco de reações imunológicas, formação de granuloma e extrusão6; atualmente é utilizado somente para tratamentos em que a expectativa de vida é limitada7. A longevidade limitada do gelfoam restringe seu uso como tratamento definitivo8, porém, sua aplicabilidade surge enquanto se define a modalidade definitiva a ser proposta. Mais recentemente o colágeno, inicialmente bovino1, depois autólogo9, seguido pelo homólogo10 também foi utilizado. O custo elevado e o alto índice de reabsorção restringiram seu uso.
Os enxertos autólogos como a gordura e a fáscia muscular mostraram resultados promissores e sua segurança e risco mínimo de reações indesejadas ao enxerto estimulam seu uso. A gordura é altamente biodisponível11 além de apresentar viscosidade similar à da camada superficial da lâmina própria sugerindo que a sua consistência pode ser próxima da ideal para injeção em prega vocal12. A longevidade do enxerto gorduroso é questionável e dependente de alguns fatores como: tamanho e grau de manipulação do enxerto, região anatômica de coleta e região anatômica a ser implantada13.
A fáscia muscular figura desde entre as possibilidades cirúrgicas também autólogas para uso em laringologia. Previamente teve seu uso amplamente difundido na cirurgia plástica reparadora. A fáscia muscular pode ser usada por apresentar algumas vantagens: é um tecido delicado, que suporta tensão, é composto por fibroblastos (colágeno) e apresenta grande biodisponibilidade. A principal desvantagem está relacionada com a maior adaptação em preencher espaços bidimensionais como na cirurgia cosmética e não tridimensionais como as pregas vocais13.
Em relação aos materiais utilizados, a literatura encontra-se repleta de trabalhos14-18 referentes à distribuição do enxerto, processo inflamatório, tipo e quantificação celular, porém são raros os estudos que priorizam o estudo do tecido cicatricial gerado após o enxerto desses materiais19. O objetivo desta pesquisa é descrever, comparar e quantificar o colágeno resultante da enxertia de fáscia muscular e de gordura na prega vocal do coelho, bem como compará-los às pregas vocais não enxertadas, utilizando o método da picrossírius-polarização.
MATERIAL E MÉTODO
MaterialO estudo foi aprovado pela Comissão de Ética para Análise de Projetos de Pesquisa (CAPPesq) da Diretoria do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (protocolo de pesquisa 200/02).
Foram utilizados 19 coelhos albinos da raça New Zealand, todos do sexo masculino, sadios, pesando entre 2,5 e 3,5kg. Os animais foram divididos em 4 (quatro) grupos. Nos dois primeiros (Grupos F1 e F2), os coelhos foram submetidos à inserção de enxerto de fáscia lata na prega vocal direita. Nos outros dois grupos (Grupos G1 e G2), os coelhos foram submetidos a implante de gordura autóloga "em bloco" também na prega vocal direita. Nos coelhos dos quatro grupos citados, o grupo controle é composto pela prega vocal esquerda, pois foi submetida ao mesmo procedimento com exceção da colocação do enxerto. Todos os animais operados foram mantidos vivos, com cuidados diários e controle do processo de cicatrização. Todos foram sacrificados pelo mesmo método de injeção endovenosa de 2,0 ml de KCl 20%, sendo que:
· As pregas vocais direitas dos animais sacrificados após um período de 90 dias do procedimento cirúrgico formaram os grupos Fáscia (F1) e Gordura (G1) e as pregas vocais esquerdas o grupo controle (C1);
· As pregas vocais direitas dos animais sacrificados após um período de 180 dias do procedimento cirúrgico formaram os grupos Fáscia (F2) e Gordura (G2) e as pregas vocais esquerdas o grupo controle (C2).
Método
Técnica CirúrgicaOs animais foram anestesiados com Xilazina (5 mg/Kg) associado à Quetamina (50 mg/Kg) por via intramuscular. Foram mantidos em ventilação espontânea, através da incisão laríngea, sem necessidade de cânula traqueal e fixos à mesa cirúrgica pelas patas. Os coelhos foram submetidos à incisão na linha média, a partir da margem superior da cartilagem tireóidea até a borda inferior da cartilagem cricóidea, utilizando-se bisturi lâmina 15, na pele e subcutâneo, permitindo a exposição das cartilagens tireóidea e cricóidea. A gordura foi captada para posterior inserção através da incisão na região cervical para acesso à laringe. A fáscia muscular foi obtida após incisão na pele da região anterior e lateral da coxa, seguida de controle da hemostasia e delicada dissecção (10 x 10mm).
A membrana cricotireóidea foi incisada na linha média, com bisturi lâmina 15, permitindo a visualização da subglote. A cartilagem tireóidea, aberta anteriormente, permitiu a exposição das pregas vocais. Ambas as pregas vocais foram submetidas à incisão de 0,3mm em sua margem superior seguindo-se de minucioso descolamento da mucosa ao longo da margem medial. O procedimento realizado com estilete Hollemback 3s utilizado em dentística permitindo a confecção de uma bolsa para receber o enxerto. Foi necessário todo cuidado no sentido de evitar a penetração do músculo tireoaritenóideo. O enxerto (fáscia muscular ou gordura medidos compaquímetro), com aproximadamente 3mm de diâmetro e 1mm de altura, foi implantado na bolsa entre a musculatura e a mucosa da prega vocal direita. A prega vocal esquerda não recebeu enxerto.
Os coelhos receberam antibioticoterapia com Benzilpenicilina procaína 300000 UI, Benzilpenicilina potássica UI, diluída em 3ml de água destilada, sendo aplicado 0,4ml intramuscular por dose. A primeira dose foi aplicada durante o procedimento, e duas outras, a cada 24 horas.
Estudo histológico e morfométricoApós o sacrifício do animal, foi removida a laringe através de incisão cervical seguido de remoção do fragmento mediano da prega vocal direita e esquerda. Todas as peças medindo cerca de 3 x 5mm foram fixadas em formalina a 10%, sendo então encaminhadas para processamento: desidratadas com álcool etílico a 95%, clareadas em xilol, impregnadas pela parafina fundida em estufa a 60°C, incluídas e a seguir cortadas no micrótomo com espessura de 3¼m. Os cortes corados pelo método da picrosírius- polarização foram utilizados para a visualização e análise das fibras colágenas. Este método consiste na coloração pelo Sírius-red dissolvido em ácido pícrico aquoso saturado. A análise das lâminas foi realizada sob microscopia de Luz utilizando polarização óptica.
Foi realizada análise descritiva dos quatro grupos, detendo-se na identificação do colágeno, classificação em Tipo I e III determinada pela sua birrefringência, bem como a presença do enxerto e estado do mesmo em relação com a estrutura muscular adjacente. Em cada um dos grupos de estudo, foi analisada também amostras da prega vocal esquerda onde foi realizada a dissecção porém sem a implantação do enxerto.
Foi efetuado também estudo morfométrico, com a quantificação das fibras colágenas através de um sistema digital de análise de imagens usando o software Image Pro Plus versão 4.0, determinando-se a concentração das fibras colágenas por unidade de área medida. Foram analisadas amostras de ambas as pregas vocais para obtenção dos valores da concentração do colágeno.
Análise estatísticaFoi realizado o teste de normalidade de Kolmogorov-Smirnov, tendo mostrado distribuição normal. Na comparação dos grupos, foi utilizado o teste T de Student.
RESULTADOSA análise microscópica das pregas vocais coradas pelo método da picrossírius polarização mostrou diferenças com relação à distribuição do colágeno cicatricial. A fáscia lata dos grupos F1 e F2 apresentam aspecto fusiforme (Fotos 1 e 2) enquanto a gordura (G1 e G2) apresenta aspecto difuso, formando focos encapsulados por colágeno espesso (Fotos 3 e 4). Há predomínio do colágeno tipo I (maior birrefringência) em todos os grupos, porém em G1 e G2 o colágeno tipo III é mais identificado quando comparado ao grupo da fáscia muscular, independente do tempo.
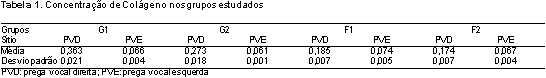
A Tabela 1 resume a concentração média de colágeno e seu desvio padrão em todos os grupos estudados, em ambas as pregas vocais. A análise estatística da concentração de colágeno por área demonstrou aumento do colágeno em todos grupos enxertados quando comparados com os grupos controle (p<0,001).
Houve maior concentração de colágeno no grupo da gordura quando comparado à fáscia tanto na análise aos 90 dias (p<0,001), quanto aos 180 dias (p<0,001), respectivamente Gráficos 1 e 2.
Comparando o grupo de gordura aos 90 e 180 dias, observamos uma redução estatisticamente significante da concentração de colágeno (p<0,001), havendo uma redução da ordem de 25% neste período. No grupo de fáscia, contudo, não houve diferença entre as amostras de 90 e 180 dias (p=0,08), com variação da ordem de 6% da concentração de colágeno no período. No grupo controle, também não houve diferença entre 90 e 180 dias (Gráfico 3).
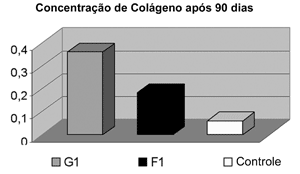
Gráfico 1. Comparação da Concentração de Colágeno após 90 dias, demonstrando maior concentração no grupo enxertado com gordura (p<0,001).
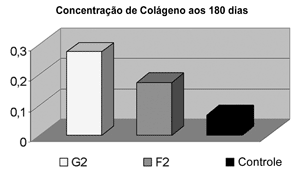
Gráfico 2. Comparação da Concentração de Colágeno após 180 dias, demonstrando maior concentração no grupo enxertado com gordura (p<0,001).
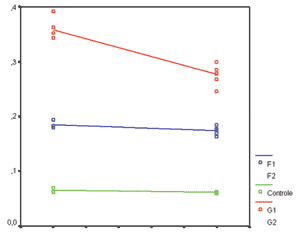
Gráfico 3. Comparação da Concentração de Colágeno aos 90 e 180 dias, demonstrando redução estatisticamente significante apenas nos coelhos enxertados com gordura.
O método da picrossírius-polarização tem contribuído significativamente para a identificação e compreensão do colágeno e de suas funções. A especificidade do método é baseada na presença de aminoácidos básicos nas moléculas do colágeno que reagem fortemente com o corante ácido (Sírius-red). Essa reação aumenta a birrefringência normal do colágeno, composto por moléculas agregadas. A diferenciação dos tipos do colágeno também é possível, sendo o tipo I fortemente birrefringente, fibras espessas amarelas ou vermelhas; tipo III pouco refringentes, esverdeados e o tipo II ainda menos refringentes20,21.
A presença de um arranjo anormal das fibras do colágeno caracteriza o desenvolvimento de uma cicatriz ou fibrose3. Em nosso estudo foi freqüente esse desarranjo do colágeno quando comparado com a distribuição do colágeno do músculo vocal do coelho em todos os grupos. Essa alteração foi muito mais identificada nos grupos submetidos a enxerto de gordura, caracterizada por desarranjo em blocos envoltos por colágeno espesso. Nos grupos F1 e F2 (enxerto de fáscia), a distribuição é fusiforme e mais compacta.
A literatura é repleta de artigos que enfatizam o processo inflamatório conseqüente à enxertia de materiais nas pregas vocais, com qualificação e tipagem celular, na tentativa de corrigir defeitos pré-existentes ou mesmo voluntariamente causados na lâmina própria22,23. No entanto, estudos que objetivam estudar o processo cicatricial causado pela manipulação e pelo enxerto são raros. Thibealt et al. (2002)24, em estudo histológico e reológico da cicatriz produzida na lâmina própria após manipulação cirúrgica, encontraram menor densidade do colágeno associado à desorganização tecidual. O presente estudo faz uma avaliação do processo cicatricial quando comparado ao músculo vocal, sendo encontrado maoir densidade além de desorganização tecidual. Esse fato sugere que a gordura é metabolicamente mais ativa do que a fáscia, estimulando uma maior deposição do colágeno cicatricial.
Acredita-se que a baixa taxa metabólica e a ultra-estrutura composta principalmente por fibrócitos e matriz extracelular de colágeno são as principais responsáveis pela longevidade do enxerto de fáscia muscular nas pregas vocais16. Reijonen et al. (2001)15, após injeção de fáscia lata na prega vocal paralisada de nove cães, identificaram que a fáscia muscular não promoveu reação inflamatória intensa e a mesma foi identificado até após 12 meses da injeção. Duke et al. (2001)18 em estudo clínico em pacientes previamente submetidos à injeção de gordura obtiveram 95% de melhora nos padrões de análise acústica da voz.
A prega vocal do coelho é similar à prega vocal humana demonstrando divisão por camadas e presença de células da matriz extracelular como o colágeno. Uma limitação para o presente estudo deve-se ao fato das pregas vocais dos coelhos não apresentarem as mesmas forças mecânicas de vibração da prega vocal humana. Tem sido mostrado que essas forças podem estimular o "turn-over" do colágeno com conseqüente alteração na deposição das fibras25. De qualquer forma esses achados sugerem que embora a enxertia promova maior deposição de colágeno no processo cicatricial, esse processo é mais exuberante com gordura do que com a fáscia. Entretanto, ainda são necessários estudos das propriedades reológicas das pregas vocais enxertadas com gordura e fáscia para melhor definição do melhor enxerto.
CONCLUSÃOO estudo permite concluir que a enxertia de gordura e fáscia lata na prega vocal de coelho promoveu maior deposição de colágeno do que no grupo controle, sendo mais exuberante na inserção de gordura. Houve alteração na distribuição das fibras colagênicas após enxerto de fáscia e de gordura, também mais alterado no grupo gordura.
REFERÊNCIAS BIBLIOGRÁFICAS1. Ford CN, Bless DM. Clinical experience with injectable collagen for vocal fold augmentation. Laryngoscope 1986; 96: 863-9.
2. Benninger MS, Crumley RL, Ford CN, Gould WJ, Hanson DG, Ossoff RH, Sataloff RT. Evaluation and treatment of the unilateral paralyzed vocal fold. Otolaryngol Head Neck Surg 1994; 111: 497-598.
3. Kriesel KJ, Thibealt SL, Vangroll PJ, Chan RW, Bless DM, Suzuki T, Ford CN. Treatment of vocal fold scarring: rheological and histological measures of homologous collagen matrix. Ann Otol Rhinol Laryngol 2002; 111:884-9.
4. Cotran RS, Kumar V, Robbins SL. Patologia Estrutural e Funcional. 4ed. Rio de Janeiro, RJ: Ed. Guanabara-Koogan; 1991.
5. Peacock EE. Wound Repair. 3rd ed. Philadelphia, PA: Saunders; 1984.
6. Rubin HJ. Misadventure with injectable polytef (Teflon). Arch Otolaryngol 1975; 101:238-46.
7. Rosen CA. Phonosurgical vocal fold injection: indications and techniques. Operat Techniq Otolaryngology Head Neck Surg 1998; 9:203-9.
8. Schramm VL, May M, Lavorato AS. Gelfoam paste injections for vocal fold paralysis: temporary rehabilitation of glottic incompetence. Laryngoscope 1978; 88:1268-73.
9. Ford CN, Staskowski PA, Bless DM. Autologous collagen vocal fold injection: A Preliminary Clinical Study. Laryngoscope 1995; 105:944-8.
10. Courey MS. Homologous collagen substances for vocal fold augmentation. Laryngoscope 2001; 111:747-58.
11. Shindo ML, Zaretsky LS, Rice DH. Autologous fat injection for unilateral vocal fold paralysis. Ann Otol Laryngol 1996; 105:602-6.
12. Chan RW, Titze IR. Viscosities of implantable biomaterials in vocal fold augmentation surgery. Laryngoscope 1998; 108:725-31.
13. Boyce RG, Nuss DW, Kluka EA. The use of autogenous fat, fascia, and nonvascularized muscle grafts in the head and neck. Otolaryngol Clin North Am 1994, 27:39-68.
14. Bauer CA, Valentino J, Hoffman HT. Long-term results of vocal cord augmentation with autogenous fat. Ann Otol Laryngol 1995; 104:871-4.
15. Reijonen P, Leivo I, Nevalainen T, Rihkanen H. Histology of injected autologous fascia in paralyzed canine vocal fold. Laryngoscope 2001; 111:1068-74.
16. Rihkanen H, Soderlund-Lehikoinen, S, Reijonen P. Voice acoustics after autologous fascia injection for vocal fold paralysis. Laryngoscope 1999; 109:1854-7.
17. Imamura R, Sennes LU, Chung D, Bohadana S, Tsuji DH. Injeção de gordura na prega vocal: efeitos do local de injeção sobre a configuração glótica e a distribuição espacial da gordura injetada. Rev Bras Otolaryngol 2003; 69:445-50.
18. Duke SG, Salmon S, Blalock D, Postma GN, Koufman JA. Fascia augmentation of the vocal fold: graft yield in the canine and preliminary clinical experience. Laryngoscope 2001; 111:759-64.
19. Duprat AC, Costa HO, Eckley CA, Pupo DB, Rossi HH. Implante de gordura no espaço de Reinke para correção de alterações histoestruturais das pregas vocais. Rev Bras Otorrinolaringol 2001; 67:78-83.
20. Montes GS, Junqueira LCU. The use of picrosirius-polarization method for the study of the biopathology of collagen. Mem Inst Oswaldo Cruz 1991; 86 (suppl III): 1-11.
21. Melo ECM, Lemos M, Ximenes Filho JA, Sennes LU, Saldiva PHN, Tsuji DH. Distribution of collagen in the lamina propria of the human vocal fold. Laryngoscope 2003, 113:2187-91.
22. Rodgers BJ, Abdul-Karim FW, Strauss M. Histological study of injected autologous fascia in the paralyzed canine vocal fold. Laryngoscope 2000; 110:2012-5.
23. Woo P, Rahbar R, Wang Z. Fat implantation into Reinke space: A histological and stroboscopic study in the canine. Ann Otol Laryngol 1999; 108:738-44.
24. Thibealt SL, Gray SD, Bless DM, Chan, RW, Ford CN. Histologic and rehologic characterization of vocal fold scarring. J Voice 2002, 16:96-104.
25. Bishop, JE. Regulation of cardiovascular collagen deposition by mechanical forces. Mol Med Today 1998; 4(2):69-75.
1 Doutorando em ORL pela FMUSP, Otorrinolaringologista.
2 Livre-docente pela em Otorrinolaringologia FMUSP, Professor Associado.
3 Professor Titular do Departamento de Anatomia Patológica da FMUSP.
4 Doutor em Medicina pela Faculdade de Medicina da USP (Prof. Convidado da Pós-Graduação em Cirurgia da Faculdade de Medicina da UFC.
Artigo recebido em 05 de março de 2005. Artigo aceito em 13 de junho de 2005.


