O VocábuloA palavra "colesteatoma" foi utilizada pela primeira vez pelo anatomista alemão Johannes Mueller, em 18381. As raízes deste vocábulo significam cole - colesterol; esteado - gordura; oma - tumor, ou seja, um tumor onde estão presentes tecido gorduroso e cristais de colesterol. Etimologicamente, este termo é completamente incorreto, sendo, inclusive, considerado o segundo termo mais errôneo em otologia (em primeiro está o \"neurinoma do acústico\", visto que, na verdade, trata-se de um Schwanoma do nervo vestibular2. O uso dessa denominação é inadequado porque o colesteatoma origina-se de epitélio escamoso queratinizado da membrana timpânica e/ou conduto auditivo externo, sem presença de cristais de colesterol ou gordura na sua estrutura, além da natureza tumoral ser totalmente discutível.
Outras denominações foram sugeridas, como tumor peroláceo, por Cruveilhier, em 1829; margaritoma, por Craigie, em 1891, colesteatoma epidérmico por Cushing, em 1922, epidermóide por Critchley e Ferguson, em 1928 e queratoma, por Shuknecht, em 1974; todos estes termos, apesar de mais adequados e descritivos, não são empregados e o vocábulo colesteatoma é consagrado entre os otologistas.
DefiniçãoOs colesteatomas foram definidos por Friedmann3, em 1959, como estruturas císticas revestidas por epitélio escamoso estratificado, repousando sobre um estroma fibroso de espessura variável, o qual pode conter alguns elementos do forro mucoso original.
Mais simplesmente, Schuknecht4, em 1974, define-os como acúmulo de queratina esfoliada dentro da orelha média ou de qualquer área pneumatizada do osso temporal, nascendo a partir de um epitélio escamoso queratinizado. Informalmente, este autor afirmou que os colesteatomas caracterizam-se por \"pele no lugar errado\".
EpidemiologiaA incidência anual de colesteatomas está em torno de 3 por 100.000 em crianças e 9 por 100.000 em adultos, sendo mais predominante no gênero masculino5,6.
Dados epidemiológicos mostram uma alta prevalência do colesteatoma entre os caucasianos, seguidos pelos descentes do povo africano, sendo raramente visto em asiáticos. De acordo com Ratnesar7, essa prevalência é bem mais baixa nos esquimós Inuit, sugerindo que suas características anatomomorfológicas poderiam facilitar a aeração da orelha média e prevenir as seqüelas das otites crônicas.
No Ambulatório de Otite Média Crônica no Hospital de Clínicas de Porto Alegre (AOMC-HCPA), dos 450 pacientes acompanhados desde agosto de 2000, 30% eram portadores de Otite Média Crônica Colesteatomatosa (OMCC), apresentando-se bilateralmente em 12% da amostra total. Dos pacientes com OMCC, 45% tinham até 18 anos, considerados, portanto, pediátricos. Quanto ao gênero, encontramos 70% de casos do sexo masculino8.
ClassificaçãoHabitualmente, os colesteatomas são classificados como congênitos e adquiridos, sendo estes subdivididos em primários e secundários.
Os congênitos são restos epiteliais, encontrados em orelhas com membranas timpânicas intactas e sem história prévia de infecções9. De acordo com Valvassori10, são encontrados em quatro regiões do osso temporal: tímpano-mastoideo, ápice petroso, ângulo pontocerebelar e forame jugular. Há ainda uma quinta localização, descrita por Sobol11, o qual relatou a existência de pequenas pérolas epiteliais entre as camadas da membrana timpânica.
Os colesteatomas adquiridos primários seriam decorrentes de retrações timpânicas, que acumulariam epitélio descamado e perderiam seu poder de autolimpeza. Já os secundários seriam formados a partir da migração do epitélio através de uma perfuração marginal na membrana timpânica (Costa et al., 1999).
Meyerhoff e Truelson6 tentaram classificar os colesteatomas de acordo com sua patofisiologia, localização, defeitos ossiculares e presença de complicações, dividindo-os em congênitos e adquiridos, sendo que os últimos em primário, secundário e terciário.
Tos6 propôs uma outra classificação, baseada no local de origem do colesteatoma, o qual considera como um importante fator para o procedimento cirúrgico e para o prognóstico. Esta taxonomia apresenta três categorias:
1. Colesteatoma Atical - uma retração da parte flácida ou membrana de Shrapnell, estendendo-se do ático, passando pelo ádito, e chegando, eventualmente, até o antro, mastóide ou cavidade timpânica.
2. Colesteatoma do Seio Timpânico - retração póstero-superior ou perfuração da parte tensa, estendendo-se para o seio timpânico e porção posterior do tímpano.
3. Colesteatoma da Parte Tensa - retração e adesão total da parte tensa da membrana timpânica envolvendo o orifício timpânico da tuba auditiva.
Saleh e Mills13 propuseram outra classificação, de acordo com os locais afetados pelo colesteatoma, assim caracterizada:
S1 - se o colesteatoma estiver restrito ao local onde tenha começado;
S2 - quando a doença se estende para outro local;
S3 - se afetar três locais;
S4 - se estiver instalado em quatro locais;
S5 - para os casos em que o primeiro local afetado e, além deste, quatro ou mais estão envolvidos.
Estes mesmos autores distinguem sete locais utilizados para essa classificação: ático e antro, orelha média, mastóide, tuba auditiva, labirinto e fossa média. Este estadiamento é uma solução prática para descrever a extensão da doença e é clinicamente relevante, podendo ser aplicado para todas as lesões exceto às do ápice petroso, as quais não podem ser diagnosticadas por otoscopia.
Saleh e Mills13 também apresentam uma classificação da condição da cadeia ossicular, baseada nas descrições de Wullstein (1956) e Austin (1969), através da seguinte pontuação:
0 - se a cadeia ossicular estiver intacta;
1 - se a bigorna estiver erosada e com descontinuidade da cadeia;
2 - se a bigorna e a supraestrutura do estribo estiverem erosadas;
3 - se a cabeça do martelo e a bigorna estiverem ausentes e a supraestrutura do estribo estiver erosada.
Quanto às complicações pré-operatórias, Saleh e Mills13 classificaram a otite média crônica colesteatomatosa como:
C0 - quando não há complicações;
C1 - para a ocorrência de uma complicação;
C2 - para a existência de duas ou mais.
Como complicações, os autores consideram a fístula do canal semi-circular lateral, a paralisia facial, a perda auditiva sensorioneural total, a trombose do seio e a invasão intracraniana.
Um profundo entendimento sobre a patogênese do colesteatoma da orelha média é particularmente importante, visto que sua natureza destrutiva é responsável por muitas das complicações referidas. A tendência de erosão óssea dos colesteatomas e a falta de um tratamento não-cirúrgico justificam a importância da investigação dos mecanismos básicos relacionados ao desenvolvimento da otite média crônica colesteatomatosa.
EtiopatogêneseFerlito14 descreve que seriam necessárias três condições predisponentes para o desenvolvimento de um colesteatoma: a) o encontro de dois epitélios diferentes na fenda auditiva; b) a destruição crônica da camada submucosa da orelha média pelos processos infeccioso e inflamatório; c) o processo de cicatrização ou fase de proliferação.
Porém, a etiopatogênese dos colesteatomas é ainda muito discutida, havendo, basicamente, seis hipóteses principais (Quadro 1), as quais geram controvérsia há mais de 100 anos.
Quadro 1. Principais hipóteses para a etiopatogênese dos colesteatomas
Hipótese Autor Ano
Colesteatomas congênitos Korner e Virchow 1863
Metaplasia Wendt 1873
Migração Habermann 1889
Bezold 1889
Invaginação Bezold 1908
Hiperplasia Manasse 1917
Implantação Schöer 1958
Existem diversos estudos a respeito da patogênese dos colesteatomas, porém ainda resta muito a ser esclarecido15. Conforme observações no AOMC-HCPA, e vários trabalhos deste grupo8,16-22 essas hipóteses, individualmente, não explicariam a patogênese de todos os colesteatomas.
É inequívoca a existência de colesteatomas congênitos e o surgimento de colesteatomas por invaginação e por implantação, mas essas situações não poderiam ser responsáveis por todos os casos de OMCC. Acreditamos que a patogênese dos colesteatomas, na verdade, envolveria várias dessas hipóteses agregadas (Quadro 1), podendo haver a interposição de duas ou mais delas em um mesmo paciente.
Em conseqüência dessa constatação, parece-nos que a hipótese do continuum, postulada pelo Dr. Michael Paparella23, em 1970, aproxima-se de uma concepção multifatorial, mais abrangente de patogênese. Segundo essa, a otite média pareceria existir ao longo de uma série contínua de eventos epiteliais e subepiteliais, onde, após um insulto inicial, uma otite serosa ou purulenta tornar-se-ia seromucóide, mucóide e, finalmente, caso não houvesse regressão espontânea ou terapêutica do quadro, sobreviria a cronificação. Podemos dizer, baseados nessa hipótese, que o colesteatoma é a apoteose de uma única patologia da orelha média, a otite média crônica, e não, portanto, um evento isolado.
EstruturaO colesteatoma, macroscopicamente, é uma lesão cística redonda ou oval com configuração e tamanho variáveis. Ferlito et al.14 caracterizaram o colesteatoma como um cisto epidermóide, de crescimento independente e progressivo, com destruição dos tecidos adjacentes, em especial o tecido ósseo, com tendência a recorrer.
O advento da microscopia eletrônica de transmissão possibilitou muitos avanços no conhecimento da estrutura celular. Utilizando esse instrumento, em 1972, Lim e Saunders24 apresentaram uma descrição histológica detalhada dos colesteatomas. Descreveram que o colesteatoma possui um epitélio escamoso estratificado queratinizado, com as quatro camadas idênticas às da epiderme normal (basal, espinhosa, granulosa e córnea), células de Langerhans (em maior quantidade do que na epiderme normal) e grânulos querato-hialinos. Chamaram este epitélio de matriz do colesteatoma. Observaram, ainda, a presença de um tecido conjuntivo, contendo fibras colágenas, fibrócitos e células inflamatórias, que foi denominado de perimatriz, a qual estava em contato, na maioria dos casos, com uma camada de células escamosas ou cilíndricas ciliadas, remanescentes da mucosa original da orelha média. Em alguns casos, apesar de a perimatriz estar ausente à microscopia óptica, fazia-se presente quando estudada com o microscópio eletrônico de transmissão, mostrando-se extremamente fina, com as fibras colágenas praticamente ausentes e contendo cristais de carbonato de cálcio. Já em trabalho realizado por Paludetti et al.25, a perimatriz consistia de tecido de granulação ou tecido conectivo subepitelial inflamado.

Segundo Milewski et al.26, o crescimento de um colesteatoma poderia requerer angiogênese no tecido conjuntivo da perimatriz, e que, células e substâncias da cascata de cicatrização poderiam ter um importante papel no desenvolvimento e crescimento dos colesteatomas. Esses processos envolveriam o fator de crescimento fibroblástico b (b-FGF), o qual, segundo esses autores, poderia estimular a produção de colagenase. Sugeriram, ainda, que a persistência da inflamação causaria um processo permanente de cicatrização na perimatriz, a proliferação de fibroblastos (tecido de granulação) e do epitélio (matriz).
Ferlito et al.14 descrevem a perimatriz como a porção mais periférica do colesteatoma, constituída de tecido de granulação ou tecido conjuntivo subepitelial inflamatório, com linfócitos, histiócitos e neutrófilos. Sprekelsen et al.27 afirmam que a matriz e a perimatriz, em tecidos normais ou patológicos, são formadas por colágeno tipo IV, tenascina, fibronectina, b-FGF e metaloproteinases (MMP). Segundo Jacob et al.28, o incremento na proliferação da matriz do colesteatoma seria resultado do processo de inflamação, sugerindo que a perimatriz seria o principal fator do desenvolvimento dos colesteatomas.
Resumidamente, podemos definir a perimatriz como uma rede inflamatória que envolve o colesteatoma. A Figura 1, a seguir, apresenta um corte histológico de um colesteatoma, onde podemos ver seus componentes estruturais: a perimatriz, a matriz e o conteúdo cístico.
Pereira et al.29, estudando 31 colesteatomas, sendo 20 de adultos e 11 de crianças, encontraram nove espécimes sem perimatriz, visível à microscopia óptica, sendo dois de adultos e sete pediátricos. Estes achados corroboram com os de Lim e Saunders24, os quais constataram que algumas perimatrizes só podem ser vistas em microscopia eletrônica. Estes autores sugerem que uma possível causa dessa diminuição das fibras de colágeno poderia ser resultado de uma ação diferencial das colagenases.
Hamsei et al.30 analisaram 21 colesteatomas, através de reação em cadeia de polimerase (PCR), imunohistoquímica e histologia, com o objetivo de investigar os fatores de estimulação e diferenciação de osteoclastos em colesteatomas, utilizando pele do meato acústico externo como controle. A análise imunohistoquímica demonstrou uma elevação de células precursoras de osteoclastos e macrófagos nos colesteatomas. A análise da perimatriz demonstrou que, nesta região do colesteatoma, há todos os fatores necessários para a osteoclastogênese e para a estimulação da reabsorção óssea.
Biologia do ColesteatomaO estudo das células, em microscopia óptica e eletrônica, pode dar a impressão enganosa de que essas são estruturas estáticas. Porém, ao contrário, muitos processos e movimentos estão constantemente acontecendo na intimidade celular, ocorrendo em alguns tecidos de forma mais rápida, em outros mais vagarosa. É fácil compreender que, à medida que as células vão se diferenciando, paralelamente vão adquirindo certas particularidades estruturais e fisiológicas.
Os epitélios são tecidos com vida limitada, com renovação constante, decorrente de uma atividade mitótica contínua. A velocidade dessa reposição celular é variável, podendo ser de dois a 50 dias, dependendo do tecido considerado31.
Já o tecido conjuntivo, constituinte da perimatriz do colesteatoma, apresenta um processo de crescimento mais complexo, pois é formado por diversos tipos de células - fibroblastos, macrófagos, mastócitos, plasmócitos, leucócitos - separadas por abundante material intercelular. A riqueza desse material é uma das suas características mais importantes. Constitui-se por uma parte com estrutura microscópica definida - fibras do conjuntivo - e por outra não estruturada - substância fundamental amorfa31. Por toda essa complexidade, é de esperarmos que o processo de renovação deste tecido seja bastante elaborado.
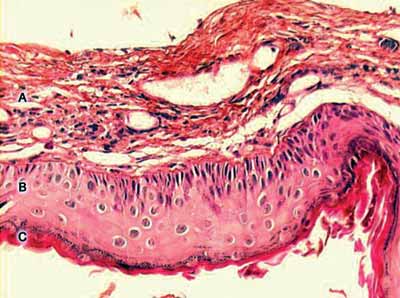
Figura 1. Imagem digitalizada de lâmina, com corte transversal de colesteatoma, corada em Hematoxilina-Eosina. Podemos ver suas três partes constituintes: A - perimatriz, B - matriz, C - conteúdo cístico.
A otite média crônica colesteatomatosa poderia ser resultado de um descontrole da proliferação celular, mais simplesmente, nessa patologia há o crescimento de um cisto de epitélio escamoso queratinizado, o colesteatoma14. Este poderia ser considerado como uma desordem no controle do crescimento celular, compreendendo uma série de complexos e dinâmicos eventos envolvendo componentes celulares e extracelulares com alterações em seu comportamento biológico, como desregulação dos queratinócitos32, os quais apresentam um crescimento hiperproliferativo e alterações na diferenciação celular. Porém, não se sabe ao certo se esse descontrole é causado por defeitos em genes que controlam a proliferação, por citocinas liberadas de células inflamatórias ou por outros mecanismos ainda desconhecidos12. Sendo assim, determinar a existência de defeitos na sua biologia, bioquímica e genética é crítico para o conhecimento da sua patogênese.
Conforme descrito anteriormente, a capacidade de invasão, migração, alteração na diferenciação, proliferação e recorrência dos colesteatomas é muito similar às neoplasias, porém há relutância, entre os pesquisadores, em aceitar o enquadramento dos colesteatomas nessa categoria33,34. Para os colesteatomas serem considerados uma lesão neoplásica é necessário a evidência de instabilidade genética; esta pode ser manifestada através de alterações no DNA ou de anormalidades cromossômicas específicas. Em 1995, Shinoda e Huang35 detectaram a proteína p53 em colesteatomas, sugerindo que estes poderiam ser tumorais. Porém, Desloge et al.33 demonstraram não haver alterações no DNA, descartando, assim, essa hipótese.
Como as pesquisas citadas não indicam nenhuma instabilidade genética dessas lesões, devemos investigar uma outra possível razão para o desenvolvimento da OMCC, sendo necessário perguntar sobre a origem do epitélio escamoso queratinizado nos colesteatomas. Para estudar essa questão, muitas investigações utilizando análise imunohistoquímica têm sido realizadas para comparar a localização de marcadores de diferenciação nos colesteatomas e na pele do canal auditivo externo. Pelas propriedades apresentadas pelas citoqueratinas, essas têm sido consideradas, por muitos investigadores36,37,32, como um dos melhores instrumentos para este propósito.
As citoqueratinas são proteínas que constituem uma das duas categorias de filamentos intermediários, localizados no citoplasma das células epiteliais; possuem vinte subclasses, sendo sua expressão dependente do tipo de epitélio e do seu estágio de diferenciação38. Pereira39, Albino et al.40 e Kim e Chung41 relatam que a matriz dos colesteatomas expressa citoqueratina 16 (CK16) nas camadas suprabasais, sendo que a expressão deste filamento protéico é característica de epitélios hiperproliferativos. Lepercque et al.42 descrevem que a CK16 não aparece no epitélio normal, a não ser em áreas sob pressão e atrito, ou no epitélio de revestimento dos folículos pilosos. Segundo Broekaert et al.43, a CK16 é expressa em regiões específicas, como o anel timpânico e as regiões medial e inferior do meato acústico externo. Pereira et al.29 afirmam que a presença de CK16 na matriz do colesteatoma poderia indicar seu comportamento hiperproliferativo, semelhante ao de doenças epidérmicas hiperproliferativas. De acordo com Albino et al.40, o colesteatoma forma-se como decorrência da tentativa de reparar uma lesão, o que poderia explicar a presença de CK16, caracterizando este epitélio como imaturo com predomínio de proliferação celular. Kujipers et al.37 analisaram o padrão de citoqueratinas e sugeriram que a matriz do colesteatoma não é resultado de uma mudança metaplásica. Em seu estudo, encontraram um epitélio semelhante ao da membrana timpânica e ao da pele do canal auditivo externo, mas em diferentes estágios de proliferação, dependendo do grau de inflamação presente.
Um sinal característico dos colesteatomas é a infiltração da perimatriz por células do sistema imune. Piltcher44, em sua tese sobre citocinas na otite média crônica com efusão, afirma que, além dos já conhecidos fatores de risco, como a disfunção tubária e as infecções, muitas pesquisas sobre otite média têm-se direcionado ao estudo dos diferentes componentes da resposta inflamatória. O ponto fundamental é se a inflamação deve ser considerada apenas como um processo de defesa ou se ela tem papel na perpetuação da otite média crônica colesteatomatosa. Milewski45 sugeriu que as citocinas inflamatórias, os fibroblastos e os macrófagos seriam os responsáveis pela origem, crescimento e destruição óssea dos colesteatomas. Várias citocinas e fatores de crescimento poderiam estar envolvidos no mecanismo de proliferação e desenvolvimento do epitélio do colesteatoma46,47. Tomita48 afirma que existem várias hipóteses de que os fatores de crescimento e as citocinas, presentes nos colesteatomas, induzam a ativação de genes, como o c-myc, causando a desregulação da proliferação celular. Sudhoff e colaboradores49 investigaram a distribuição e expressão do fator de crescimento tumoral (TGF-alfa), do fator de crescimento epitelial (EGF-R) e do oncogene c-myc em células epiteliais normais da orelha média e em colesteatomas. Estes fatores foram encontrados na matriz de colesteatomas, porém não em células normais. Além da regulação autócrina do epitélio, pela produção de fator de crescimento epitelial (EGF), a hiperproliferação do colesteatoma poderia depender da interação do tecido subepitelial e das mudanças inflamatórias que ocorrem nessa patologia. Sudhoff et al.50 investigaram a expressão e localização dos fatores de crescimento na angiogênese em 22 colesteatomas, em comparação à epiderme normal do canal auditivo externo (8) e à mucosa de orelha média normal (5), para identificar alguns fatores de crescimento envolvidos na patogênese dos colesteatomas. Esses pesquisadores encontraram, na pele e na mucosa normais, 5,3±1,2 vasos/mm2, enquanto que no grupo dos colesteatomas havia 21,1±11,7 vasos/mm2, essa média variou conforme o grau de inflamação na perimatriz: 9,0±3,5 vasos/mm2 em grau I, 19,2±3,6 vasos/mm2em grau II e 31,7±9,4 vasos/mm2em grau III. Também relataram uma diminuição do colágeno tipo IV e da laminina na membrana basal no colesteatoma, em comparação aos controles.
Uma característica comum na patogênese dos vários tipos de colesteatomas é a presença de bactérias, conseqüentemente, uma grande quantidade de citocinas liberadas pelas células inflamatórias, decorrentes da resposta imune. A presença de bactérias poderia promover um vínculo crítico entre o colesteatoma e o hospedeiro, impedindo que o epitélio neoformado concluísse o seu processo de diferenciação, o que o deixaria em um estado quiescente, minimamente proliferativo, sem ser migratório ou invasivo nessa etapa51. As interações entre células inflamatórias e o epitélio do colesteatoma poderiam ser responsáveis pela indução das características biológicas aberrantes dessa patologia.
Chole e Faddis51 estudaram, por microscopia eletrônica de transmissão, 24 colesteatomas humanos e 22 de esquilo da Mongólia (gerbil). Das amostras provenientes de humanos, 16 apresentaram achados histológicos consistentes com bactérias biofilme, enquanto no material de gerbil, 21 mostraram evidências dessa bactéria. Esse achado poderia estar relacionado com a atividade dos colesteatomas, principalmente com as infecções persistentes ou recorrentes e com sua resistência aos antimicrobianos tópicos e sistêmicos. Os autores sugeriram que a matriz do colesteatoma é um meio ideal para o desenvolvimento de um misto de biofilme microbiológico. Estes autores afirmam, ainda, que as bactérias com biofilme são resistentes a antibióticos por mecanismos diferentes dos usados por bactérias planctônicas, porém o exato mecanismo de resistência das colônias de bactérias em biofilme é desconhecido.
Os estudos publicados até agora apresentam muitos dados a respeito da biologia dos colesteatomas, porém muitas dúvidas persistem. Como anteriormente referido, os colesteatomas apresentam características neoplásicas (invasão, migração, alteração na diferenciação), mas, até o momento, não foi encontrada nenhuma indicação de instabilidades genéticas na sua estrutura, fato que descarta a possibilidade de enquadrá-los como neoplasia. Outra propriedade que parece constante nos colesteatomas é a sua atividade hiperproliferativa, residindo aqui, talvez, uma possível resposta para suas características de agressividade e crescimento descontrolado. Além desse fato, os estímulos da resposta imune, representados pelas citocinas relacionadas às células inflamatórias da perimatriz, representam um forte candidato ao papel de ator principal desta trama intrincada de mecanismos. Todas essas hipóteses levam-nos a considerar a complexidade envolvida na biologia dos colesteatomas e, conseqüentemente, ao emaranhado de eventos relacionados a sua patogênese.
Poder de Erosão ÓsseaOs colesteatomas apresentam grande poder de erosão óssea52,53. Usualmente atingem a cadeia ossicular e, menos freqüentemente, os ossos do crânio, inclusive o osso mais rígido do corpo humano, o labirinto, o que demonstra sua forte ação destrutiva sobre o tecido ósseo. A destruição parcial ou total dos ossículos é observada em cerca de 80% dos pacientes com colesteatoma, ao passo que na otite média crônica não-colesteatomatosa há erosão da cadeia ossicular em aproximadamente 20% dos casos54,55. Os mecanismos que levam a esse aumento na degradação óssea e invasão ainda estão em investigação16.
Conforme Fisch56, as complicações causadas pelos colestetomas podem ser divididas em dois grupos: as intracraniais - meningites, abcessos e trombose do seio venoso - e as do osso temporal - mastoidite, fístula labiríntica, paralisia do nervo facial, labirintites e destruição ossicular.
Sadé e Berco57 realizaram exame histológico em 80 ossículos, obtidos em cirurgia, sendo 41 desses provenientes de pacientes com OMCNC, e 39 de OMCC. A erosão óssea foi encontrada em 42,5% dos ossículos de pacientes sem colesteatoma e em 84% dos pacientes com colesteatoma, sendo essa diferença estatisticamente significativa (P<0,001). Em estudo de Prescott58, foram acompanhadas 81 crianças com Otite Média Crônica Colesteatomatosa; de um total de 96 colesteatomas (15 bilaterais), havia apenas 19 cadeias ossiculares íntegras, 23 apresentavam erosão no martelo com a supraestrutura intacta, 51 com erosão no martelo e perda da supraestrutura, três não foram descritos.
Sadé e Fuchs59 compararam os achados da erosão ossicular em adultos (idade ? 14 anos) com aqueles achados em crianças (idade ? 13 anos). O percentual de destruição do estribo e do martelo foram similares nos dois grupos; já a bigorna apresentou destruição significativamente maior em adultos. Também a paralisia do nervo facial e a fístula labiríntica apresentaram percentual maior nos adultos. Dornelles et al.16 realizaram um estudo de descrições dos achados, da orelha média, no trans-operatório de 55 pacientes com Otite Média Crônica, acompanhados no AOMC-HCPA. Desses pacientes, 49% tinham diagnóstico de Otite Média Crônica Colesteatomatosa (OMCC). No conjunto da amostra, havia algum envolvimento da cadeia ossicular em 66%, sendo que, na OMCC, este índice era de 96% e na OMCNC caía para 37%. A presença de colesteatoma estava associada à existência de dois ou mais ossículos afetados, assim como à maior prevalência de ausência ou erosão dos ossículos. Esses achados indicam que a maioria dos pacientes com OMC, submetidos à intervenção cirúrgica, possui algum acometimento da cadeia ossicular, e que a freqüência e a extensão do comprometimento estavam muito mais relacionados com a presença de colesteatoma. Em nosso grupo, categorizamos as idades como: crianças até 18 anos e adultos a partir de 19 anos; quando analisamos o conjunto da cadeia ossicular, observado no trans-operatório de pacientes com otite média crônica colesteatomatosa, encontramos 100% de comprometimento nas crianças e 92% nos adultos. Quando comparamos os ossículos, separadamente, temos 30% de alterações no martelo, 30% no estribo e 90% na bigorna, sem diferenças entre adultos e crianças. Ao refazermos essa análise utilizando a mesma classificação etária de Sadé e Fuchs59, não foram reproduzidos os resultados desses autores, pois não foram encontradas diferenças estatisticamente significativas, quando comparado o estado dos ossículos em crianças e adultos16.
Segundo Swartz60, a destruição ossicular é a mais comum entre as complicações dos colesteatomas, sendo que o tipo de destruição depende da sua origem e do seu modo de expansão. Segundo seus dados, a cadeia ossicular está intacta em apenas 26% dos colestetomas aticais, sendo o processo longo da bigorna a região mais afetada, seguida pelo corpo da bigorna e a cabeça do martelo. Já os colesteatomas da parte tensa apresentam um poder de erosão de 90%.
A absorção óssea é estimulada por uma variedade de fatores, incluindo a inflamação, a pressão local, citoqueratinas específicas e queratina6. O conceito enzimático, no qual enzimas de origem epitelial são consideradas as responsáveis pela destruição óssea, foi definido por Abramson61-64, o qual demonstrou a presença de colagenases e hidrolases no colesteatoma, hipótese posteriormente confirmada por Thompsen65. Ferlito et al.14 sugeriram que a propriedade destrutiva dos colesteatomas, a erosão óssea, é causada pela produção de colagenase pelos componentes dos tecidos epitelial escamoso e fibroso. Não está bem demonstrado, ainda, se o osso mineralizado possa ser absorvido pela colagenase. À hipótese de reabsorção óssea por ação bioquímica, exclusivamente exercida por enzimas colagenolíticas, foram incorporados, posteriormente, outros agentes, como o fator de necrose tumoral (TNF), as interleucinas (IL-1a) e as prostaglandinas (PGE2)66-68.
Peek et al.69 estudaram a concentração de lipopolissacarídeos, componente da membrana de bactérias Gram-negativas70, em colesteatomas e compararam com os nível encontrados em amostras de pacientes com otite média crônica não-colesteatomatosa. Encontraram concentrações mais altas em pacientes com colesteatoma e sugeriram que estes resultados estariam correlacionados com os altos índices de absorção óssea.
Colesteatoma PediátricoExistem referências a que o colesteatoma seria mais agressivo e teria um prognóstico menos favorável em crianças do que em adultos71-75. Smythe et al.76 consideram, inclusive, que o comportamento clínico do colesteatoma pediátrico é tão diferente do adulto, que deveriam ser consideradas duas doenças distintas.
Quaranta et al.77 tentaram verificar se, em crianças, o comportamento clínico dos colesteatomas depende de características histomorfológicas da perimatriz. Compararam o número de plasmócitos, linfócitos, macrófagos, granulócitos e células gigantes na perimatriz de amostras retiradas de 30 pacientes com menos de 16 anos com as de 30 adultos, utilizados como controle. Os resultados sugeriram que, nas crianças, o número de elementos inflamatórios mononucleares da perimatriz seria maior que nos adultos, com evidente atividade da enzima colagenase. Com base nesse comportamento, os autores sugeriram que as características da perimatriz poderiam exercer um importante papel na patogênese do colesteatoma, podendo ser um dos fatores que justificaria as diferenças clínicas entre crianças e adultos.
Bujia et al.73 analisaram a expressão de MIB1 (anticorpo monoclonal marcador de proliferação celular) em 20 colesteatomas de crianças, tendo como controles 15 colesteatoma de adultos e pele do conduto auditivo externo. A análise imunohistoquímica mostrou índices normais na epiderme do canal, e níveis aumentados em ambas as categorias de colesteatomas. Entretanto, o número de células em proliferação foi significativamente maior no grupo pediátrico (p<0,01). Quando foram comparados colesteatomas infectados com não-infectados, não foi encontrada diferença significativa, sugerindo que o índice de proliferação poderia ser independente de fatores externos.
Por outro lado, Edelstein78 afirma que o colesteatoma infantil seria menos expansivo, o que levaria a uma incidência menor de complicações, e que os adultos seriam mais suscetíveis à paralisia facial, infecção intracraniana, fístula labiríntica e erosão ossicular. Discordando desse autor, Darrouzet et al.79 sugeriram que a menor quantidade de complicações, no grupo pediátrico, poderia dever-se ao fato de que neste grupo o tempo de evolução da doença está, em média, abaixo do encontrado nos adultos.
Entretanto, é consenso entre a maioria dos autores que o colesteatoma recorrente, ou seja, o desenvolvimento de um novo colesteatoma após tratamento cirúrgico, e o colesteatoma residual, que é o originado do crescimento de partes do colesteatoma não removidas totalmente durante a cirurgia80, são mais comuns no grupo pediátrico, sendo de 30% a taxa de recorrência média, comparada com 3% a 15% em adultos78,81. Prescott58 acompanhou 81 crianças com Otite Média Crônica Colesteatomatosa, em uma coorte de 10 anos, encontrando um percentual de recorrência de colesteatoma foi de 12%. Já Lino et al.82 realizaram um estudo em 83 crianças com OMCC e encontraram 25% de recorrência, enquanto o colesteatoma residual foi diagnosticado em 42%. Estes autores sugeriram que a recorrência de colesteatomas poderia estar intimamente relacionada à disfunção da tuba auditiva e que a alta taxa de proliferação da matriz poderia ser a responsável pelos colesteatomas residuais.
Ruah et al.72 sugerem que a persistência do mesênquima e a grande reação inflamatória observadas na parte flácida e no quadrante póstero-superior da parte tensa da membrana timpânica, bem como as alterações no colágeno e na elastina, observadas nas otites médias purulentas e serosas, podem representar uma justificativa patológica para o desenvolvimento típico dos colesteatomas em crianças.
Manejo do ColesteatomaO tratamento da otite média crônica colesteatomatosa é essencialmente cirúrgico. O objetivo primário é a erradicação completa da doença, proporcionando ao paciente uma orelha seca e segura de complicações. O objetivo secundário, mas não menos importante, é a preservação ou a melhora da função do sistema timpanossicular, quando isso for possível83.
O primeiro é cumprido através da remoção meticulosa de todo o colesteatoma (incluindo-se a matriz e a perimatriz, na técnica fechada) e dos demais tecidos doentes. Para tanto, uma variedade de técnicas cirúrgicas têm sido utilizadas, mas essas podem ser resumidas em basicamente duas, conforme a remoção ou a manutenção da parede posterior do conduto auditivo externo: as mastoidectomias aberta e fechada. Seja qual for a técnica, o segredo para o sucesso do tratamento cirúrgico é a erradicação completa da doença. A seleção do procedimento é baseada no tipo, no grau e na extensão do colesteatoma; na avaliação auditiva pré-operatória; na existência ou não de complicações associadas; no estado da orelha contralateral; em conjunto com a função da tuba auditiva e grau de pneumatização da mastóide. Essa escolha também dependerá das condições gerais do paciente, da sua idade, da sua procedência e da sua profissão1.
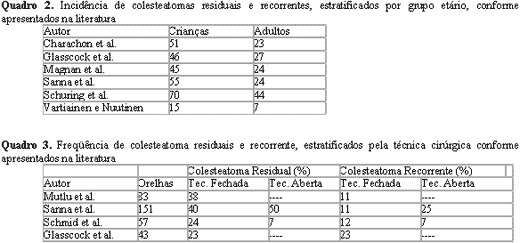
A técnica aberta poderia ser mais segura quanto à erradicação e à prevenção da recidiva, porém não possibilita a manutenção da anatomia e, por vezes, do nível de audição pré-operatória84. Não devemos esquecer que essa abordagem cria uma cavidade que irá requerer um acompanhamento médico minucioso e longo, além de demandar, em geral, cuidados por toda a vida do paciente, sendo um fator limitante para alguns esportes como natação e mergulho85. Porém, a técnica aberta, quando comparada com a técnica fechada, apresenta uma menor incidência de colesteatoma residual86, não obstante essa taxa mostrar grande variação nos relatos de diversos autores87-92. Em todos os estudos, mostra-se sempre maior em crianças (Quadros 2 e 3, a seguir, adaptado de Darrouzet et al.79).
Desde o primeiro relato da técnica de mastoidectomia, em 1649, por Riolanus, até os dias atuais, essa cirurgia passou por uma evolução gradual, auxiliada por pesquisas nesse campo e pelo desenvolvimento tecnológico. Entretanto, o manejo cirúrgico dos colesteatomas em crianças permanece sendo a principal controvérsia entre os otologistas93-95. Para a definição da melhor estratégia terapêutica, principalmente neste grupo especial de pacientes, é necessário considerarmos muitos fatores tais como a erradicação total da doença e a preservação da função auditiva; para a decisão definitiva, estas devem ser colocadas em uma balança e muito bem equilibradas. O ponto crucial da questão é que, até o momento, não foram encontradas diferenças histológicas ou bioquímicas, entre os colesteatomas nas diferentes faixas etárias, que confirmem ou não a maior agressividade da otite média crônica colesteatomatosa na infância, fato que poderia justificar o emprego de técnicas cirúrgicas menos conservadoras.
Os Próximos PassosUm dos primeiros passos no avanço da compreensão e tratamento dos colesteatomas é a interação entre estudos clínicos, histológicos e experimentais.
Realizar o elo entre estas três correntes de pesquisa será de fundamental importância para a compreensão da Otite Média Crônica Colesteatomatosa.
REFERÊNCIAS BIBLIOGRÁFICAS1. Cruz OL, Costa SS. Otologia Clínica e Cirúrgica. Ed. Revinter; 1999.
2. Costa SS, Roithmann R, Matheus MC. A patogênese dos colesteatomas. Rev Bras Otor 1992; 57(4): 30-5.
3. Friedmann I. Epidermoid cholesteatoma and granuloma. Ann Otol Rhin Laryngol 1959; 68: 57-9.
4. Schuknecht HF. The pathology of the ear. Cambridge: Harvard University; 1974.
5. Tos M. Recurrence and the condition of the cavity after surgery for cholesteatoma using various techniques. Kugler and Ghedini; 1989.
6. Olszewska E, Wagner M, Bernal-Sprekelsen M, Ebmeyer J, Dazert S, Hildmann H, Sudhoff H. Etiopathogenesis of cholesteatoma. Eur Arch Otorhinolaryngol 2004; 261(1): 6-24.
7. Ratnesar P. Aeration: a factor in the sequels of chronic ear disease along the Labrador and northern Newfoundland Coast 1977.
8. Dornelles C, Hemb L, Schweiger C, Matter R, Smith M, Schimdt L, Costa SS. Epidemiologia dos pacientes pediátricos do ambulatório de otite média crônica no Hospital de Clínicas de Porto Alegre (AOMC-HCPA). Rev Bras de Otorringol 2004. No prelo.
9. Derlacki EL, Clemis JD. Congenital cholesteatoma of the middle ear and mastoid. Ann Otol Rhinol Laryngol 1965; 74: 706-27. In: Cruz OL, Costa SS. Otologia Clínica e Cirúrgica. Ed. Revinter; 1999.
10. Valvassori GE. Benign tumors of the temporal bone. Radiol Clin North Am 1974; 12: 533-42. In: Cruz OL, Costa SS. Otologia clínica e cirúrgica. Ed. Revinter; 1999.
11. Sobol SM. Intramembranous and mesotympanic cholesteatomas associated with an intact tympanic membrane in children. Ann Otol 1980 98: 312-17. In: Cruz OL, Costa SS. Otologia Clínica e Cirúrgica. Ed. Revinter; 1999.
12. Costa SS, Hueb MM, Ruschel C. Otite média crônica colesteatomatosa. In: Cruz OL, Costa SS. Otologia Clínica e Cirúrgica. Ed. Revinter; 1999.
13. Saleh HA, Mills RP. Classification and staging of cholesteatoma. Clin Otolaryngol 1999; 24: 355-9.
14. Ferlito O, Devaney KO, Rinaldo A, Milroy C, Wenig B, Iurato S, McCabe B.F. Clinicopathological consultation ear cholesteatoma versus cholesterol granuloma. Ann Otol Rhinol Laryngol 1997; 106: 79-85.
15. Sculerati N, Bluestone C. Pathogenesis of cholesteatoma. The Otol Clin of North Am 1989; 22 (5): 859-68.
16. Dornelles C, Weber R, Schimdt VB, Schimdt L, Dall´Igna D, Carvalhal LHSK, Kruse L, Costa SS. Descrição da cadeia ossicular no trans-operatório de pacientes com otite média crônica. Pesquisa: Logos e Práxis. Unidade de Pesquisa do Instituto de Cardiologia; 2002. p. 221.
17. Dornelles C, Costa SS, Laux M, Weber R. Estudo comparativo da dissolução de três diferentes marcas de colágeno utilizadas em técnicas cirúrgicas otológicas. Rev Bras de Otorrinolaringol 2003; 69(6): 744-51.
18. Hemb L, Schweiger C, Matter R, Dornelles C, Smith M, Schmidt L, Costa SS. Papel da via de formação do colesteatoma na orelha contralateral em pacientes pediátricos do AOMC-HCPA. Revista On-Line do HCPA www.hcpa.ufrgs.br 2003.
19. Schweiger C, Hemb L, Matter R, Schmidt L, Smith M, Dornelles C, Costa SS. Perda auditiva sensorioneural em crianças com otite média crônica. Revista on line do HCPA. www.hcpa.ufrgs.br 2003.
20. Matter R, Schweiger C, Hemb L, Smith M, Schmidt L, Dornelles C, Costa SS. Estudo da orelha contralateral na otite média crônica em pacientes pediátricos. Revista do HCPA www.hcpa.ufrgs.br 2003.
21. Schmidt V, Dornelles C, Weber R, Schimdt L, Dall´Igna D, Carvalhal L, Kruse L, Costa SS. Perda auditiva condutiva na otite média crônica com perfuração central ou marginal. Pesquisa: Logos e Praxis. Unidade de Pesquisa do Instituto de Cardiologia; 2002 p. 220.
22. Scheibe AB, Smith MM, Schmidt LP, Schmidt VB, Dornelles C, Carvalhal LHSK, Kruse L, Costa SS. Estudo da orelha contralateral na otite média crônica: \"Efeito Orloff\". Rev Bras Otorrinolaringol 2002; 68(2): 245-9.
23. Paparella MM, Hiraide F, Juhn SK, Kaneco J. Celular events involved in middle ear fluid production. Ann Rhinol Otol Laryngol 1970; 79(4): 766-79. VER.
24. Lim DJE, Saunders WE. Acquired cholesteatoma: light and electron microscopic observations. Ann Otol 1972; 81: 2-12.
25. Paludetti G, Alamadori G, Ottaviani F, Rosignoli M, Rossodivita M, D´Alatri L. Ultrastructural aspects of cholesteatoma of the middle ear. Acta Otorhinolaryngol Ital 1989; 9(2): 169-80.
26. Milewski C, Fedorowski A, Stan AC, Walter GF. Basic fibroblast growth factor (b-FGF) in the perimatrix of cholesteatoma. HNO 1998(a) 46(9): 804-8.
27. Sprekelsen BM, Ebmeyer J, Anonopoulos A, Sudhoff H. Alteraciones de la membrana basal en el colesteatoma de oído medio. Acta Otor Esp 2001; 52: 330-5.
28. Jacob R, Welkoborsky HJ, Mann W. Epithelium-stroma interaction in cholesteatoma of the middle ear. Laryngorhinootologie 2001; 80 (1): 11-7.
29. Pereira CSB, Almeida CIR, Vianna MR. Imunoexpressão da citoqueratina 16 e do antígeno nuclear Ki-67 no colesteatoma adquirido da orelha média. Rev Bras de Otorrinolaringologia 2002; 68(4): 453-60.
30. Hamzei M, Ventriglia G, Hagnia M, Antonopolous A, Bernal-Sprekelson M. Dazert S, Hildmann H, Sudhoff H. Osteoclast stimulating and differentiating factors in human cholesteatoma. Laryngoscope 2003; 113(3): 436-42.
31. Junqueira LCE, Carneiro J. Histologia Básica. Rio de Janeiro: Editora Guanabara; 1985.
32. Vennix PP, Kuijpers W, Peters TA, Tonnaer EL, Ramaekers FC. Keratinocyte differentiation in acquired cholesteatoma and perforated tympanic membranes. Arch Otolaryngol Head Neck Surg 1996; 122: 825-32.
33. Desloge RB, Carew JF, Finstad CL, Steiner MG, Sassoon J, Levenson MJ, Staiano-Coico L, Parisier SC, Albino AP. DNA analysis of human cholesteatomas. Am J Otol 1997; 18(2): 155-9.
34. Albino AP, Reed JA, Bogdany JK, Sassoon J, Desloge RB, Parisier SC. Expression of p53 protein in human middle ear cholesteatomas: pathogenetic implications. Am J Otol 1998(a); 19(1): 30-6.
35. Shinoda H, Huang CC. Expressions of c-jun and p53 proteins in human middle ear cholesteatoma: relationship to keratinocyte proliferation differentiation and programmed cell death. Laryngoscope 1995; 105(11): 1232-7.
36. Bujia J, Schiling V, Holly A, Stammberger M, Kastenbauer E. Hyperproliferation-associated keratin expression in human middle ear cholesteatoma. Acta Otolaryngol 1993; 113: 364-8.
37. Kuijpers W, Vernnix PP, Peters TA, Ramaekers FC. Squamous metaplasia of the middle ear epithelium. Acta Otolaryngol 1996; 116: 293-8.
38. Moll R, Frankev W, Schiller DL. The catalog of human cytokeratins: patterns of expression in normal epithelia tumors and cultured cells. Cell 1982; 31: 11-24.
39. Pereira CSB. Análise de estudos da expressão das citoqueratinas no colesteatoma adquirido. Dissertação de Mestrado. Faculdade de Ciências Médicas da Santa Casa de São Paulo; 1997.
40. Albino AP, Kimmelman CP, Parisier SC. Cholesteatoma: a molecular and cellular puzzle. Am J Otol 1998(b); 19: 7-19.
41. Kim CS, Chung JW. Morphologic and biologic changes of experimentally induced cholesteatoma in Mongolian gerbils with anticytokeratin and lectin study. Am J Otol 1999; 20(1): 13-8.
42. Lepercque S, Broekaert D, Van Cowwenberge P. Cytokeratin expression patterns in the human tympanic membrane and external ear canal. Eur Arch Otorhinolaryngol 1993; 250: 78-81.
43. Broekaert D, Coucke P, Lepercque S, Ramaekers F, Van Muijen G, Boedts D, Leigh I, Lane B. Imunohistochemical analysis of the Cytokeratin expression in middle ear cholesteatoma and related epithelial tissues. Ann Otol Rhinol Laryngol 1992; 101: 931-8.
44. Piltcher O. Um novo modelo experimental para investigação da otite média com efusão e sua aplicação no estudo das citocinas durantes as diferentes fases dessa doença. Tese de Doutorado. Faculdade de Ciências Médicas da Santa Casa de São Paulo; 2000.
45. Milewski C. Role of perimatrix fibroblast in development of acquired middle ear cholesteatoma. A hypothesis. HNO 1998(b); 46(5): 494-501.
46. Aumente PO, Bujia J, Kim C, Jimenez-Gimenez J, Lopez-Villarejo P. Estudio cuantitativo de la presencia de interleucina-1 e interleucina-6 en el colesteatoma de oído medio. Acta Otorrinolaringol Esp 1996; 47(4): 259-62.
47. Bujia J, Kim C, Ostos P, Kastenbauer E, Hultner L Role of interleukin 6 in epithelial hyper proliferation and bone resorption in middle ear cholesteatomas Eur Arch Otorhinolaryngol 1996(a); 253(3): 152-7.
48. Tomita S. Aspectos moleculares do colesteatoma - imunoexpressão das proteínas controladas do ciclo celular: p53 BAX e BCL-2. SP Tese de Doutorado. Escola Paulista de Medicina; 2000.
49. Sudhoff H, Borkowski G, Bujia J, Hildmann H. Immunhistochemische Untersuchungen Von Mittelohrschleimhautresten im Cholesteatom. HNO 1997; 45(8): 630-5.
50. Sudhoff H, Dazert S, Gonzales AM, Borkowski G, Park SY, Baird A, Hildmann H, Ryan AF. Angiogenesis and angiogenic growth factors in middle ear cholesteatoma. Am J Otol 2000(b); 21: 793-8.
51. Chole RA, Faddis BT. Evidence for microbial biofilms in cholesteatomas. Arch Otolaryngol Head Neck Surg 2002; 128: 1129-33.
52. Sadé J, Halevy A. The aetiology of bone destruction in chronic otitis media. J Laryngol Otol 1974; 88(2): 139-43.
53. Bretlau P, Jorgensen MB, Sorenses CH, Dabelsteen E. Bone resorption in human cholesteatomas. Ann Otol 1982; 91: 131-5.
54. Chole RA. The molecular biology of bone resorption due to chronic otitis media. Ann New York Acad Sci 1997; 830: 95-109.
55. Costa SS. Contribuição ao Estudo das Otites Médias Crônicas. Dissertação de Mestrado. Faculdade de Medicina de Ribeirão Preto, USP; 1991.
56. Fisch U. Intracranial complications of cholesteatoma. In: Swartz JD. Colesteatomas of the middle ear. Diagnosis etiology and complications. Radiol Clin North Am 1984; 22: 15-34.
57. Sadé J, Berco E. Bone destruction in chronic otitis media. A histopathological study. J Laryngol Otol 1974; 88(5): 413-22.
58. Prescott CAJ. Cholesteatoma in children - the experience at The Red Cross War Memorial Childrens Hospital in South Africa 1988-1996. Int J Pediatric Otorhinolaryngol 1999; 49(1): 15-9.
59. Sadé J, Fuchs C. Cholesteatoma: ossicular destruction in adults and children. J Laryngol Otol 1994; 108(7): 541-4.
60. Swartz JD. Colesteatomas of the middle ear. Diagnosis Etiology and Complications. Radiol Clin North Am 1984; 22: 15-34.
61. Abramson M. Collagenolytic activity in middle ear cholesteatoma. Ann Otol 1969; 78: 112-25.
62. Abramson M. Collagenase in the mechanisms of action of cholesteatoma. Ann Otol Rhinol Laryngol 1971(a); 80(3): 414.
63. Abramson M, Gross J. Further studies on a collagenase in middle ear cholesteatoma. Ann Otol Rhinol Laryngol 1971(b); 80: 177-85.
64. Abramson M, Huang CC. Localization of collagenase in human middle ear cholesteatoma. Laryngoscope 1976; 86: 771-91.
65. Thompsen J. Bone resorption in chronic otitis media. In: McCabe BF, Sade J. Abramson M. eds. Cholesteatoma: first international conference. Birmingham Ala: Aescupulus Publishing Co.; 1977. p. 136.
66. Minotti AM, Kountakis SE, Leighton WR, Cabral FR. Effects of extracellular calcium on cholesteatoma migration and adhesion in vitro. Otolaryngol Head Neck Surg 1996; 115(5): 458-63.
67. Kurihara A, Toshima M, Yuasa R, Takasaka T. Bone destruction mechanisms in chronic otitis media with cholesteatoma: specific production by cholesteatoma tissue in culture of bone-resorbing activity attributable to interleukin-1 alpha. Ann Otol Rhinol Laryngol 1991; 100(12): 989-98.
68. Hansen T, Unger RE, Gaumann A, Hundorf I, Maurer J, Kirkpatrick J. Kriegsmann J. Expression of matrix-degrading cysteine proteinase cathepsin K in cholesteatoma. The United States and Canadian Academy of Pathology 2001; 14(12): 1226-31.
69. Peek FA, Huisman MA, Berckmans RJ, Sturk A, Van Loon J, Grote JJ. Lipopolysaccharide concentration and bone resorption in cholesteatoma. Otol Neurotol 2003; 249(5): 709-13.
70. Schorder NW, Heine H, Alexander C, Manukyan M, Eckert J, Hamann L. Lipopolysaccharide binding protein binds to triacylated and diacylated lipopeptides and mediates innate immune responses. J Immunol 2004; 173(4): 2683-91.
71. Glasscock ME, Dickins JFE, Wiet R. Cholesteatoma in children. Laryngoscope 1981; 91: 1743-53.
72. Ruah CB, Schachem PA, Paparella MM, Zelterman D. Mechanisms of retraction pocket formation in the pediatric tympanic membrane. Arch Otolaryngol Head Neck Surgery 1992; 118(12): 1298-305.
73. Bujia J, Holly A, Antoli-Candela F, Tapia MG Immunobiological peculiarities of cholesteatoma in children: quantification of epithelial proliferation by MIB1. Laryngoscope 1996(b); 106(7): 865-8.
74. Palva A, Karma P, Kärjä J. Cholesteatoma in children. Arch Otolaryngol 1997; 103(2): 74-7.
75. Sudhoff H, Tos M. Pathogenesis of attic cholesteatoma: clinical and imunohistochemical support for combination of retraction theory and proliferation theory. Am J Otol 2000(b); 21: 786-92.
76. Smythe JL, Brachman D, Grahm M. Complications of cholesteatoma: A report on 1.024 cases. In: Swartz JD. Colesteatomas of the middle ear. Diagnosis etiology and complications. Radiol Clin North Am 1984 22: 15-34.
77. Quaranta A, Ressa L, Santangelo A. Otomastoid cholesteatoma in children: histopathological findings. Int J Pediatric Otorhinolaryngol 1986; 12(2): 121-6.
78. Edelstein DR. Acquired cholesteatoma in pediatric age group. The Otoloraryngol Clin North Am 1989; 22(5): 955-64.
79. Darrouzet V, Duclos JY, Portmannd, Bebear JP. Preference for the closed technique in the management of cholesteatoma of the middle ear in children: a retrospective study of 215 consecutive patients treated over 10 years. Am J Otol 2000; 21(4): 474-81.
80. Caldas N, Caldas S. Considerações sobre colesteatomas residuais e iatrogênicos. Rev Bras Otor 1988; 54: 51-3.
81. Sien KCY. Cholesteatoma in children. Pediatric Clinics of North America 1996; 43(6): 1245-52.
82. Lino Y, Imamura Y, Kojima C, Takegoshi S, Suzuki JI. Risk factors for recurrent and residual cholesteatoma in children determined by second stage operation. Int J Pediatric Otorhinolaryngol 1998; 46(1-2): 57-65.
83. Costa SS, De Souza LCA, Andrade MI. Procedimentos sobre o temporal - revisando a nomenclatura. Rev Bras Otor 1991; 57(4): 170-9.
84. Hartwein J, Hormann K. A technique for the reconstruction of the posterior canal wall and mastoid obliteration in radical cavity surgery. Am J Otol 1990; 69(6): 333-6.
85. Ahn SH, Oh SH, Chang SO, Kim CS. Prognostic factors of recidivism in pediatric cholesteatoma surgery. Int J Pediatric Otorhinolaryngol 2003; 67(12): 1325-30.
86. Paparella MM, Moris MS, Costa SS. A one stage compromise of the open vs. closed method. The IBM Procedure Proco of the Third Intem Conf on Cholesteatoma and Mastoid Surg. Amsterdam: Kluger Publications; 1988.
87. Sheehy JL, Brackmann DE, Graham MD. Cholesteatoma surgery: residual and recurrent disease. A review of 1.024 cases. Ann Otol Rhinol Laryngol 1977; 86(4): 451-62.
88. Shambaugh GE Jr. Endocrine aspects of Meniere's disease. Laryngoscope 1959; 69: 1027-32.
89. Brandow EC Jr. Surgical procedure for the mastoid cavity problem. Otolaryngol Head Neck Surg 1980; 88(5); 622-4.
90. Schuknecht HF. Myringoplasty. Clin Otolaryngol 1976; 1(1): 53-65.
91. Glasscock ME, Kanok MM. Tympanoplasty - a chronological history. Otolaryngol Clin North Am 1977; 10(3): 469-477.
92. Smyth GD. Postoperative cholesteatoma in combined approach tympanoplasty. Fifteen year report on tympanoplasty. Laryngol Otol 1976; 90(7): 597-621.
93. Edelstein DR, Parisier SC, Ahuja GS. Cholesteatoma in the pediatric age group. Ann Otol Rhinol Laryngol 1988; 97: 23-9.
94. Quaranta A, Cassano P, Carbonara G. Cholesteatoma surgery: open vs. closed tympanoplasty. Am J Otol 1988; 9(3): 229-31.
95. Mutlu C, Khashaba A, Saleh E. Surgical treatment of cholesteatoma in children. Otolaryngol Head Neck Surg 1993; 113: 56-60.
Mestre em Ciências Médicas - Pediatria Doutorando do Programa de Pós-Graduação em Ciências Médicas: Pediatria - UFRGS, Bióloga no Centro de Otite Média do Brasil.
Médico Otologista, Doutor em Cirurgia, Professor Adjunto no Departamento de Oftalmologia e Otorrinolaringologia dos Programas de Pós-Graduação em Ciências Médicas: Pediatria e Pós-Graduação em Ciências Médicas: Cirurgia da Universidade Federal do Rio Grande do Sul.
Médica Patologista, Doutora em Ciências em Gastroenterologia, Médica Contratada do Serviço de Patologia do Hospital de Clínicas de Porto Alegre; Professora Orientadora do Programa de Pós-Graduação em Ciências Gastroenterológicas.
Médica Residente do 1º ano no Hospital de Clínicas de Porto Alegre.
Serviço de Otorrinolaringologia - HCPA Serviço de Patologia - Hospital de Clínicas de Porto Alegre - HCPA.
Endereço para correspondência: Cristina Dornelles - Rua Cangussu 1343 Porto Alegre RS 90830-010.
Tel (0xx51) 3249-2275 - E-mail: cristinadornelles@yahoo.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 8/3/2005 e foi aprovado em 1/4/2005.


