INTRODUÇÃOO HPV é um vírus de replicação intranuclear, de tamanho pequeno, com cerca de 50 nm de diâmetro1. Pode infectar mucosas e superfícies cutâneas em quase todas as espécies vertebrais2. Até o momento foram identificados cerca de 70 tipos de HPVs3 classificados de acordo com a distribuição dos ácidos nucléicos no genoma viral, sendo os subtipos 1, 2, 4, 6, 11, 13, 16, 18, 30, 31, 32 e 57 encontrados na cavidade oral4.
Pesquisa extensa associou alguns subtipos de HPV a lesões malignas e pré-malignas de cérvice uterino, vulva, pênis, conjuntiva e trato aerodigestivo superior5. O HPV é universalmente aceito como agente causal do câncer de colo uterino e, em anos recentes vem se especulando sobre sua possível relação com câncer de cavidade oral e orofaringe.
O efeito citopático viral mais conhecido é a coilocitose, considerado \"critério maior\" na infecção pelo HPV do ponto de vista histopatológico, sendo que a atipia coilocitótica consiste em atipia nuclear e vacuolização perinuclear6.
Atualmente, dispõem-se de métodos de biologia molecular para o estudo do HPV, como hibridização in situ, captura híbrida e PCR, que permitem não só maior sensibilidade diagnóstica como também a tipagem do HPV, porém são exames de custo muito mais elevado se comparado com a detecção de coilocitose em lâminas coradas por hematoxilina-eosina.
HPV e Carcinoma Espinocelular Oral (CEC)O carcinoma de células escamosas oral ou também chamado carcinoma epidermóide ou espinocelular (CEC) oral representa 90% de todos os tumores malignos que afetam a cavidade bucal7. No desenvolvimento do câncer oral, os fatores mais comumente associados são fumo, álcool, sífilis, deficiências nutricionais, sol, traumatismo, má higiene e irritação por bordas pontiagudas de dentes ou dentaduras8. Além dessas, os vírus vêm sendo amplamente estudados como possíveis agentes carcinogênicos. Sÿrjanen et al.9 sugeriram o envolvimento do HPV com o câncer bucal, quando associaram as alterações celulares encontradas em lesões malignas e pré-malignas da boca às mesmas que ocorriam no câncer de cérvice uterina. A infecção pelo papiloma vírus humano é identificado como causa de mais de 95% dos carcinomas do colo uterino e em grande proporção em outros carcinomas genitais10.
O uso do tabaco e álcool são fatores de risco bem estabelecidos para câncer oral, entretanto uma pequena proporção (15-20%) dos pacientes não têm história de tabagismo e etilismo, sugerindo a presença de outros fatores de risco11 como o HPV, porém seu papel ainda não foi bem definido. Um achado intrigante é a redução de aproximadamente 40% no risco de óbito de pacientes com tumores HPV positivos.
O HPV 16 é o tipo mais comum associado a câncer oral e de colo de útero12,13 enquanto os tipos 6 e 11 são os mais freqüentemente encontrados em lesões benignas e pré-malignas e raramente nas lesões neoplásicas da cabeça e pescoço14.
A importância da infecção pelo HPV na carcinogênese oral é suportada pela capacidade dos HPV de alto risco para imortalizar ceratinócitos orais in vitro15.
OBJETIVOO objetivo do presente estudo é determinar a prevalência de achados sugestivos de papilomavírus humano - coilocitose - em CEC de cavidade oral e orofaringe através do estudo histológico dessas lesões.
MATERIAL E MÉTODOForam examinadas por microscopia óptica 20 casos com diagnóstico de CEC de cavidade oral e orofaringe na procura de sinais sugestivos de infecção pelo HPV em lâminas coradas por hematoxilina-eosina.
Paralelamente, foram pesquisados dados de prontuário dos 20 casos, como pode ser visto na Tabela 1.
RESULTADOSFoi encontrada coilocitose em 75% dos casos (15/20), o que denominamos casos coilocitose positivos (C+).
No levantamento dos prontuários, foi encontrado que 19 pacientes eram do sexo masculino e 1 do sexo feminino, com idade variando de 42 a 86 com média de 58,9 anos; quinze da raça branca, três pardos e dois negros. Dentre os pacientes C+, a idade variou de 47 a 80 anos, com média de 57,9 anos e dentre os C- a idade variou de 42 a 86 anos, com média de 61,8 anos.
Onze pacientes eram tabagistas (55%) e seis eram etilistas (30%), sendo que em 6 pacientes (30%) - 5 C+ e 1 C- não havia relato no prontuário sobre tabagismo e etilismo. Dentre os pacientes C+, 60% eram tabagistas e 40% eram etilistas, enquanto dentre os C-, 40% eram tabagistas e nenhum etilista, como pode ser visto na Tabela 2.
A localização do tumor era variável, sendo a maioria no palato (35%) - sendo 20% em palato mole e 15% em palato duro - seguido de assoalho da cavidade oral (25%), orofaringe (20%), língua (10%), gengiva (5%) e mucosa jugal (5%). Dentre os pacientes C+, as localizações mais freqüentes foram palato e assoalho da cavidade oral, ambas com 27% enquanto dentre os C- a região mais acometida foi palatal (60%).
Quanto ao aspecto clínico no momento do diagnóstico, a maioria dos pacientes apresentavam lesão infiltrativa ulcerada (60%), e em estádio avançado - T4 (50%), sendo que em 7 pacientes (35%) - 5 C+ e 2 C- - não havia relato no prontuário sobre estádio clínico. Dentre os pacientes C+ 66% apresentavam lesão infiltrativa ulcerada e 54% em estádio avançado enquanto dentre os C- 40% apresentavam lesão infiltrativa ulcerada e 40% em estádio avançado.
DISCUSSÃONo presente estudo, evidenciamos coilocitose em 15 das 20 lâminas estudadas, correspondendo a 75% dos casos.
A coilocitose, inicialmente descrita por Leopoldo Koss et al. em 195616, consiste em células com núcleos picnóticos, contornados por extensos halos claros com volume geralmente superior ao citoplasma, visto em lâminas sob microscopia óptica, como pode ser visto na Figura 1. Segundo alguns autores17,18, a coilocitose constitui sinal patognomônico de infecção por HPV, servindo como base para os estudos de biologia molecular.
Alguns trabalhos na literatura mostram que a freqüência de HPV em carcinoma oral varia de 0 a 100%13,19 enquanto outros autores relatam ser de 18 a 100%12,14. A média de 25% foi estimada por Garlick20 em sua revisão sobre o assunto. Como se pode perceber, há extrema variabilidade de positividade, o que pode ser devido a diferentes tamanhos de amostra ou também por utilizarem métodos com variável sensibilidade e especificidade.
Herrero et al.21 evidenciaram DNA de HPV em 3,9% de 766 biópsias de câncer de cavidade oral e 18,3% de 142 biópsias de câncer de orofaringe, através de estudo por PCR. Klussmann et al.22 encontraram 18% de DNA de HPV em biópsias de câncer de cavidade oral, 8% em câncer de nasofaringe, 25% em câncer de hipofaringe e 45% em câncer de orofaringe e particularmente em carcinomas de tonsila (58%). Ritchie et al.23 detectaram HPV em 21% dos tumores de cavidade oral e orofaringe, sendo 83% deles HPV-16. Ha et al.24 encontraram 0,98% de DNA de HPV em lesões pré-malignas e somente 2,9% em lesões malignas da cavidade oral.
Niv et al.25 realizaram estudo no qual investigaram a presença de HPV em carcinoma de cavidade oral e encontraram 17,3% de positividade, sendo que em todas elas a localização do tumor era em pilar anterior amigdaliano. Outros estudos, as localizações tumorais mais freqüentes nas quais foram encontrados indícios de HPV foram mucosa jugal e palatal (40-50%)26. No presente estudo, as localizações mais freqüentes foram palato e assoalho da cavidade oral, ambas com 27% de prevalência.
Os carcinomas HPV positivos parecem ser uma entidade distinta (acometem mais células basais e tem um componente inflamatório menor), com biologia distinta (menor mutação de p53), fatores de risco distintos (menor associação com tabaco e álcool) e um curso clínico distinto (maior sobrevida)11. No entanto, no presente estudo não observamos menor associação com tabaco e álcool, pelo contrário, encontramos maior porcentagem de etilistas e tabagistas entre o grupo C+.
Cruz et al.27 verificaram que pacientes com menos de 60 anos com CEC oral tem oito vezes mais risco de estar infectado pelo HPV do que pessoas com mais de 60 anos. Em seu estudo, homens tinham mais positividade para HPV do que mulheres, mas não encontraram associação entre infecção por HPV e local de tumor, estágio clínico no diagnóstico ou tabagismo e etilismo. No nosso levantamento, não encontramos diferença significativa de faixa etária entre os grupos C+ e C-.
Klussmann et al.28 perceberam diferença estatisticamente significante entre a prevalência de HPV em tumor de orofaringe (45%), especialmente em tonsilas palatinas (58%) em relação a outras regiões da cavidade oral (7 a 25%).
Alguns autores11,28 acreditam que os carcinomas de tonsila palatina HPV positivos componham uma entidade tumoral à parte. Klussmann et al.28 observaram que esses pacientes apresentaram exposição estatisticamente menor aos fatores de risco sabidamente conhecidos como o cigarro e álcool, além de também terem encontrado correlação estatisticamente significante entre HPV e baixo grau de diferenciação dos tumores, contradizendo os achados dos autores anteriormente citados.
Miller e Johnstone29, em meta-análise de 1982-1997 concluíram que o HPV é um fator de risco independente e de suma importância no CEC, sendo que os seus resultados indicam que a detecção do HPV é duas a três vezes mais comum em lesões pré-malignas orais e 4,7 vezes mais comum em CEC, quando comparado com a mucosa oral normal.
Brandwein et al.30 observaram que não há associação estatística entre HPV e estádio TNM e clínico ou grau de diferenciação do tumor. Em seus estudos, não foram observadas diferenças estatisticamente significantes entre os grupos HPV negativos e positivos a respeito do intervalo livre de doença e tempo de sobrevida.
Apesar de termos conhecimento que o melhor método atual para pesquisa de HPV é o PCR, iniciamos esta pesquisa com a investigação de coilocitose em lâminas coradas por hematoxilina-eosina o que é muito sugestivo de infecção por HPV. O estudo em questão trata-se de um projeto piloto pois será dada continuidade a esta pesquisa através da realização de PCR em todas as lâminas já examinadas a fim de confirmar a alta prevalência de infecção por HPV em CEC oral. O estudo histológico, por si só, pode sugerir a presença de HPV, sendo um método de screening de lesões associadas ao HPV. É um método de grande utilidade em centros que não dispõem de métodos de diagnóstico sofisticados de biologia molecular.
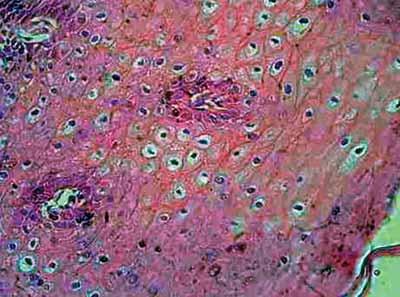
Figura 1. Lâmina corada por hematoxilina-eosina mostrando coilocitose: células com halos picnóticos, contornados por extensos halos claros com volume geralmente superior ao citoplasma.
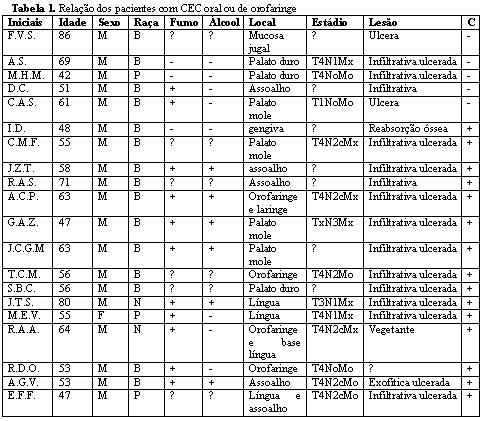
C: coilocitose; T: tumor, N: linfonodo, M: metástase (classificação TNM); ?: não relatado no prontuário; M: masculino, F: feminino; B: branco, P: pardo, N: negro; +: presente, -: ausente.

C+: coilocitose
Através do exame criterioso dos anatomopatológico de CEC de cavidade oral e orofaringe, observamos alta prevalência de coilocitose - 75% -, o que sugere possivelmente alta prevalência de HPV nesses tumores.
REFERÊNCIAS BIBLIOGRÁFICAS1. Sarruf MBJM, Dias EP. Avaliação citopatológica da cavidade bucal em pacientes portadores de infecção genital pelo papilomavírus humano (HPV). J Bras Doenças Sex Trans 1997; 9(2): 4-18.
2. Howley PM, Schlegel R. The human papillomaviruses. An overview. (Review). Am J Med 1988; 85(2A): 155-8.
3. Oliveira LHS. Virologia Humana. Rio de Janeiro: Cultura Médica; 1994. p 311.
4. Kellokoski JK, Syrjanen SM, Syrjanem KJY, Kiloski M. Oral mucosal changes in women with genital HPV infection. J Oral Pathol Med 1990; 19: 142-8.
5. Pfister H, Fuchs PG, Volcker HE. Human papillomavirus DNA in conjuntival papilloma. Graefes Arch Clin Exp Ophthamol 1985; 223: 164-7.
6. Cotran RS, Kumar V, Robbins SL, Schoen FJ. Patologia Estrutural e Funcional. 5º ed. Rio de Janeiro: Guanabara- Koogan; 1996. p. 937.
7. Neville BW, Damm DD, Allen CM, Bouquot JE. Patologia Oral e Maxilofacial. 1º ed. Rio de Janeiro: Guanabara- Koogan; 1998. p. 705.
8. Shafer WG, Hine MK, Levy BM. Tratado de Patologia Bucal. 2º ed. Rio de Janeiro: Interamericana; 1985.
9. Syrjanen K, Gissman L, Koss K. Papillomaviruses and human disease. Berlin/ Heidelberg/ New York: Springer; 1987. p. 104, 37.
10. Rosenberg SK, Greenberg MD, Reid R. Sexually transmitted papilloma viral infection in men. Obstet Gynecol Clin North Am 1987; 14: 495-512.
11. Gillison ML, Koch WM, Capone RB et al. Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. JNCI 2000; 92(9): 709-20.
12. Yeudall WA. Human papillomavirus and oral neoplasia. Oral Oncol Eur J Cancer 1992; 28B: 61-6.
13. Woods K, Shillitoe E, Spitz M, Schantz S, Adler-Stortz K. Analysis of human papillomavirus DNA in oral squamous cell carcinomas. J Oral Pathol Med 1993; 22: 101-8.
14. Snijders PJ, Scholes AG, Hart CA, Jones AS, Vaughan ED, Woolgar JA et al. Prevalence of mucosotropic human papillomaviruses in squamous-cell carcinomas of the head and neck. Int J Cancer 1996; 66: 464-9.
15. Sugerman PB, Shillitoe EJ. The high risk human papillomaviruses and oral cancer: evidence for and against a causal relationship. Oral Dis 1997; 3: 130-47.
16. Koss LG, Durfee GR. Unusual patterns of squamous epithelium of the uterine cervix: cytologic and pathologic study of koilocytic atypia. Ann N Y Acad Sci 1956; 63: 1245-61.
17. Syrjänen K, Syrjänen S, Lamberg M, Pyrhönen S, Nuutinen J. Morphological and immunohistochemical evidence suggesting human papillomavirus (HPV) involvement in oral squamous cell carcinogenesis. Int J Oral Surg 1983; 12: 418-24.
18. Premoli-de-Percoco G, Galindo I, Ramirez JL, Perrone M, Rivera H. Detection of human papillomavirus-related oral verruca vulgaris among Venezuelans. J Oral Pathol Med 1993; 22: 113-6.
19. Dekmezian RH, Batsakis JG, Goepfert H. In situ hybridization of papillomavirus DNA in head and neck squamous cell carcinomas. Arch. Otolaryngol. Head Neck Surg 1987; 113: 819-21.
20. Garlick JA, Taichman IB. Human papillomavirus infection of the oral mucosa. Am J Dermatopathol 1991; 13: 386-95.
21. Herrero R et al. Human papillomavirus and oral cancer: the International Agency for Research on Cancer multicenter study. J Natl Cancer Inst 2003; 95(23): 1772-83.
22. Klussmann JP, Weissenborn SJ, Wieland U, Dries V, Eckel HE, Pfister HJ, Fuchs PG. Human pappilomavirus-positive tonsillar carcinomas: a different tumor entity? Med Microbiol Immunol 2003 (Berl); 192(3): 129-32.
23. Ritchie JM, Smith EM, Summersgill KF, Hoffman HT, Wang D, Klussmann JP, Turek LP, Haugen TH. Human papillomavirus infection as a prognostic factor in carcinomas of the oral cavity and oropharynx. Int J Cancer 2003; 104(3): 336-44.
24. Ha PK, Pai SI, Westra WH, Gillison ML, Tong BC, Sidransky D, Califano JA. Real-time quantitative PCR demonstrates low prevalence of human papillomavirustype 16 in premalignant and malignant lesions of the oral cavity. Clin Cancer Res 2002; 8(5): 1203-9.
25. Niv A, Sion-Vardi N, Gatot A, Nash M, Fliss DM. Identification and typing of human papillomavirus (HPV) in squamous cell carcinoma of the oral cavity and oropharynx. J Laryngol Otol 2000; 114: 41-6.
26. Shindoh M, Chiba I, Yasuda M. et al. Detection of human papillomavirus DNA sequences in oral squamous cell carcinomas and their relation to p54 and proliferating cell nuclear antigen expression. Cancer 1995; 76: 1513-21.
27. Cruz IBF, Snijders PJF, Steenbergen RDM, et al. Age- dependence of human papillomavirus DNA presence in oral squamous cell carcinomas. Oral Oncol Eur J Cancer 1996; 32B: 55-62.
28. Klussmann JP, Weissenborn SJ, Weiland U, Dries V, Kolligs J, Jungehuelsing M et al. Prevalence, distribution, and viral load of human papillomavirus 16 DNA in tonsillar carcinomas. Cancer 2001; 92: 2875-84.
29. Miller CS, Johnstone BM. Human papillomavirus as a risk factor for oral squamous cell carcinoma: a meta-analysis, 1982-1997. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001; 91: 622-35.
30. Brandwein M, Zeitlin J, Nuovo GJ, et al. HPV detection using \"hot start\" polymerase chain reaction in patients with oral cancer: a clinicopathological study of 64 patients. (Review). Mod Pathol 1994; 7: 720-7.
Médica Otorrinolaringologista, mestranda.
Doutor em Otorrinolaringologia, Professor Adjunto do Departamento de Otorrinolaringologia da Santa Casa de Misericórdia de São Paulo.
Doutora em Patologia, Professor Adjunto do Departamento de Patologia da Faculdade de Ciências Médicas da Santa Casa de Misericórdia de São Paulo.
Irmandade da Santa Casa de Misericórdia de São Paulo.
Endereço para correspondência: Rua Nazaré Paulista, 163 bloco 2 ap. 94 B Vila Madalena São Paulo SP 05448-000.
Tel. (0xx11) 3672-6457 - 9972-0009 - E-mail: ssandoria@yahoo.com.br
Artigo submetido em 24/3/2005 e aprovado em 13/6/2005.


