INTRODUÇÃOA melhora na sobrevida dos pacientes com câncer, com a utilização de drogas antineoplásicas mais efetivas, como a cisplatina, tem favorecido o aumento na incidência de seus efeitos colaterais, particularmente no sistema nervoso central, rins e a ototoxicidade.1
Assim sendo, diferentes substâncias têm sido estudadas buscando a proteção destes efeitos, sem reduzir a atividade antitumoral da cisplatina.
A cisplatina causa uma perda auditiva neurossensorial bilateral e simétrica nas freqüências de 4 a 8 Khz, com a associação do sintoma de zumbido.2
A incidência de ototoxicidade é aumentada à medida que se aumenta a dose acumulada de cisplatina acima de 200 mg/m2 de superfície corporal. Com os estudos através de audiometria de altas freqüências, a incidência da perda auditiva aumenta, chegando até 70%, para freqüências até 16 Khz.3
McAlpine e Johnstone, 1990, em estudo experimental em cobaias, observaram lesão às células ciliadas externas cocleares, na espira basal da cóclea, sem alterar a stria vascularis.4
Estudos da década de 90 mostram que a cisplatina inibe a atividade da adenil ciclase na stria vascularis, inibe o DNA e RNA, a síntese protéica e atua aumentando os níveis de radicais livres de oxigênio, tóxicos para a célula.5
Ravi, 1995, mostra que a cóclea pode estar sofrendo alterações na sua capacidade antioxidante, com redução nos níveis de glutation coclear, diminuição na glutation oxidase e aumento na atividade das enzimas catalase e superóxido dismutase.6
Diferentes drogas otoprotetoras têm sido testadas, sendo que a maioria atua como anti-radical livre celular, entre elas a amifostina. (WR 2721, ácido S - 2[3-aminopropilamino] ethilphospho-rothiol), desenvolvida pelo Walter Red Army Institute, na década de 1950, com o objetivo de proteção aos efeitos tóxicos da radioterapia, sem alterar seu potencial antitumoral.7,8
Yuhas e Culo, 1980, foram os primeiros a mostrar que a amifostina promove uma diminuição na nefrotoxicidade induzida pela cisplatina, sem alterar sua atividade antitumoral, confirmados posteriormente pelos estudos de Glover et al., 1986 e 1987.7,9,10
Mollman et al., 1988, mostraram uma discreta redução na ototoxicidade pela cisplatina em pacientes tratados previamente com amifostina.11 Rubin et al., 1995, mostrou que não houve ototoxicidade em nenhum dos pacientes tratados com amifostina e cisplatina para as freqüências da fala.12
A amifostina é convertida em um composto ativo sulfídrico, denominado WR1065, que atua como citoprotetor, quelando radicais livres. Existe proteção seletiva da amifostina a células de tecido normal, devido à alta concentração deste composto nestas células em relação à célula tumoral. Tal fato é explicado pela redução na atividade da fosfatase alcalina nas células tumorais, pela baixa vascularização tumoral e pelo metabolismo anaeróbio tumoral que causa um meio com pH muito baixo, o que não permite a entrada do WR1065 no meio intracelular, pois este necessita de um pH entre 6,6 a 8,2.7,8
A amifostina foi aprovada pelo FDA para uso em pacientes recebendo cisplatina, na década de 80, para prevenir a nefrotoxicidade da cisplatina13. No entanto, seu uso não é recomendável nos casos de tumores potencialmente curáveis, por não se saber exatamente a influência da cisplatina na eficácia da quimioterapia.12,14
Não encontramos na literatura estudos experimentais que confirmam a proteção ás células ciliadas externas cocleares pela amifostina aos efeitos ototóxicos da cisplatina.
Dois estudos experimentais em "Hamsters", utilizando-se de microscopia eletrônica de superfície e potencial auditivo evocado de tronco cerebral, testaram o potencial de otoproteção da amifostina e outras drogas aos efeitos da cisplatina. Mostraram que o tiossulfato de sódio e o dietilditiocarbamato são mais efetivos como otoprotetores do que a amifostina e a fosfomicina.15,16
Propusemos estudar os efeitos otoprotetores da amifostina aos danos causados pela cisplatina às células ciliadas externas, utilizando medidas funcionais através de emissões otoacústicas por produtos de distorção e avaliação anatômica dos danos causados às células ciliadas externas, por microscopia eletrônica de varredura.
MATERIAL E MÉTODOSeleção dos Animais ExperimentaisElegemos como animal experimental cobaias albinas, pelo fácil manejo, pela facilidade de dissecção coclear e manipulação, facilidade para vias de infusão das drogas anestésicas e drogas em experimentação pela via intraperitoneal e por serem mais sensíveis aos efeitos da cisplatina, sendo que com a dose de 8,0 mg/Kg/dia por três dias consecutivos, apresentam alterações cocleares significativas.
A cobaia possibilita manutenção adequada, segundo as diretrizes do guia para cuidados e uso de animais de laboratório do Institute of Laboratory Animal Resources, Comission on Life Sciences, National Research Council, National Academy Press, Washington, DC. (1996).
Os animais foram selecionados no Biotério Central da Universidade de São Paulo - Campus de Ribeirão Preto, através da pesquisa do reflexo de Preyer. Escolhemos animais com peso variando entre 400 e 600 gramas, por serem animais mais resistentes aos efeitos colaterais sistêmicos da cisplatina, como inapetência, perda de peso, desidratação e diarréia.17,18
Após um repouso auditivo de 24 horas, os animais eram reavaliados e, desta vez, realizávamos a otoscopia manual. Os animais que apresentavam sinais de otite externa ou média aguda, cerume de difícil remoção, alterações inflamatórias do conduto auditivo externo, ou mesmo conduto auditivo muito estreito para acomodar adequadamente a sonda do equipamento de emissões otoacústicas, eram descartados do experimento e os que apresentavam apenas rolha de cerume de fácil remoção eram mantidos.
Submetiam-se então as cobaias a uma triagem auditiva por EOAPD em cabine com isolamento acústico e sob anestesia com Ketamina (65 mg/Kg) e Xylasina (6,5 mg/Kg). As que apresentavam EOAPD presentes, em pelo menos uma das orelhas, eram selecionadas para o experimento.
Os animais foram mantidos no Biotério do Laboratório de Cirurgia Experimental do Departamento de Cirurgia da Faculdade de Medicina de Ribeirão Preto-USP.
Por se tratar de um experimento com utilização de drogas sistêmicas, para cada animal consideramos duas cócleas e o animal que apresentou EOA presente em uma única orelha foi utilizado.
Drogas Utilizadas, Doses e Via de Administração1. Cisplatina (10 mg/ml) - 0,75; 1,5 e 8,0 mg/Kg/dia via intraperitoneal;
2. Xilazina (2g/100ml) - 6,5mg/Kg via intraperitoneal;
3. Cloridrato de Cetamina (50 mg/ml) - 65mg/Kg - via intraperitoneal;
4. Amifostina 100 mg/ Kg/ dia - via intraperitoneal.
Para a aplicação controlada das drogas em teste, foram utilizadas seringas descartáveis de 1cc, milimetradas para cada animal. Para a aplicação intraperitoneal utilizou-se de agulhas descartáveis BD tamanho 21G1 (25 X 8 - 0.8 x 25 milímetros).
Grupos de EstudoGrupo 1: 06 animais - 12 orelhas - dose de cisplatina de 8,0 mg/Kg/dia, por via intraperitoneal, por três dias.
Grupo 2: 06 animais - 12 orelhas - dose de Amifostina de 100 mg/Kg/dia, por via intraperitoneal e 90 minutos após, cisplatina 8,0 mg/Kg/dia, por via intraperitoneal por três dias.
Grupo 3: 03 animais - 06 orelhas - dose de Amifostina de 100 mg/Kg/ dia, por via intraperitoneal por três dias.
Avaliação Funcional AuditivaEmissões Otoacústicas por Produto de DistorçãoEquipamento: ILO 92 CAE System Otodynamics LTD
As cobaias eram anestesiadas com Cloridrato de Cetamin e Xylasina para serem submetidas aos testes. Antes da realização do registro das EOA eram submetidas à otoscopia manual para avaliação do conduto auditivo externo e membrana timpânica, sendo descartadas aquelas que apresentavam sinais de otites ou cerume de difícil remoção.
O teste de EOAPD foi realizado pré-tratamento e momentos antes dos animais serem sacrificados, seguindo a relação de freqüências 2F1 - F2 com relação F1:F2 = 1,22, resolução dois pontos por oitava.
Consideramos as EOA a partir de 1,5 kHz, pois as dimensões do conduto auditivo externo da cobaia fazem com que haja uma dificuldade de detecção das EOA abaixo desta freqüência, obtendo respostas que coincidam com as respostas do ruído.
Desta forma, ao analisarmos a freqüência de 2 kHz, oferecemos um tom puro um pouco acima e um pouco abaixo, de tal modo que a relação entre eles seja de 1,22, obtendo assim, automaticamente, uma resposta de freqüência resultante seguindo a relação 2F1-F2 (abaixo da freqüência avaliada) e 2F2-F1 (acima da freqüência resultante). Deve-se ainda levar em consideração que as intensidades de F2 e F1 podem ser iguais ou diferentes. Neste estudo utilizamos intensidades iguais de 70 dB NPS. A intensidade do estímulo desencadeante pode variar numa faixa de 0 a 70 dB NPS e podem ser medidas na faixa de 500 a 8000Hz.19
As otoemissões resultantes costumam ser em torno de 55 dB NPS menos intensas que o estímulo provocante. Com um estímulo de 70 dB NPS, provavelmente teríamos uma EOAPD, com variabilidade de mais ou menos 10 ou 15 NPS.20
Deste modo observa-se o chamado "DPGRAM", o audiococleograma, onde se tem um estímulo que é o som e uma resposta que também é um som e que fornece a função das células ciliadas externas cocleares responsáveis pelas freqüências analisadas.21
Neste estudo o que consideramos mais importantes foram as EOA nas freqüências mais agudas, que avaliam qualitativamente o estado funcional das células ciliadas externas na espira basal da cóclea. Foram consideradas as EOAPD como presentes e ausentes.
Avaliação AnatômicaMicroscopia Eletrônica de Varredura (MEV)Equipamento: Microscópio Eletrônico JEOL SCANNING MICROSCOPE - JSM 5200
As cobaias foram sacrificadas em tempo programado após administração das drogas via intraperitoneal e anestesia com éter, tendo sido decapitadas e suas cócleas removidas da bula.
Com dissecção microscópica as cócleas foram perfundidas com solução de fixação com glutaraldeído 3% a 4o Celsius e mantidas na solução por 24 horas para a fixação. Os passos seguintes foram realizados no Laboratório de Microscopia Eletrônica do Departamento de Morfologia da FMRP-USP.
Através da janela redonda foi injetado, nas cócleas, para fixação uma solução de glutaraldeído a 3% em tampão fosfato 0,1 M, pH = 7,4, por 4 horas a 4o Celsius, lavadas três vezes por 5 minutos com o mesmo tampão. Depois de dissecadas as cócleas foram fixadas com tetróxido de Ósmio 1% por 2 horas a 4o Celsius e submetidas a uma desidratação à temperatura ambiente em uma bateria crescente de etanol (50%, 70%, 90% e 95% - uma vez por 10 minutos em cada concentração) e etanol absoluto três vezes por 15 minutos. Terminada a desidratação, seguiu-se para a secagem pelo método do ponto crítico em CO2, onde o material ficou desprovido de água. Após ser fixado em porta espécime adequado, o material foi revestido em câmara de vácuo com vapores de ouro e examinados em microscópio eletrônico de varredura.22-25
Os resultados obtidos da MEV, depois de fotografados, foram analisados através de cocleogramas. Foram utilizadas as contagens do número de células ciliadas externas da espira basal da cóclea, em determinado campo fotográfico, sendo contadas dez células, presentes ou ausentes, conforme a Figura 1.
Os dados foram tratados estatisticamente, utilizando-se o programa estatístico Statistical Package for Social Sciencies - (S.P.S.S.).
Foram considerados na comparação dos resultados e tratados estatisticamente somente os dados referentes à espira basal, que é a que mais interessa do ponto de vista de lesão pela cisplatina, entretanto, mostramos em valores absolutos, plotados em gráficos, os dados referentes às outras espiras da cóclea.
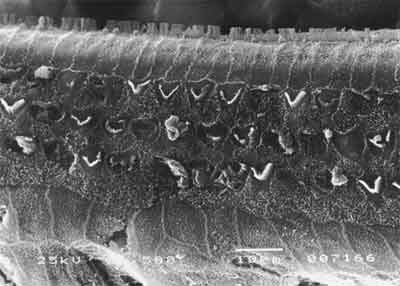
Figura 1. Representação esquemática do cocleograma utilizado para a contagem do número de células ciliadas por espira, sendo que:
V = célula ciliada normal
V = célula ciliada lesada
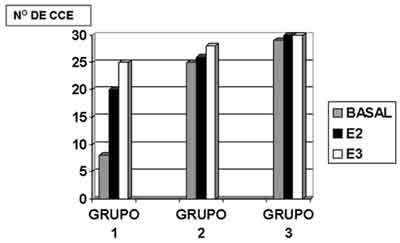
Figura 2. MEV, com aumento de 1.500X, da cóclea de cobaia do grupo 1.

Figura 3. Média do número de células ciliadas externas presentes nas espiras da cóclea, basal, E2 e E3 encontradas nos grupos 1, 2 e 3.
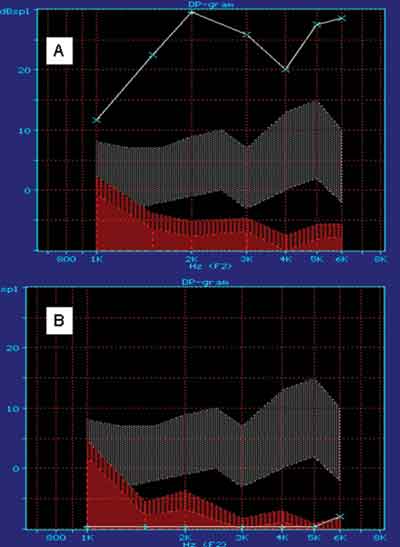
Figura 4. MEV, com aumento de 1.000X, da cóclea de cobaia do grupo 2.
Quanto à avaliação anatômica, no grupo 1, tratado com cisplatina isolada (8,0 mg/Kg/dia por três dias consecutivos) houve lesão com ausência de cílios nas três fileiras de células ciliadas externas em nível da espira basal, seguida da espira 2 e espira 3. As alterações mais evidentes foram na espira basal, mas observamos também distorção ciliar com desarranjo no padrão em "v" (ou "w"), com cílios dobrados ou ausência parcial de um dos "braços" do "v", Figura 2. Em nível das células ciliadas internas também observamos alterações ciliares, com cílios presentes, mas desarranjados.
Na Figura 3, observamos a comparação por estria das cócleas dos grupos 1, 2 e 3.
No grupo tratado previamente com amifostina observamos a manutenção da arquitetura normal das células ciliadas externas, à microscopia eletrônica de varredura e emissões otoacústicas por produtos de distorção presentes em todas as cócleas testadas.
Quanto à análise estatística dos dados apresentados, para comparar a variável número de células ciliadas externas na espira basal da cóclea, entre os grupos 1, 2 e 3, foi utilizado o teste não paramétrico de Kruskal-Wallis. Optou-se por tal metodologia não-paramétrica, pois os dados não seguem uma normalidade nesta variável (teste de Kolmogorov-Smirnoff com p<0.001). Assim, a hipótese H0 foi:
H0: os valores dos 3 grupos em questão são equivalentes entre si
X
H1: existe ao menos um par de grupos que difere significativamente.
Caso H0 fosse rejeitada usaríamos o teste post-hoc de Dunn para verificar quais as diferenças detectadas.
Adotamos p£0.05 como nível de significância. O resultado do teste foi p<0.001, mostrando que existiu diferença significativa entre os grupos. Pelo teste de Dunn constatamos que o número de células ciliadas externas no GRUPO 1 (CISPLATINA 8,0 mg/ Kg/dia) é menor que no GRUPO 2 (amifostina 100 mg/Kg/dia e CISPLATINA 8,0 mg/Kg/dia), que por sua vez é igual ao número do GRUPO 3 (amifostina 100 mg/Kg/dia).
Com relação à variável EOAPD, foi considerada a comparação dos percentuais de presente e ausente. No grupo 1 foram obtidos 100% de ausências, com tamanho 12, e, nos grupos 2 e 3, obteve-se 100% de presença, com grupos de tamanho 12 e 06. Com esses valores, pelo teste Exato de Fisher, temos com p<0.001 que os grupos 2 e 3 são equivalentes e significativamente diferentes dos grupos 1.
DISCUSSÃOA amifostina tem mostrado baixa toxicidade e bons resultados quanto à proteção contra os efeitos ototóxicos da radioterapia como relatam Foster Nora e Siden, 1997.13
Quanto à otoproteção contra agentes antineoplásicos, principalmente a cisplatina, Church et al. (1995), encontraram estudo eletrofisiológico por Potencial auditivo evocado encefálico, em hamsters, proteção pelo tiossulfato de sódio e dietildimetiltiocarbamato, não observando proteção efetiva pela amifostina e fosfomicina.15
Kaltenbach et al. (1997) analisaram as mesmas drogas, agora associando avaliação anatômica por Microscopia eletrônica de varredura e potencial auditivo evocado de tronco encefálico. Encontraram 91% de manutenção de células ciliadas externas com o tiossulfato de sódio, 68% com o dietilditilcarbamato, 52% com a fosfomicina e 45% com a amifostina.16
Apesar destes dados experimentais em animais, estudos em humanos utilizando cisplatina para o tratamento de diferentes neoplasiasmostram uma tendência a nefroproteção, neuroproteção, otoproteção e mieloproteção aos efeitos tóxicos da cisplatina. Foster Nora e Siden, 1997, relataram que estes estudos englobam pequenos números de pacientes com diferentes tipos de tumores e interação de antineoplásicos, além de estarem recebendo diferentes dosagens de cisplatina.13
Alguns centros de tratamento do câncer têm incluído em seus "Guidelines" o uso da amifostina para prevenir alguns dos efeitos tóxicos da cisplatina, em situações específicas e dose dependente, principalmente após a autorização e padronização do seu uso a partir de 1980 pelo FDA, conforme os estudos de Vincent et al. (2003).26
Pelo que pudemos observar em cobaias albinas tratadas com cisplatina 90 minutos após a administração da amifostina, avaliadas funcionalmente através das emissões otoacústicas por produtos de distorção e Microscopia eletrônica de varredura, encontramos proteção significativa funcional e estrutural aos efeitos ototóxicos agudos da cisplatina, diferente do que encontraram Kaltenbach et al. (1997), em hamsters, mostrando evidências do potencial de otoproteção da amifostina, em tratamentos agudos pela cisplatina, com doses sabidamente ototóxicas. Tais achados podem justificar sua indicação conforme é realizado em diferentes centros de tratamento do câncer, seguindo as orientações do FDA (1980).16
No entanto, seu uso não é recomendável nos casos de tumores potencialmente curáveis, por não se saber exatamente a influência da cisplatina na eficácia da quimioterapia.12,14
CONCLUSÃOA amifostina mostra evidentes sinais de otoproteção aos efeitos ototóxicos produzidos pela cisplatina em cobaias albinas.
No entanto, seu uso não é recomendável nos casos de tumores potencialmente curáveis, por não se saber exatamente a influência da cisplatina na eficácia da quimioterapia.12,14
REFERÊNCIAS BIBLIOGRÁFICAS1. Gandara DR, Perez EA, Wiebe V, De Gregorio MW. Cisplatin Chemoprotection and Rescue: pharmacologic modulation of toxicity. Sem Oncology 1991; 18: 49-55.
2. Piel IJ, Meyer D, Percia CP, Wolfe VI. Effects of cis-diamminedichoroplatinun (NSC - 119875) on hearing function in man. Cancer Chemother Rep 1974; 58: 871-5.
3. Drescheler WA, Van Der Hulst RJ, Tange RA, Urbanus NA. Role of high-frequency audiometry in the early detection of ototoxicity. II - clinical aspects. Audiology 1989; 28(4): 211- 20.
4. McAlpine D, Johnstone BM. The ototoxic mechanism of cisplatin. Hear Res 1990; 47: 191-203.
5. Schewetzer VG. Cisplatin induced ototoxicity: the effect of pigmentation and inhibitory agents. The Laryngoscope 1993; 103 Suppl 59.
6. Ravi R, Somani SM, Rybak LP. Mechanism of cisplatin ototoxicity: antioxidant system. Pharmacology & Toxicology 1995; 76: 386-94.
7. Glover D, Glick J, Weiter C. Phase I/II Trials of WR-2721 and Cisplatin. Int. J. Radiat Oncol Biol Phys 1986; 12: 1509-12.
8. Kalaycioglu M, Bukowski R. Clinical Status of the new chemoprotective agent amifostine. Oncology 1994; 8: 15-23.
9. Glover D, Glick J, Weiter C. WR-2721 and High-dose Cisplatin: an active Combination in the Treatment of Metastatic Melanoma. J Clin Oncol 1987; 5: 574-8.
10. Yohas JM & Culo F. Selective Inhibition of the Nephrotoxicity of Cisdichlorodiammineplatinun (II) by WR-2721 Without Altering its Antitumor Properties. Cancer Treat Rep 1980; 64: 57-64.
11. Mollman JE, Glover DJ, Hogen WM. Cisplatin Neuropathy: risk factors prognosis and protection by WR-2721. Cancer 1988; 61: 2192-5.
12. Rubin JS, Waler S, Beitter JJ, Haynes H, Razenblit A, Mcgill F, Goldeberg G, Runowicz C. Audiological findings in a phase I protocol investigating the effect of WR-2721 high-dose cisplatin and radiation therapy in patients with locally advanced cervical carcinoma. J Laryngol Otol 1995; 109: 744-7.
13. Foster Nora JA & Siden R. Amifostine for Protection From Antineoplastic Drug Toxicity. Am J Health Syst Pharm 1997; (54) 787-800.
14. Ramath N, Lorusso P, Simon M. Phase II evaluation of cisplatin and WR-2721 of refractory metastatic breast cancer. Am J Clin Oncol 1997; 20: 368-72.
15. Church MW, Kaltenbach JA, Blakley BW, Burgio DL. The Comparative Effects of Sodium Thiosulfate Diethyldithiocarbamate Fosfomycin and WR-2721 on Ameliorating Cisplatin - induced ototoxicity. Hear Res 1995; 86 (1-2): 195-203.
16. Kaltenbach JA, Church MW, Blakley BW, McCaslin DL, Burgio DL. Comparison of five agents in protecting the cochlea against the ototoxic effects of cisplatin in the hamster. Otolaryngol Head Neck Surg 1997; 117(5): 493-500.
17. Jero J, Coling DE, Lalwani AK. The use of Preyer's reflex in evaluation of hearing in mice. Acta Otolaryngol Jul 2001; 121(5): 585-9.
18. Preyer W. Die Seele des Kindes. Leipzig: Grieben - Verlag; 1882.
19. He NJ, Schmiedt RA. Fine structure of the 2F1-F2 acoustic distortion product: changes with primary level. J Acoust Soc Am 1993; 94(5): 2659-69.
20. Rasmussen AN, Popelka GR. Osterhammel PA, Nielsen LH. Clinical significance of relative probe tone levels on distortion products otoacoustic emissions. Scand Audiol 1993; 22(4): 223 -9.
21. Lopes Filho O, Carlos R, Redondo MC. Produtos de distorção das emissões otoacústicas. Rev Brasileira de Otorrinolaringologia 1995; 61(6): 485-94.
22. Saito T, Aran J.M. Comparative ototoxicity of cisplatin during acute and chronic treatment. ORL J Otorhinolaryngol Relat Spec 1994; 56(6): 315-20.
23. Cardinaal RM, Groot JCMJ, Huizing EH, Veldman JE, Smoorenburg G.F.Dose-dependent effect of 8-day cisplatin administration upon the morphology of the albino guinea pig cochlea. Hearing Res 2000; 144: 135-46.
24. Demarco RC. Uso da gentamicina intra-timpânica para induzir ablação vestibular unilateral em cobaias. Tese de Dissertação de Mestrado FMRP-USP; 2001.
25. Oliveira JAAO, Canedo DM, Rossato M. Autodefesa contra a ototoxicidade de antibióticos aminoglicosídeos. Rev Brasileira de Otorrinolaringologia 2002; 68(1): 7-13.
26. Vincent M, Bramwell V, Moran LA, Anderson D. Use of aminfostine to ameliorate the toxic effects of chemotherapy in the treatment of cancer. Toronto(ON): Cancer Care Ontario (OCO). Practice Guideline 2003; 12-6.


