INTRODUÇÃOA polipose nasossinusal (PNS) caracteriza-se pela presença de pólipos nasais múltiplos, comumente bilaterais, decorrentes de processo inflamatório da mucosa nasossinusal. Histologicamente, os pólipos nasais podem ser classificados em eosinofílicos e não eosinofílicos. A PNS eosinofílica representa 80 a 90% das PNS, associa-se à hiper-reatividade nasal e/ou brônquica e responde bem à corticoterapia. Engloba pacientes com diferentes fatores etiológicos e evoluções clínicas em relação às vias aéreas superiores e inferiores. A PNS eosinofílica é encontrada na Rinite Eosinofílica Não Alérgica (NARES), na Intolerância Aspirínica, na Atopia, na Sinusite Fúngica Alérgica e na Síndrome de Churg Strauss1,2,3
A infiltração dos pólipos pelos eosinófilos é a característica mais marcante da PNS eosinofílica, sendo o gatilho para se tentar compreender a patogênese desta afecção. A eosinofilia tecidual pode ser explicada pelo aumento da migração de eosinófilos para o local do processo inflamatório e/ou pelo aumento da sobrevida destes eosinófilos no tecido, conseqüente ao retardo no processo de apoptose.4
O termo apoptose, ou morte celular programada, refere-se ao processo não-patológico de morte celular. Caracteriza-se por uma seqüência de eventos distintos da necrose, impedindo a liberação de constituintes internos da célula e a ativação de mediadores da inflamação.5
Sabe-se que a apoptose é um processo ativo dependente de RNA e síntese protéica. Simon et al. (1997)6 demonstraram que o fator estimulador de colônias de granulócitos macrófagos (GM-CSF) e a interleucina 5 (IL-5), produzidos por eosinófilos e linfócitos7,8, têm capacidade de prolongar a sobrevida dos próprios eosinófilos, por inibição da apoptose.
Bjornson, Harvey e Rose (1985)9 demonstraram que a hidrocortisona pode suprimir, por ação direta sobre as células, a formação de colônias de eosinófilos. Liles, Dale e Klebanoff (1995)10 e Meagher et al. (1996)5 demonstraram a existência de efeito contrário dos corticosteróides sobre os eosinófilos e neutrófilos. Haveria aumento do número de neutrófilos conseqüente à redução da taxa de apoptose.11,12
O receptor Fas (CD 95/APO1), membro da superfamília TNF/NGF (Fator de Crescimento Neural), parece induzir apoptose nos eosinófilos. Sua ativação nos eosinófilos de indivíduos normais conduz rapidamente à apoptose. Em contrapartida, eosinófilos de indivíduos eosinofílicos não sofrem apoptose, mesmo que o receptor Fas ativo seja expresso normalmente nestas células.13 Isso sugere que outros sistemas estejam envolvidos na regulação da apoptose.14,15
Whyte, Meagher e Haslett (1991)16 comprovaram que o bloqueio da produção de proteínas por cicloheximidina e actinomicina-D induz apoptose de eosinófilos e neutrófilos, diferentemente dos corticosteróides. Concluíram que a apoptose é continuamente inibida pela produção de certas proteínas e induzida na ausência destas proteínas.
A mitomicina C (MMC) é uma droga anti-neoplásica e antibiótica extraída do Streptomyces caespitosus. Seu mecanismo de ação baseia-se na inibição seletiva da síntese de DNA, recombinação, troca de cromatinas irmãs e na reparação de DNA em bactérias.17
Existem poucos relatos de indução da apoptose com MMC em células de mamíferos. Schwartz et al. (1995)18 relataram indução de apoptose em tumores gástricos tratados com MMC. A simples aplicação, por cinco minutos, de MMC numa concentração de 0,4mg/ml é capaz de inibir a proliferação de uma cultura de fibroblastos por 35 dias.19 Kim et al. (1999)20 observaram que a MMC (0,4 mg/ml por 5 minutos) induziu, in vitro, a apoptose de fibroblastos humanos da cápsula de Tenon, primariamente cultivados.
Esta droga tem sido freqüentemente utilizada em laringologia quanto em otologia com segurança e bons resultados.21-24
O objetivo deste estudo foi avaliar a ação da Mitomicina C sobre o índice apoptótico de eosinófilos no estroma de pólipos nasais eosinofílicos.
MATERIAL E MÉTODOA população estudada foi constituída por pacientes portadores de PNS extensa, com faixa etária entre 16 e 79 anos, encaminhados pelo Sistema Único de Saúde SUS para realização de tratamento cirúrgico no Hospital São Geraldo, anexo do Hospital das Clínicas da Universidade Federal de Minas Gerais HC-UFMG.
Critérios de inclusão: pacientes portadores de polipose nasossinusal eosinofílica com porcentagem igual ou superior a 40% de qualquer etiologia.
Critérios de exclusão: pólipos nasais unilaterais, presença de secreção purulenta ou uso de medicamentos como corticosteróides ou antialérgicos num período de 2 meses antecedentes à avaliação inicial.
Foram selecionados 9 pacientes portadores de PNS eosinofílica, com porcentagem de eosinófilos igual ou superior a 40%25, no período de janeiro a junho de 2003.
Os pacientes selecionados foram submetidos a exame otorrinolaringológico completo, com especial atenção ao segmento nasal. As fossas nasais foram exploradas via rinoscopia anterior e fibronasolaringoscopia.
Foi realizado estudo comparativo experimental auto-pareado de 9 amostras de pólipos nasais eosinófílicos com tamanho aproximado de 3 mm. O grupo de estudo foi composto por culturas de fragmentos dos pólipos tratados com MMC e avaliados em zero, 12 e 24 horas para cada paciente. O grupo controle foi composto por culturas de fragmentos dos pólipos não-tratados com MMC e avaliados nos mesmos tempos horas.
As biópsias dos pólipos nasais obtidas para cultura foram realizadas no ambulatório de Otorrinolaringologia do HC-UFMG. Os fragmentos retirados foram imediatamente acondicionados em meio de cultura à temperatura ambiente. Durante a coleta foram utilizados dois tubos FALCON®. O primeiro recebeu a amostra por um a dois minutos, sendo levemente agitado e, então, feita a transferência para o segundo tubo. Esse procedimento visou diminuir o índice de contaminação das culturas.
No Laboratório de Imunologia do Hospital São Geraldo, os fragmentos foram seccionados em seis porções e semeados numa placa de seis orifícios. Destes seis compartimentos, três formaram o grupo experimental e três o grupo controle. No grupo experimental aplicou-se MMC por cinco minutos, na concentração de 400 µg/ml19. Após a aplicação da droga, as culturas foram lavadas em meio RPMI. Para o grupo controle, não tratado com MMC, utilizou-se somente o meio RPMI. Os fragmentos contidos nos dois primeiros compartimentos, controle e experimento, foram imediatamente submetidos ao preparo para histopatologia. Os outros dois pares de amostras, cada qual contendo controle e experimento, foram encubados por 12 e 24 horas, respectivamente, em estufa a 37º C e 5% de CO2 em meio de cultura. Ao final de cada tempo (hora 12 e 24), os fragmentos foram enviados para exame histopatológico.26
O meio de cultura utilizado foi RPMI 1640, comercializado por Gibco UK26, contendo 5% de soro humano AB, 2 M de mercaptoethanol, 1 mM L-glutamina, 2mM piruvato de sódio, 10 gr/ml de estreptomicina, 100U/ml de penicilina e 5mg/ml de fungisona.
Os fragmentos de cada amostra, após retirado o sobrenadante, foram transferidos para recipientes contendo formol a 10% e encaminhados para histopatologia rotineira, após impregnação em parafina. As lâminas resultantes foram coradas pela hematoxilina-eosina (HE) e avaliadas em microscópio óptico. As imagens dos campos com infiltrado eosinofílico foram digitalizadas, armazenadas em compact disc e posteriormente analisadas em programa de morfometria. Esta parte da pesquisa foi realizada nos Laboratórios de Apoptose e de Morfometria (Departamento de Patologia Geral do ICB - UFMG).
A análise da celularidade, isto é, da eosinofilia tecidual, foi obtida através da exploração de cinco a 10 campos do microscópico óptico com aumento de 400X, contando-se o maior número de células inflamatórias por campo para obtenção da porcentagem de eosinófilos.25
Para a análise do índice apoptótico (IA) foi realizada, em cada lâmina, a contagem dos eosinófilos num aumento de 1.000X em óleo de imersão, dividindo-se o total de eosinófilos em apoptose pelo total de eosinófilos contados.4 O eosinófilo em apoptose caracteriza-se pela perda do contato celular, condensação citoplasmática e nuclear além da coalescência ou extrusão nuclear.4,27
O método de análise estatística utilizado foi o teste t pareado para comparação dos grupos em cada um dos tempos considerados, segundo Snedecor e Cochran (1977)28. Foi considerado nível de significância de 5% e utilizado o pacote estatístico Minitab, versão 13, na análise estatística dos dados.
Este estudo foi previamente aprovado pelo Comitê de Ética em Pesquisa da UFMG Parecer no 109/02.
RESULTADOSForam enviados para preparo de lâminas e cálculo do índice apoptótico 9 experimentos (Figura 1).
Ao todo, foram obtidos e analisados 741 campos digitalizados. Destes, 67 foram analisados numa magnificação de 400X para quantificação da celularidade. A média de celularidade (porcentagem de eosinófilos) encontrada foi de 55,7% (48,2% - 67,5%). Para determinação do IA foram analisados 674 campos numa magnificação de 1.000X. O resultado da análise do IA obtido nos nove experimentos pode ser observado na Figura 1. No tempo hora zero, não houve diferença significativa entre os dois grupos, tratados ou não com MMC (p= 0,189). Em 12 horas, as culturas tratadas apresentaram uma taxa de apoptose significativamente maior (p<0,001) que as não tratadas. Na hora 24 não foi observada diferença significativa entre os dois grupos (p= 0,301).
Ao se analisar isoladamente o grupo não tratado com MMC, observa-se uma diferença significativa entre os tempos hora zero e 12 (p<0,001), entre os tempos hora zero e 24 (p<0,001) e entre os tempos hora 12 e 24 (p<0,001). Este padrão se mantém para o grupo tratado com MMC, no qual existe uma diferença significativa entre os tempos hora zero e 12 (p<0,001), entre os tempos hora zero e 24 (p<0,001) e entre os tempos hora 12 e 24 (p< 0,001). Como demonstrado nas Figuras de 2 a 5, o método utilizado na avaliação histopatológica mostrou-se claramente favorável à detecção de eosinófilos em apoptose.
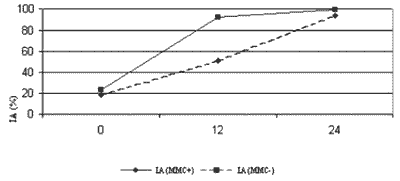
Figura 1. IA nas culturas tratadas e não tratadas com MMC. IA (MMC-) refere-se às culturas sem MMC. IA (MMC+) refere-se às culturas com MMC.
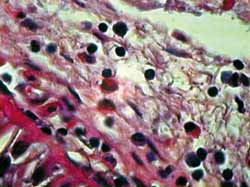
Figura 2. Corte hispatológico sem aplicação de MMC, no tempo zero hora. Eosinófilos se apresentam viáveis em sua maioria. Coloração pela HE. Aumento de 1.000X.
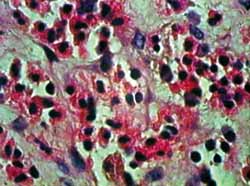
Figura 3. Corte hispatológico com aplicação de MMC, no tempo zero hora. Como no corte anterior (Figura 2), os eosinófilos mantem-se viáveis em sua maioria. Coloração pela HE. Aumento de 1.000X.
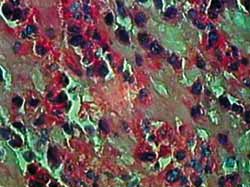
Figura 4. Corte hispatológico sem aplicação de MMC, no tempo de 12 horas. Os eosinófilos mantem-se viáveis em sua maioria, mas alguns já apresentam sinais de apoptose. Coloração pela HE. Aumento de 1.000X.
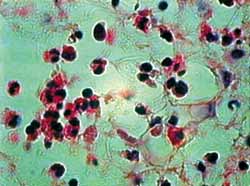
Figura 5. Corte hispatológico com aplicação de MMC, no tempo de 12 horas. Os eosinófilos já mostram evidentes sinais de apoptose. Nota-se, também, desorganização do tecido conjuntivo. Coloração pela HE. Aumento de 1.000X.
A coloração por HE nos permite uma boa identificação dos eosinófilos e das mudanças histopatológicas relacionadas à apoptose. Como apresentado nas Figuras de 2 a 5, observam-se claramente a perda do contato celular, a contração citoplasmática e nuclear, além da coalescência e extrusão nucleares. Foram detectados numerosos corpos apoptóticos (extrusão citoplasmática e/ou nuclear) em cortes de 12 horas com MMC e de 24 horas, com ou sem aplicação da droga. Esse resultado demonstra que o método utilizado foi claramente favorável ao estudo histopatológico desse tipo de lesão tecidual.27
A apoptose ou morte celular programada é um processo regulador da resposta inflamatória. Acredita-se que na PNS eosinofílica a inibição da apoptose determinaria retardo na remoção tecidual dos eosinófilos, os quais permaneceriam ativados, prolongando a eosinofilia e os danos teciduais.6,8
Trabalhos mostram que altos níveis de IL-5 e GM-CSF inibem o processo apoptótico. Trabalhos de Davidsson, Anderson e Hellquist (2000)13 demonstraram que os eosinófilos, quando ativados nas PNS eosinofílicas, apresentam o antígeno Fas ativado como primeiro sinal da cascata apoptótica. Dessa forma, a apoptose deveria ser continuamente inibida pela produção de proteínas. Dibbert et al. (1998)12 mostraram que a IL-5 e o GM-CSF estimulavam o gene Bcl-xL, anti-apoptótico. Por outro lado, a função do gene BAX, pró-apoptótico, não se altera diante destas citocinas.
Cox (1995)11 e Meagher et al. (1996)5, utilizando corticosteróides, concluíram que a inibição da apoptose ocorreria pela produção de proteínas específicas e não pela ação direta do GM-CSF. Uma prova da necessidade de produção de proteínas para a inibição da apoptose foi dada por Whyte, Meagher e Haslett (1991)16, que utilizaram cicloheximidina e actinomicina-d para induzirem apoptose em eosinófilos e neutrófilos.
A MMC é um agente antiblástico alquilante capaz de inibir a síntese de DNA17 e induzir apoptose em células de tumores gástricos.18 Kim et al. (1999)20 observaram que a MMC (0,4 mg/ml por cinco minutos) induziu, in vitro, a apoptose de fibroblastos humanos da cápsula de Tenon.
A MMC tem sido largamente utilizada na prevenção de processos cicatriciais em diversas áreas da medicina.22 Uma simples aplicação de MMC, por cinco minutos, a uma concentração de 0,4 mg/ml é capaz de inibir a proliferação de uma cultura de fibroblastos por 35 dias.19 Jang, Song e Pack (2003)24 estudaram a ação da MMC na concentração de 400µg/ml sobre cultura de fibroblastos de membrana timpânica, concluindo que existe diferença estatisticamente significativa na inibição da proliferação em relação ao grupo controle. Tais estudos dão suporte ao emprego da MMC na concentração de 0,4 mg/ml na presente pesquisa.
A análise do IA não mostrou diferença significativa no tempo zero para os grupos tratados ou não com MMC (p= 0,189). Em 12 horas houve diferença estatisticamente significativa entre os grupos (p< 0,001). Este resultado reforça a ação da MMC como agente alquilante, inibindo a produção de proteínas e liberando a cascata apoptótica, o que determina alterações morfológicas e morte celular. Essas alterações foram claramente detectadas pelo método histopatológico.
Na hora 24 não houve diferença significativa entre os dois grupos, com valor de p= 0,301. Esse fato decorre do elevado IA presente nos dois grupos. No grupo não tratado com MMC, o IA aumentou progressiva e lentamente, ao contrário do grupo tratado com MMC, no qual houve uma progressão rápida do IA nas primeiras 12 horas.
Supõe-se que, como agente alquilante, a MMC bloquearia a produção de proteínas nas células envolvidas, com suspensão dos mecanismos anti-apoptóticos e liberação dos mecanismos pró-apoptóticos induzidos na ativação dos eosinófilos13, mas mantidos em contínuo bloqueio pela ação de citocinas como GM-CSF e IL-5.16 Sendo assim, após a aplicação de MMC, teríamos níveis teciduais de GM-CSF mais baixos, inibindo a ativação de novos eosinófilos e liberando a cascata de apoptose nos eosinófilos atingidos pela droga.5,7,12
Observou-se, nas culturas em 24 horas do grupo não tratado com MMC, uma alta porcentagem de eosinófilos em apoptose, igualando-se ao grupo de 24 horas tratado com MMC. Tal fato se deve provavelmente à ausência de fatores de estimulação.
CONCLUSÕESOs dados do presente estudo demostraram que a mitomicina C foi capaz de determinar o aumento do índice apoptótico em culturas de estromas de PNS eosinofílica.
AgradecimentosEste trabalho só foi possível graças à cooperação de várias pessoas e serviços, propiciando a abertura de um novo campo de estudo em nosso Departamento.
Ao Prof. José Renan da Cunha Melo, por ter me apoiado e permitido livre acesso ao seu laboratório no início de minha pesquisa.
A Edilene Matias do Amaral, pelo grande empenho e dedicação no trabalho de laboratório, com agradecimentos extensíveis ao André Macedo Vale e a Eliane Perlatto Moura.
À CAPES pelo apoio e incentivo à pesquisa.
REFERÊNCIAS BIBLIOGRÁFICAS1. Settipane GA, Nasal polyps and systemic diseases. In: Schatz M, Zeiger RS, Settipane GA. Nasal manifestations of systemic diseases. Providence: Oceanside Publ.): 43-51, 1991a.
2. Ponikau JU, Sherris DA, Kern EB, Homburger HA, Frigas E, Gaffey TA, Roberts GD. The diagnosis and incidence of allergy fungal sinusitis. Mayo Clin Proc Sept. 1999; 74(9): 877-84.
3. Becker HMG, Guimarães RES, Nascimento E., Becker CG, Gonçalves DU, CROSARA PFTB. Perfil das Citocinas e Tipificação de HLA em Pacientes com Polipose Nasossinusal Eosinofílica Tolerantes e Intolerantes a Aspirina. Rev Bras Otorrinolaringol São Paulo 2003; 69 (3): 296-302.
4. Woolley KL, Gibson PG, Carty K, Wilson AJ, Twaddell SH, Woolley MJ. Eosinophils apoptosis and the resolution of airway inflammation in asthma. Am J Respir Crit Care Med 1996; 1(54): 237-43.
5. Meagher LC, Cousin JM, Seckl JR, Haslet C. Oppositing Effects of Glucocorticoids on the Rate of Apoptosis in Neutrophil Granulocytes. Journal of Imunnology; 1996.
6. Simon HU, Yousefi S, Schranz C, Schapowal A, Bachert C, Blaser C. Direct demonstration of delayed eosinophil apoptosis as a mechanism causing tissue eosinophilia. The Journal of Immunology 1997; 158: 3.902-8.
7. Simon HU. Regulation of eosinophil and neutrophil apoptosis - Similaties and differences. Immunol. Rev 2001; 1(79): 156-62.
8. Kowalski ML, Grzgorczyc J, Pawliczak R, Kornatowzki T, Wagowzka-Danilewicz M, Danilewicz M. Deceased apoptosis and distinct profile of infiltrating cells in the nasal polyps of patients with aspirin hypersensitivity. Allergy 2002; 57 (6): 493-500.
9. Bjornson BN, Harvey JM, Rose L. Differential effects of hydrocortisone on eosinophil and neutrophil proliferention. J Clin Invest 1985; (76): 924-9.
10. Liles C, Dale DC, Klebanoff SJ. Glucocorticoids inhibits apoptosis of human neutrophils. Blood 1995; 86 (8): 3.181-8.
11. Cox, G. Glucocorticoids treatment inhibits apoptosis in human neutrophils, separation of survival and activation outcomes. J. Immunol 1995; 154: 4.719.
12. Dibbert B, Daigle I, Braun D, Schranz C, Weber M, Blaser C, Zangemeister-Wittke U, Akbar A, Simon HU. Role of Bcl-xL in delayed eosinophil apoptosis mediated by granulocyte-macrophage colony-stimulation factor and interleukin-5. Blood 1998; 92 (3): 778-83.
13. Davidsson A, Anderson T, Hellquist HB. Apoptosis and phagocytosis of tissue-dwelling eosinophils in sinonasal polyps. Laryngoscope Jan 2000; 110 (1): 111-6.
14. Hebestreit H, Yousefi S, Balatti M, Weber M, Crameri R, Simon D, Hartung K, Schapowal A, Blaser K, Simon HU. Expression and function of FAS on human blood and tissue eosinophils. Eur. J. Immunol 1996; (26): 1775-80.
15. Hebestreit H, Dibert B, Balatti I, Braun D, Schapowal A, Blaser K, Simon HU. Disruption of fas receptor signaling by nitric oxide in eosinophils. J Exp Med Feb 1998; 187 (3): 415-25.
16. Whyte MKB, Meagher L, Haslett C. Cycloheximide and actinomicin-d programmed cell death (apoptosis) in neuthophils. Clin Sci 1991; (80): 5.
17. Carrano AV, Thompson LH, Stretka DG, Minkler JL, Frong S. DNA crosslinking sister chromatid exchange and specific locus mutation. Mutat Res 1979; (63): 175-88.
18. Schwartz GK, Haimovtz-Friedman A, Dhupar SK, Ehleiter D, Maslak P, Lau L, Laganzo F.Jr, Kelsen DP, Fucks Z, Alpino AP. Potentiation of apoptosis by treatment with protein kinase-c specific inhibitor safingol in mitomycin c treated gastric cancer cells. J. Nat. Cancer Inst 1995; (87): 1394-99.
19. Khaw PT, Doyle JW, Sherwood MB, Grierson H, Shultz G, Megorray S. Prolonged localized tissue effects from 5 minutes exposures fluoracil and mitomycin C. Arch Ophtalmol 1994; (72): 155-61.
20. Kim JW, Kim SK, Song IH, Kim, IT. Mitomycin C-induced apoptosis in cultured human Tenon's capsule fibroblasts. Korean J Ophthalmol Jun. 1999; 13 (1): 7-15.
21. Correa AJ, Reinish L, Sanders DL, Huang S, Deriso W, Duncavage JA. Inhibition of subglottic stenosiswith mitomycin c in the canine model. Ann Otol Rhinol Laryngol Nov. 1999; 108 (1): 1053-60.
22. Rahbar R, Valdez TA, Shapshay SM. Preliminary results of intraoperative mitimycin-C in the treatment and prevention of glottic and subglottic stenosis. J Voice June 2000; 14 (2): 282-6.
23. Becker CG, Silva AL, Guimarães RES, Becker HM, Barra IM, Oliveira WD. Tratamento cirúrgico da otite media com efusão: tubo de ventilação versus aplicação tópica de mitomicina C. Rev Bras Otorrinolaringol jul/ago. 2003; 69 (4) 513-9.
24. Jang CH, Song CH, Pak SC. Effect of exposure to mitomycin c on cultured tympanic membrane fibroblasts. Int J Pediatr Otorhinolaryngol Feb. 2003; 67 (2): 173-6.
25. Ingels K, Durez JP, Cuvelier C, Cauwenberge PV. Nasal biopsy is superior to nasal smear for finding eosinophils in nonallergic rhinits. Allergy Mar. 1997; 52 (3): 338-41.
26. Teram LM, Park HS, Djukanovic R, Roberts K, Holgate S. Cultured nasal polyps from nonatopic and atopic patients release RANTES spontaneously and after stimulation with phytohemagglutinin. J Allergy Clin Immunol Oct. 1997; 100 (4): 499-504.
27. Walsh GM, Dewson G, Wardlaw AJ, Lebi-Shaffer F, Moqbel R. A comparative study of different methods for the assement of apoptosis and necrosis in human eosinophils. Journal of Immunological Methods 1998; 217: 153-63.
28. Snedecor GW and Cochran WG. Statistical Methods, AMES: Iowa State University Press; 1977.
1 Doutor pelo Departamento de Oftalmologia, Otorrinolaringologia e Fonoaudiologia da Universidade Federal de Minas Gerais.
2 Professor Adjunto do Departamento de Parasitologia da Universidade Federal de Minas Gerais.
3 Professor Adjunto do Departamento de Oftalmologia, Otorrinolaringologia e Fonoaudiologia da Universidade Federal de Minas Gerais.
4 Professor Adjunto do Departamento de Patologia Geral da Universidade Federal de Minas Gerais.
5 Professor Adjunto do Departamento de Estatística da Universidade Federal de Minas Gerais.
6 Pós-graduando, nível doutorado pelo Departamento de Cirurgia Geral da Universidade Federal de Minas Gerais.
Trabalho realizado no Departamento de Oftalmologia, Otorrinolaringologia e Fonoaudiologia da Universidade Federal de
Minas Gerais. Laboratório de Imunologia: Professor Evaldo Nascimento.
Endereço para correspondência: Dr. Paulo Fernando Tormin Borges Crosara - Rua Bernardo Guimarães 2053 ap.1602 Lourdes Belo Horizonte MG 30140-082.
Telfax (0xx31) 3281-4604 - E-mail: pcrosara@hotmail.com.
Artigo recebido em 22 de abril de 2004. Artigo aceito em 05 de agosto de 2004.


