INTRODUÇÃOO granuloma reparativo de células gigantes (GRCG), também conhecido como granuloma central de células gigantes, é considerado um tumor intra-ósseo pela Organização Mundial de Saúde, incomum, não-neoplásico, e responsável por menos que 7% de todas as lesões expansivas da mandíbula, que por sua vez representa a localização mais comum do tumor1,2. Com menor freqüência, desenvolve-se no antro maxilar e raramente apresenta-se com comprometimento etmoidal3.
O GRCG constitui um importante diagnóstico diferencial nas lesões expansivas mandibulares e sinusais, sobretudo em crianças e adolescentes.
O GRCG deve ser diferenciado do tumor de células gigantes (TCG), também denominado de osteoclastoma, do cisto ósseo aneurismático e do tumor marrom hiperparatireóideo. De fato, a diferenciação histopatológica entre o GRCG e TCG pode ser difícil e, nestas situações, dados clínicos como a idade do paciente, o comportamento clínico do tumor e a resposta ao tratamento instituído são importantes para a elucidação diagnóstica4.
Até 1953, as lesões expansivas da mandíbula com células gigantes multinucleadas (CGMN) eram genericamente designadas de tumores de células gigantes. Naquele ano, Jaffè5 propôs o termo "granuloma reparativo de células gigantes" da mandíbula, reconhecendo-a como uma doença não-neoplásica, óssea, de curso benigno, e acreditando que a mesma resultasse primariamente de um processo de reparação tecidual a uma lesão prévia, supostamente de natureza traumática. O TCG, por sua vez, seria uma neoplasia verdadeira, que, embora histologicamente benigna na maioria dos casos, pode metastatizar, principalmente para o pulmão. Atualmente, sabe-se que ambos os tumores podem ser localmente agressivos4.
Posteriormente, o GRCG foi descrito, em vários artigos, nos seios paranasais6,7, ossos temporais8, órbita9 e ossos tubulares de extremidades10. A distinção entre o GRCG e TCG tornou-se bem estabelecida e mais amplamente aceita.
Embora apresentem semelhanças histopatológicas, o GRCG e o TCG habitualmente evidenciam achados clínicos e anatomopatológicos característicos, que auxiliam na distinção entre ambos, mas que podem variar amplamente de um paciente para outro.
O objetivo do presente trabalho é descrever dois casos de GRCG em pacientes do sexo masculino, com acometimento maxilo-etmoidal e maxilar, respectivamente, e revisar características inerentes ao GRCG, com ênfase no diagnóstico diferencial, sobretudo com o tumor de células gigantes.
REVISÃO DA LITERATURAPoucos tumores ósseos têm suscitado tanta controvérsia em terminologia quanto o GRCG. Quanto à intitulação de "granuloma central de células gigantes", observa-se que a atual designação "central" promove uma importante distinção destes com os tumores de células gigantes (TCG) (osteoclastoma) que geralmente ocorrem em ossos longos. Porém, o GRCG também já foi descrito em ossos tubulares das mãos e pés10.
Por outro lado, o termo "granuloma reparativo" proposto por Jaffè, baseado na hipótese fisiopatogênica de um reparo pós-trauma continua em debate. Porém, não se trata de um granuloma verdadeiro, pois não há célula epitelióide verdadeira, uma vez que alguns autores crêem que as CGMN representam, em realidade, osteoclastos11. Entretanto, a designação de Jaffè é atraente e amplamente utilizada, haja vista algumas evidências histológicas sugestivas de reparo tissular, em que a hemorragia intra-óssea pós-trauma levaria à inflamação localizada e ao subseqüente desenvolvimento do tumor em indivíduos predispostos. Segundo esta hipótese, a hemossiderina nos macrófagos, freqüentemente encontrada nestas lesões, seria resultado da hemorragia intra-óssea. Por fim, o comum achado de neoformação óssea constituiria uma forte evidência do processo de reparação tecidual. Realmente, não raro obtém-se um antecedente claro de traumatismo local prévio ou sinusopatia crônica.
Nos casos de GRCG dos seios paranasais, acredita-se que um processo inflamatório crônico, e não um traumatismo, seja o mais freqüente fator associado à hemorragia intra-óssea8 e à subseqüente reação com CGMN.
Um tecido celular fibroso associado a focos hemorrágicos e agregados de células gigantes multinucleadas são achados histológicos típicos8. Depósitos esparsos de hemossiderina são comuns. O estroma de tecido conjuntivo recente contém numerosos fibroblastos alongados e em fuso, e algumas formações císticas. A CGMN habitualmente mostra-se com um menor número de núcleos em relação ao observado no TCG.
O TCG, a seu turno, mostra uma preponderância citoplasmática sobre a celularidade e os fibroblastos apresentam marcado predomínio nuclear, além de formato mais arredondado. No TCG, o tecido é densamente ocupado por células gigantes multinucleadas envolta em escasso estroma de fibroblastos em fuso. Figuras de mitose também podem ser observadas, em contraste com o GRCG, em que estão ausentes ou são raramente vistas.
Por outro lado, o cisto ósseo aneurismático (COA) é considerado um processo reparativo no tecido ósseo e apresenta várias características em comum com o GRCG. Contudo, é mais freqüente em ossos longos e vértebras. Raramente desenvolve-se no esqueleto facial, mas também tem a mandíbula como o sítio predileto de origem no segmento cefálico. Igualmente, tem maior incidência na primeira e segunda décadas de vida e no sexo feminino. De acordo com o melhor do nosso conhecimento, somente dois casos de envolvimento etmoidal foram descritos na literatura12. Histologicamente, não é um cisto verdadeiro pois não apresenta revestimento epitelial13. É caracterizado por um estroma fibroso que abriga CGMN e múltiplos espaços vasculares sinusóides e cavernosos, responsáveis pelo abundante sangramento intra-operatório. Alguns autores acreditam que este tumor pode ter origem em outras lesões primárias como o GRCG que, por motivos desconhecidos, sofre alterações hemodinâmicas que levariam às anormalidades vasculares previamente descritas13.
A doença óssea secundária ao hiperparatireoidismo de qualquer etiologia geralmente está associada a aumento da reabsorção óssea e osteopenia. Porém, numa fase mais tardia, a atividade osteoclástica pode resultar no desenvolvimento de múltiplas formações císticas intra-ósseas associadas a focos de hemorragia e depósito de hemossiderina. Estas lesões são conhecidas como tumor marrom (ou pardo) hiperparatireóideo ou osteíte fibrosa cística e devem ser incluídas no diagnóstico diferencial do GRCG. Semelhante aos tumores previamente citados, no segmento cefálico é mais comum na mandíbula. Os níveis séricos de paratormônio (PTH) e cálcio estão elevados em contraste à hipofosfatemia, resultado de um processo contínuo de desmineralização óssea.
RELATO DE CASOSCaso 1
Paciente do sexo masculino, 11 anos de idade, mulato claro, com história de proptose e obstrução nasal à direita, progressivos, há aproximadamente um ano. Não referia dor ocular ou diplopia. Sem antecedentes de traumatismo crânio-facial ou doença inflamatória naso-sinual.
Ao exame físico, deformidade facial grosseira com proptose acentuada do globo ocular direito e presença, à palpação, de tensão na região de tecido mole supramedial da órbita. Presença de hiperemia conjuntival ipsilateral. Movimento ocular extrínseco preservado bilateralmente. Rinoscopia anterior revela obstrução de fossa nasal direita pelo tumor. Exame físico segmentar restante, incluindo o cervical, não evidenciou anormalidades.
A tomografia computadorizada (TC) de seios paranasais mostra lesão expansiva de contornos regulares e limites parcialmente definidos, medindo cerca de 6,0 cm em seu maior diâmetro, comprometendo predominantemente o seio maxilar e etmoidal direito, deslocando o globo ocular e o músculo reto medial ipsilaterais ântero-lateralmente. Evidencia-se ainda solução de continuidade do tumor com o assoalho do seio frontal direito e a parede anterior do seio esfenoidal homolateral, com pequena extensão para o interior dos mesmos. Fossa nasal direita parcialmente preenchida pelo tumor. Ausência de anormalidade contra-lateral (Figura 1 e 2). As características tomográficas sugerem o seio etmoidal como o local de origem do tumor.
Caso 2
Paciente do sexo masculino, 9 anos de idade, mulato escuro, com queixa de tumoração em região malar esquerda há 2 anos, com crescimento progressivo, indolor, associada à deformidade facial. Não refere obstrução nasal, rinorréia ou epistaxe. Relata traumatismo facial há aproximadamente três anos e meio sobre a região malar esquerda.
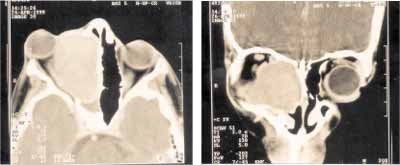
Figuras 1 e 2. imagens por tomografia computadorizada(TC) em cortes axial e coronal revelam uma formação expansiva com densidade intermediária de partes moles comprometendo os seios etmoidal direito e maxilar além de extensão para a fossa nasal homolateral. Evidencia-se proptose acentuada, erosão da lâmina papirácea e deslocamento lateral e anterior do globo ocular e músculo reto medial à direita, além de sinusopatia esfenoidal obstrutiva.
Ao exame físico, a inspeção revelou macromala à esquerda. Sinais flogísticos ausentes. Tratava-se de uma tumoração de consistência endurecida à palpação e indolor, sendo a anormalidade limitada à região maxilar esquerda. Arcada dentária compatível com a faixa etária. Palato duro com moderado abaulamento à esquerda. À rinoscopia anterior, observou-se estreitamento progressivo, em sentido ântero-posterior, de fossa nasal esquerda (FNE), com medialização da parede nasal lateral, sugerindo ser conseqüência de processo expansivo maxilar ipsilateral, além de estase de muco.
A TC dos seios paranasais evidenciou formação expansiva sólida, de contornos regulares e limites bem definidos, com aproximadamente 3,6 cm em seu maior diâmetro, acometendo o seio maxilar esquerdo e processo alveolar homolateral, com adegalçamento da cortical óssea, sem, contudo, haver evidência de rompê-la, e densidade heterogênea com áreas sugestivas de calcificação e formações císticas. No assoalho do antro maxilar contra-lateral vê-se uma imagem sugestiva de cisto mucoso (Figura 3).
Nos dois casos estudados, os exames laboratoriais de rotina e o cálcio sérico foram normais.
Foi realizada exérese cirúrgica dos tumores, executada sem intercorrências. Contudo, foi necessária a remoção das unidades dentárias instáveis de números 24, 26 e 27 (inclusa) no paciente com tumor maxilar abordado via Caldwell-Luc.
No paciente com doença pansinusal unilateral, a abordagem externa combinada via incisão de Lynch estendida e Caldwell-Luc foi suficiente para oferecer satisfatória exposição do tumor. A parede medial da órbita foi reconstruída com prótese de titânio (Figura 4). No segundo dia pós-operatório (DPO), este paciente passou a apresentar diplopia na mirada para a esquerda e estrabismo divergente, que se resolveram após o vigésimo quarto DPO.
O controle clínico, endoscópico e tomográfico de ambos os pacientes por dois anos não revelou recorrência (Figura 5). Os resultados anatomopatológicos revelaram tratar-se de granuloma central de células gigantes, sendo estas conclusões ratificadas por dois outros serviços de referência em anatomia patológica do país (Figuras 6, 7 e 8).
DISCUSSÃONa mandíbula, o GRCG é duas vezes mais freqüente no sexo feminino14. É mais comum em crianças, adolescentes ou adultos jovens. Por outro lado, um TCG num paciente com idade inferior a 18 anos é excepcional e até o momento não foi descrito em indivíduos com idade abaixo de 10 anos8. O tumor de células gigantes (osteoclastoma) é mais freqüente na terceira e quarta décadas. Em ambos os casos estudados, a faixa etária dos pacientes está de acordo com as descrições clássicas.
O GRCG é mais freqüente no osso mandibular (2/3 dos casos) que na maxila e raramente é encontrado fora do maciço crânio-facial, sendo que apenas alguns casos foram descritos nos ossos frontal, etmoidal e temporal. O TCG, ao contrário, tipicamente acomete a epífise de ossos longos. No segmento cefálico, entretanto, também é mais comum na mandíbula15.
Os dois casos em estudo representam localizações atípicas do GRCG. De acordo com a literatura consultada, até o presente momento, apenas 17 casos de GRCG do etmóide foram descritos1,4,11, sendo que apenas em um relato o tumor se encontrava limitado ao etmóide1. Por outro lado, o envolvimento maxilar do tumor se encontra bem descrito em vários relatos.
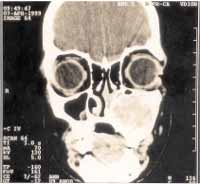
Figura 3. Imagem por TC evidencia lesão expansiva no seio maxilar esquerdo com densidade heterogênea e áreas de calcificação. Observa-se extensão significativa ao processo alveolar adjacente.
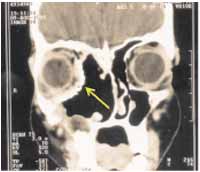
Figura 4. TC de seios paranasais no décimo quarto dia pós-operatória, com destaque para a prótese de titânio que substitui a parede óssea medial da órbita(seta amarela).
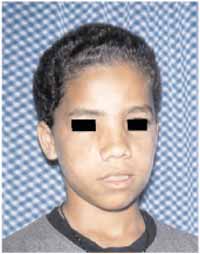
Figura 5. aspecto da face no segundo mês pós-operatório.
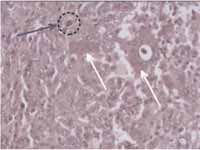
Figura 6. A histopatologia mostra tecido com estroma de fibroblastos em fuso, alongados, abundantes, que circundam algumas células gigantes multinucleadas(seta branca). Observa-se agregados de hemossiderina no interior de macrófagos(círculo pontilhado, com seta)(HE, 400x).
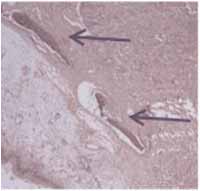
Figura 7. Setas azuis indicam tecido ósseo neo-formado(HE, 100x).
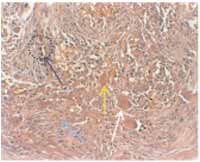
Figura 8. Histopatologia mostra abundante estroma rico em fibroblastos em fuso(seta azul), células gigantes multinucleadas(seta branca), macrófagos contendo hemossiderina(círculo pontilhado, com seta) e agregados hemorrágicos(seta amarela)(HE, 200x).
Em relação aos possíveis fatores etiopatogênicos previamente discutidos, apenas o paciente com GRCG circunscrito ao seio maxilar apresentava antecedente de trauma facial.
O quadro clínico, que pode evoluir em poucas semanas ou mesmo anos, geralmente está associado à expansão tumoral e seus respectivos efeitos compressivos sobre estruturas adjacentes, com possibilidade de desconforto local, mas a dor franca é pouco freqüente. Portanto, os sintomas variam principalmente em conformidade com a localização e agressividade do tumor. A partir do seio maxilar, é comum o comprometimento dos pré-molares, molares e caninos. A diplopia, proptose, amaurose, cefaléia, obstrução nasal, epistaxe, oftalmoplegia, alterações de nervos cranianos e deformidade facial são alguns dos possíveis e inespecíficos sintomas relacionados a tumores do complexo crânio-facial.
Pela exuberância do quadro clínico, ambos os casos sugeriam a presença de uma tumoração extensa, que foi ratificada com os achados radiológicos e intra-operatórios.
Exames de imagem, sobretudo por tomografia computadorizada, são muito úteis para definir a localização e extensão da lesão. Nos casos em análise, o achado de uma lesão expansiva com imagem heterogênea ou com densidade de partes moles por tomografia computadorizada, com limites bem definidos e áreas de calcificação, possivelmente pela neoformação óssea, foram concordantes com os estudos prévios. A imagem por ressonância magnética é particularmente valiosa na investigação de invasão intracraniana pelo tumor.
Por sua vez, o estudo anatomopatológico estabeleceu o diagnóstico definitivo nos dois casos. Sempre que possível, o tumor deve ser biopsiado pré-operatoriamente e a amostra submetida a estudo anatomopatológico. Recentemente, foi descrita a análise imunocitoquímica em aspirado do tumor por agulha para diagnóstico da doença primária ou recorrente16.
A maioria dos autores concorda que o tratamento de escolha para o GRCG é o cirúrgico, excetuando-se os casos considerados inoperáveis ou mesmo recidivantes, sendo estas últimas situações infrequentes. A recorrência pós-operatória é de 4 a 12%, e geralmente atribuída à ressecção incompleta do tumor1. Por outro lado, o TCG apresenta uma elevada taxa de recorrência após cirurgia ou radioterapia e pode originar metástases. Sabe-se também que o TCG não regride sem tratamento, enquanto a melhora espontânea do GRCG já foi descrita4.
O tratamento cirúrgico pode ser realizado por curetagem ou ressecção em bloco, mas com possibilidades de recidiva independente da técnica utilizada. Estudos recentes associam a perfuração óssea cortical da mandíbula, à análise histopatológica, a maior risco de recorrência do GRCG deste sítio17.
A terapia anti-angiogênica com interferon alfa-2 a, bem estabelecida no tratamento de hemangiomas, tem apresentado resultados promissores como uma alternativa no tratamento do GRCG nos casos inoperáveis ou recidivantes18. Para estas situações, até o presente momento, alguns autores preconizam a radioterapia, com resultados variáveis. Porém, a malignização sarcomatosa do GRCG já foi relatada em pacientes submetidos à radioterapia19.
Como ocorre na maioria dos casos de GRCG, os pacientes estudados não necessitaram de intervenção pós-operatória, cirúrgica ou não, e até o presente momento não foi observada recidiva.
COMENTÁRIOS FINAISEmbora rara, a possibilidade de acometimento dos seios paranasais pelo GRCG deve ser lembrada no diagnóstico diferencial de tumores nesta localização, sendo os dados clínicos e de imagem inespecíficos, cuja confirmação deve ser anatomopatológica. O tratamento de escolha é a remoção cirúrgica, uma vez que a radioterapia ou terapia anti-angiogênica são reservadas à inoperabilidade ou refratariedade. Por se tratar de uma lesão benigna, o diagnóstico correto evita, a princípio, tratamentos radicais mutilantes.
REFERÊNCIAS BIBLIOGRÁFICAS1. Arda HN, Karakus MF, Ozcan M, Arda N, Gun T. Giant cell reparative granuloma originating from the ethmoid sinus. Int J Pediatr Otorhinolaryngol 2003; 67(1):83-7.
2. Bodner L, Bar-Ziv J. Radiographic features of central giant cell granuloma of the jaws in children. Pediatr Radiol 1996; 26:148-151.
3. Felsberg GJ, Tien RD, McLendon LE. Frontoethmoidal giant cell reparative granuloma. AJNR Am J Neuroradiol 1995; 16(7): 1551-4.
4. Wiatrak BJ, Gluckman JL, Fabian RL. Giant cell reparative granuloma of the ethmoid sinus. Otolaryngol Head Neck Surg 1987; 97: 504-9.
5. Jaffè HL. Giant cell reparative granuloma traumatic bone cyst end fibrous(fibro-osseous) dysplasia of the jawbones. Oral Surg Oral Med Oral Pathol 1953; 6: 159-75.
6. Friedberg SA, Eisenstein Re, Linden JW. Giant cell lesions involving the nasal acessory sinus. Laryngoscope 1969; 79: 763-76.
7. Schlorf RA, Koop SH. Maxillary giant cell reparative granuloma. Laryngoscope 1977; 87: 10-7.
8. Hirsh S, Katz A. Giant cell reparative granuloma outside the jaw-bone. Hum Pathol 1974; 5: 171-81.
9. Hoopes PC, Anderson RL, Blodi FC. Giant cell (reparative) granuloma of the orbit. Ophthalmology 1981; 88: 1361-6.
10. Lorenzo JC, Korfman HD. Giant cell reparative granuloma of the short tubular bones of the hands and feet. Am J Surg 1980; 4: 551-63.
11. Hyver SW, Ellis DS, Stewart WB, Spencer WH, Bartlett PC. Sino-orbital giant cell reparative granuloma. Ophthal Plast Reconstr Surg 1998; 14(3):178-81.
12. Baker HL, Papsidero MJ, Batsakis JG, Krause CJ. Aneurysmal bone cyst of the ethmoid. Head Neck Surg 1982; 5: 177-80.
13. Larsen PE, Hegtvedt AK. Odontogenesis and odontogenic cysts and tumors. In: Cummings CW. Otolaryngology-Head and Neck Surgery; 1998. 3rd. ed. Mosby. p. 1572-3.
14. Waldron CA, Shafer WG. The central giant cell reparative granuloma of the jaws: an analysis of the 38 cases. Am J Clin Pathol 1966; 45: 437-47.
15. Burman JA, Benson J, Cohen I. Giant cell tumor of the ethmoid sinuses: diagnostic dilema. Laryngoscope 1979; 89: 1415-24.
16. Castro WH, Filho ECS, Souza PEA, Gomez RS. Imunocytochemistry of fine-needle aspirates from central giant cell granuloma. Br J Oral Maxilo Facial Sur 1998; 36: 301-3.
17. Minic A, Stajcic Z. Prognostic significance of cortical perforation in recorrence of central cell granulomas of jaws. J Cranio Maxilo Facial Sur 1996; 24: 104-8.
18. Collins A. Experience with anti-angiogenic therapy of giant cell granuloma of the facial bones. Ann R Aust Coll Dent Surg 2000; 15: 170-5.
19. Austin LT, Dahlin DC, Royer RQ. Giant cell granuloma and related conditions affecting jaw bones: an analysis of 38 cases. Oral Surg Oral Med Oral Pathol 1959; 12: 1285-90.
20. Hamlin WB, Lund PK. "Giant cell tumors" of the mandible and facial bones. Arch Otolaringol 1967; 86: 658-65.
21. Upchurch KS, Lee SS, Schiller AL, Rosenthal DI, Canpion EW, Crane SM. Giant cell reparative of Paget´s disease of bone. Ann Intern Med 1983; 98: 35-40.
22. Kaffe I et al. Radiographic features of central giant cell granuloma of the jaws. Oral Surg Oral Med Oral Pathol Oral Radiol Endo 1996; 81: 720-6.
1 Mestrando pelo Centro de Pós-graduação em Medicina e Saúde da Universidade Federal da Bahia. Ex-médico residente do
Serviço de Otorrinolaringologia do Hospital das Clínicas da Universidade Federal da Bahia.
2 Ex-médicas estagiárias do Serviço de Otorrinolaringologia do Hospital das Clínicas da Universidade Federal da Bahia.
3 Coordenador da Divisão de Cirurgia de Cabeça e Pescoço do Serviço de Otorrinolaringologia do Hospital das Clínicas da Universidade Federal da Bahia.
4 Professor Doutor da Disciplina de Otorrinolaringologia da Faculdade de Medicina da Universidade Federal da Bahia e
Chefe do Serviço de Otorrinolaringologia do Hospital das Clínicas da Universidade Federal da Bahia.
Trabalho realizado pelo Serviço de Otorrinolaringologia do Hospital das Clínicas da Universidade Federal da Bahia.
Endereço para Correspondência: Fernando P. G. Sobrinho - Cd. Rec. dos Pássaros R3 B29-A Ap.301 Cabula 41150-050 Salvador BA.
Tel(0xx71) 257-0226 - E-mail: fpgsobrinho@bol.com.br
Artigo recebido em 21 de abril de 2003. Artigo aceito em 13 de maio de 2003.


