Introdução e Revisão da LiteraturaManter uma boa saúde bucal depende, entre outros fatores, de um fluxo salivar adequado. A saliva é um fluido produzido pelas glândulas salivares e composta de restos celulares, bactérias, proteínas e restos alimentares. Graças às suas propriedades de interferir na cicatrização tecidual, atuar no tamponamento ácido, atuar nos processos de desmineralização e remineralização dental, ser bactericida e bacteriostática, ser fonte de fatores de crescimento, é que podemos ter equilíbrio e saúde na cavidade bucal1,2,3.
A perda de alguma porção de glândula salivar, por obstrução, por traumas, remoção de tecido tumoral ou outra alteração patológica, poderá acarretar em prejuízo do fluxo salivar, trazendo conseqüências danosas ao organismo. Portanto, o conhecimento mais profundo de todos os processos envolvidos na recuperação do órgão afetado se torna fundamental.
O desenvolvimento de todas as glândulas salivares é semelhante. Na submandibular (GSM) de ratos, que é um excelente modelo experimental para estudo dos processos que envolvem a organogênese, o desenvolvimento glandular inicia-se aos 14 dias de vida intra-uterina e completa-se com a diferenciação de seu compartimento acinar por volta da 4ª semana após o nascimento4,5. No desenvolvimento glandular, o qual influencia tanto a morfogênese (arquitetura ramificada) como a citodiferenciação (amplificação da capacidade secretora das células), estão bem estabelecidas as interações que ocorrem entre o ectomesênquima e as células epiteliais6,7.
No entanto, existem poucas referências na literatura a respeito de processos regenerativos de glândulas salivares submetidas a danos mecânicos ou que tenham parte de sua estrutura excisada.
Baseados nesses fatos, o objetivo deste estudo foi a compreensão melhor do processo de regeneração da GSM de ratos submetida à excisão parcial de um de seus lobos.
Foi utilizada a técnica de coloração de hematoxilina e eosina para a comparação morfológica do processo regenerativo com o desenvolvimento normal glandular visto por Fossati (2000)6. Para verificar a diferenciação celular (aqui entendida como a capacidade de formação/secreção de produtos celulares) foi empregada a técnica histoquímica do Ácido Periódico Reativo de Schiff (PAS), que é capaz de evidenciar a formação de mucinas e carboidratos, que são componentes do fluido salivar primário8-2.
Material e MétodoEste estudo foi submetido à apreciação e aprovado pela Comissão Científica e Comissão de Pesquisa e Ética em Saúde do Hospital de Clínicas de Porto Alegre, Projeto nº 01-048.
Em complementação ao material utilizado na pesquisa, foram analisadas lâminas de arquivo representativas do desenvolvimento embrionário da GSM de ratos aos 15, 16, 17, 18 e 19 dias de vida fetal. Esse material fez parte do estudo desenvolvido na Tese de Doutorado de Fossati (2000)6.
Animais
Foram utilizados no experimento 20 ratos Wistar machos de 30 (jovens) ou 60 (adultos) dias de idade, considerados um excelente modelo animal no estudo da GSM.
Técnica Cirúrgica
Os animais foram anestesiados com as drogas Vetanarcol e Rompum na proporção 1:1 e na dose de 0,2ml para cada 100 gramas de peso corporal, aplicada intramuscularmente.
Realizada a tricotomia da região média do pescoço, a GSM foi exposta e os lobos glandulares medidos por meio de um compasso e de uma régua milimetrada.
O lobo esquerdo teve seu terço inferior removido, tendo-se o cuidado de não lesar nenhuma estrutura do animal. Suturados, os animais foram levados ao biotério central, onde ficaram com alimentação e água ad libitum, durante os tempos de recuperação estabelecidos na pesquisa: 2, 3, 7 e 15 dias pós-cirúrgicos.
Foram divididos de acordo com a idade e com o tempo de espera de recuperação, momento em que foi feita a remoção do material glandular. Ambos os lobos foram medidos novamente, removidos e imediatamente colocados em solução fixadora de Methacarn durante 3 horas à temperatura ambiente.
Procedimentos histológicos
Após a fixação, procedeu-se ao processamento histológico de rotina, sendo cada peça incluída em parafina. Foram realizados cortes de 5mm em micrótomo rotatório, sendo alguns espécimes submetidos á técnica de coloração da hematoxilina e eosina (H/E) e outros à técnica histoquímica do Ácido Periódico Reativo de Schiff.
Análise Observacional
As peças histológicas dos grupos de animais jovens e adultos nos diferentes tempos de regeneração foram analisadas morfologicamente, na coloração de hematoxilina e eosina.
A análise qualitativa observacional do material obtido foi realizada por três observadores em microscópio de luz marca Olimpus modelo V-MDOB3 em aumentos de 100x e de 400x.
Resultados
Morfologia
O processo regenerativo ocorreu em 100% dos casos analisados e se instalou precocemente. Aos dois dias pós-cirúrgicos, nos animais jovens, o local da cirurgia se caracterizou por uma grande quantidade de estroma, zonas hemorrágicas, presença de células inflamatórias, vasta angiogênese e proliferação de cordões de tecido epitelial maciço (Figura 1A).
Aos três dias, já se observou a presença de luz no interior de alguns dos rudimentos inicialmente maciços, com figuras prováveis de apoptose nas células centrais desses acúmulos epiteliais, e ainda a presença de abundante estroma e dos elementos celulares do processo inflamatório (Figura 1B). Esta situação se modificou aos sete dias, onde se verificou redução do tecido conjuntivo, devido à proliferação do tecido epitelial em busca do padrão ramificado da GSM. Esse aspecto foi semelhante àquele observado durante o desenvolvimento glandular normal (Figura 1C e 2). Em alguns espécimes, nesta mesma época, notou-se proliferação acentuada de estruturas semelhantes a ductos, já apresentando luz central, mas ainda com pouca diferenciação (Figura 1D).
Aos 15 dias, o processo regenerativo assemelhou-se à porção remanescente da GSM, apresentando pouca quantidade de estroma, septos de conjuntivo que formam lóbulos e uma estrutura epitelial de ductos e secretória bastante complexa (dado não mostrado).
Nos animais adultos, o processo regenerativo se mostrou retardado em relação aos jovens, com estruturas glandulares mais rudimentares (Figura 3).
Diferenciação celular
Aos dois dias pós-cirúrgicos observou-se poucos rudimentos com uma marcação muito discreta do PAS, que foi observada mais no estroma e lâmina basal de vasos (Figura 4A). Aos três dias ficou bem evidente no citoplasma de ductos e terminações secretórias em desenvolvimento (Figura 4B).
Notou-se um declínio nas fases seguintes, com poucos grânulos positivos nas estruturas mencionadas, e a marcação ficou restrita aos ductos estriados aos 15 dias de regeneração (Figura 4C e 4D). A avaliação do desenvolvimento normal da GSM mostrou que as mucinas neutras são inicialmente marcadas aos 17 dias de vida fetal nos rudimentos glandulares embrionários.
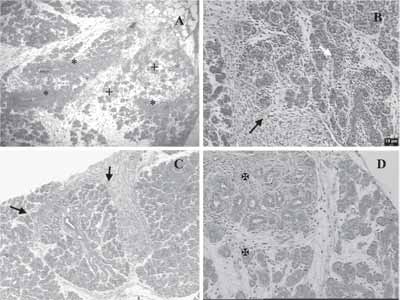
Figura 1. Fases da regeneração com coloração H/E.
a) Aos dois dias mostrando proliferação de cordões maciços (*) e rudimentos epiteliais indiferenciados (+) em abundante estroma.
b) Aos três dias com estroma em abundância (seta preta), apresenta rudimentos epiteliais mais diferenciados mostrando células centrais em apoptose (seta branca).
c) Regeneração observada aos 7 dias, com aspecto lobular instalado e redução do estroma (setas).
d) Aos sete dias, estruturas ductais ainda em diferenciação (X).
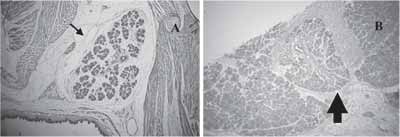
Figura 2. a) GSM com dezenove dias de vida intra-uterina H/E 10x (seta). b)Regeneração de animal jovem aos sete dias H/E 10x (seta).
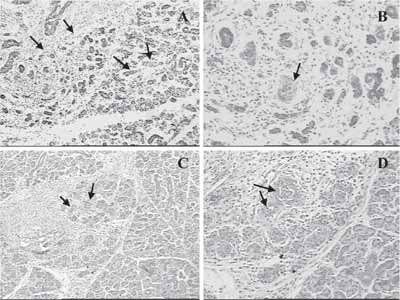
Figura 3. Coloração em H/E: em a e b - animal de 60 dias com três dias de regeneração, com rudimentos epiteliais maciços (setas); em b - células provavelmente em apoptose (seta); em c e d - animal de 30 dias com três dias de regeneração, já com luz central (setas); b e d - aumento maior de regiões de a e c.
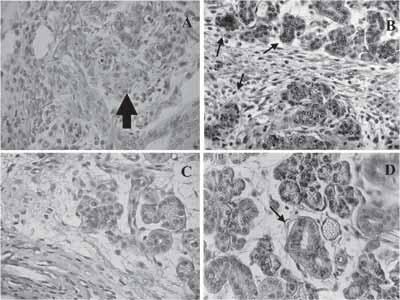
Figura 4. Marcação de PAS nas fases de regeneração.
a) Aos dois dias observa-se pouca marcação na área de regeneração (seta).
b) Aos três dias observa-se marcação intensa no citoplasma dos rudimentos epiteliais (setas).
c) Aos sete dias ocorre um decréscimo da marcação citoplasmática.
d) Aos quinze dias observa-se a marcação nos ductos, principalmente nas paredes celulares dos ductos estriados (seta).
Observa-se intensa angiogênese em todas as fases.
Achados semelhantes aos deste estudo foram obtidos por outros autores13-17. Aspecto semelhante ao desenvolvimento normal da GSM foi observado em todas as fases, fato este que diferencia bem o aspecto encontrado, de uma simples reparação do órgão. A região em processo de regeneração foi característica em todos animais, independente da faixa etária. Apresentou-se mais adiantada no animal mais jovem (30 dias), onde os rudimentos glandulares encontravam-se mais definidos, aparentando um grau mais adiantado de desenvolvimento. Esse fato é explicável por se encontrar o rato na puberdade, quando seu ducto granuloso, hormônio-dependente, torna-se muito proeminente no animal macho18. O referido segmento ductal, que se localiza entre o ducto intercalar e o estriado, é fonte de fatores de crescimento como EGF (epidermal growth factor), FGF (fibroblast growth factor), dentre outros, que provavelmente influenciam na regeneração19,20. A área se mostrou rica em tecido conjuntivo, um estroma abundante e muito celularizado, principalmente nos primeiros dias pós-cirúrgicos. A população de células inflamatórias diminuiu com a evolução da regeneração, bem como o estroma ambiente. Este pareceu desempenhar um papel tão importante na regeneração como o faz durante o desenvolvimento6,21.
Hanks & Chaudhry (1971)13, ao estudarem a regeneração da GSM de ratos após excisão parcial, observaram uma região necrótica central no lobo excisado no 1º dia pós-cirúrgico, com áreas hemorrágicas presentes, como as visualizadas nesse estudo ainda no 2º dia de regeneração, onde os rudimentos recém-formados foram poucos e esparsos.
Da mesma maneira, nos dias subseqüentes verificou-se uma angiogênese intensa e um grande número de células inflamatórias, que estavam presentes desde o primeiro dia observado. Acredita-se que os nutrientes fundamentais ao processo e substâncias (citocinas) mediadoras da inflamação que se instalou desempenhem importante papel.
Em muitos casos, principalmente aos três dias pós-cirúrgicos, notou-se uma extensa proliferação de células epiteliais, semelhante a cordões maciços, apresentando luz central em algumas regiões. Esses cordões se orientavam a partir da glândula remanescente e se direcionavam à porção em processo de formação. Foram também observados por Hanks & Chaudhry (1971)13, que os atribuíram a células dos ductos estriados remanescentes da cirurgia, que então dariam origem às células epiteliais em regeneração.
Entretanto, os autores deste estudo discordam, pois acreditam que os ductos são ainda muito indiferenciados para admitir qualquer caracterização, e mesmo assim, pelo aspecto de suas células, posição e tamanho nuclear, se assemelhavam mais a ductos do segmento intercalar, os quais sabidamente possuem células progenitoras em sua estrutura22.
Takahashi & Wakita (1993)14, em seus estudos sobre a regeneração da GSM de ratos, também relataram que, após ablação glandular com irradiação a laser, estruturas semelhantes a ductos, contínuas com os ductos remanescentes eram regeneradas na periferia do lobo danificado. No presente estudo, a formação das novas peças secretórias pareceu se dar a partir das estruturas remanescentes, com seu crescimento subseqüente dependente da diferenciação e proliferação progressiva das células recém-formadas. A afirmação de que ocorreria a partir dos ductos, como é salientada na literatura, parece não ser comum a todos os casos analisados.
A regeneração glandular que se estabelece a partir da excisão parcial do órgão, ou a partir da atrofia que se segue à ligadura de seu ducto excretor, se processam de maneiras diversas. Esse fato é bem compreensível, e se deve provavelmente à natureza e extensão do dano causado à glândula, e ao suprimento sangüíneo da região envolvida. Takahashi et al. (1998)23, verificaram em seu estudo, que na regeneração que ocorreu após a atrofia da glândula parótida provocada por ligadura do seu ducto excretor, somente células ductais foram vistas na região atrófica, sem a presença de nenhuma célula acinar. Este fato foi atribuído à provável apoptose destas células, sendo este aspecto observado também nesse estudo em alguns espécimes.
No entanto, este fato não foi comprovado por Colombo (2001)24, que realizou obstrução da glândula parótida e não encontrou número suficiente de células ductais PCNA-positivas após a remoção da ligadura.
Já Ihler et al. (2002)25, trabalhando com glândulas salivares humanas, normais e metaplásicas, verificaram que, em estado normal, as células luminais dos ácinos e do ducto intercalar se regeneravam independente da proliferação das células basais ou mioepiteliais, enquanto que nos ductos estriados e terminais a regeneração das células dependia da proliferação das células basais.
Um aspecto similar ao da GSM do rato aos 19 dias de vida fetal foi encontrado aos sete dias da cirurgia, com ductos e extremidades secretoras mais diferenciadas, ainda um parênquima pouco desenvolvido, circundado por um estroma abundante. Várias figuras apoptóticas foram vistas nesta época, tanto nos ductos como nos futuros ácinos, na porção central. Esse fato também foi observado por Hayashi et al. (2000)26, que constataram por meio da técnica de Túnel, microscopia de luz e eletrônica, células apoptóticas que estariam envolvidas com a redução do número de células do túbulo terminal e com a formação do lúmen glandular, no desenvolvimento pós-natal da GSM de ratos.
Aos 15 dias de regeneração foi observado aspecto semelhante à glândula adulta, envolvida já por uma cápsula fibrosa. Isto foi também observado por Hanks & Chaudhry (1971)13, ao constatarem que estas células em diferenciação, às três semanas pós-cirúrgicas se organizavam em lóbulos. Takahashi et al. (1998)23, no entanto, observaram essa situação mais precocemente, já a partir dos 10 dias de regeneração, que se seguiu à obstrução ductal da glândula parótida. Essa diferença nos tempos de regeneração total glandular se deve talvez à maior destruição do órgão que ocorre na ablação parcial. Ao contrário do que foi constatado pelos primeiros autores, a regeneração observada quando parte da glândula foi perdida, foi mais adiantada na região proximal à porção não danificada da glândula, sendo mais atrasada na periferia do órgão (dado não mostrado).
Neste estudo foi utilizada a técnica histoquímica do PAS com a finalidade de estabelecer o início da produção de mucinas neutras pela GSM regenerada. Foi utilizada a técnica histoquímica do PAS com a finalidade de estabelecer o início da produção de mucinas neutras pela GSM regenerada. Pode-se observar que a produção de mucinas neutras (fato que revela a diferenciação celular) já estava presente, de forma discreta, aos dois dias de regeneração, mostrando assim também a precocidade da citodiferenciação. A marcação intensificou-se aos três dias, com o citoplasma de células de ductos e porções secretórias fortemente marcados, sendo caracterizada essa fase como o pico da produção de mucinas. Nas fases seguintes ocorreu um declínio, com poucos grânulos positivos nas estruturas mencionadas se restringindo às paredes dos ductos estriados, aos 15 dias pós-cirúrgicos, situação semelhante àquela encontrada na glândula intacta.
Comparando com material glandular fetal, se pode observar que o pico de marcação se deu no 17º dia de gestação, portanto com um desenvolvimento mais maturo, pois isto corresponderia em nosso estudo à uma regeneração de cinco dias.
O processo regenerativo da GSM de ratos excisada é estável, permanente e gradual, seguindo etapas definidas.
ConclusõesPode-se constatar, neste estudo, que a regeneração glandular que se seguiu à ablação parcial se instalou muito precocemente, provavelmente logo após à excisão realizada, foi mais adiantada nos animais que se encontravam na puberdade, e ocorreu com provável influência de componentes da matriz extracelular abundante. A citodiferenciação pareceu ser mais precoce que durante o desenvolvimento glandular normal, e mudou de localização com a evolução do processo.
Referências Bibliográficas 1. Kagamy H, Hiramatsu Y, Hishida S, Okazaki Y, Horie K, Oda Y, Ueda M. Salivary growth factors in health and disease. Adv Dent Res 2000; 14:99-102.
2. Nagy, G. Role of saliva, salivary glands and Epidermal Growth Factor (EGF) on oral wound healing. Fogorv Sz 2003; 96(1):17-20.
3. Thylstrup A, Fejerskov O. Cariologia Clínica. 2a Edição São Paulo: Santos; 1995. 13-6.
4. Cutler L, Chaudry A. Intercellular contacts at the epithelial-mesenquimal interface during the prenatal development of the rat submandibular gland. Dev Biol 1973; 33:229-40.
5. Cutler L, Chaudry A. Cytodifferentiation of the acinar cells of the rat submandibular gland. Dev Biol 1974; 41:31-41.
6. Fossati ACM. Integrinas e proteínas de matriz extracelular durante o desenvolvimento da glândula submandibular de ratos. São Paulo [Tese De Doutorado]. Instituto De Ciências Biomédicas, USP, 2000, 62f.
7. Spooner BS, Hardman P. Localization of extracellular matrix components in developing mouse salivary glands by confocal microscopy. Anat Rec 1992; 234:452-9.
8. Gal R, Koren R, Nofech-Mozes S, Mukamel E, His Y, Zajdel L. Evaluation of mucinous metaplasia of the prostate gland by mucin histochemistry. Br J Urol 1996; 77(1):113-7.
9. Harrison JD, Auger DW, Paterson KL, Rowley PS. Mucin histochemistry of submandibular and parotid salivary glands of man: light and electron microscopy. Histochem J 1997; 19(10-11):555-64.
10. Kodaira H, Ishihara K, Hotta K, Kagoshima M, Shimada H, Ishii K. Rat gastric mucous gel layer contains sialomucin not produced by the stomach. Jpn J Pharmacol 1999; 81(1):86-93.
11. Liman N, Bayram G, Kocak M. Histological and histochemical studies on the lingual, preglottal and laryngeal salivary glands of the Japanese quail (Coturnix Coturnix Japonica) at the post-hatching period. Anat Histol Embryol 2001; 30(6):367-73.
12. Slomiany BL, Murty VL, Slomiany A. Structural features of carbohydrate chains in human salivary mucins. Int J Biochem 1993; 25(2):259-65.
13. Hanks CT, Chaudhry AP. Regeneration of rat submandibular gland following partial extirpation - a light and electron microscopic study. Am J Anat 1971; 130(2):195-207.
14. Takahashi S, Wakita M. Regeneration of the intralobular duct and acinus in rat submandibular glands after yag laser irradiation. Arch Histol Cytol 1993; 56(2):199-206.
15. Takahashi S, Wakita M. Cytokeratin expression during regeneration of the intralobular duct in rat submandibular glands after YAG laser irradiation. Arch Histol Cytol 1994; 57(2):167-73.
16. Takahashi S, Domon T, Yamamoto T, Wakita M. Regeneration of myoepithelial cells in rat submandibular glands after yttrium aluminium Garnett Laser Irradiation. Int J Exp Pathol 1997; 78(2):91-9.
17. Takahashi S, Nakamura S, Suzuki R, Domon T, Yamamoto T, Wakita M. Changing myoepithelial cell distribution during regeneration of rat parotid glands. Int J Exp Pathol 1999; 80(5):283-90.
18. Garcia HF, Garcia-Poblete E, Moro-Rodriguez E, Catala-Rodriguez M, Rico-Morales ML, Garcia-Gomez De Las Heras MS. Histomorphometrical study of the submandibular gland ductal system in the rat. Histol Histopathol 2002; 17(3):813-6.
19. Amano O, Iseki S. Expression and localization of cell growth factors in the salivary gland: a review. Kaibogaku Zasshi 2001; 76(2):201-12.
20. Okazaki Y, Kagami H, Hattori T, Hishida S, Shigetomi T, Ueda M. Acceleration of rat salivary gland tissue repair by basic fibroblast growth factor. Arch Oral Biol 2000; 45(10):911-9.
21. Kashimata M, Gresik EW. Epidermal growth factor system is a physiological regulator of the development of the mouse fetal submandibular gland and regulates the expression of the a6-integrin subunit. Dev Dyn 1997; 208:149-61.
22. Man YG, Ball WD, Marchetti L, Hand AR. Contributions of intercalated duct cells to the normal parenchyma of submandibular glands of adult rats. Anat Rec 2001; 263(2):202-14.
23. Takahashi S, Schoch E, Walker NI. Origin of acinar cell regeneration after atrophy of the rat parotid induced by duct obstruction. Int J Exp Pathol 1998; 79(5):293-301.
24. Colombo CED. Atrofia e regeneração da glândula parótida após ligadura do ducto excretor: estudo histológico, histoquímico e imuno-histoquímico em ratos. São José Dos Campos [Dissertação De Mestrado]. Faculdade De Odontologia, Universidade Estadual Paulista, 2001, 130f.
25. Ihrler, S.; Zietz, C.; Sendelhofert, A.; Lang, S.; Blasenbreu-Vogt, S.; Lohrs, U. A morphogenetic concept of salivay duct regeneration and metaplasia. Virchows Arch 2002; 440(5): 519-26.
26. Hayashi H, Ozono S, Watanabe K, Nagatsu I, Onozuka M. Morphological aspects of the postnatal development of submandibular glands in male rats: involvement of apoptosis. J Histochem Cytochem 2000; 48(5):695-8.
1 Doutora em Biologia Celular e Tecidual - USP, Mestre em Odontologia/Odontopediatria - USP, Professora Adjunta de Histologia e Embriologia Buco-Dentária - Departamento de Ciências Morfológicas, Instituto de Ciências Básicas da Saúde, Universidade Federal do Rio Grande do Sul (UFRGS).
2 Acadêmicos da Faculdade de Odontologia da UFRGS.
Instituto de Ciências Básicas da Saúde - Faculdade de Odontologia - Disciplina de Histologia e Embriologia Buco-Dentária - Laboratório de Biologia Bucal - UFRGS.
Endereço para Correspondência: Profa. Dra. Anna C. M. Fossati - R. Ramiro Barcelos, 2492 5º andar sala 503 Porto Alegre RS 90035-003
Tel (0xx51) 33165024 - Fax (0xx51) 3316-5439 - E-mail: annafo@ufrgs.br
Artigo recebido em 14 de novembro de 2003. Artigo aceito em 02 de abril de 2004.


