IntroduçãoA necessidade do emprego dos antibióticos aminoglicosídicos (Estreptomicina, Diidroestreptomicina, Canamicina, Aminosidina, Paromomicina e Gentamicina) por períodos prolongados de tempo para o adequado tratamento da tuberculose, propiciou o aparecimento de efeitos colaterais principalmente relacionados com a nefro e ototoxicidade. A propósito desta última destaca-se a estreptomicina e a canamicina por serem os mais empregados na espécie humana em esquemas longos de tratamento, embora eles tenham se mostrado, nos animais experimentais, menos tóxicos em relação a neomicina, aminosidina, paromomicina e gentamicina.
Ototoxicidade da Ertreptomicina
A incidência e intensidade dos fenômenos ototóicicos, dependem da via de administração, da dose e da duração do tratamento. Não sendo absorvidas quando aplicados pela via oral, esses fenômenos foram registrados após a aplicação intramuscular de 0,5 a 1 grama diária do antibiótico por período prolongado de tempo (Meyler, 1963; Marseillan, 1972). O emprego excepcional da via intratecal em casos de meningite por bacilos sensíveis ao antibiótico, proporcionou o aparecimento dessas alterações mostrando o perigo dessa via de administração (Hawkins, 1959).
Os primeiros sinais e/ou sintomas das alterações do labirinto, são representados por vertigens que podem surgir subitamente ou serem precedidos por zumbidos e/ou calafrios. Se intensa, a vertigem pode vir acompanhada de náuseas e vômitos, podendo o paciente referir tonturas giratórias mesmo deitado. Este período de vertigem intensa dura alguns dias mesmo após cessar o tratamento e a recuperação geralmente não é completa, permanecendo a tontura giratória aos movimentos rápidos por um período considerável. A vertigem não desaparece em virtude da recuperação do aparelho vestibular, mas por adaptação do corpo a um equilíbrio por outras vias. Os sinais e sintomas de natureza vestibular são os mais frequentemente descritos com a aplicação de doses tóxicas desse antibiótico (Hinsbaw e Peldrnan; 1945; Powler e Seligman, 1947; Glorig e Powler, 1947; Nortinghton, 1950) , não obstante tenham sido referidos também casos de perda parcial ou total da audição geralmente precedidos por zumbidos no ouvido (Powler, 1949; Ruedi, 1951; Hanson, 1951). Esses fenômenos tóxicos que revelam a presença de lesões labirínticas na espécie humana foram registrados na grande maioria das vezes após administração de doses diárias superiores a 1 grama e que atingiram valores superiores a 60 gramas no tratamento global (Barr e col., 1949). Doses inferiores podem desencadear os mesmos efeitos na vigência de comprometimento renal, em virtude do antibiótico não sofrer degradação no organismo e ser eliminado na proporção de aproximadamente 70% da aplicação por via renal. Foi tamb°m observado que tais fenômenos são menos frequentes nas crianças e jovens (IVinston, 1953; Ranta, 1958). A ototoxicidade dos antibióticos aminoglicosídicos, levou diversos investigadores a estudar possíveis "protetores" que reduzissem ou eliminassem a ação tóxica desses medicamentos. A toxicidade reduzida de alguns pantotenatos pôde ser demonstrada não só em animais tomo também no homem (Osterberg e cols. 1956-1957; Muckter, 1961; Tyberghein, 1962); complexos vitamínicos e ácidos aminados (Coben. 1946; Darrouzet. 1963, 1967); ozotina, empregado como expectorante e solvente dos antibióticos (Stupp, 1970).
Com base no acima exposto nos propuzemos a fazer um estudo comparativo dos efeitos ototóxicos induzidos pelo sal de estreptomicina usado em prática médica, isto é, o sulfato e o seu correspondente tricloridrato de estreptomicina-cloreto de cálcio. As razões que nos levaram a esse estudo baseiam-se na acentuada diferença de toxicidade aguda entre o sulfato e o complexo de estreptomicina demonstrado por Corrado e cols., 1969. Esses autores não só verificaram uma apreciável diminuição da toxicidade aguda do antibiótico sob a forma de complexo com o cloreto de cálcio, como demonstraram ser este íon um agente antagônico competitivo dos efeitos tóxicos agudos da estreptomicina. O complexo tricloridrato de estreptomicina-cloreto de cálcio é facilmente obtido pois trata-se de uma das etapas da biosíntese da obtenção do sulfato de estreptomicina. Não havendo sido referidas variações significativas entre á atividade antibiótica do sulfato e do correspondente complexo propuzemos realizar o referido estudo comparativo em que essas substâncias são aplicadas em quantidades correspondentes a base do antibiótico. O presente trabalho consistiu no estudo paralelo dos níveis de estreptomicina no sangue e na perilinfa correlacionando-se com as alterações funcionais do labirinto posterior e com as alterações da ultraestrutura do órgão de Corri.
Material e MétodosDETERMINAÇÃO DOS NIVEIS DE ESTREPTOMICINA NO SANGUE E PERILINFA E ESTUDO DE POSSIVEIS ALTERAÇÕES FUNCIONAIS E ULTRAESTRUTURAIS DO OUVIDO INTERNO.
Injetamos no membro inferior de cobaias, por, via intramuscular, as drogas de escolha, sulfato de estreptomicina e complexo tricloridrato de estreptomicina-cloreto de cálcio. O sangue foi obtido por punção cardíaca e a perilinfa colhida em capilar atiavés de um orifício na base do caracol (Fig. 1) .
Experimento 1
Método Para a Análise Microbiológica
Pelo método da difusão em agar, foram determinadas as concentrações do sulfato de estreptomicina e do complexo tricloridrato de estreptomicína-cloreto de cálcio no sangué e na perilinfa de cobaias (Gania coba-ya, Lin. 1766), após administração de dose única ou sucessivas desses produtos. As concentrações do antibiótico nos materiais examinados foram determinadas aferindose os halos de inibição produzidos por quantidades determinadas de soro e de perilinfa em placas de agar com aquelas produzidas no mesmo meio de cultura por concentrações conhecidas (curvas-padrão) preliminarmente estabelecidas. Para cada uma das drogas ensaiadas, estabelecemos sete grupos de seis animais. Quatro grupos foram utilizados para o experimento agudo, recebendo cada animal uma única dose do antibiótico. Cada um desses grupos foi utilizado para se determinar os níveis de antibiótico no soro e na perilinfa com intervalos diferentes, 1, 5, 18 e 24 horas, após a administração da droga. Os outros três grupos de animais (crônicos) receberam doses diárias do antibiótico durante 5, 10 e 15 dias respectivamente. Os níveis de antibióticos no soro e na perilinfa desses animais foram determinados i hora após a última administração da droga.
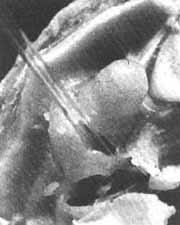
FIG. 1 - Introdução do capilar no orifício feito na base do caracol para retirada da perilinfa.
Antibiótico, Doses e Vias de Administração
Utilizamos sulfato de estteptonmicina e complexo tricloridrato de estreptomicina-cloreto de cálcio, fornecido pelo Laboratório Fontoura-Wyeth S. A. A quantidade dessas drogas a ser administrada por via intramuscular foi pesada para conter 50 miligramas do antibiótico por quilograma de peso corporal, obedecendo a sua potência.
Meios de Cultura para os Testes
Para avaliar os halos de inibição produzidos por concentrações conhecidas do antibiótico, ou para determinar as concentrações nos soros e nas perilinfas utilizou-se como bactéria teste o Bacillus subtilis ATCC - 6633 e o "Batto Penassay Seed Agai" (Difco, code 0263). Esse meio é designado "Medium n .O i", por Grove & Randall (1955) , e. a "Difcti " também o designa "Bacto-Antibiotic Medium 1".
Técnica do Preparo das Placas para os Ensaios
No mesmo dia do ensaio dos materiais (soro e perilinfa), de um grupo de animais tratados ou no mesmo dia em que se ensaiava concentrações conhecidas do antibiótico, um número de placas suficientes foi preparado. Para os ensaios com esse antibiótico as placas foram preparadas com o "Bacto Penassay Seed Agar" com o pH ajustado para 7.9 - 8.0. Ao meio, ainda quente (45°C), foi adicionada uma quantidade suficiente da "suspensão inóculti" de Bacillus subtilis e homogeneizada. O meio com o inóculo foi distribuído em placas de Petri de 105 mm de diâmetro em porcões de 15 mililitros. Para orientar a execução dos orifícios as placas foram colocadas em um modelo construído em papel cartolina. A parede lateral desta foi representada por uma circunferência de igual diâmetro da mesma e pequenas esferas (4 mm de diâmetro) foram traçadas em pontos equidistántes e suficientemente afastados da circunferência representativa da parede da placa. Nos pontos indicados pelo modelo foram efetuados orifícios no meio de cultura com o auxílio de um tubo de vidro de 4 mm de diâmetro. Uma quantidade do meio de cultura sem inócirlo e mantida á temperatura de 45°C, foi colocada no fundo de cada orifício á fim de impedir que o material a ensaiar escoasse pela junção da superfície do meio de cultura com a superfície do fundo da Placa.
Ensaios dos Materiais
Os soros dos animais tratados foram testados colocando-se 0,02 mililitros em cada um dos seis poços das diferentes placas. O volume da perilinfa coletada de cada animal foi colocado em um único poço e completado para 0,02 ml quando necessário, com solução fisiológica esteri. lizada. Após a distribuição dos materiais, as placas foram mantidas em temperatura ambiente por 1 hora a fim de permitir a difusão do antibiótico neles contidos. A fim de absorver a água de condensação do meio foi colocada uma. folha circular, de papel de filtro, sob a tampa de cada placa e incubadas sem inversão, a 35°C, por um período de 16-18 horas. Com o auxílio de uma régua milimetrada, mediu=se os diâmetros dos halos de inibição de todas as determinações de cada material ensaiado. As concentrações do antibiótico foi calculado pela média aritmética dos diâmetros dos halos de inibição das determinações.
Experimento 11
Técnica de Estudo do Labirinto Posterior
Empregados 2 grupos de 6 animais.
No primeiro grupo de animais, administramos sulfato de estreptomicina (400 mg/kg/dia) por via intramuscular em doses fracionadas de 200 mg/kg, duas vezes por dia. No 2 ° grupo, administramos complexo tricloridioato de estreptomicina-cloreto de cálcio utilizando-se a mesma dosagem, fracionamento, via de administração e tempo referentes aos animais já mencionados. Para o estudo da função do labirinto posterior os animais foram colocados numa caixa de contenção especial, constituída por tela de arame e forrada internamente com esponja plástica. Posicionamos a cabeça do animal em retroflexão formando um ângulo de aproximadamente 40° com o plano horizontal. A cabeça assim posicionada permite aos canais semicirculares externos ficarem em posição vertical com as ampolas para cima; na posição de repouso os canais formam um ângulo de 50° com o plano horizontal e (Claoué, 1928). Em seguida, colocamos no pavilhão auditivo da cobaia uma peça moldada em resina acrílica na qual havia uma segunda perfuração. Essa peça foi fixada no pavilhão auricular com fita adesiva de papel. Por um dos orifícios, utilizando-se de uma seringa e um tubo de polietileno, injetamos 2 ml de água fria a 10°C, durante 40 segundos (Marseillan, Grellet e Colafêmina, 1969). A excitação calórica do labirinto foi realizada diariamente medindo-se a duração do nistagmo em segundos, iniciando a contagem no ato da administração do estímulo e terminando-a quando não mais se visualizava os batimentos nistagmicos. Os animais foram controles de si mesmos e, para isto, estimulamos o labirinto previamente durante dois dias consecutivos, utilizando-se os mesmos princípios técnicos já referidos.
Técnica Histológica e Citológica Inclusão em Plástico
Os animais foram sacrificados por decapitação, imediatamente retirado o rochedo, aberta a bula timpânica e exposto o caracol. Na base do mesmo foi aberto um orifício sendo o bloco imergido no fixador, aldeido glutárico 2,5% em tampão fosfato pH 7.2. Todo o conjunto foi então submetido ao vácuo para facilitar a penetração do fixador. Depois de 2 horas o bloco foi reduzido a um tamanho mínimo e lavado várias vezes em tampão, pos-fixado por 1 hora em ácido ósmico 0,1 M em tampão fosfato pH 7.2. A peça, agora com a porção membranosa corada em negro pelo ósmio, foi dissecada sob microscópio estereoscópio Zeiss e retiradas amostras das diferentes espiras para inclusão em plástico. Após desidratação em bateria de acetona, as peças foram incluídas em araldite de superfície plana que permitisse orientar o bloco para, os diferentes eixos de corte do órgão de Corri. Os blocos foram aparados e cortados no ultra-micrótomo Porter-Blum (MT.,). Os cortes de 1/2 micron foram corados pelo azul de toluidina, estudados ao microscópio de luz e fotografados no fotomicroscópio Zeiss. Estes cortes serviram para orientar as áreas dos cortes ultrafinos para serem examinados ao micros:ópio eletrônico (AM-EM68). Estes cortes ultrafinos foram montados em grades malha 200 e corados pelo nitrato de chumbo e uranila.
Resultados
Experimentos Agudos
Determinação da concentração do sulfato de estreptomicina e do complexo Estreptomicina-cloreto ao cálcio no sangue e na perilinfa.
Nos animais utilizados para medirmos a concentração de sulfato de estreptomicina e do complexo estreptomicina-cloreto de cálcio na perilinfa, o volume médio do líquido labiríntico colhido nos espaços vestibulares cocleares dos ouvidos de cada animal foi de 0,011 e 0,013 mililitros, respectivamente. A média, com o respectivo erro padrão de 6 experimentos, está representada na tabela I e II.
TABELA I
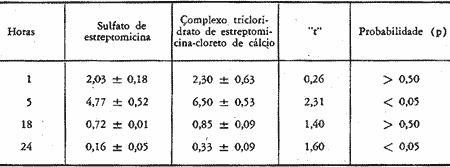
Concentração (mcg/ml) de estreptomicina base na perilinfa de cobaias após uma única injeção de 50 mg/kg de sulfato de estreptomicina ou do complexo tricloridrato de estreptomicina-cloreto de cálcio, por via intramuscular. Os resultados representam a média e o respectivo erro padrão de 6 experimentos.
TABELA II
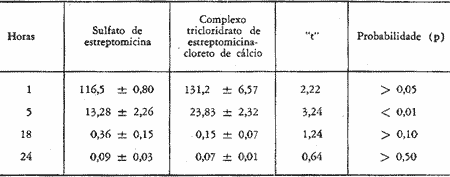
Concentrações (mcg/ml) de estreptomicina base no soro de cobaias após uma única injeção de 50 mg/kg de sulfato de estreptomicina ou do complexo tricloridrato de estreptomicina-cloreto de cálcio, pela via intramuscular. Os resultados representam a média e o respectivo erro padrão de 6 experimentos.
O exame dos dados expostos mostra que a concentração do sulfato de estreptomicina no soro atingiu um valor máximo 1 hora após a injeção caindo rapidamente para um valor mínimo 20 horas após. Já na perilinfa, a concentração foi mais baixa, atingindo um pico máximo 5 horas após a injeção. Vinte horas após a injeção os níveis de sulfato de estreptomicina não diferem no soro e perilinfa (gráfico I). A análise estatística pela aplicação do teste "t" de Student mostra que apenas as diferenças na 5 1 hora tanto para o soro como para a perilinfa são significativas ao nível de 5%.
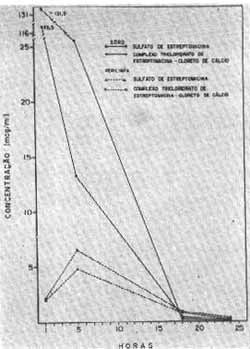
Gráfico I - Concentrações do sulfato de estreptornicina e do complexo tricloridrato de estreptomicina-cloreto de cálcio (mcg/ml) no soro e na perilinfa da cobaia após uma única administração de 50 mg/kg do produto por via intramuscular.
Experimentos Crônicos
Dosagem de concentração do olfato de estreptomicina e complexo estreptomicina-cloreto de cálcio no sangue e perilinfa.
Nos experimentos crônicos o volume médio de perilinfa extraído pata determinar as concentrações do sulfato de estreptomicina e do complexo estreptomicina-cloreto de cálcio foi de 0,011 mililitros e 0,013 mililitros respectivamente. A média, com o respectivo erro padrão de 6 experimentos, está representada nas tabelas III e IV.
TABELA III

Concentrações (mcg/ml) de estreptornicina base na perilinfa de cobaias após injeções diárias de 50 mg/kg de sulfato de estreptomicina ou do complexo tricloridrato de estreptornicina-cloreto de cálcio pela via intramuscular. Os resultados representam a média e o respectivo erro padrão de 6 experimentos.
TABELA IV

Concentrações (mcg/ml) de estreptornicina base no soro de cobaias após injeções diárias de 50 mg/kg de sulfato de estreptornicina ou do complexo tridoridrato de estrepcomicina-cloreto de cálcio pela via intramuscular. Os resultados representam a média e o respectivo erro padrão de 6 experimentos.
Nos experimentos crônicos realizados verificamos efeito cumulativo das concentrações do antibiótico na perilinfa em relação com as dos experimentos agudos tomando-se com referência a determinação da concentração realizada 1 hora após administração da droga (gráfico II).
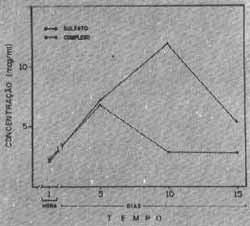
Gráfico II - Concentrações do sulfato de estreptomicina e complexo tricloridrato de estrepcomicina-cloreto de cálcio (mcg/ml) na perilinfa da cobaia após administrações diárias de 50 mg/kg do produto por via intramuscular.
As concentrações do complexo estreptomicina-cloreto de cálcio foram menores do que a do sulfato de estreptornicina 5, 10 e 15 dias após administtacão das drogas (Gráfico II). No entanto, apenas as diferenças no 10.° e 15 ° dias foram estatisticamente significantes (Teste "t" de Student). Também no soro verificou-se efeito cumulativo das concentrações de sulfato de esaeptomicina e complexo tricloridrato de escreptomicina-cloreto de cálcio, em relação com suas concentrações nos experimentos agudos obtidos 1 hora após sua administração (gráficos I e III). O nível sético do sulfato de estrepcomicina foi superior nas determinações crônicas ao do complexo tricloridrato de estreptomicina-cloreto de cálcio (gráfico III). Neste caso as diferenças foram sempre estatisticamente significativas de acordo com o teste "i" de Student.
Encontramos portanto divergências entre os resultados dos experimentos crônicos e agudos quando relacionamos as concentrações de sulfato de estreptornicina e o complexo tricloridrato de estreptomicina-cloreto de cálcio na perilinfa e soro. Após 24 horas de injeção o sulfato de estteptomicina e seu complexo tricloridrato-cloreto de cálcio se comportam da mesma maneira, isto é, as concentrações no soro e perilinfa se equivalem. A diferença de distribuição aparece mais nítida no 10 ° dia quando no soro as concentrações se mantém ao redor de 100 mcg/ml, enquanto que, na perilinfa, há uma nítida diferença de concentrações. A concentração do complexo na perilinfa foi nitidamente inferior ao do sulfato de estreptomicina.
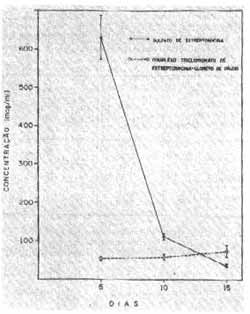
Gráfico III - Concentrações do sulfato de estreptomicina e do complexo tricloridrato de estreptomicina-cloreto de cálcio (mcg/ml) no soro da cobaia após administrações diárias de 50mg/ kg do produto por via intramuscular. Cada ponto representa a média e o respectivo erro padrão de 6 experimentos.
Experimento II
Labirinto posterior
No estudo da função do labirinto posterior verificamos que, no grupo de animais que receberam sulfato de estreptomicina, a excitação do labirinto provocada pelo estímulo calórico, que é refletida pela duração do nistagmo, começou a diminuir no quinto dia, desaparecendo a partir do 7 ° dia em 3 animais, no oitavo dia em mais 2 cobaias e finalmente um animal apresentou inexcitabiiidade labiríntica com nove dias de administração da droga. (gráfico IV). Os animais, recebendo complexo tricloridrato de estreptomicina-cloreto de cálcio, não apresentaram alterações da excitabilidade do sistema vestibular com o teste calórico durante os dez dias da realização do experimento. (gráfico IV).
Mitroacopia eletrónica
O exame de cortes de 1/2 micron incluídos em Araldite mostraram num corte horizontal do órgão de Corri as três fileiras de células ciliadas externas na sua porção supra nuclear. Esta área foi escolhida por ser o sítio mais frequente de lesões ototóxicas e serviram para orientar os cortes ultrafinos para exame ao microscópio eletrônico.
O resultado das alterações ultra-estruturais causadas pelos tratamentos está representado nas figuras 2 a 6. Nas eletromicrografias 2, 3 e 4 podemos ver cortes horizontais das células externas na sua porção supranuclear. A fig. 2 representa o animal controle, onde se observa a riqueza das mitocondrias e microtúbulos. No animal tratado pelo sulfato de estreptomicina (fig.3), pode ser observada vacuolização citoplasmática e degeneração das mitocondrias desta região supra nuclear. 0 exame da fig. 4 mostra que no animal tratado pelo complexo não houve alteração acentuada das mitocondrias ou dos microtúbulos. As alterações provocadas pelo antibiótico na sua forma de sulfato podem também ser observadas na fig. 5 que representa a porção apical das células sensoriais. Observa-se aí, logo abaixo da cutícula, um grande número de mitocondrias destruídas. A fig. 6 representa a mesma região do órgão de Corri de um animal tratado pelo complexo. Aqui também não são observadas alterações acentuadas do citoplasma ou de mitocondtias.
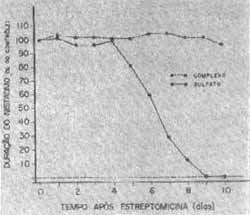
Gráfico IV - Efeitos da injeção intramuscular de sulfato e complexo de estreptomicina (400 mg base/kg/dia) na duração do nistagmo em cobaias. Cada ponto representa a média de 6 experimentos.
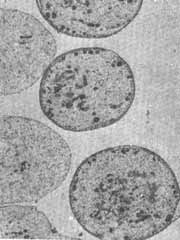
FIG. 2 - Electtomicrografia da região supranuclear das células ciliadas externas do órgão de Corti (2 espira) de cobaia normal. Coloração pelo corante de Reynold e urinila. Aumento final 15.000 x.
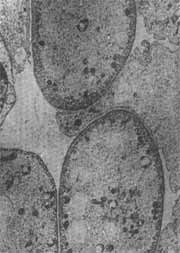
FIG. 3 - Electromicrografia da região supranuclear das células ciliadas externas do órgão de Corri (2 a espira) de cobaias que receberam dose diária de 400 mg/kg de sulfato de estreptomicina durante 10 dias. Coloração pelo corante de Reynold e uranila. Aumento final 15.000 x.
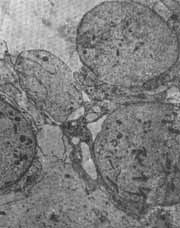
FIG. 4 - Elettromicrografia da região supranuclear de células ciliadas externas do órgão de Corti (2 a espira) de cobaia que recebeu dose de 400 mg/kg ie peso do complexo tricloridrato de estreptomicina-cloreto de cálcio por 10 dias. Coloração pelo corante de Reynold e uranila. Aumento final 15.000 x.
FIGS. 5 e 6 - Elettromicrografia da porção apical de células ciliadas externas do órgão de Corri (2 a espira) de cobaias.

FIG. 5 - Animal tratado pelo sulfato de estreptonmicina.
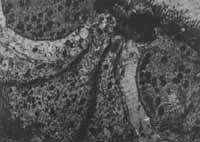
FIG. 6 - Animal tratado com complexo tricloridrato de estreptomicina-cloreto de cálcio.
Embora tenhamos observado uma diferença substancial entre a ototoxicidade determinada pelos dois sais de estreptornicina empregados, os nossos resultados experimentais são ainda insuficientes para atribuirmos um eventual papel do íon cálcio na toxicidade crônica desse antibiótico. As nossas condições experimentais nos impossibilitam identificar o provável local de ação do íon cálcio, isto é, se interferindo na excreção renal do antibiótico, ou na passagem deste último do plasma para a perilinfa ou protegendo as células sensoriais do labirinto à ação tóxica da estreptomicina. Não é improvável que todos esses fenômenos se processem simultaneamente. Assim, o fato de havermos verificado, no 5 ° dia de tratamento com o sulfato de estreptomicina, apreciável acúmulo do antibiótico no plasma com repercussão posterior nos seus níveis na perilinfa, ao contrário do observado em relação ao complexo estreptomicina-cloreto de cálcio cujos valores encontrados durante aplicação prolongada são inferiores aos verificados após administração de uma única dose, sugere que algum fator deve ter interferido na excreção renal do antibiótico quando administrado sob a forma de complexo. A esse propósito merece ser mencionado que quando administrados em altas doses os antibióticos aminoglicosldicos podem promover efeitos nefrotóxicos propiciando seu acúmulo no sangue o que explicaria o referido aumento dos níveis de estreptomicina na sua forma de sulfato. E fato constatado que cerca de 70% da estreptomicina injetada é eliminada por via renal, e 30% está ligada a proteínas plasmáticas e parte depositadas nos tecidos, não tendo sido encontrados produtos de degradação (Harold e cols., 1945; Goodmaan e Gilman, 1970). Embora essa nefrotoxicidade seja mais frequente com a neomicina e canamicina, quando são atingidas altas concentrações sanguíneas dos demais antibióticos da série, esta toxicidade foi igualmente observada inclusive com a estreptomicina (Brighman e Nielsen, 1958; Riwllin e Minovitch, 1965; Schreiner e Maker, 1965; Greenburg, 1965; Rubem e Daly, 1968). O papel desempenhado pelo eventual efeito nefrotóxico induzido pela aplicação da estreptomicina poderá ser definitivamente esclarecido ao se realizar, paralelamente ao presente estudo, a avaliação da função renal e dosagem do antibiótico na urina. No caso de não ser comprovada a nefrotoxicidade, então fatores outros, como um aumento do depósito do antibiótico em tecidos ou a sua maior incorporação à proteínas piasmáticas ou à formação de produtos inativos ou a sua maior eliminação renal deverá ser investi gada. De um modo geral, a maior concentração de estreptomicina no plasma quando injetada na forma de sulfato, proporciona também maior concentração da mesma na perilinfa, fenômeno observado com maior evidência entre 5.° e 10.° dia em completa discordância ao que foi observado com a aplicação crônica desse antibiótico sob a forma de complexo com cloreto de cálcio, cujos níveis na perilinfa caíram do 5.° para o 10.° mantendo-se em níveis significativamente mais baixos até o final do experimento. A eliminação lenta do antibiótico da perilinfa descrita por outros autores (vide revisão Sl~, 1970) explicaria a diferença entre o aumento dos níveis desse antibiótico na perilinfa e sua queda no plasma entre o 5 ° e 10.u dia. O desaparecimento da resposta nistagmica por estímulo calórico em todas as cobaias injetadas com sulfato de estreptomicina teve seu início a partir do 5.° dia de aplicação do antibiótico observando-se o bloqueio total entre o 9 ° e o 10.° dia, período esse que corresponde exatamente ao de maiores níveis do antibiótico na perilinfa. O estudo morfológico do órgão de Corri em nível ultraestrutural mostra lesões do epitélio sensorial principalmente das células ciliadas externas nos animais tratados pelo sulfato de estreptomiçina. Estas lesões, observada por diversos autores (Wertall e Hawkins, 1962; Duval e Wersall, 1964; Cherkarov, 1964, Ortyn e Tyberghein, 1968; Watanuki e Meyer, 1971) referem-se principalmente as mitocondrias, microttíbulos e á presença de vacuolização citoplasmática. Nos animais injetados com o complexo, entretanto, não foram observadas alterações acentuadas durante o período de tempo estudado, sugerindo, além da menor concentração do antibiótico na perilinfa a presença de algum fator de "proteção" do epitélio sensorial do órgão de Corri. Este fator poderia ser o próprio íon cálcio. As alterações morfológicas observadas no 10 ° dia confirmaram as diferenças de ototoxicidade entre os dois sais empregados e demonstraram que, quando o sulfato é administrado em altas doses, a estreptomicina pode atingir níveis elevados na perilinfa capazes de lesar as células ciliares do órgão de Corti. Estas lesões não se apresentaram com a mesma intensidade quando se administraram altas doses de estreptomicina por longos períodos de tempo sob a forma de complexo de tricloridratocloreto de cálcio cujos níveis sanguíneos e da perilinfa mantiveram-se bem inferiores aos do sulfato de estreptomicina. Embora não possamos de todo afastar uma eventual interferência do íon cálcio no processo de passagem desses antibióticos da sangue para a perilinfa, o real papel desempenhado pelo íon cálcio em antagonizar a intoxicação crônica pela estreptomicina só poderá ser definitivamente esclarecido após o estudo comparativo da toxicidade dos sais de estreptomicina usados neste experimento após sua aplicação direta por via intratimpânica, isto é, em condições em que são eliminados o eventual comprometimento renal bem como o papel da concentração plasmática do antibiótico como fatores preponderantes do fenômeno em estudo.
Resumo e ConclusõesDeterminamos a concentração da estreptomicina base injetadas sob as formas de sulfato e de complexo tricloridrato-cloreto de cálcio no sangue e na perilinfa da cobaia. A administração por via intramuscular do complexo na dose de 50 mg/kg, demonstrou níveis médios no sangue e na perilinfa maiores em relação ao sulfato nas diferentes determinações correspondentes a 1, 5, 18 e 24 horas após a injeção da droga. A análise estatística mostrou que apenas as diferenças na 5 1 hora tanto para o soro como para a perilinfa são significativos ao nível de 5%. Nos experimentos crônicos realizados verificamos efeito cumulativo do antibiótico na perilinfa em relação com as dos experimentos agudos. A concentração do complexo foi menor que a do sulfato. No entanto, apenas as diferenças no 10.° e 15 ° dias foram estatisticamente significantes. No estudo da função do labirinto posterior verificamos que as alterações nistagmicas provocadas pelo sulfato de estreptomicina não foram observados quando administramos esse antibiótico na sua forma de complexo no decorrer do período, necessário para que todas as cobaias tratadas com sulfato apresentassem bloqueio total da resposta nistagmica ao estímulo calórico. O exame morfológico revelou alterações das células ciliadas externas nas regiões supranucleares e apicais provocadas pela estreptomicina sob a forma de sulfato, sem haver correspondência quando o sal usado foi o tricloridrato de estreptomicina-cloreto de cálcio. Foram aventadas hipóteses sobre os possíveis mecanismos de ação do antibiótico sob as formas de sulfato e complexo cálcico, discutindo-se o eventual papel desempenhado por este íon na proteção do labirinto anterior e posterior da cobaia à ação tóxica da estreptomicina.
SummaryThe concentration of sulfate and trihydrochloride-calcium chioride complex of streptomycin in the blood and perilymph of the guinea pig was assayed after intramuscular injection. The blood and perilymph levels after the injection of a single dose of 50 mg/kg of body weight showed heigher levels in the animais injected with the calcium complex sair of streptomvcin ar different times after the injection (1-5-18 and 24 h.) . However, only the samples collecred 5 h after administration showed a statistically significant difference. In animais injecced dayly (50 mg/kg/day) for 5 - 15 days there was a cummulative effect of the antibiotic in the perilymph, the sulfate sair levels being much higher than those of the sair complex. However the statistical analysis only showed significant difference after the l0th and 15th days of treatment. In another experimental group animais were injected dayly (400 mg/kg/day) for terá days either with sulfate or sair complex of streptomycin, until ali sulfate treated animais presented a supression of nistagmus induced by heating stress. At this time norte of the calcium complex treated animais presented these alterations. The ultrastructural study of the externai ciliary cells of animais injected dayly for ten days (400 mg/kg/day) with sulfate streptomycin showed lesion in the supranuclear and apical region of these cells. In calcium complex treated animais the lesions were much less extensive. Speculations are made as to the mechanism by which the trihydrochloride-calcium chloride complex acts protecting the anterior and posterior labyrinth of guinea pig against the toxic action of streptomycin sulfate.
Bibliografia1. Barr, B., Floberg, L. E., Hamberger, C. A., Koch, H. 1. : Otological aspects of streptomvcin therapy. Acta Otolaryngol., supp. 75: 5, 1949.
2. Brighan, R. S., u. Nielsen, 1. K. : The effect of calcium pantothenate on lhe acute and chronic toxic)ty of streplomycin and dihydrostreptomvcin in mice. Antibiot. chemother. N. Y. 8 : 122, 1958.
3. Cherkasov, V. S. : Changes in lhe vestibular analyses due to streptomycin. Fed. Proceedinr;s, 23:657, 1964.
4. Claoué, C. 1928. Citado em Marseiilan, R. F.
Ototoxicidade dos antibióticos. Estudo experimental na cobaia. Tese apresentada à Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, 1972.
5. Cohen, S. S. 1946. Citado em Stupp, H. F.
Untersuchung der Antibiotikaspiegel in den innenorhrflüssigkeiten un lhre Bedeutung für die Spezifische Ototoxizitat der Aminoglykosidantibiotika. Acta Oto-laryngologica, suppl. 262:1, 1970.
6. Corrado, A. P., Menezes, R., Katazu, H., Bicudo, M. R., Bareicha, 1., Carcia Leme, I., Fiorillo, A., Marseilian, R. F. Redução da toxicidade aguda e da atividade bloqueadora neuromuscular de antibióticos oligossacarídeos. Prémio da Associação Brasileira da Indústria Farmacêutica, 1969.
7. Darrouzet, I. : Essais de protection de I'organe de Corti contre Pototoxicité des antibiotiques. Revue de laryngologie-Otologie-Rhinologie, Suppl. aoút, 459, 1963.
8. Darrouzet, 1. : Essaís de protection de L'organe de Corti contre I'ototoxicité des antibiotiques. Revue de laryngologie, extrait 3-4, 188, 1967.
9. Duval, A. I., Wersãll, 1. : Site of action streptomycin upon inner ear sénsory cells. Acta Iaryngologica, 57:581, 1964.
10. Fowler, E. P. Ir., Seligman, E. : Otic complications of streptomicyn therapy: a preliminary report. J. Ann, Med. Ass., 133:87, 1947.
11. Fowler, E. P., Feind, C. R. : Toxicity of streptomycin for the auditory and vestibular mechanisms. Amer. Rev. Tuberc., 60:30, 1949.
12. Glorig, A., Fowler, E. P., Ir. : Tests for labyrinth junction folloxving strepto:nyc:a :ierapy. Ann. Otol. 56:379, 1947.
13. Goodman, L. S., Gilman, A. : The pharmacological basis of therapeutics. 4th ed. MacMillan, 1970.
14. Greenbúrg, L. H., Moncarey, H. : Audiotoxicity and nephrotoxicity due to orally administered neomycin. J. Amer. Med. Ass. 194 : 827, 1965.
15. Groove, D. C. & Randall, W. A. : Assay ma- thods of antibiotics: a laboratory manual (Antibiotics Monografs, n .O 2), New York, Medicai Encyclopedia, Inc., 1955.
16. Hanson, H. V. : The treatment of endolymphatic hydrops with streptomycín. Ann. Otol. 60 : 676, 1951.
17. Harold, A. 1., Flippin, H. F., Nichols, A. C., Wiley, M. M., Rhoads, I. .E. : Studies on streptnmycin in man. I. Absorption, distribution, excretion and toxicity. The American Journal of the Medical Sciences, 210:422, 1945.
18. Hawkins, 1. E., Ir. : Antibiotics and the inner ear Trans. Ann. Acad. Ophtalm. Otolaryng. 63:206, 1959.
19. Hawkins, I. E., Ir. : The ototoxicity of kanamycin. Ann. Otol. 68:698, 1959.
20. Hinshaw, H. C., Feldman, W. H. 1945, Citado em Mittelman, H. : Ototoxicity of "ototopical" antibiotics: Past, Present and Future. Transactions American Academy of Ophthalmology and Otolaringology, 76 :1432, 1972.
21. Marseilian, R. F., Grellet, M., Colafémina, 1.
Fstudo electronistagmográfico da função vestibular na cobaia. Ciência e Cultura, 21 :545, 1969.
22. Marseillan, R. F. : Ototoxicidade dos antibióticos. Estudo experimental na cobaia. Tese apresentada à Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, 1972:
23. Meyler: Streptomycin and not dihydrostreptomycin. Acta Oto-laryngol., 183:92, 1963.
24. Mückter, H. Citado em Stupp, H. F. : Untersuchungen der antibiocaspiegel in den inneonohrflussigkeiten und ihre Bedeutung FOR DIE SPEZIFISCHE OTOTOXIZITAT DER AMINOGLYKCSIDANTIBIOTIKA. Acta Otolaryngol, Stock) Suppl. 262:1, 1970.
25. Northington, P. : Syndrome of bilateral vestibular paralysis and its ocurrence from streptomycin therapy. Arch. Otolaryngol., 52:380, 1950.
26. Osterberg, A. C., Oleson, G. I., Yuda, N. N., Rauch, C. E., Parr, H. G., Will, L. W. : Cochtear, vestibular and acure toxicity studies of streptomycin and dihydrostreptomycin panthothenate salts. Antibiot. Ann. 564, 1956-1957.
27. Ostyn, F., Tyberghein, I.: Influence some streptomycin antibiotics on inner ear of the guines pig. Acta Oto-laryngol., Sup. 134:1, 1968.
28. Ranta, L. 1. : Acustic and vestibular disturbance following streptomycin treated tuberculous meningitis in children. Acta Oto-laryngol., 136:9, 1958.
29. Ruben, R. I., Daly, 1. F. : Neomycin ototoxiritv and nephrotoxicity. The Laryngoscope. 1734. 1968.
30. Ruedi, 1. : Therapeutic and toxic effeUs of streptomycin in otology. Laryngoscope, 61
613, 1951.
31. Rywlin, A. M., Minovitch, E. S. : Bacitracin and neomycin nephrosis ocurring after a single intraperitoneal instillation. South Med. )ouro. 58:736, 1965.
32. Schreiner, C. E.; Maker, /. F. : Toxic nephropathy. Amer. ) Med., 58:736 1965.
33. Stupp, H. F. : Untersuchungen der antibioticaspiegel in den lnnenohrflüssigkeiten und lhre Bedeutung für die Spezifische ototoxicitat der Aminoglykosidantibiotika. Acta Oto-laryngol. (Stockh), Suppl. 262:1, 1970.
34. Tyberghein, /. 1962, Citado em Stupp, H. F.: Untersuchungen der antibioticaspiegel in den Inneonohrflüssigkeiten und lhre fur die spezifische ototoxicitat der Aminoglykosidantibiotika. Acta Oto-laryngol. (Stockh) Suppl. 262 : 1, 1970.
35. Watanuki, K., Meyer, A. : Toxic effects of streptorrycin and kanamycin upon the sensory epithelium of the crista ampularis. Acta Otolaryngol. 72 : 56, 1971.
36. Wersafl, /., Hawkins, 1. E. o The vestibular sensory epithelia in the,cat labyrint and their reactions in chronic streptomycin intoxication. Acta Otolaryngol., 54:1, 1962.
37. Winston, 1. : Clinica] problems pertaining to neurotoxicity of streptomycin group of drugs. A. M. A. Arch. Otolar. 58:55, 1953.
* Professor Livre-Docente e Coordenador da Clínica Otorrinolaríngológica do Departamento de Oftalmologia e Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto U.S.P.
** Professor Adjunto do Departamento de Morfologia da Faculdade de Medicina de Ribeirão Preto - U.S.P.
*** Professor Livre-Docente do Departamento de Ciências Patológicas da Faculdade de Farmácia e Odontologia de Ribeirão Preto - (Disciplina de Microbiologia e Imunologia).


