INTRODUÇÃOAs cirurgias de ressecção das amígdalas palatinas e adenóide, especialmente indicadas nas hipertrofias adenoamigdalianas, que levam ao prejuízo da respiração nas crianças, são procedimento antigo, restrito a poucas técnicas5, 6, 8, 13, 14; e nos últimos tempos tem-se valorizado o uso da dissecção tradicional por descolamento, com o abandono da técnica de Sluder.
Segundo alguns autores, nos oito volumes publicados da Enciclopédia Médica, no ano 3 D.C., Cornelius Caesus realizou uma das primeiras descrições de tonsilectomia9. O procedimento mais usual é a dissecção pela técnica tradicional13; e o mais recente, pelo laser8.
A amigdalectomia por meio do amigdalótomo de Sluder é uma técnica que tem sido abandonada devido aos riscos clínicos injustamente imputados à cirurgia, mas que na realidade são gerados em parte pelo procedimento anestésico. Realizou-se um estudo comparativo entre esta técnica e a dissecção tradicional, sob anestesia geral, com intubação orotraqueal, objetivando a análise da morbidade entre as duas técnicas cirúrgicas.
MATERIAL E MÉTODONo período de novembro de 1997 a junho de 1998, foram estudadas cem crianças submetidas a adenoamigdalectomia na faixa etária de quatro a oito anos de idade, com indicação cirúrgica por problemas respiratórios obstrutivos altos, em razão de hipertrofia adenoamigdaliana.
Os casos selecionados foram submetidos à nasofibroscopia, tendo se constatado aumento do tamanho das adenóides. Então, verificou-se a necessidade de realizar adenoamigdalectomia e não apenas amigdalectomia.
Classificação do tamanho das amígdalas palatinas
O tamanho das amígdalas palatinas foi classificado de acordo com o seguinte critério (Figura 1):
A - Pequena - amígdalas alinhadas ás pregas palato-glosso (pilar anterior).
B - Moderada - projeção das amígdalas entre as pregas palato-glosso (pilar anterior) e linha mediana (úvula).
C - Grande - amígdalas atingem a linha mediana que passa pela úvula.
Neste estudo, foram selecionados os casos com hipertrofia das amigdalas palatinas classificadas como grande.
Subdividiu-se esse material em dois grupos:
1° grupo - dissecção convencional (50 casos);
2° grupo - dissecção com guilhotina de Sluder (50 casos).
Desenvolveu-se um protocolo que foi preenchido pelo cirurgião responsável.
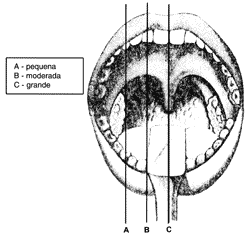
Figura 1. Classificação do tamanho das amígdalas.
Critérios de avaliação do método
O trabalho envolveu mais de cem pacientes; porém, foram selecionados cem casos que se enquadraram de acordo com a proposta do estudo (protocolo). Os casos tabulados foram dos pacientes que realmente compareceram às visitas de pós-operatório. Os casos não acompanhados no pós-operatório foram excluídos.
O tempo de cirurgia, em ambas as técnicas, foi cronometrado a partir do momento de colocação do abridor de boca até à sua retirada. As perdas sangüíneas foram medidas em mililitros de sangue encontrado no vidro de aspiração.
Neste estudo comparativo, aplicamos dois testes estatísticos4: o teste t-independente (quando a informação é numérica) e o teste Qui-quadrado (quando a informação é categorizada). No teste t-independente (p), quando seu valor for menor ou igual a 0,05, existe diferença significante; caso contrário, não há. No teste de Qui-quadrado, quando o valor observado for menor ou igual ao valor crítico, dizemos que há diferença significante.
Descrição do método de dissecção convencional
Com o paciente em decúbito dorsal na posição de Rose, sob anestesia geral com utilização de anestésico halogenado (Halotano) e intubação orotraqueal, colocou-se o abridor de boca de Mc'Ivor e em seguida gaze ancorada na hipofaringe.
Após a visualização, as amígdalas foram tracionadas medialmente com pinça Brunnings, perpendicularmente ao pilar. A mucosa faríngea foi incisada na altura do pilar anterior (Figura 2), com bisturi lâmina nº 12, a partir da prega lingual até o pólo superior. Procurou-se a cápsula amigdaliana; e, com o aspirador - descolador de Hurd (Figura 3), liberou-se a amígdala da parede lateral da faringe com movimentos firmes no sentido crânio-caudal, chegando ao pólo inferior até completa exérese da amígdala (Figura 4); ou, então, cortou-se o pedículo amigdaliano com tesoura curva de Metzembaum (Figura 5). A seguir, fez-se hemostasia com gaze ancorada; e, quando necessário, suturou-se com categut simples 2-0. Realizou-se o mesmo procedimento do outro lado.
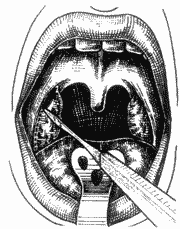
Figura 2. Incisão da mucosa faríngea na altura do pilar anterior.
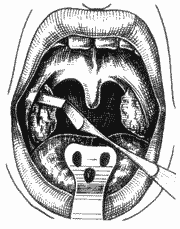
Figura 3. Dissecção da cápsula amigdaliana

Figura 4. Descolamento da amígdala até o pólo inferior.
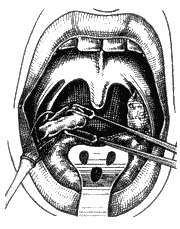
Figura 5. Exérese da amígdala
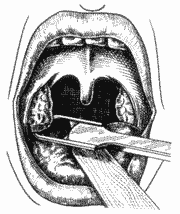
Figura 6. Colocação da amígdala (pólo inferior) dentro da guilhotina de Sluder.
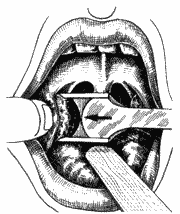
Figura 7. Pressão do pilar anterior com o dedo indicador da mão oposta.
Descrição do método de dissecção pela guilhotina de Sluder
Com o paciente em posição semi-sentada, formando ângulo de 45 graus com o plano horizontal, sob anestesia geral com a utilização de anestésico halogenado (Halotano) e intubação orotraqueal, colocou-se o abridor de boca de Sluder, para a exposição das amígdalas. Usou-se gaze ancorada em hipofaringe, para proteção das vias aéreas inferiores. Em seguida, encaixou-se o pólo inferior para dentro da guilhotina de Sluder (Figura 6), auxiliado pelo dedo indicador da mão oposta pressionando no pilar anterior (Figura 7), tomando-se o cuidado com a úvula e a musculatura. Logo a seguir, pressionou-se fortemente a guilhotina, fazendo para cima o movimento de rotação em sentido horário na loja amigdaliana direita (Figura 8) e anti-horário na loja amigdaliana esquerda, bem lateralizado, descrevendo um vetor medial, inferior e posterior. Nessa altura, com a amígdala já totalmente dissecada com o auxílio do dedo indicador em gancho (Figura 9), e mantendo a guilhotina tracionada, fez-se a sua extração. Em seguida, realizou-se hemostasia com gaze ancorada. Quando necessário, foi usado categut simples 2-0 para sutura.
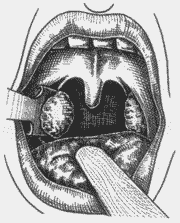
Figura 8. Fechamento da guilhotina, com movimento de rotação no sentido horário.
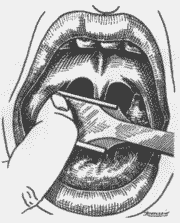
Figura 9. Dissecção da amígdala com o dedo indicador oposto até sua extração.
Pela análise deste estudo, chega-se aos resultados que estão demonstrados em tabelas.
A Tabela 1 analisa a duração da cirurgia em minutos em ambas as técnicas, onde podemos verificar, com a aplicação do teste t-independente (p), que a técnica Sluder leva significantemente menos tempo que a dissecada (p<0,001). já na Tabela 2, que compara a perda sangüínea em mililitros, não houve diferença significante (p=0,229) entre as técnicas.
A Tabela 3 representa o número de ligaduras, constatando que na técnica de Sluder esse número foi significantemente menor que na técnica dissecada (p=0,044).
Ao analisarmos os restos amigdalianos (Tabela 4), não constatamos diferença entre as técnicas cirúrgicas aplicando-se o teste Qui-quadrado, no qual o valor observado foi igual a 0,00; e o valor crítico, 3,84.
TABELA 1 - Duração da cirurgia em minutos.
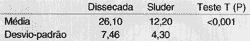
TABELA 2 - Perda sangüínea em mililitros.
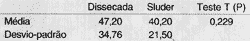
TABELA 3 - Número de ligaduras.
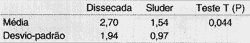
TABELA 4 - Restos Amigdalianos.

Legenda: N - número de casos.
TABELA 5 - Febre no 1°, 7° e 14° dia de pós-operatório.
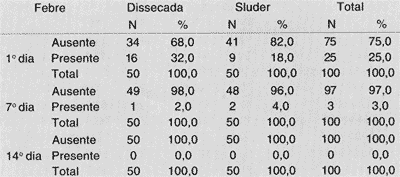
Legenda: N - número de casos.
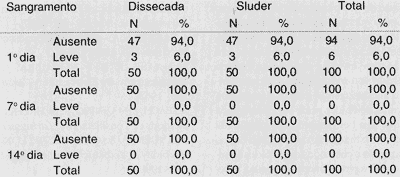
TABELA 6 - Sangramento no 1°, 7° e 14° dia de pós-operatório.
A Tabela 5 verifica a presença de febre no primeiro, sétimo e décimo quarto dias de pós-operatório, tendo sido utilizado o teste Qui-quadrado para análise estatística: no primeiro dia de pós-operatório, o valor observado foi 1,92, e o valor crítico, 3,84; no sétimo e décimo quarto dias o valor observado foi 0,00, e o crítico, 3,84. Constatamos, então, que não houve diferença significativa entre as técnicas quanto à febre.
A observação do sangramento (Tabela 6) foi realizada em ambas as técnicas no primeiro, sétimo e décimo quarto dias de pós-operatório, não tendo havido diferença estatística quando aplicamos o teste Qui-quadrado (valor observado = 0,00 e valor crítico = 3,84).
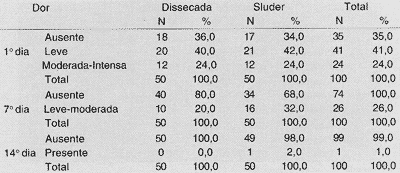
A Tabela 7 demonstra a dor no pós-operatório (primeiro, sétimo, e décimo quarto dias de pós-operatório). Quando realizamos o teste Qui-quadrado, não ocorreu diferença significante no primeiro dia (valor observado = 0,05 e valor crítico = 5,99), no sétimo dia (valor observado = 1,30 e valor crítico = 3,84) nem no décimo quarto dia (valor observado = 0,00 e valor crítico = 3,84).
DISCUSSÃOA busca da menor morbidade na amigdalectomia beneficia o paciente, diminuindo custos hospitalares e farmacêuticos1, 23, 7, 11. Objeções para amigdalectocnia pela técnica de Sluder foram tantas, que elas levaram à impopularidade da técnica nos últimos tempos2, 12, não havendo, conseqüentemente, Serviços de residência médica em Otorrinolaringologia nos dias atuais que formem especialistas aptos para o manejo do amigdalótomo de Sluder. As desvantagens que se relatam são a falta de controle da perda sangüínea, restos amigdalianos remanescentes, acidentes como uvulectomia, glossectomia acidental parcial e lesão de pilar, bem como aspiração de sangue para a árvore respiratória inferior10. Alguns autores, entretanto, relatam baixa incidência de hemorragia no pós-operatório e apresentam como uma das principais vantagens a velocidade com que ela é realizada13, deixando a impressão de que o cuidado com a aplicação correta desta técnica propicia que as amígdalas sejam removidas com segurança, sem lesar qualquer estrutura. O hábito arriscado e condenável de se aplicar a guilhotina de Sluder sem intubação orotraqueal não deve invalidar a técnica operatória que nos parece boa, mas que se torna arriscada e de fato Perigosa apenas pela forma da anestesia empregada. A cirurgia para amigdalectomia pela técnica de Sluder pode ser considerada uma boa opção, desde que seja bem empregada, e realizada por cirurgiões experientes e sob intubação orotraqueal. Com o paciente intubado, monitorizado e com todos os cuidados técnicos adequados, qualquer um dos procedimentos é seguro, apresentando alguma vantagem a guilhotina de Sluder para o cirurgião e para ó paciente, como se constatou neste estudo.
TABELA 7 - Dor no 1°, 7° e 14° dia de pós-operatório.
Com base nos nossos resultados, podemos concluir que:
o ambos os procedimentos são igualmente bons e resolutivos;
o a técnica de amigdalectomia pela guilhotina de Sluder é estatisticamente mais rápida, necessitando de um menor número de ligaduras no intra-operatório;
o a análise da morbidade foi semelhante nos dois grupos estudados.
REFERÊNCIAS BIBLIOGRÁFICAS1. CAPPER, J. W. R.; RANDALL, C. - Postoperative Haemorrhage in tonsillectomy and Adenoidectomy in children. J. Laringol. Otol., 98: 363-365, 1984.
2. CARMODY, D.; VAMADEVAN, T. e COOPER, S. M. - Posttonsillectomv Haemorrhage. 1. Larungol. Otol., 96: 363-365, 1982.
3. CARITHERS, J. S.; GEBHART, D. E.; WILLIANS, J. A. - Post operative Risks of Pediatric Tonsilloadenoidectomy. Laryngoscope, 97.- 422-429, 1987.
4. GLANTZ, S. A. - Primer of Biostatistics, 4a edição, USA, Editora Mc.Graw Hill, 1997, 1-455.
5. HAASE, F. R. e NOGUERA, J. T. - Hemostasis in Tonsillectomy By Eletrocautery. Arch. Otolaryngol., 75: 125126, 1962.
6. LEACH, J.; MANNING, S.; SCHAEFER, S. - Comparison of Two Methods of Tonsillectomy. Laringoscope, 103: 619-622, 1993.
7. LINDEN, B. E.; GROSS, C. W.; LONG, T. E.; LAZAR, T. H. Morbidity in Pediatric Tonsillectomy. Laryngoscope, 100: 120124, 1990.
8. MARTINEZ, S. A. e AKIN, D. P. - Laser Tonsillectomy and Adenoidectomy. Otolaryngol. Clin. North Am., 20: 371-376, 1987.
9. McAULIFFE, J. C. - The History of Tonsil and Adenoidal surgery. Otolaryngologic. Clinics of North América, 20: 415419, 1987.
10. McGUIRE, N. - A Method of Guilhotine Tonsillectomy With an Historical Review. Laryngoscope, 105: 187-194, 1995.
11. SALAM, M. A. e CABLE, H. R. - Post-tonsillectomy pain with diathermy and ligation techniques. A prospective randomized study in children and adults. Clin. Otolaryngol., 17.- 517-519, 1992.
12. SIODLACK, M. Z.; GLEESON, M. J.; WENGRAF, C. L. - Posttonsillectomy secondary hemorrhage. Annals of the Royal College of surgeons of England, 67.- 167-168, 1985.
13. WAKE, M.; GLOSSOP, P. - Guillotine and dissection Tonsillectomy compared. J. Laryngol. Otol., 103: 588-591, 1989.
14. WEIMERT, T. A.; BABYAK, J. W.; RICHTER, H. J. Eletrodissection Tonsillectomy. Arch Otolaryngol. Head and Neck Surg., 126- 186-188, 1990.
* Médico Otorrinolaringologista, Coordenador do Curso de Aperfeiçoamento em ORL da CLINORL - Instituto de Otorrinolaringologia e Oftalmologia, de São Paulo/SP
** Médica Residente - R3 da CLINORL - Instituto de Otorrinolaringologia e Oftalmologia, de São Paulo/SP
*** Médica Otorrinolaringologista da CLINORL - Instituto de Otorrinolaringologia e Oftalmologia, de São Paulo/SP
**** Médica Otorrinolaringologista, Ex-Residente da CLINORL - Instituto de Otorrinolaringologia e Oftalmologia, de São Paulo/SP
Trabalho realizado na CLINORL - Instituto de Otorrinolaringologia e Oftalmologia, de São Paulo/SP, e apresentado no 34° Congresso Brasileiro de Otorrinolaringologia em 22 de novembro de 1998, em Porto Alegre /RS.
Endereço para correspondência: Edson Carlos Miranda Monteiro - Av. Leôncio de Magalhães, 750 - 02042-000 São Paulo/SP - Telefone: (0xx11) 6950-2339.
E-mail: clin_orl@uol.com.br
Artigo recebido em 26 de junho de 2000. Artigo aceito em 18 de janeiro de 2001.


