INTRODUÇÃOA cisplatina é um quimioterápico utilizado desde a década de 70, para o tratamento de carcinoma testicular, de ovário, tumores ósseos e de cabeça e pescoço. Sua criação ocorreu em 1965, quando Rosemberg e colaboradores20 fizeram passar uma corrente elétrica entre eletrodos de platina em meio de cultura com Escherichia coli, observando a inibição de seu crescimento.
A nefrotoxicidade da cisplatina é o seu maior efeito tóxico, podendo levar a insuficiência renal. A utilização de hidratação prévia e a infusão com solução hipertônica de cloreto de sódio a 3%22, utilizado rotineiramente atualmente, contribuem para a diminuição dessa toxicidade. A mielossupressão é encontrada freqüentemente, mas é reversível com a parada da quimioterapia14. Náuseas e vômitos são controlados com a hidratação e o uso de anti-heméticos. A neuropatia periférica é irreversível, acometendo principalmente as extremidades, e está relacionada com a dose acumulada.
A ototoxicidade é irreversível, bilateral, neurossensorial e acomete principalmente as freqüências entre 4 e 8 kHz; mas, com o acúmulo de doses, pode progredir para as freqüências da fala3, 8, 11, 17. A incidência da ototoxicidade na literatura varia de 12,5%12 a 100%2 nos pacientes submetidos à quimioterapia com a cisplatina. A idade parece ser um fator de agravamento da ototoxicidade, sendo mais comum em indivíduos idosos5, 8 e em crianças4, 19, 21. A dose acumulada4, 8, 14 e sua utilização em bolo19, 23 são fatores de agravamento para a ototoxicidade.
Os achados histopatológicos em seres humanos demonstram perda nas três fileiras de células ciliadas externas, principalmente na espira basal da cóclea e com discreto acometimento das células ciliadas internas6, 7.
Esse estudo teve como objetivo avaliar a audição de crianças que fizeram uso da cisplatina como quimioterápico.
MATERIAL E MÉTODOForam avaliadas oito crianças com idade média de 10,2 anos, durante o período de agosto de 1996 a março de 1999, que fizeram uso de cisplatina. Todos os pacientes realizaram o tratamento no Hospital Sarina Rolim Caracante, na cidade de Sorocaba /SP. Das oito crianças, quatro eram do sexo masculino e quatro do sexo feminino. O protocolo quimioterápico utilizado foi semelhante ao utilizado na Unidade de Oncohematologia do Instituto da Criança do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo. A dose individual utilizada de cisplatina foi de 90 mg/m2, e a dose total variou de 180 a 630 mg/m2. A histologia da patologia tumoral foi: dois pacientes com osteosarcoma, dois com rabdomiosarcoma, dois com linfoma de Hodgkin, um com meduloblastoma e um com condrossarcoma mesenquimal.
O exame otorrinolaringológico foi realizado pelo mesmo profissional e os pacientes foram avaliados sobre o passado auditivo prévio à quimioterapia e sobre o passado de infecções otorrinolaringológicas. Os exames audiológicos foram realizados sempre pela mesma fonoaudióloga em cabine acústica e utilizando-se: audiômetro MA-41 da Maico e o imitanciômetro MA-630 do mesmo fabricante. Em todos os pacientes foram realizados audiometria tonal nas freqüências de 250 Hz a 8 kHz, índice de reconhecimento de fala (IRF), imitanciometria e pesquisa do reflexo do músculo do estribo. O critério de normalidade foi a presença de limiares menores ou iguais a 20 dBNA nas freqüências testadas.
RESULTADOSForam realizadas, no total, 28 avaliações audiológicas, mas em duas crianças foi realizada apenas uma avaliação após o término da quimioterapia. Na Tabela 1 encontram-se a histopatologia tumoral, a dose da cisplatina e os resultados 4udiométricos de cada paciente.
A imitanciometria estava normal em todos os pacientes. A pesquisa do reflexo do músculo do estribo apresentava níveis aumentados nas freqüências afetadas. O teste de discriminação de fala estava em conformidade com o resultado da audiometria tonal. Devido à dificuldade de discriminação da fala e a problemas escolares, um paciente recebeu recomendação de uso de prótese auditiva.
DISCUSSÃOA ototoxicidade da cisplatina foi primeiramente descrita por Rossof e colaboradores, em 1972, e vem sendo amplamente estudada ao longo dos anos. A incidência da ototoxicidade é muito variável na literatura, afetando, de 12,5%12 a 100%2, 9, e está relacionada diretamente à dose e a forma de administração da cisplatina. Em nosso estudo, apenas um dos oito pacientes não apresentava perda auditiva após o uso da cisplatina. A perda auditiva inicialmente está localizada entre 6 e 8 kHz; e, posteriormente, com o aumento da dose acumulada, pode acometer as freqüências abaixo de 4 kHz10, 19. A simetria da perda auditiva é um achado comum, descrito na literatura; e, em nosso estudo, encontramos assimetria em um paciente. Este achado pode estar relacionado com a radioterapia local, utilizada na região craniana desse paciente. Em nosso estudo, as freqüências de 6 e 8 kHz foram as mais afetadas; e, com acúmulo das doses, ocorreu acometimento em outras freqüências. A irreversibilidade é um achado constante; e pudemos notar em nosso estudo que nos pacientes que realizaram a avaliação audiológica poucos dias após a quimioterapia houve melhora da audição nas avaliações subseqüentes. Acreditamos que tal achado esteja relacionado às condições clínicas precárias dos pacientes durante a realização do exame. A idade é um fator de agravamento da ototoxicidade da cisplatina; e sendo assim, as crianças4, 19, 21 e os indivíduos reais idosos5, 8 são mais predispostos. O uso de radioterapia prévia ou concomitante à utilização da cisplatina é um fator de piora auditiva2, 2. Em nosso estudo, apenas um paciente utilizou radioterapia na região craniana - e teve piora auditiva no ouvido próximo à área irradiada.
TABELA 1 - Histopatologia, dose da cisplatina e resultados audiométricos.
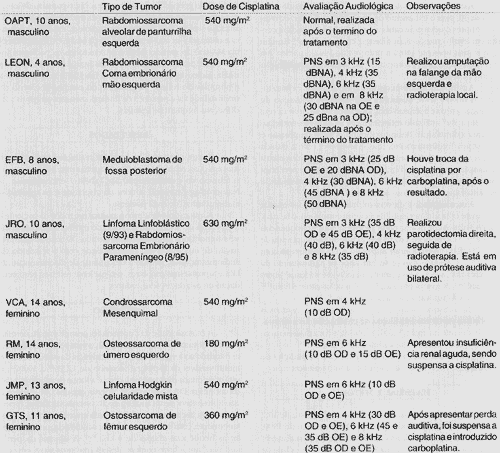
Legenda: PNS: perda neurossensorial; OE: ouvido esquerdo; OD: ouvido direito.
A audiometria tonal é o método mais comumente usado para o diagnóstico da ototoxicidade da cisplatina. Em crianças, a audiometria de reforço visual4, 15, a audiometria de tronco cerebral2, 4, 13 ou a utilização das emissões otoacústicas13, 18 podem ser utilizadas para a detecção da ototoxicidade. A audiometria de alta freqüência é um método muito eficaz para a detecção precoce da ototoxicidade induzida pela cisplatina5, 13, 24; pois, observa-se perda auditiva nas freqüências entre 12 e 20 kHz precocemente. A ASNA (American Speech-language Hearing Association)1 preconiza como método a avaliação dos pacientes com até 24 horas antes do início da utilização da cisplatina e 24 horas de cada dose, mas a freqüência pode variar na dependência das alterações encontradas.
CONCLUSÃOA cisplatina é um quimiterápico ototóxico e que produz perda auditiva simétrica, irreversível, principalmente nas altas freqüências. A avaliação prévia ao tratamento e antes de cada dose da droga é fundamental para o diagnóstico precoce da perda auditiva. A possibilidade de alteração da quimioterapia, quando ocorrem perdas importantes e principalmente nos limiares da fala, deve ser discutida pelo otorrinolaringologista. A utilização de próteses auditivas e o acompanhamento fonoaudiológico devem ser realizados o mais precocemente possível, principalmente em crianças na idade de aquisição de linguagem e escolar.
REFERÊNCIAS BIBLIOGRÁFICAS1. AMERICAN SPEECH-LANGUAGE-HEARING ASSOCIATION - Guidelines for the audiologic management of individuals receiving cocheotoxic drug therapy. Asha, 36- 11-19, 1994.
2. BARR-HAMITON, R. M.; MATHELSON, L. M.; KEAY, D. G. Ototoxicity of cis-platinun and its relationship to eye color. J Laryngol Otol., 105- 7-11, 1991.
3. BLAKLEY, B. W.; GUPTA, A. K.; MYRES, S. F.; SCHWAN, S. - Risk factors for ototoxicity due to cisplatin. Arch Otolaryngol Head Neck Surg., 120: 541-6, 1994.
4. BROCK, P. R.; BELLMAN, S. C.; YELMANS, E. C.; PINKERTON, C. R.; PRICHARD, J. - Cisplatin ototoxicity in children: a practical grading system. Med Pediatric Oncol.; 19: 292-300, 1991.
5. DRESCHLER, W. A.; HULST, R. J.; TANGE, R. A.; URBANUS, N. A. - The role of high-frequency audiometry in early detection of ototocity. Audiology, 24: 387-95, 1985.
6. FAUSTI, S. A.; HENRY, J. A.; SCHAFFER, H. L; OSLON, D. J.; FREY, R. H.; BAGBY, G. C. JR. - High frequency monitoring for early detection of cisplatin ototoxicity. Arch Otolaryngol Head Neck, 119: 661-6, 1993.
7. FAUSTI, S. A.; SCHECHTER, M. A.; RAPPAPORT, B. Z.; FREY, R. H.; MASS, R. E. - Early detection of cisplatin ototoxicity. Câncer, 53: 224-31, 1984.
8. HELSON, L.; OKONKWO, E.; ANTON, L.; CVITKOVIC, E. Cis-platinun ototoxicity. Clinical Toxicology; 13: 469-478, 1978.
9. HINOJOSA, R.; RIGGS, L. C.; STRAUSS, M.; MATZ, G. J. Temporal bone histopathology of cisplatin ototoxicity. Am J Otol., 16: 731-40, 1995.
10. KALAMAR, P.; FREEMAN, A. L; HIGBY, D. J.; WALLACE, H. J. JR.; SINKS, L. F. - Clinical response and toxicity with cisdichlorodiammineplatinun (II) in children. Cancer Treat Rep., 61: 835-9, 1997.
11. KOMUNE, S.; ASAKUMA, S.; SNOW, J. B. JR. - Pathophysilogy, of the ototoxicity of cisdiammindichoroplatinun. Otolaryngol Head Neck Surg., 89: 275-82, 1981.
12. KOPELMAM, J.; BUDNICK, A. S.; SESSIONS, R. B.; KRAMER, M. B.; WONG, G. Y. - Ototoxicity of high-dose cisplatin by bolus administration in patients with advanced cancers and normal hearing. Laryngoscope, 98: 858-64, 1988.
13. KRETSCHMAR C. S.; WARREN, M. P.; LAVALLY, B. L.; TARDELL, N. J. - Ototoxicity of preradiation cisplatin for children with central nervous system tumors. J Clin Oncol, 8: 1191-8, 1990.
14. LIPPMAN, A. J.; HELSON, C.; HELSON, L. - Clinical trials of Cisdiamminedichloroplatinun (NSH-119875). Cancer chemother Rep., 57: 191-200, 1974.
15. MIETTINEN, S.; LAURIKAINEN, E.; JOHANSSON, R.; MINN, H.; LAURELL, G.; SALMI, T. T. - Radiotherapy enhanced ototoxicity of cisplatin in children. Acta Otolaryngol (Stoch),
supl 529: 90-4, 1997.
16. PASIC, T. R. & DOBIE, R. A. - Cis-platinun ototoxicity in children. Laryngoscope, 101: 985-91, 1991.
17. PIEL, I. J.; MEYER, D.; PERLIA, C. P.; WOLFE, V. I. - Effects of cis-diamminedichloroplatinun on hearing function in man. Cancer chemother Rep., 58, 871-5, 1974.
18. PLINKERT, P. K. & KROBER, S. - Früherkennung einer cisplatin ototoxizität durch evozierte otoakustishe emissionen. Laryngorhinootologie, 70: 457-62, 1991.
19. REDDEL, R. R.; KEFFORD, R. F.; GRANT, J. M.; COATES, A. S.; FOX, R.M.; TATTERSALL, M.H. - Ototoxicity in patients receiving cisplatin: importance of dose and method of drug administration. Cancer Treat Rep., 66.- 19-23, 1982.
20. ROSENBERG, B.; VANCAMP, L.; KRQAS, T. - Inhibition of cell division in Escherichia Coli by eletrolisis products from a platinun eletrode. Nature, 205: 689-9, 1965.
21. SCHELL, M. J.; MCHANEY, V. A.; GREEN, A. A.; KUN, L. E.; HAYES, F. A.; HOROWITS, M.; MEYER, W. H. - Hearing loss in children and young adults receiving cisplatin with or without prior cranial irradiation. J Clin Oncol., 7: 754-60, 1989.
22. SCHWEITER, V. G. - Ototoxicity of chemotherapeutic agents. Otolaryngol Clin North Am., 26: 759-89, 1993.
23. STRAUSS, M.; TOWFIGHI, J.LIPTON, A.; BROWN, B.; LORD, S.; HARVEY, H. A. - Cis-platinunn ototoxicity: clinical experience and temporal bone histopathology. Laryngoscope; 93: 1554-9, 1983.
24. ZOROWBA, P. G.; SCHIMITT, H. J.; GUTJAHR, P. - Evoked otoacoustic emissions and pure tone threshold audiometry in patients receiving cisplatinun therapy. Int. J. Pediatr Otorhinolaryngol.; 25: 73-80, 1993.
* Mestre e Doutorando em Otorrinolaringologia pela Faculdade de Ciências Médicas de São Paulo.
** Mestre em Fonoaudiologia pela Pontifícia Universidade Católica de São Paulo.
*** Auxiliar de Ensino da Faculdade de Ciências Médicas e Biológicas da Pontifícia Universidade Católica de São Paulo.
**** Professor Titular da Disciplina de Otorrinolaringologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
Endereço para correspondência: Godofredo Campos Borges - Rua Francisco Ferreira Leão, 183 - 18040-330 Sorocaba/SP - Telefone: (0xx15) 222-2657 - Fax: 222-3899.
E-mail: gcborges@uol.com.br
Artigo recebido em 14 de setembro de 2000. Artigo aceito em 9 de fevereiro de 2001.


