INTRODUÇÃOO implante coclear (IC) multicanal é um recurso altamente benéfico e efetivo para a (re)habilitação de indivíduos com deficiência auditiva neurossensorial de graus severo e profundo. O IC é formado por componentes externos e internos. Os componentes externos são o microfone, o processador de fala e a antena transmissora. Dentre os componentes internos estão: o receptor-estimulador, o qual inclui a antena interna, colocado cirurgicamente junto ao osso do crânio, atrás da orelha, sob a pele e o feixe de eletrodos, o qual é posicionado dentro da cóclea. O IC substitui parcialmente as funções da cóclea, transformando a energia sonora em sinais elétricos. A sobrevivência de estruturas neurais em quantidade suficiente no nervo coclear permite que esta estimulação elétrica seja transmitida para o córtex cerebral.
Um fator importante com relação ao IC é que a quantidade de corrente necessária para eliciar uma sensação auditiva é diferente para cada indivíduo e para cada canal de estimulação. Desta forma, os parâmetros de estimulação elétrica, no processador de fala, devem ser ajustados individualmente para adequarem-se às necessidades dos usuários. Isto é feito por meio de um processo denominado "mapeamento". Quanto mais acurado for o mapeamento, maior o potencial para o paciente atingir resultados de percepção da fala em conjunto aberto1,2. O mapeamento é realizado por um fonoaudiólogo, por meio da utilização de um sistema de programação formado por um computador (PC) conectado a uma interface específica que, por sua vez, é conectada ao processador de fala por intermédio de um cabo. Pela utilização do software de programação o fonoaudiólogo pode acessar a interface e enviar os sinais, em níveis precisamente determinados, para o processador de fala e, então, para o paciente3.
O procedimento comum na programação dos implantes cocleares é a determinação da área dinâmica para estimulação elétrica. A área dinâmica é a região compreendida entre a quantidade de corrente que primeiramente induz uma sensação auditiva, isto é, o limiar para a estimulação elétrica (nível-T) e o nível de sensação de intensidade máxima que o paciente irá aceitar para a estimulação elétrica (nível-C). Isto é feito para que o IC seja programado dentro de uma extensão da loudness que permita que os sons de fala e outros sons sejam audíveis mas não desconfortáveis4.
A área dinâmica é determinada por meio de medidas psicofisicas e a facilidade com o qual o fonoaudiólogo irá obter estes níveis varia de acordo com uma série de fatores como a idade cronológica, condições mentais, tempo de surdez e outras condições de desenvolvimento do paciente2. Em crianças pequenas ou indivíduos com outros comprometimentos associados, a obtenção da área dinâmica faz parte de um longo e complicado processo, principalmente nos períodos iniciais de uso do IC. A limitada experiência auditiva que estes indivíduos tiveram antes da cirurgia do implante coclear, bem como a imaturidade cognitiva e lingüística para executarem os procedimentos necessários faz com que as respostas obtidas sejam muitas vezes inconsistentes. Embora técnicas de condicionamento e observação comportamental possam ser utilizadas para a obtenção dos níveis T e C, infelizmente, para uma parte da população, estes valores não são obtidos de maneira fidedigna. Como resultado, estes níveis são muitas vezes ajustados arbitrariamente.
Recentes melhoras na tecnologia do implante coclear e os resultados de reconhecimento da fala vastamente comprovados têm levado a uma expansão nos critérios para seleção de candidatos à cirurgia de implante coclear, tanto no que se refere ao critério audiológico como à idade cirúrgica. Recentemente, crianças a partir de 12 meses de idade têm sido implantadas. Estudos mostram que crianças com deficiência auditiva congênita que foram implantadas precocemente obtêm melhores resultados de reconhecimento de fala5,6.
A diminuição da idade cirúrgica faz emergir a necessidade de medidas objetivas com a finalidade de estimar os níveis psicofísicos de estimulação elétrica adequados para programar o processador de fala. Estudos têm sido feitos com os potenciais de tronco cerebral evocados eletricamente (EABR) registrados em indivíduos implantados a fim de correlacionar os limiares destes potenciais com os níveis T e C7,8. O registro do EABR requer o uso de eletrodos de superfície e pode ser facilmente contaminado por artefatos da atividade muscular ou interferência elétrica externa. Devido a isto, é difícil obter estes registros em crianças pequenas que não estejam sedadas ou em estado de sono profundo ou em ambientes que não sejam preparados para estarem livres de interferência.
O reflexo estapediano têm sido também medido em resposta ao estímulo elétrico na cóclea por meio de observação direta da contração do músculo estapédio no ato cirúrgico ou pelo uso de medidas padrões da impedância acústica no ouvido contra-lateral ao ouvido implantado. Os limiares do reflexo estapediano evocados eletricamente podem ser utilizados para estimar o nível C, porém existe muita variabilidade nestas medidas tanto intra como inter-sujeitos. Além disto, estes reflexos não são registrados em aproximadamente 40% da população9,10.
Uma maneira mais direta de medir a função do nervo coclear é o potencial de ação composto eletricamente evocado (Eletrically Evoked Compound Action Potential - ECAP). O ECAP reflete o disparo sincronizado das fibras do nervo coclear e é de muitas formas semelhante à onda I encontrada no EABR, ocorrendo em uma latência menor que 0.5 ms11. Em humanos, originariamente estas medidas podiam ser feitas apenas intra-operatoriamente ou por intermédio de implantes cocleares que utilizassem estimulação percutânea.
A Telemetria de Respostas Neurais (Neural Response Telemetry - NRT) é uma nova técnica que permite a medida direta do ECAP intra ou pós operatoriamente em pacientes implantados. Atualmente somente o sistema de implante coclear multicanal Nucleus 24 (Cochlear Co.) apresenta este método, mas estima-se que no futuro outros fabricantes de implantes cocleares adicionarão esta capacidade em seus implantes12. As medidas feitas pela NRT não requerem equipamentos adicionais além dos que são utilizados no processo de mapeamento, não necessitam sedação, requerem pouca promediação e são obtidas em aproximadamente 80% dos indivíduos avaliados.
A técnica da NRT pode constituir uma ferramenta valiosa na confirmação da integridade do dispositivo interno, na determinação objetiva de quais eletrodos podem ser incluídos em um determinado mapa, das melhores velocidades de estimulação e estratégias de codificação da fala, bem como na estimativa dos níveis T e C, o que seria de extrema importância clínica12.
O objetivo deste artigo é descrever a técnica da telemetria de respostas neurais e algumas de suas aplicações clínicas e de pesquisa na área dos implantes cocleares.
REVISÃO DE LITERATURAO sistema de IC Nucleus 24 possui três sistemas de telemetria: um sistema é utilizado para medir a impedância de eletrodos individuais dentro do implante, outro sistema é utilizado para monitorar a compliância dos geradores de corrente do IC e o terceiro sistema é o da telemetria de respostas neurais (NRT)13.
O sistema de medição da NRT consiste dos seguintes elementos: (1) computador com sistema Windows 3.11 ou Windows 95, que seja compatível com o software WinDPS; (2) software NRT versão 2.04 ou superior; (3) interface de programação; (4) processador de fala e headset SPrint; (6) implante Nucleus 24. O software do NRT foi desenvolvido pelo departamento de engenharia da Cochlear Corporation em parceria com Abbas e Brown da Universidade de Iowa e escrito por Dillier e colaboradores em Zurique, Suíça12.
A Figura 1 demonstra como o sistema da NRT funciona. Um computador equipado com uma interface de programação é utilizado para estimular eletrodos específicos dentro da cóclea. Uma série pulsos de rádio freqüência são transmitidos da interface do processador de fala SPrint para o receptor-estimulador interno, através da pele. Este código em rádio freqüência controla os parâmetros de estimulação utilizados para evocar o ECAP. O receptor-estimulador interno do IC Nucleus 24 é equipado com um amplificador e um conversor analógico-digital. Estes componentes adicionais permitem que a voltagem registrada em um par de eletrodos intracocleares seja amplificada, amostrada e transmitida de volta para a antena externa e, posteriormente, para a interface de programação. Estas voltagens são analisadas e a onda do ECAP resultante é mostrada em uma tela e pode ser armazenada no computador. Não são necessários eletrodos de superfície para fazer o registro13,14.
O sistema da NRT permite a estimulação e registro em qualquer par de eletrodos, nos modos monopolar ou bipolar. Normalmente, o modo monopolar é utilizado. Os pulsos de estimulação são apresentados para um eletrodo intracoclear específico que tem como referência o eletrodo extracoclear MP1, posicionado abaixo do retalho do músculo temporal. Outro eletrodo intracoclear situado na vizinhança é utilizado como eletrodo de registro, tendo como referência outro eletrodo extracoclear (MP2), situado no receptor-estimulador. Geralmente, o eletrodo intracoclear utilizado para registro do ECAP está localizado aproximadamente 1.5 mm mais apical (espaço de dois eletrodos) em relação à posição do eletrodo de estimulação. Por exemplo, se o eletrodo de estimulação selecionado for o 5, o eletrodo de registro será o 7. O par de eletrodos ativo e referência utilizados para a estimulação deve ser diferente do par de eletrodos utilizados para o registro, a fim de reduzir o artefato. Eletrodos com valores de impedância altas ou eletrodos que estejam fora da compliância não devem ser utilizados para as medições11,14,15.
O ECAP é caracterizado por um único pico negativo (N1), que ocorre em uma latência de, aproximadamente, 0.2 a 0.4 ms relativo ao início da estimulação. Este pico negativo é seguido por um pico positivo (P2). A amplitude do ECAP é medida entre os picos N1 e P2 (Figura 2). Embora estas amplitudes variem com o nível de estimulação, com a posição dos eletrodos e entre sujeitos, elas podem atingir valores de centenas de µV.
O estímulo utilizado para evocar o ECAP é uma corrente bifásica de 25µs/fase apresentada em uma razão de estimulação de 400Hz, porém velocidades de 80 Hz ou 250 Hz são geralmente recomendadas15. O sistema foi desenvolvido para registrar uma série de 16 amostras após cada pulso de estímulo e a razão de amostragem máxima é de 10 kHz. O ganho do amplificador interno pode ser ajustado para 40, 60 ou 80 dB, sendo recomendado 60 dB como padrão. A saída do amplificador é amostrada e transmitida para a antena externa como 16 pares de pulsos. O tempo entre os pares de pulso carrega a informação de voltagem e é limitado entre oito e nove bits de resolução13. Pelo fato do ECAP ser registrado dentro da cóclea é necessária pouca promediação, sendo normalmente utilizadas de 100 a 200 varreduras. A resposta também não é afetada pelo artefato muscular, podendo ser registrada sem que haja necessidade de sedação. A desvantagem deste procedimento é que o artefato do estímulo elétrico, muito maior em magnitude do que a resposta neural, é registrado juntamente com ela. Desta forma a separação da resposta neural do artefato do estímulo torna-se imprescindível16,17.
O método da subtração18,19 se vale das propriedades refratárias do nervo coclear para a para redução do artefato na NRT. O potencial de ação em uma fibra nervosa é seguido por um breve período de diminuição da excitabilidade, ou período refratário, o qual pode ser dividido em duas fases: absoluto e relativo. O período refratário absoluto ocorre imediatamente após o potencial de ação. Durante este período é impossível excitar novamente a célula, não importa o quão grande seja a magnitude do estímulo aplicado20,21.
De modo geral, a técnica de subtração requer que dois pulsos de corrente bifásica, um estímulo "prova" e um estímulo "mascarador", sejam apresentados em uma velocidade e nível suficiente para levar o nervo ao período refratário e, desta forma, ser possível subtrair a resposta neural do artefato gerado pelo estímulo. O paradigma da subtração envolve os seguintes intervalos de estimulação (Figura 3).
a) apenas o estímulo ("prova") é apresentado, resultando em um registro que consiste tanto da resposta neural como do artefato gerado pelo estímulo.
b) apresentação do estímulo mascarador seguido, após um curto intervalo de tempo (denominado intervalo inter-pulso - IPI), do mesmo estímulo "prova" utilizado anteriormente. Um IPI de 0.3 a 0.5 ms é adequado para assegurar o paradigma de subtração22. Supõe-se que se o intervalo entre o mascarador e o estímulo prova for suficientemente curto os neurônios que normalmente disparariam ao estímulo prova estarão no período refratário absoluto pelo fato de já terem disparado frente ao estímulo mascarador. Isto produz um registro que contém a resposta neural e o artefato advindos da apresentação do mascarador bem como apenas o artefato, advindo da apresentação do estímulo "prova".
c) O estímulo mascarador e o "prova" são apresentados novamente, porém o estímulo "prova" está ajustado em um nível mínimo o que, efetivamente, resulta na condição de apresentação apenas do mascarador. O registro correspondente contém o artefato advindo do mascarador e a resposta neural.
Subtraindo-se "C" de "B" têm-se apenas o artefato, gerado pela apresentação do estímulo "prova". Subtraindo este artefato da condição "A", têm-se a resposta neural gerada pelo estímulo "prova". Um outro artefato é produzido toda vez que o amplificador utilizado na medição é ligado. Este artefato é registrado em um quarto intervalo:
d) apresentação dos estímulos mascarador e "prova" em amplitudes mínimas e, portanto, não contribuindo para gerar artefatos. Este artefato do amplificador será é subtraído dos outros registros.
Resumindo, a resposta neural será igual a: A - (B- (C - D)).
Não é possível saber de antemão qual nível do estímulo mascarador que será suficiente em uma dada mensuração. Contudo, a apresentação do mascarador com uma amplitude igual ou maior do que a do estímulo prova aumenta a probabilidade de que o mascaramento seja suficiente13.
O nível de apresentação do estímulo mascarador e prova devem ser suficientemente elevados de modo a permitir uma resposta neural mensurável, mas também é imperativo que a estimulação não exceda o limite de tolerância (nível máximo aceitável - NMA) do indivíduo. O NMA representa o limite superior de estimulação para fazer os registros e não deve ser ultrapassado15.
Existem vários parâmetros que precisam ser selecionados quando da utilização da telemetria de respostas neurais para registro do ECAP. A manipulação destes parâmetros afeta a resposta obtida e, portanto, é determinante que os mesmos sejam ajustados adequadamente, de acordo com o objetivo que se quer atingir. É sugerido ao leitor a consulta aos artigos originais12,13,15,17,23 para verificar os protocolos propostos para otimização e registro do ECAP. Os parâmetros que estão sendo utilizados em uma dada mensuração podem ser visualizados durante todo o teste (Figura 4, painel A).
Curvas de crescimento da amplitude:
A latência das respostas eletricamente evocadas não sofrem muita alteração em função do nível de apresentação do estímulo. Assim, a amplitude da onda é geralmente utilizada para quantificar o ECAP. Por meio da diminuição gradativa do estímulo prova é possível determinar o limiar e curvas de crescimento da amplitude do ECAP15 (Figura 4, painel B).
As amplitudes das respostas podem ser determinadas utilizando o recurso denominado "marcador de picos" (peak-peaker) existente no software NRT. Por meio deste recurso o software demarca, para cada curva, onde ocorreram as amplitudes mínimas e máximas. A demarcação é indicada por cursores e pode ser visualizada em um gráfico de amplitude em função do tempo (Figura 4, painel D).
Os valores das amplitudes da resposta para cada um dos diferentes níveis do estímulo prova são registrados em um gráfico. Uma linha de regressão linear é traçada utilizando o algoritmo presente no software NRT (Figura 4, painel C). O ponto de interseção entre esta linha e o eixo das abcissas mostra o valor do limiar extrapolado, denominado "pNRT"12. O limiar do ECAP também pode ser determinado visualmente.
Estudos conduzidos registrando o ECAP em implantados, no período pré ou pós cirúrgico, demonstram que existem variações tanto do limiar quanto da curva de crescimento da amplitude entre sujeitos e entre eletrodos em um mesmo sujeito14,24. Isto sugere que tais medidas podem ser indicativas do limiar e distribuição espacial da população neural sobrevivente que está sendo afetada por cada eletrodo.
Investigações realizadas mostraram que, para a maioria dos indivíduos, os limiares do ECAP são obtidos em valores próximos ao nível C obtido no mapeamento12,17,28,23. No entanto, existe variabilidade destes resultados entre sujeitos e entre eletrodos para um mesmo sujeito. Correlações dos limiares do ECAP com os níveis T e C foram encontradas no caso de crianças17. De modo geral, os estudos concluíram que os limiares do ECAP obtidos pela NRT podem servir como base para ajustar os níveis de conforto dos mapas, sendo também sugerido a utilização da NRT em conjunto com medidas comportamentais obtidas em apenas um eletrodo, a fim de facilitar a programação do processador de fala23.
Curvas de recuperação
A habilidade das fibras do nervo coclear em transmitir a informação temporal acuradamente pode afetar a performance com o uso do implante. Uma maneira de avaliar a capacidade de processamento temporal de um usuário de implante coclear é medir as propriedades refratárias do nervo coclear. Estas propriedades referem-se ao efeito que um estímulo tem na resposta de um estímulo subseqüente e podem ser de particular importância na determinação da habilidade dos neurônios de reproduzirem padrões temporais complexos de estímulos necessários para codificar a fala24.
As propriedades refratárias podem ser medidas por meio da NRT utilizando a técnica de subtração. Neste caso, os estímulos prova e mascarador são mantidos fixos em um nível supraliminar e o intervalo inter-pulso (IPI) é variado. A variação do IPI permite analisar os efeitos que variações de propriedades temporais do estímulo exercem sobre o ECAP, sendo estabelecidas então as chamadas "curvas de recuperação". Conforme o IPI é aumentado, existe mais tempo após o sinal mascarador para que os neurônios saiam do período refratário e respondam ao estímulo prova, nos intervalos utilizados no paradigma de subtração. A conseqüência disto é que a amplitude das respostas subtraídas irão diminuir conforme aumenta-se o intervalo inter-pulso.
Estudos iniciais demonstram heterogeneidade das curvas de recuperação, tanto entre sujeitos como entre eletrodos em um mesmo sujeito14,18. Outras pesquisas são necessárias a fim de relacionar estes dados com a performance de sujeitos implantados.
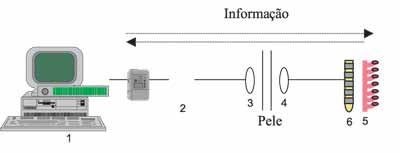
Figura 1: Representação esquemática de como o ECAP pode ser medido pela técnica da telemetria de respostas neurais no sistema de implante coclear Nucleus 24: (1) computador e interface de programação; (2) processador de fala; (3) antena externa; (4) receptor-estimulador; (5) feixe de eletrodos e (6) nervo coclear.
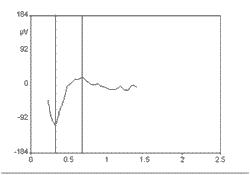
Figura 2: Representação do ECAP medido pela técnica da telemetria de respostas neurais.
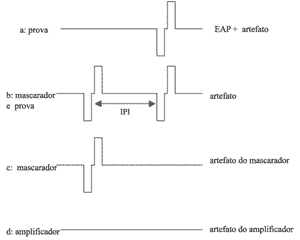
Figura 3: Intervalos utilizados no paradigma da subtração.
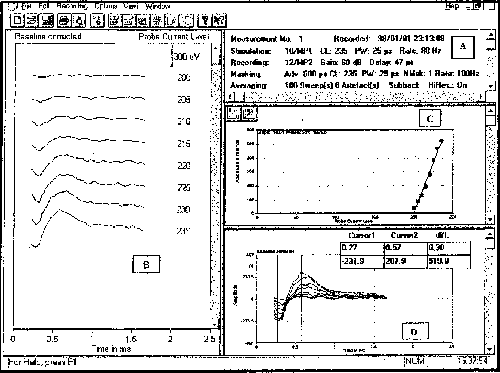
Figura 4: Painel A: Parâmetros de estimulação e registro utilizados para medida do ECAP no eletrodo 10 e nível de estimulação igual a 235. Painel B: Diferentes amplitudes do ECAP obtidas com a variação do estímulo prova. Painel C: Gráfico das amplitudes do ECAP em função dos níveis do estímulo prova e a curva de regressão fornecida pelo software NRT. Painel D: Resposta do ECAP para o nível de estimulação de 235, com os cursores posicionados pelo software NRT, v. 2.04.
Os implantes cocleares possuem diferentes números e posicionamento dos eletrodos intra-cocleares e permitem que parâmetros selecionados sejam ajustados em cada eletrodo de maneira específica. Com a expansão dos critérios de seleção a utilização de medidas objetivas para auxiliar a programação do processador de fala torna-se desejável.
Além disto, a obtenção de dados relacionados à permeabilidade do nervo coclear à estimulação elétrica e a maneira com a qual alguns parâmetros de estimulação elétrica interagem com as estruturas neurais sobreviventes ainda constituem um desafio para os profissionais que atuam em um programa de implante coclear. A determinação dos elementos neurais estimuláveis que existem nos diferentes processos patológicos da cóclea também seria de grande utilidade já que se supõe que a sobrevivência de células ganglionares ou outros elementos neurais possa ser uma das causas para a variabilidade com relação à performance de reconhecimento da fala encontrada entre os indivíduos implantados.
A telemetria de respostas neurais pode constituir um método mais vantajoso para o estudo destas questões pois13,14,16,18,24:
· o ECAP é a medida mais direta da função do nervo coclear em humanos e, como tal, pode ser eficaz para analisar alterações na resposta do sistema auditivo decorrente de perdas auditivas periféricas, bem como o padrão de estimulação do nervo coclear e como este varia entre indivíduos e entre locais de estimulação ao longo da cóclea;
· o registro feito por eletrodos intracocleares permite a captação de respostas com amplitudes maiores do que aquelas registradas por eletrodos de superfície, o que diminui o número de varreduras necessárias para a coleta dos dados, tornando o procedimento mais rápido e eficiente. Além disto, pequenas atividades musculares não contaminam os registros, não sendo necessário sedação, o que torna a medida mais fácil de ser utilizada em crianças;
· o ECAP tem um tempo de latência relativamente curto o que permite verificar as alterações obtidas nesta resposta frente às altas velocidades de estimulação que são utilizadas nos processadores de fala atuais.
Por outro lado, esta medida apresenta algumas restrições. Por exemplo, o ECAP não reflete as alterações que ocorrem ao nível do sistema nervoso central como resultado de perdas auditivas periféricas ou como resultado da estimulação elétrica subseqüente. Para avaliar estas e outras questões concernentes a funções de processamento superiores, faz-se necessário a utilização de outras medidas eletrofisiológicas, como os potenciais mais tardios.
COMENTÁRIOS FINAISA telemetria de respostas neurais é uma nova técnica que permite o registro do potencial de ação composto eletricamente evocado peri ou pós operatoriamente em usuários do sistema de implante coclear Nucleus 24. Diversos centros de pesquisa estão estudando a utilidade deste procedimento para estimar os limiares e níveis de conforto para estimulação elétrica utilizados na programação do processador de fala. Outras pesquisas são necessárias para entender como estas medidas podem auxiliar no estudo das propriedades das estruturas sobreviventes do nervo coclear.
REFERÊNCIAS BIBLIOGRÁFICAS 1. Rance G, Dowell RC. Speech processor programming. In: Clark GM, Cowan RSC, Dowell RC. (eds.) Cochlear implantation for infants and children-advances. San Diego: Singular Publishing; 1997. p.147-70.
2. Shapiro W. Device programming. In: Waltzman SB, Cohen NL. (eds). Cochlear implants. New York: Thieme; 2000. p.185-98.
3. Bevilacqua MC, Moret ALM. Reabilitação e implante coclear. In: Lopes Filho O. (ed.). Tratado de fonoaudiologia. São Paulo: Roca; 1997. p. 401-14.
4. Roberts S. Speech-processor fitting for cochlear implants. In: Cooper H (ed.) Cochlear implants: a practical guide. London: Whurr Publishers; 1991. p.201-18.
5. Bevilacqua MC. Implante coclear multicanal: uma alternativa na habilitação de crianças surdas. Bauru; 1998. 115p. (Tese de Livre Docência - Faculdade de Odontologia de Bauru Universidade de São Paulo).
6. Tyler RS, Fryauf-Bertschy H, Kelsay DM, Gantz BJ, Wooodworth GP, Parkinson A. Speech perception by prelingually deaf children using cochlear implants. Otolaryngol Head Neck Surg 1997; 117:180-7.
7. Fria TJ, Shallop JK. Application of evoked potential audiometry to children with cochlear implants. In: Owens E, Kessler DK. Cochlear implants in young deaf children. Boston: College-Hill; 1989. p. 71-80.
8. Hodges AV, Ruth RA, Lambert PR, Balkany TJ. Eletric auditory brain-stem responses in nucleus multichannel cochlear implant users. Arch Otolaryngol Head Neck Surg 1994; 120:1093-99.
9. Spivak LG, Chute PM. The relationship between eletrical acoustic reflex thresholds and behavioral confort levels in children and adult cochlear implant patients. Ear Hear 1994; 15:184-92.
10. Spivak LG, Chute PM, Popp AL, Parisier SC. Programming the cochlear implant based on electrical acoustic reflex thresholds: patient performance. Laryngoscope 1994; 104:1225-30.
11. Shallop JK. Objective measures and the audiological management of cochlear implant patients. In: Alford BR, Jerger J, Jenkins HA. Electrophysiologic evaluation in otolaryngology. Basel: Karger; 1997. p.84-111.
12. Shallop JK, Facer GW, Peterson A. Neural response telemetry with the Nucleus CI24M cochler implant. Laryngoscope 1999; 109:1755-9.
13. Abbas P, Brown C. Electrophysiology and device telemetry. In: Waltzman SB, Cohen NL. (eds.). Cochlear implants. New York: Thieme; 2000. p.117-51.
14. Brown CJ, Abbas PJ, Gantz BJ. Preliminary experience with neural response telemetry in the Nucleus CI24M cochlear implant. Am J Otol 1998; 19:320-7.
15. Lai W. An NRT cookbook: guidelines for making NRT measurements. Zurich: Cochlear AG; 1999. 32p.
16. Abbas PJ, Brown CJ, Shallop JK, Firzt JB, Hughes ML, Hong SH, Staller SJ. Summary of results using the Nucleus CI24M implant to record the eletrically evoked compound action potential. Ear Hear 1999; 20: 45-59.
17. Hughes ML, Brown CJ, Abbas PJ, Gantz BJ. Using electrically evoked compound action potential thresholds to facilitate creating MAPs for children with the Nucleus CI24M. Adv Otorhinolaryngol 2000; 57:260-5.
18. Brown CJ, Abbas PJ. Eletrically evoked whole-nerve action potentials: parametric data from the cat. J Acoust Soc Am 1990; 88:2205-10.
19. Sauvage CR De, Cazals Y, Erre JP, Aran JM. Acoustically derived auditory nerve action potential evoked by eletrical stimulation: an estimation of the waveform of single unit contribution. J Acoust Soc Am 1983; 73:616-27.
20. Bear MF, Connors BW, Paradiso MA. Neuroscience: exploring the brain 2. Baltimore: Williams & Wilkins; 1996. p. 855.
21. Kandel ER, Schwartz JH, Jessel TM. Principles of neural science. 4.ed. New York: McGraw-Hill; 2000. 1414p.
22. Miller CA, Abbas PJ, Brown CJ. An improved method of reducing stimulus artefact in the electrically evoked whole-nerve potential. Ear Hear 2000; 21:280-90.
23. Hughes ML, Brown CJ, Abbas PJ, Wolaver AA, Gervais JP. Comparison of EAP thresholds wit MAP levels in the nucleus 24 cochlear implant: data from children. Ear Hear 2000; 21:164-74.
24. Gantz BJ, Brown CJ, Abbas PJ. Intraoperative measures of eletrically evoked auditory nerve compound action potential. Am J Otol 1994; 15:137-44.
1 Professora do Departamento de Fonoaudiologia FOB-USP; Fonoaudióloga do CPA-HRAC-USP Bauru -SP;
Doutoranda em Neurociências e Comportamento, IP -USP, São Paulo.
2 Médico do Hospital de Reabilitação de Anomalias Craniofaciais (HRAC) da USP e Professor Livre Docente do Departamento de Fonoaudiologia da Faculdade de Odontologia de Bauru (FOB) da USP, Bauru-SP.
3 Professora Livre Docente e Chefe do Departamento de Fonoaudiologia da FOB-USP, Fonoaudióloga do HRAC-USP; Bauru-SP.
4 Professor do Departamento de Patologia e do Laboratório de Neurocirurgia Funcional da Faculdade de Medicina da Universidade de São Paulo, São Paulo.
Instituição: Centro de Pesquisas Audiológicas do Hospital de Reabilitação das Anomalias Craniofaciais da Universidade de São Paulo, Bauru-SP.
Apoio financeiro: Conselho Nacional para o Desenvolvimento Científico e Tecnológico (CNPq).
Endereço para Correspondência: Deborah Ferrari - Al. Otavio Pinheiro Brizola 9-75 Vila Universitária Bauru SP 17043-900.
Tel (0xx14)235 8332 - Fax (0xx14)234 2280 - E-mail: dferrari@fob.usp.br
Artigo recebido em 26 de março de 2003. Artigo aceito em 30 de outubro de 2003.


