INTRODUÇÃOIsolamento de Células Chiadas em Cultura
Nos últimos anos apareceram técnicas de isolamento e manutenção de células ciliadas em meio de cultura, que têm possibilitado vários autores pesquisar o comportamento mecânico, elétrico e bioquímico destas células em diferentes condições de estimulação.
Esta técnica foi utilizada por Brownell (1984)', que a desenvolveu através de procedimentos rotineiros usados para se isolar fotorreceptores de vertebrados. Através dela, aplicando estímulos elétricos no meio de cultura, Brownell (1985)2 conseguiu provocar contrações mecânicas nas células ciliadas externas (CCE).
Kachar et al (1986)3 e Evans (1990)4 estudaram a mobilidade das respostas das CCE isoladas em meio de cultura, evocadas por correntes elétricas injetadas intra e extracelularmente, e ainda por aplicação iontoforética de acetilcolina.
Esta técnica também foi utilizada para se observar a mobilidade das CCE induzida por altas concentrações de potássio 5.6, por ATP e Cálcio7,8,9, e ainda para se estudar os efeitos de algumas drogas como o salicilato'° e quinino".
A maioria dos autores citados acima, utilizou a técnica de isolamento das CCE cocleares, para demonstrar que o sistema de CCE tinha a capacidade mecânica de contração que seria responsável pela existência de um mecanismo eletrobiomecânico na cóclea, que explicaria a amplificação coelear, a estimulação das células internas, assim como a acurada seletividade de freqüência da membrana basilar semelhante à das fibras do nervo auditivo'².
Amicacina
A Amicacina (BB-K8), aminoglicosídeo semi-sintético, é resultado da acetilação do 2-deoxiestriptamina, produto da Kanamicina. Esta modificação molecular criou um antibiótico de amplo espectro, ativo contra a maioria das espécies de Enterobacteriaceae e Pseudo mo nas, resistentes à Gentamicina e Kanamicina13,14.
Nefrotoxieidade e ototoxicidade são os maiores fatores limitantes no uso clínico desta droga.
Muitos estudos clínicos da Amicacina no homem, têm revelado que a mesma pode produzir alterações que provocam zumbidos, discreta perda auditiva para freqüências altas e mais raramente alterações vestibulares. Conseqüentemente, a ototoxicidade experimental de Amicacina tem sido estudada em diferentes animais e sob diferentes condições15,16,17,18.
Estudos histológicos, utilizando-se técnicas de preparações de superfície, microscopia eletrônica de varredura e de transmissão, têm sido realizados, detectando-se alterações estruturais no órgão de Corti de cobaias tratadas com Amicacina19,20,21,22.
Gangliosideos Corticais Cerebrais (GCC)
São esfingolipídeos hidrosolúveis encontrados em alta concentração nas células ganglionares do sistema nervoso central. Estão presentes em estruturas neuronais responsáveis pela condução nervosa (membrana de mielina), atuando aparentemente nas sinapses onde permitiriam a transmissão de impulsos interneurais e nas placas mororas.
Questiona-se o real papel deste grupo de substâncias. Para Aporti et al (1977)23 eles têm um papel ativo na excitabilidade dos tecidos, participando de eventos que ocorrem na superfície das células, e atuam na recuperação funcional de nervos lesados, interferindo favoravelmente na velocidade de condução nervosa. Cita-se também participação importante como transportadores de íons ativos em células metabólicas altamente diferenciadas, como ascélulas nervosas e musculares24.
Alguns investigadores têm demonstrado que os GCC exercem um efeito protetor sobre as células ciliadas da cóclea contra agentes lesivos, como o ruído intenso 2,5 e antibióticos ototóxlcos24.
OBJETIVOSEssa pesquisa foi desenvolvida visando os seguintes objetivos:
1 - Padronizar e normatizar a técnica de isolamento das C.CE em meio de cultura.
2 - Estudar os tipos de alterações degenerativas e a viabilidade das células no meio de cultura após o isolamento.
3 - Detectar e caracterizar os tipo de lesões das CCE individuais vivas provocadas por antibiótico aminoglicosídeo ototóxico.
4 - Avaliar a validade do uso desta técnica para estudo da ototoxicidade de drogas.
5 - Analisar possível efeito protetor cios gangliosídeos contra a ototoxicidade.
Amicacina
MATERIAL E MÉTODOS1. Animais
Foram utilizados neste estudo experimental 24 cobaias albinas do Biotério da Faculdade de Medicina de Ribeirão Preto, pesando cerca de 400 a 500 g. No decorrer deste experimento as cobaias permaneceram no Laboratório de técnica cirúrgica e Cirurgia Experimental do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP). Todas as cobaias manifestaram reflexo de Preyer normal, indicando presença de boa acuidade auditiva.
2. Administração de drogas
As drogas utilizadas nesta pesquisa foram o antibiótico aminoglicosídeo amicacina (Novamin-Laboratório BristolMyers Squibb Brasil S/A) nas doses de 400 mg/kg/dia e o gangliosídeo cortical cerebral (Cronassial-Laboratórios Bíosintétiea Ltda.) na dose de 40 mg/kg/dia. A via de administração foi sempre a intramuscular, dosagem única diária, aplicada nas patas traseiras do animal. A cada 3 dias as cobaias foram pesadas e as doses reajustadas. O reflexo de Preyer foi avaliado diariamente.
As cobaias foram separadas inicialmente em três grandes grupos: I, II e III..
I: este grupo era composto de 8 cobaias e serviu como controle, não recebendo portanto qualquer droga.
II: também composto de 8 cobaias, foi tratado com Amicacina na dose de 400 mg/kg/dia, até que o reflexo de Preyer estivesse ausente, o que ocorreu após 12 a 14 dias. As cobaias foram então sacrificadas.
III: este grupo, também com 8 cobaias, recebeu a Amicacina na mesma dose do grupo anterior, associada a 4 mg/ kg/dia de gangliosídeo. As cobaias foram sacrificadas após o desaparecimento do reflexo de Preyer, o que ocorreu 12 a 14 dias após início do tratamento. As cobaias dos três grupos foram sacrificadas para estudo das CCE com a técnica proposta (Tabela I).
TABELA I Distribuição dos grupos de cobaias, conforme tratamento recebido
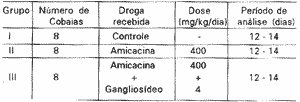

Figura 1. Equipamentos utilizados no isolamento e documentação das CEE.
3. Isolamento das células ciliadas externas cocleares de cada cobaia sacrificada
A) Material e manuseio do meio de cultura
O meio de cultura utilizado neste experimento foi "Hanks Balanced Salt Solution" (HBSS) tamponado em pH de 7,4, com osmolaridade ajustada a300 (+-1)m Osm. Composição do HBSS:
NaC1 147 mmol/1
KC1 2,7 mmol/1
KH2PO4 1,5 mmol/1
Na 2HPO4 x 7 H2O 8,1 mmol/1
CaC12 1,5 mmol/1
MgC12 1,5 mmol/1
C6H12O6 10 mmol/1
O meio de cultura, preparado no de células e tecidos do Departamento de Morfologia da FMRP-USP foi conservado em vidro borocilicado com tampa de baquelite autoclavável na geladeira. Sempre que usado, o procedimento de retirada de líquido para as placas de Petri foi feito em uma Capela de fluxo laminar horizontal, totalmente estéril, pertencente ao Banco de Olhos do HC-FMRP-USP. Todos os cuidados foram tomados para que não houvesse contaminação do meio.
B) Sacrifício da Cobaia
A cobaia foi inicialmente anestesiada utilizando-se éter como ínalador; após sua decapitação, os ossos temporais contendo as bulas foram removidos e os excessos de tecidos ao redor das bulas retirados. Com a ajuda de uma pinça hemostática curva delicada as bulas foram abertas, e ambas as cócleas mergulhadas em uma placa de petri com HBSS. Este procedimento foi realizado de uma forma bem rápida (8 a 10 min) para preservação adequada das células.
C) Microdissecção da Cóclea da Cobaia
Nestafase o experimento desenvolveu-se no Laboratório de estudos histológicos da estrutura coclear do Setor de Otorrinolaringologia da FMRP-USP.
Com a ajuda de um otomicroscópio DF Vasconcelos o osso circundante da cóclea foi retirado; em seguida, com um bisturi lâmina 1 1 a cóclea foi raspada delicadamente, tornando suas paredes mais finas; com um estilete de ponta curva delicado, as espiras da cóclea foram expostas, a estria vascular retirada e o modíolo dividido, separando-se as espiras apicais das basais. Utilizando-se um pipetador manual, as espiras apicais foram aspiradas e transferidas para um eppendorf com 400(gl) de HBBSS.
D) Isolamento das células ciliadas externas
As CCE foram isoladas das espiras por dissociação mecânica através de um micropipetador automático de 0-100 (gl) com ponteira de 1-100 (gl). Em seguida, 200 (gl) do líquido com as células foram aspirados do eppendorf e transferido para uma lâmina escavada para serem examinados.
As CCE isoladas foram estudadas e fotografadas com um fotomicroscópio Axioshop MC 100 Zeiss e suas imagens arquivadas em fitas de vídeo, usando-se um sistema de videocâmera (Câmera Panasonic WCL 110-Color CCTV com Drive Unit WV-PS10); Video e Monitor Broksonic acoplado ao Fotomicroscópio (Figura 1).
Análise Estatística
O teste empregado para análise estatística dos dados obtidos foi o teste não paramétrico de Mann Whitney26 usado para comparação de duas amostras independentes.
RESULTADOSEstudo da Viabilidade das CCE isoladas
As CCE isoladas, vivas, foram facilmente diferenciadas de outras células do órgão de Corti por sua morfologia específica. São alongadas, têm forma cilíndrica, núcleo globoso localizado excentricamente na extremidade sinápticadacélula; na extremidade apical existe a placa cutilar com estereocílios, nem sempre preservados. As membranas laterais exibem uma refringência típica de célula viva; seu citoplasma é homogêneo ou muitas vezes finamente granular, e apresenta uma densidade de organelas aumentada na região infranuclear. Grânulos de cromatina ficam dispersos no núcleo (Figura 2).
Os critérios utilizados para se considerara viabilidade das CCE isoladas foram: membrana íntegra, forma cilíndrica, núcleo na posição normal (pólo inferior), citoplasma homogêneo, em um estado de semitransparência com um alo na periferia.
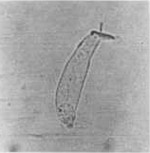
Figura 2. Aspecto normal da CCE viva isolada. Original 40x.
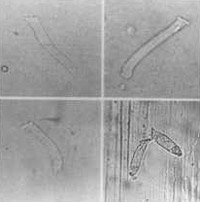
Figura 3. CCE isoladas, vivas e normais. Original 40x.
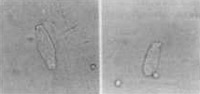
Figura 4. Tipo de degeneração celular após 3 horas em meio de cultura. Original 40x.
Na figura 3 visualizamos outros exemplos de CCE isoladas, vivas e normais.
Degeneração e durabilidade das CCE
Para avaliação da durabilidade das CCE procurou-se conservá-las em meio de cultura (HBSS) em lâmina escavada, dentro de uma placa de petri fechada e úmida. Desta forma manteve-se meio de cultura por mais 24 horas.
Noventa por cento das CCE conservaram suas características vitais ao final de 2 horas e meia; após 3 horas as células apresentavam inicialmente diferentes tipos de degeneração:
1. Células encurtadas e alargadas, com núcleo aparentemente normal (Figura 4).
2. Células discretamente alargadas, com núcleo aumentado e deslocado superiormente (Figura 5).
3. Células conservando seu comprimento, mas apresentando seu núcleo bastante aumentado, embora mantendo sua posição normal (Figura 6).
4. Células discretamente alargadas, núcleo normal, mas o citoplasma com vacúolos (Figura 7).
Ao final de 4 horas, apenas 10 a 20% das CCE permaneceram com suas características normais. Observouse que as mesmas foram gradualmente se alterando, com 6 horas elas se tornaram verdadeiras esferas, muitas já sem o núcleo (Figura 8). Este padrão se manteve por cerca de 24 horas.
Nas figuras 9, 10 e 11 ilustramos o padrão de degeneração apresentado por CCE cerca de 3 hora após serem isoladas.
Análise dos grupos de cobaias estudados
Grupo I
Grupo controle composto de 8 cobaias. Foram examinadas todas as CCE de ambas as cócleas de cada cobaia, observandose aspectos morfológicos e o número de células encontradas. As CCE isoladas normais de cada cobaia foram encontradas em uma média de 179 +-33 e uma mediana de 181. Poucas células com alterações foram observadas (Tabela II).

Figura 5. Tipo de degeneração celular após 3 horas em meio de cultura. Original 40x.

Figura 6. Tipo de degeneração celular após 3 horas em meio de cultura. Original 40x.
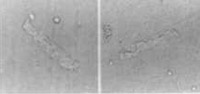
Figura 7. Tipo de degeneração celular após 3 horas em meio de cultura. Original 40x.

Figura 8. Estágio final de degeneração celular após 6 horas em meio de cultura. Original 40x.

Figura 9. CCE normais (A); as mesmas células após 3 horas em meio de cultura (B). Original 40x.
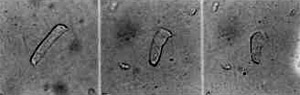
Figura 10. CCE normal (A); a mesma célula 3 horas após; (B) a mesma célula 6 horas após (C). Original 40x.
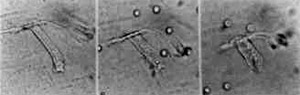
Figura 11. CCE normal (A); a mesma célula 3 horas após (B); a mesura célula 6 horas após (C). Original 40x.
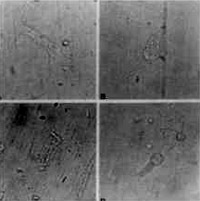
Figura 12. CCE isoladas alteradas pelo uso da Amicacina. A, B, C e D: diferentes tipos de lesões.
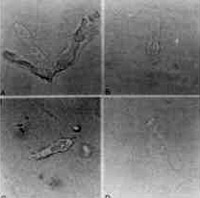
Figura 13. CCE isoladas alteradas pelo uso da Amicacina. A, B, C e D: diferentes tipos de lesões.
Grupo II
Composto de 8 cobaias que foram tratadas como antibiótico aminoglícosídeo Amicacina na dose de 400 mg/kg/dia Estas cobaias foram sacrificadas entre os dias 12 a 14, quando o reflexo de Preyer estava totalmente abolido; ambas as cócleas de cada cobaia foram preparadas e suas CCE isoladas, examinadas. Observou-se um padrão de alteração celular bastante típico nestes casos: desaparecimento dos estereocílios e, às vezes, da placa cuticular; núcleo aumentado, deslocado do pólo inferior, e com cromatina distribuída irregularmente; células encurtadas, alargadas, com citoplasma heterogêneo e preenchido por vacúolos. Em algumas células notou-se ausência do núcleo (Figura 12, 13 e 14).
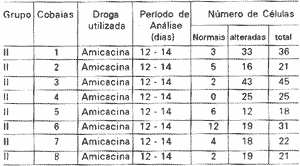
Procurou-se quantificar o número de CCE isoladas normais e alteradas encontradas em cada cobaia. A média de CCE normais foi de 4,25 +- 3,6 e a mediana 3,5. A média de células alteradas de 23 +- 10 e a mediana 19, valores estatisticamente significantes quando comparados cota o grupo controle (Tabela III).
Grupo III
Este grupo também com 8 cobaias, recebeu um associação de 400 mg/kg/dia de Amicacina e 4 mg/kg/dia de gangliosídeo. O padrão de alteração celular encontrado foi o mesmo do padrão do grupo II. Procurou-se também quantificar as CCE isoladas normais e alteradas em cada cobaia para estudo comparativo com os grupos anteriores. Encontrou-se uma média de 3,25 +-2,6 de células normais e 16.75 +-8,4 de células alteradas; a mediana foi de 2,5 para células normais e 17 para células alteradas (Tabela IV). Estes valores também são estatisticamente significantes quando comparados com os valores do grupo I, mas não apresentam diferenças significantes quando comparados com o grupo II (Gráfico I).
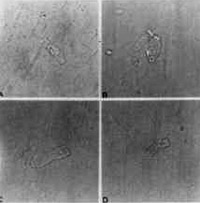
Figura 14. CCE isoladas alteradas pelo uso da Amicacina. A, B, C e D: diferentes tipos de lesões.
TABELA II - Análise quantitativa e qualitativa das CCE isoladas do grupo I
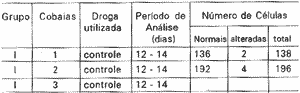
TABELA III - Análise quantitativa e qualitativa das CCE isoladas do grupo II.
Utilizou-se nesse trabalho o método de isolamento mecânico de CCE. Um dos objetivos do isolamento foi o de padronizar e normatízar esta técnica. As CCE isoladas das cócleas das cobaias do grupo controle apresentaram características normais; o número médio foi de 179 +-33 células normais por cobaia. Um número pequeno de células alteradas foi encontrado, provavelmente danificadas durante a dissociação mecânica. Nenhum tratamento com enzima foi usado no órgão de Corti antes do mesmo ser colocado nomeio de cultura. Brownell' encontrou aproximadamente 1000 CCE isoladas por animal, um número bastante superior ao nosso, provavelmente pelo fato do órgão de Corti ter sido incubado sob condições apropriadas em solução de papaína, antes de ser transferido para o meio de cultura. Su27 também utilizou o tratamento enzimático com papaína previamente e encontrou um média de 70 +- 27 CCE isoladas em cada cóclea, um número bem reduzido em relação ao encontrado por Brownell e discretamente inferior ao por nós encontrado, que não realizamos qualquer tratamento enzimático prévio.
Procurou-se estudar a viabilidade e a durabilidade das CCE; 90% das mesmas conservaram suas características vitais por 2 horas e meia; após 4 horas 80 a 90% das células já apresentaram vários tipos de degeneração e 6 horas após elas já estavam totalmente degeneradas, como verdadeiras esferas, muitas já sem o núcleo e sem cílios. Este comportamento celular por nós observado foi semelhante ao encontrado por Su27.
TABELA IV - Análise quantitativa e qualitativa das CCE isoladas do grupo III.
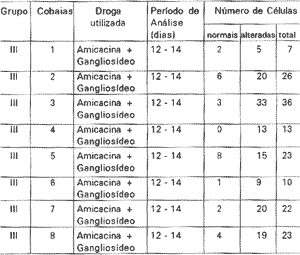
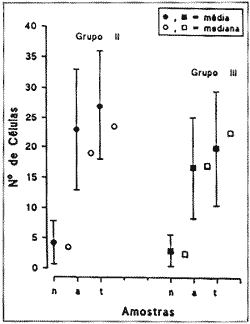
GRÁFICO 1 - Análise comparativa do número de CCE isoladas normais (n), alteradas (a) e total (+) entre os grupos.
Quando foram estudados os tipos de lesões das CCE vivas provocados pelo antibiótico aminoglicosídeo amicacina, observou-se que as CCE isoladas apresentaram alterações características. O padrão de alteração foi encontrado nas CCE isoladas tanto de cobaias tratadas com 400 a 100 mg/kg/d de amicacina, o u mesmo nas tratadas coma associação de amicacina e gangliosídeos. Um fato relevante, foram os números encontrados nas cobaias do Grupo II: um número reduzido de células normais e um número proporcionalmente grande de células alteradas, somando um número total de células bastante inferior ao encontrado nó grupo controle. Provavelmente esta redução seja explicada pelo fato de um número de CCE já ter sido totalmente lesado, desaparecendo, como demonstraram vários autores através de estudos com outras técnicas histológicas28,29,30,31. Com esta técnica proposta neste trabalho a amicacina na dose de 400 mg/kg/dia revelouse altamente lesiva para as células ciliadas externas isoladas.
Existem na literatura vários tipos de modelos para se estudar ototoxicidade causada por antibióticos aminoglicosídeos19,20,21, 22. Riehardson e Russel 32, assim como, Honda et a1`, propuseram recentemente um novo modelo de estudo de ototoxicidade através da cultura de preparação de superfície do órgão de Corti. Células ciliadasvivas, isoladas de cóclea de cobaia tese constituído um importante modelo para se estudar a eletrofisiologia, a patologia e a farmacologia das células ciliadas.
Neste trabalho propomos pela primeira vez a aplicação da técnica para estudos de ototoxicidade com uma fase "in vivo" e outra fase complementar "in vitro".
Aran 34 utilizando esta mesma técnica estudou a viabilidade e a motilidade das células ciliadas externas em resposta a estimulação elétrica e química com potássio. Adicionando aminoglicosídeo ao meio de cultura onde estavam as células isoladas não encontrou nenhuma alteração. Esta ausência de alterações contrária aos nossos achados, provavelmente se deve ao fato da droga ototóxica ficar poucas horas atuando sobre as células, tempo insuficiente para provocar lesões.
No método proposto por nós o estudo das células foi realizado "in vitro" como por Aran, mas a droga foi administrada por tempo prolongado "in vivo" no animal.
Com os resultados obtidos, as alterações morfológicas provocadas pela droga puderam ser rapidamente observadas, sob condições rigorosamente controladas, com uma metodologia simples, rápida e facilmente reprodutível em laboratório. Um aspecto importante desse estudo foi a possibilidade de se analisar pela primeira vez lesões de células ciliadas isoladas vivas "in vitro" provocadas por antibiótico ototóxico. Esses resultados nos permitem afirmar que as lesões celulares podem ser melhor caracterizadas em seus detalheseom estatécnica do que com astécnicasde preparação de superfície do órgão de Corti com microscopia de contraste de fase e preparações de varredura. A microscopia eletrônica de transmissão permite o estudo das lesões celulares, mas não em células vivas, sendo por sua vez, um método bem mais demorado e complexo que o aplicado nesse trabalho.
Maniero et al 25 relataram o efeito protetor do GCC em indivíduos saudáveis , submetidos a ruído intenso. Seus resultados evidenciaram que os gangliosídeos reduziram o aumento do limiar auditivo induzido pelo ruído. Aporti etal" também observaram efeito protetor dos gangliosídeos contra alterações dos potenciais microfônicos cocleares e potenciais de ação provocados por ruídos em gatos. Para os autores, os GCC devem agir na cóclea lesada pelo ruído, preservando a microhomeostase iônica, protegendo o mecanismo da bomba de sódio e potássio.
Molinari" demonstrou o efeito protetor dos GCC contra ototóxicos, em cobaias tratadas com estreptomicina e estreptomicina associada ao gangliosídeo. A audição foi avaliada pelo registro de potenciais cocleares. O autor observou que os potenciais de ação estavam bastante reduzidos no grupo de animais tratados somente com estreptomicina, enquanto que nas cobaias do grupo que recebeu estreptomicina associada ao gangliosídeo, a redução do potencial de ação foi bem menor.
Nesta pesquisa, analisou-se possível efeito protetor dos gangliosídeos contra a ototoxicidade da amicacina. Para tanto, o terceiro grupo de cobaias estudado, recebeu um tratamento com Amicacina e gangliosídeo. A análise estatística dos dados obtidos não mostrou diferença significativa entre os grupos II (amicacina) e III (amicacina e gangliosídeo), não sendo possível afirmar em nossa amostra, que o gangliosídeo tenha efeito protetor contra os efeitos tóxicos da amicacina, sobre as células ciliadas da cóclea da cobaia. A ausência de proteção encontrada em nossa pesquisa, talvez se deva a grande dose de antibiótico aplicada nas cobaias.
REFERÊNCIA BIBLIOGRÁFICA1. BROWNELL, W. E. -Microscopic observation ofcoehlear hair cell motility. Scanning Electron Microscopy, 111: 1401 - 6, 1984.
2. BROWNELL, W. E.; BADER, C. R.; BERTRAND, D.; RIBAUPIERRE, Y. -Evoked mechanical responsesof isolated cochiear outer hair cells. Sdence, 277: 194 - 6, 1985.
3. KACHAR, B.; BROWNELL, W. E.; ALTSCHULER, R.; FEX, J. - Electrokinetic shape of cochlear outer hair cells. Nature, 322: 365 - 7, 1986.
4. EVANS, B. N. - Fatal Contractions: ultrastructural and electromechanical changes in outer hair cells following transmembraneous electrical stimulation. Hearing Research, 45: 265 - 82, 1990.
5. ULFENDAHL, M. - Volume and length changes in outer haircellsoftheguineapigafterpotassium-induced shortening. Arch Othorhínolaryngol, 245: 237 - 43, 1988.
6. DULON, D.; ZAJIC, G.; SCHACHT, J. - Differential motile response of isolated inner and outer hair cells to stimulation by potassium and calcium ions. HearingResearch, 52: 225 - 32, 1991.
7. ZENNER, H. P. - Motile responses in outer hair cells. Hearing Research, 22: 83 - 90, 1986.
8. POU, A. M.; FALLON, M.; WINBERY, S.; BOBBIN, R. - Lowering extracellular calcium decreases the length of isolated outer hair cells. HearingResearch, 52: 305 - 11, 1991. 9. IKEDA, K.; SUNOSE, H.; TAKASAKA, T. - Effects of free radicais on the intracellular calcium concentration in the isolatedouterhaircelloftheguineapigcochlea. ActaOtolaryngol. (Stockh), 113: 137 - 41, 1993.
10. SHEHATA, W. E.; BROWNELL, W. E.; DIELER, R. - Effects of salicylate on shap e, electromotility and membrane characteristis of isolated outer hair cells from guinea pig cochlca. Acta Otolaringol. (Stockh), 12: 1- 13, 1991.
11. KARLSSON, K. K.; FLOCK, B.; FLOCK, A. - Ultrastructural changes in the outer hair cells of the guinea pig cochlea afterexposure to quinine. ActaOtolaryngol. (Stockh), 111): 500 - 5, 1991.
12. OLIVEIRA, J. A. A. -Fisiologia clínica da audição -cóclea ativa. In Lopes, O. - Temas de Otorrinolaringologia. São Paulo, Editora Roca Ltda. 1993..
13. YONG, L. S. & HEWITT, W. L. - Activity of five aminoglycoside antibiotics in vitro against gram-negative bacilli an Staphylococcus aureus. Antimicrobial Agents and Ghemotherapy, 4 617 - 25, 1973.
14. BODEY, G. P. & STEWART, D. - In vitro studies of BBK8,a new aminoglycosidè antibiotic. AntimiembialAgentsand Ghemotherapy, 4: 186 - 92, 1973.
15. CABANA, B. E. & TAGGART, J. G. - Comparative pharmacokinetics of BB-K8 and kanamycin in dogs and humans. Antimicrobial Agents and Ghemotherapy, 3: 478 - 83, 1973.
16. CHRISTENSEN, E. F.; REIFFENSTEIN, J. C.; MADISSOO, H. - Comparative ototoxicity of amikacin and gentamicin in cats. Antimicrobial Agents and Ghemotherapy, 12: 178 - 84, 1977.
17. DULON, D.; ARAN, J. M.; ZAJIC, G.; SCHACHT, J. - Comparative uptake of gentamicin, netilmicin, and amikacin . in the guinea pig cochlea and vestibule. Antimicrobial Agents and Ghemotherapy, 30: 96 - 100, 1986.
18. OLIVEIRA, J. A. A. - Aminoglycoside antibiotics - amikacin. In: Audiovestibulartoxicityofdrugs. Vol II, Florida, CRC Press, 1989. p. 35 - 47.
19. ARAN, J. M.; CAZALS, Y.; ERRE, J. P.; GUILHAUME, A. -Conflicting eletrophysiological and anatomical data from drug - impaired guinea pig cochleas. Acta Otolaringol, 87: 300 -9, 1979.
20. KOITCHEV, K.; GHILHAUME, A.; CAZALS, Y.; ARAM, J. M. - Spiral ganglion changes after massive aminoglycoside treatment in th e guinea pig. Acta Otolaryngol., 94: 431 -8,1982. 21. YOKOTA, M.; SAKAMOTO, K.; INOUYE, S.; AKIYOSHI, M.; KITASATO, I. - Ototoxic effects of a pseudodisaccharide aminoglycoside antibiotic, dactímícín, on the inner ears of guinea pigs. Chematherapy, 35: 431 - 40, 1989.
22. KITASATO,1.; YOKOTA, M.; INOUYE, S.; IGARASHI, M.- Comparative ototoxicity of riostamycin, dactimicin, dibekacin, kanamycin, amikacin, tobramycin, gentamicin, sisomicin and netilmicin in inner ear of guinea pigs.Chemotherapy, 36: 155 - 68, 1990.
23. APORTI, F.; FINESSO, M. MOLINARI, G. A.; PICCOLO, L. -The influente ofbrain cortex gangliosides on the electricalactivity ofthe cochlea after acoustic stimulatíon in cat. Nuovo Arch. Ital. Otol. Rinol. Laringol., 5: 25 - 32, 1977. 24. MOLINARI, G. A. - Gangliosides cérébraux et action ototoxique de Ia streptomycine et de 1'ácide éthacrynique. In: Congrèss International d'Audiologie, Florence, 1976. Temas Livres.
25. MANIERO, G.; BETTIOL, G.; PICCOLO, L. MOLINARI, G. A.- Effects of brain cortex gangliosides on temporary threshold shift in man. Cum Ther. Res. 20: 211 - 5, 1976.
26. SIEGEL, S. - Nonparametric statistic for the behavioral sciences. New York. Mc Graw-Hill, 1956.
27. SUJ. -Techniques for isolating hair cells form guinea pig coch I ea. Chung - Hua - Erh - Pi- Yen - Hou - Ko - Tsa - Ghih, 27: 133 - 5, 1992. (Abstract).
28. ARAN, J. M. -Some functional and morphologic correlates in inner ear pathologies: first observations using electrically envoked/pure tone derived potentials. Am. J. Otolaringol 7: 107 - 16, 1986.
29. BAMONTE, F.; DIONISOTTI, S.; GAMBÁ, M.; ONGINI, E.; ARPINI, A.; MELONE, G. - Relation of dosing regimen to aminoglycoside ototoxicity: evaluation of auditory damage in the guinea pig. Ghemotherapy, 36: 41 - 50, 1990. 30..TAKUMIDA, M.; NISHIDA, 1.; NIKAIDO, M.; HIRAKAWA, K.; HARADA, Y.; BAGGER-SJõBÃCK, D. - Effect of dosing schedule on aminoglycoside ototoxicity: comparative cochlear ototoxicity of amikacin and isepamicin. I. Otorhinolaryngol. Relat. Spec., 52: 341 - 9, 1990.
31. HARRISON, R. V.; SHIRANE, M.; FUKUSHIMA, N.; MOUNT, R. J.- Morphological changes to the cochlea in a animal model of profund deafness. Acta Otolarngol (Stockh), (Suppl489): 5 - 11, 1991.
32. RICHARDSON, G. P. & RUSSEL, I. J. - Cochlear cultures as a model system for studyng aminoglycoside induced otótoxicity. HearingResearch, 53: 293 - 311, 1991. 33. HONDA, N.; SAITO, H.; AOYAMA, H.; NOJYO, Y. - An in vitro rapid evaluation of drug-induced ototoxicity and of reductive effect of calcium on aminoglycoside ototoxicity using organ culture. Nippon -Jibiinkoka - Gakkai - Kaiho, 94: 1084 - 97, 1991.
34. ARAN, J. M. -Physiopathology of sensory hair cells: in vivo and in vitro studies on aminoglycoside. Uptake and toxicity. In Grandori, F.; Cianfrone, G.; Kemp, D. T. - Cochlearmechanisms and otoacoustic emissions.
* Professor Titular do Departamento de Oftalmologia e Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto - USP
** Técnica Especializada da Faculdade de Medicina de Ribeirão Preto USP.
*** Professora Assistente-Doutora do Departamento de Oftalmologia e Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto - USP.
Endereço para correspondência: Departamento de Oftalmologia e Otorrinolaringologia da FMRPUSP, "Compus" Universitário -Monte Alegre 14049-900 - Ribeirão Preto - SP.
Artigo recebido em 10 de agosto de 1994. Artigo aceito em 11 de outubro de 1994.


