O princípio e a evoluçãoO princípio do implante é estimular elétricamente fibras nervosas remanescentes na cóclea de pacientes com surdez profunda, conduzindo ao cérebro impulsos que irão produzir sensação auditiva(49, 52, 58, 76, 77). A idéia não é nova, já que médicos romanos preconizavam descargas elétricas no tratamento da cefaléia. Volta(83), em 1790, insertando hastes metálicas em ambos ou ouvidos e promovendo uma descarga elétrica de aproximadamente 50 V, provocava sensações sonoras desconfortáveis. Estes efeitos indesejáveis retardaram as pesquisas de eletroestimulação por cêrca de meio século. Foi na segunda metade do século XIX que Gradenigo e Politzer(49) utilizaram a estimulação elétrica no diagnóstico e terapia de doenças do ouvido. Djourno e Eyries(9), em 1957, implantaram um eletrodo em um paciente com surdez profunda durante uma cirurgia corretiva de paralisia facial. Uma bobina de indução e um eletrodo foram conectados ao músculo temporal e um cabo condutor foi colocado em um segmento do nervo auditivo. Uma segunda bobina, posicionada sobre a pele, transmitia uma corrente de indução gerada por um estimulador elétrico na frequência de 100/segundo, interrompida 20 vezesiminuto. Foi produzida sensação auditiva.
Outros pesquisadores foram, então, motivados a iniciar extensos estudos sobre o assunto, entre eles House(36, 37, 39), Miyamoto(61), Michelson(54), Merzenich(53), Kiang(45), Spoendlin(80), Hawkins(32), Schuknecht(75), Carhart(9) e Ballantyne(4) nos Estados Unidos; Chouard(11) na França; Clark(13) na Austrália; Hochmau(34) na Austria; Fisch(18) na Suíça e Douek(20) na Inglaterra.
O implante
O sistema possuí dois componentes (interno e externo). O componente interno consiste em uma bobina de indução conectada a dois eletrodos, um ativo inserido na cóclea e outro terra, posicionado na tuba de Eustáquio ou na mastóide(17, 50). A unidade externa é composta de um microfone, um processador de sinais e um transmissor. Os dois sistemas são conectados pela justaposição do transmissor com a bobina de indução. O estímulo sonoro é captado pelo microfone e conduzido ao processador de sinais, que normalmente emite uma onda de 16 kHz, cuja amplitude é modulada pela intensidade do estímulo. Esta onde chega ao transmissor, que por sinais magnéticos estimula, através da pele, a bobina de indução. Desta forma é criada uma diferença de potencial entre os dois eletrodos do sistema interno, cujo valor é proporcional. à intensidade de som captado pelo microfone. Os impulsos gerados neste campo elétrico vão então estimular as fibras remanescentes do nervo auditivo. É importante ainda enfatizar que o padrão temporal do som tem correspondência nos impulsos elétricos e que o aparelho é calibrado para que, na ausência de estímulo sonoro, a amplitude da onda gerada no processador de sinais fique abaixo do limiar de excitabilidade elétrica nervosa gerada no sistema interno(69). O diagrama do implante de cóclea com um sistema de canal único é mostrado na figura 1. O sistema de canal único, conforme foi descrito acima, utiliza apenas uma frequência fundamental e proporciona, portanto, um número limitado de informações, incluindo o ritmo da fala, a presença de sílabas e palavras tônicas e a entonação(42).
Mais recentemente, novos sistemas vêm sendo desenvolvidos fundamentados em importantes aspectos da fisiologia coclear. A cóclea normalmente realiza uma análise espectral na qual os diferentes componentes de frequência sonora são codificados quanto à posição espacial na qual causam máxima excitação das células ciliadas cocleares. Na tentativa de mimetizar esta distribuição espacial na análise de frequências, teoricamente, os componentes espectrais do som podem ser separados e conduzidos para estimular regiões apropriadas no trajeto coclear(72).
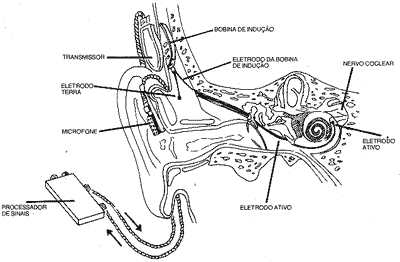
Figura 1: Diagrama do tipo de implante coclear preconizado pelo "House Ear Institute".
Baseado nestes princípios fisiológicos e eletro-acústicos é que foi introduzido o sistema de multicanais. Neste sistema o número mínimo de canais a serem usados varia de 6 a 12, visando o processamento dos sinais de fala sem perda de inteligibilidade e a manutenção de um adequado padrão de excitação neuronal. A distância considerada ótima na separação dos eletrodos varia de 0.5 a 2mm. O processador de sinais passa a exercer a função de um processador de fala, que através de um filtro fragmente a linguagem em um número correspondente de faixas de freqüência, sendo a informação conduzida aos diferentes eletrodos cocleares. Esta maior amplitude de componentes de frequência proporciona melhor discriminação do som(31).
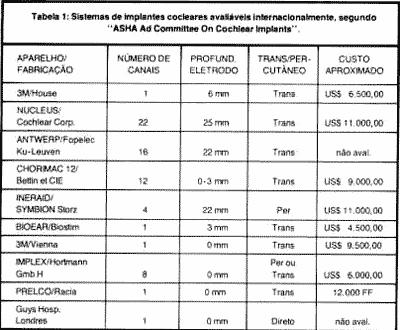
O primeiro sistema aprovado pelo "Food and Drug Administration" (FDA) nos Estados Unidos, para uso terapêutico em adultos, foi o "House Urban System", um canal, produzido pela 3M - Corporation, em novembro de 1984(31). A tabela 1 mostra os sistemas de implante de cóclea internacionalmente avaliáveis segundo "ASHA Ad Committee on Cochlear Implants"(1).
O procedimento cirúrgico
A cirurgia é realizada através de uma incisão pós-auricular. É feita uma mastoidectomia e o ouvido médio é exposto através do recesso facial. A parte anterior do nicho da janela redonda é removida e a espira basal da cóclea é aberta anterior à membrana da janela redonda. O eletrodo ativo é inserido dentro da scala timpânica da cóclea(28). O eletrodo terra é colocado através do ático, dentro da tuba de Eustáquio ou na mastóide(61). A bobina de indução é colocada em uma depressão criada na porção escamosa do osso temporal, na superfície lateral do crânio, acima e atrás da aurícula. Uma das dificuldades que pode surgir é a inserção do eletrodo ativo na vigência de surdez decorrente de meningite, quando a ossificação da scala timpânica torna necessária a remoção do neo-osso(66).
Aguarda-se aproximadamente dois meses para a colocação do componente externo do sistema, visando uma boa cicatrização.
Protocolo
Os critérios utilizados na seleção de pacientes são apresentados de forma sequencial na figura 2. No contato médico inicial com o deficiente auditivo é feita um avaliação quanto à etiologia da surdez. As maiores causas de surdez profunda são labirintites virais ou bacterianas, traumas cranianos, ototoxicidade, presbiacusia, otoesclerose severa, anóxia e algumas doenças hereditárias ou congênitas(40, 44, 65). Sob o aspecto histopatológico, ocorre uma perda quase completa de células ciliadas e uma considerável redução de neurônios cocleares, variando de 10 a 70% em certas regiões(16, 33).
A Surdez Adquirida: A maioria dos centros de pesquisa procura por esse tipo de paciente, pois é onde se encontra o maior número de células neuronais remanescentes na cóclea, o que possibilita um melhor resultado cirúrgico(14). O limiar tonal (média de 500, 1000, 2000 Hz) mostra que ouvidos com normal ou quase (normal limiar têm pelo menos 20.000 (células ganglionares. Limiares de I, perda de 50 a 60 dB têm ao redor de 10.000 células. A correlação entre população de células espirais ganglionares e discriminação da fala é possível com uma contagem tão baixa 10.000 células ganglionares espirais e 3.000 células no terço apical da cóclea(29). Em 1978, Otte, chuknecht e Kerr(66) mostraram a relação entre população de células ganglionares remanescentes e causas e surdez, permitindo estimar o número de células residuais de acordo com a patologia.
A Surdez Congênita: O mesmo critério, quanto ao número de células ganglionares remanescentes, é também aplicável a este grupo de candidatos. Todavia é uma área controversa, pois a determinação da presença ou não de audição residual é fator decisivo. Em caso positivo, esse residual é destruído com a colocação do implante. Esse procedimento retira do paciente qualquer chance de no futuro vir a se beneficiar de outro tipo de auxílio auditivo. A equipe do "House Ear Institute" está aplicando audiometria de Potencial Evocado de Tronco Cerebral para avaliar a audição residual com um mínimo de erro(38).
Durante a avaliação inicial do paciente são realizados exame otológico e exames audiométricos: audiometria e impedanciometria. É feita ainda uma avaliação quanto à saúde geral e revisão de exames passados, se avaliáveis. Seguindo, é feita uma tentativa de uso de prótese auditiva ou aparelho vibro-táctil, pelo período de 6 semanas a 6 meses(51), sendo importante salientar que é necessário tempo para a adaptação com um auxílio auditivo, a fim de usufruir de todas as suas vantagens. Nesta etapa, se o paciente obtém reais benefícios com o uso da prótese auditiva ou do aparelho vibro-táctil, é excluído como candidato ao implante(63).
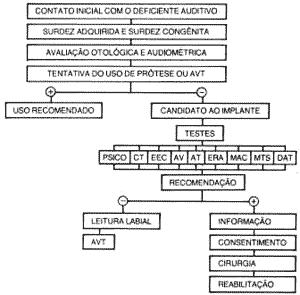
Figura 2: Protocolo para Implante Coclear. (AVT-Aparelho Vibro-táctil, PSICO-psicológico, CT- Tomografia Computadorizada, EEC - estimulação elétrica da cóclea, AV - avaliação vestibular, AT - Audiornetria Tonal, ERA - Audiornetria de Respostas Elétricas, MAC - Mínima Capacidade Auditiva, MTS - "Monosyllable, Trochee and Spondee'', DAT - Teste de Discriminação pós-Treino.)
No caso da não obtenção de benefícios com as próteses convencionais, o paciente será, então, submetido a testes visando recomendar ou não o implante. Uma análise psicológica é realizada, através do questionário de Eysenick, visando a pesquisa de extroversão e introversão, neurose e psicose e o teste de Spielberger para avaliação da ansiedade, em 6 escalas: depressivo, somático, fóbico, histérico, obsessivo e ansioso flutuante(29).
A Tomografia Computadorizada da Cóclea(10, 74), é essencial para averiguar a possibilidade cirúrgica de inserção do implante. Muitos casos se surdez adquirida têm tecido cicatricial ou neo-formação óssea coclear, o que torna a implantação, por vezes, impossível. Se o paciente teve meningite é necessário Cintilografia Cerebral para excluir dano da córtex auditiva. Na fase pré-operatória, a CT deve incluir ambos os ossos temporais; transoperatoriamente a projeção antero-posterior transorbitária pode auxiliar na inserção do eletrodo e no pós-operatório uma série incluindo visão antero-posterior, sub-mentovertex e projeções laterais é indicada.
A estimulação elétrica da cóclea auxilia na detecção de sobrevivência neuronal e dá uma idéia ao paciente do tipo de som que será produzido pelo implante, que é diferente do som que o deficiente auditivo póslingual conhece. Pode ser aplicado no surdo pré e pós-lingual. A estimulação é realizada com uma agulha transtimpânica (a mesma usada em eletrococleografia) colocada na parede medial do promotório e são apresentados três estímulos: 62.5, 125 e 255 Hz. Procura-se averiguar a menor corrente que produz sensação de som e a corrente que produz som desconfortável ou dor(77). Na Universidade de Stanford(78), o mesmo procedimento é feito, com exceção do eletrodo, que é colocado na janela redonda.
Na avaliação vestibular são feitos testes calóricos de rotina e eletronistagmografia, para demonstrar função labiríntica(29).
O enfoque principal da investigação audiométrica especial é a verificação da existência ou não de audição residual. A perda auditiva considerada para implante é igual ou superior a 95 dB HL, bilateralmente(62), sendo considerado para cirurgia o ouvido com perda auditiva maior. Para obtenção da AT (Audiometria Tonal), o audiômetro utilizado deve ter um "output" máximo de 130 dB HL, ao invés dos convencionais 110 dB HL(58). Para se ter certeza de que se está obtendo uma resposta acústica, pelo menos um dos seguintes critérios tem que ser preenchido: o paciente deve exibir um marcado "tone decay", é necessário o limiar auditivo ser melhor em um ouvido do que no outro e o paciente deve estar certo de que a sensação é mais auditiva do que tácti1(29). O ERA (Audiometria de Respostas Elétricas) é necessário para excluir surdez funcionail. Inclui Eletrococleografia e Resposta Cortical(29).
Com o objetivo de avaliar a discriminação auditiva, uma bateria de testes - MAC (Mínima Capacidade Auditiva) - foi projetada na Universidade da Califórnia, em São Francísco(67, 68). Essa bateria é composta de 13 testes auditivos e um de leitura labial. Doze testes consistem basicamente de material falado e são de gradual dificuldade. No primeiro grupo, o objetivo é avaliar se o paciente pode ou não diferenciar a intensidade de fala. Outro teste pergunta qual a palavra enfatizada na frase. A parte mais importante desse primeiro grupo de testes é verificar se o paciente distingue entre voz e ruído. O segundo grupo requer identificação de fonemas e é de escolha múltipla. Abrange consoantes e são testadas nasalidade e vocalização. O reconhecimento de 2 sílabas é relativamente fácil e consiste na seleção de 4 escolhas. Os testes remanescentes na bateria são de resposta aberta, onde o paciente é solicitado a descrever som, palavra ou sentença. São fornecidas 15 diferentes sons, 25 palavras de 2 sílabas e sentenças usadas no dia a dia. O teste final é feito com o examinador falando da distância de um metro do paciente, para avaliar leitura labial. O tempo do material gravado do MAC é de 67 minutos e o tempo total ao redor de duas horas, variando na dependência do paciente. Edgerton(24) descreveu o protocolo usado pelo "House Ear Instítute" e que recomenda o MTS ("Monosyllable, Trochee and Spondee") que é um teste de discriminação auditiva que usa palavras de 2 sílabas com acento tônico na primeira sílaba e palavras de 2 silabas com acento tônico em ambas.
O "House Ear Institute" tem enfrentado o problema de selecionar crianças para implante e respostas negativas no ERA não excluem audição residual, sendo necessário formular um teste que permita a discriminação de linguagem simples, com auxílio de uma prótese auditiva(37). Foi formulado então o DAT (Testes de Discriminação Pós-Treinamento), baseado no MTS, mas muito mais simples. O treino da criança é iniciado e, se ela melhorar com o uso da prótese, o implante não é recomendado. Se não há progresso quanto ao reconhecimento do som ou no desenvolvimento da fala, o implante é considerado(59).
Após a análise de todos os testes é feita a seleção do paciente para a cirurgia. Em caso negativo, são indicadas soluções alternativas e no caso positivo é fornecida ao candidato literatura explanatória, são promovidos encontros entre pacientes implantados e são dadas informações quanto à duração do ato cirúrgico, recuperação e reabilitação. É obtido um consentimento por escrito por parte do paciente. O procedimento cirúrgico têm uma duração aproximada de 2 horas e é realizado em conformidade com o que foi anteriormente descrito. Não menos importante é a reabilitação(73), cujo programa básico deve envolver treinamento auditivo e treinamento delinguagem. O treinamento auditivo visa primeiramente introduzir o paciente ao novo mundo de sons, reconhecendo os diferentes tons dos sons do dia a dia. Aprende a usar a informação auditiva como suporte para a leitura labial e a reconhecer a fala em presença de ruído ambiental(12, 56). O treinamento da linguagem deve acostumar o paciente ao som da própria voz, ensinando-o a controlar o volume e a intensidade. Deve desenvolver ritmo e entonação através de exercícios de articulação(25, 46, 71).
Resultados
A percepção auditiva de sons ambientais é talvez o maior benefício derivado do implante de cóclea(15, 46, 50, 62). Pacientes com surdez adquirida ralatam que os sons recebidos são estranhos, se comparados aos da pré-surdez. Com a prática, entretanto, êles aprendem a associar os novos sons com o conhecimento auditivo passado. Eles podem identificar toque de telefone, campainha de porta, buzinas de carros, alarme e vozes. A comunicação social melhora, melhorando a parte pscológica do paciente. O rendimento da leitura labial melhora, assim como a própria linguagem, e se toma capaz de modular intensidade e ritmo. No caso de zumbidos como queixa prévia, ocorre um alívio do sintoma, em 30% dos casos implantados(2). Pacientes implantados com o sistema de um canal único não são capazes de localizar o som ou de apreciar música, pois o sistema permite detectar sons dentro dos limites de frequência de 55 a 65 dB(3), sendo considerado mais um auxílio do que um substituto sensorial. Os resultados auferidos pelos pacientes implantados pré-fnguais requerem anos de reabilitação para a obtenção(30, 47, 71).
As complicações podem ser precoces ou tardias. Entre as precoces estão as infecções do local do implante, já que os implantes são biocompatíveis mas não bio-degradáveis, funcionado como corpos estranhos(21); drenagem de fluido cerebroespinhal através do aqueduto da cóclea, com risco de meningite(46); vertigens e zumbidos. Entre as complicações tardias estão incluídas as infecções devido ao mau posicionamento de cabos, direcionados para perto do meato auditivo externo, levando a otite externa crônica; mastoidite; degeneração de células residuais do Orgão de Corti e de neurônios cocleares(5, 35, 39).
Programas internacionais de implante de cóclea
Austrália (G.N. Clark, Y.C. Tong, D. Dewhurt): o grupo está trabalhando com o sistema de multicanais (Nucleus) e enfocando a histopatologia decorrente do trauma da inserção e estimulação elétrica(14).
Áustria (I.J. Hochmair-Desoyer, E.S., Hochmair e K. Burian): trabalham com um sistema de 4 canais, intracoclear, colocado na scala timpânica, e um extracoclear colocado na janela redonda(6).
França (C.H. Chouard, C. Fugain, B. Meyer): desenvolveram uma prótese cóclear com 12 canais, já implantados em mais de 60 pacientes(11).
Suíça (U. Fisch, N. Dillier, T. Spillmann): estão desenvolvendo um sistema de um só canal, colocado na janela redonda. Já implantaram e testaram 4 pacientes(49).
Alemanha Ocidental (P. Banfai, G. Hortinann, A. Karczag): usam um sistema de multi-canais, intracoclear, mas não posicionado na scala timpânica. Já implantaram 34 pacientes com resultados semelhantes ao sistema de um canal(49).
Canadá: em Vancouver, P. Doyle têm usado o sistema de um canal (3M House), assim como Rotenburg em Toronto. Outro grupo canadense (D.S. Abel, H. Kunov, J. Nedzeski, R.V. Harrison, F. Duval, R. Morris, D. Schwarz) estão desenvolvendo um novo sistema de multi-canais e trabalhando em-pesquisa fundamental sobre estimulação artificial da cóclea(49).
Universidade de Indiana: R. Miyamoto e sua equipe estão trabalhando segundo o protocolo do "House Ear Institute" e usando o sistema de um canal (3M House) e de multi-canais (Nucleus 22). Têm implantado pacientes com idade mínima de 2 anos e com surdez bilateral igual ou superior a 95 dB(59, 60, 61, 62, 63, 64, 65, 70).
"House Ear Institute" (W.F. House, K.I. Berliner, B.J. Edgerton e associados): o grupo usa o sistema de canal único (3M House), o primeiro a ser aprovado para uso terapêutico pelo FDA. Centenas de pacientes já receberam esse implante, incluindo crianças(36, 37, 38, 39).
Universidade de Stanford (F.B. Simmons, R.L. White): usam o sistema de canal único (BIOEAR) e de multi-canais, ambos intracocleares(78, 79).
Universidade da Califórnia (R.P. Michelson, M.M. Merzenich, F.A. Schindler): trabalham com o UCSF/Storz, que é um sistema de 8 canais e 16 eletrodos(55).
Universidade de Utah (D.K. Eddington, D.E. Brockmann): desenvolvem um sistema de 4 canais - INERAID - atualmente em experimentação clínica(22).
Universidade de Washington (J.M. Miller, D. Sulton, B.E. Pfingst): estudam o mecanismo de dano coclear secundário ao implante(49).
Conclusão
As pessoas que ouvem, vivem num mundo de sons ambientais e barulhos. Muito cedo na infância, elas) adquirem uma orientação acústica. Entretanto, a fala é o nosso mais importante evento acústico, porque fala é o nosso meio de comunicação primário. E a fala possui uma função emocional refletida no ritmo, qualidade e entonação da voz.
As pessoas com severa diminuição auditiva têm um rompimento n comunicação, levando a um desequilíbrio no modo de vida e personalidade. Visando reintegrar o surdo ao mundo do som, o Implante de Cóclea traz um significante benefício, pois propicia uma parte desse mundo, seja na audição ou linguagem. O sistema perfeito, que possibilitará uma completa discriminação da fala, provavelmente ainda está alguns anos longe. Mas, já é uma esperança.
Summary
The cochlear implant is a device that supplies very small amounts of electrical current to the cochlear remaining neurones. The electrical current activates the hearing nerve and a signal is transmitted to the brain. The brain interprets this signal as sound. The cochlear implant, consequently, has a similar function to the hair cells turning sound into electrical current which stimulates the hearing nerve. The cochlear implant is composed of two main parts: the internal part which is surgically implanted and the external part which is worn on the outside of the body. Protocola have been used for patient selection which maximize the benefits. Clinical research has recently increased and international prograna have been developed in an attempt to evaluate the indications, advantages and complications of the cochlear implant.
Bibliografia
1. AMERICAN SPEECH AND HEARING ASSOCIATION. Report of the Ad Hoc Commiattee on Cochlear Implants. ASNA, 28(4): 29-52, 1986.
2. ARAN, J.M. & CAZALS J. Electrical supression of tinnitus. CIBA Found. Symp. 85, 127-31, 1981.
3. BALLANTYNE, J. The resulta from various viewpoints. In Gray, R.F. Cochlear implants. College Hill Press, San Diego, pp. 180-193,1985.
4. BALLANTYNE, J.C., EVANS, E.F. & MORRINSON, A.W. Electrical auditory stimulation in the management of profound hearing loss. Report to the Departament of Health and Social Security on visita in October 1977 to centres in the USA involved in Cochlear Implant prostheses. J. Laryngol. Otol. 1: 1-117,1978.
5. BILGER, R.C. Evaluation of subjects presently fitted with implanted auditory prostheses. Ann. Otol. Rhinol. Laryngol. 86: 2124,1977.
6. BRIGHTWELL, A., ROTHERA, M.P. & GRAHAM, J.M. Evaluation of the status of the auditory nerve psychophysical tests and ABR. In Schindler, R.A., Merzenich, M.M. Cochlear Imp1attts. Raven Press, New York, pp.343-49,1985.
7. BURIAN, K., HOCHMAIR, E.E. & HOCHMAIR-DESOYER, LJ. Electrical stimulation with multichannel electrodes in deaf patients. Audiology 19: 128-36, 1980.
8. BURIAN, K., HOCHMAIR-DESOYER, I.J. & HOCHMAIR, E.S. Hoeren ulber in cochlea implantant. Archur fur ONK-Heilbeende 231: 569-70,198 1.
9. CARHART, R. Meeting Report. In Merzenich, M.M., Schindler, R.A. & Soy. Proc. First Intern. Conf. Electrical Stimulafon of the Acoustic Nerve as a Treatment for Profound Senrorineural Deafness in man. University of California, San Francisco, pp. 171-8,1974.
10. CHAKERES, DM., SPIEGEL, P.A. Systemic technique for comprehensive evaluation of the temporal bone by CT. Radiology 146:97-106,1983.
11. CHOUARD, C.H. no surgical rehabilitation of the total deafness with the multi-channel Cochlear Implant. Audiology 19: 137-45,1980.
12. CHOUARD, C.H.. MAC LEAD, P. Implantation of multiple intra-cochlear electrodes for rehabilitation of total deafness: preliminary report. Laryngoscope 86: 1743-51,1976.
13. CLARK, G.M., BLACK, R., DEWHÜRST, D.J. et alii. A multiple electrode hearing prostheses for cochlea implantation in deaf patients. Med. Prog. Technol. 5(3): 127-40,1977.
14. CLARK, G.M., PYMAN, B.C. & BAILEY, O.R. The surgery for multiple electrode cochlear implantations. Journal of Laryngology and Otology. 93: 215-23,, 1979.
15. CLARK, G.M., TONG, Y.C. & BLACK, R. et alii. A multiple electrode cochlear implant. J. Laryngol. Otol. 91: 935-45, 1977.
16. CLOPTON, B.M. SPIELMAN, F.A. & MILLER, J.M. Estimates of essencial neural elements for stimulation through cochlear prostheses. Ann. Otol. Rhinol. Laryng. 66:5-7,1980.
17. COUNCIL ON SCIENTIFIC AFFAIRS. Cochlear Implants. JAMA 250: 391-2, 1983.
18. DILLIER, N., SPÌELMAN, T., FISCH, V.P. et alii. Encoding and decoding of auditory signals in relation to human speech and its application to human cochlear implants. Audiology 19(2): 146-63, 1980.
19. DJOURNO A., EYRIES C., VALLANCIEN, B. Premiers essais d'excitation electrique du nerf auditif chez Vhonrme, par microaparicls inclue a demeure. Bulledn of the National Academy of Medicine (Paris). 141: 481-83,1957.
20. DOUEK, E., FOURCIN, E.E., MOORE, A.J. et alii. A new approach to the Cochlear Implant. Proc. R. Soc. Med. 70: 379-83, 1977.
21. DUCKERT, P. & MILLER, J.M. Acute morphological changes im guinea pig cochlea following electrical stimulation: a preliminary scanning electron microscopic study. Ann. Otol. Rhinol. Laryngol. 91: 33-40,1982.
22. EDDINGTON, D.K., DOKELL, W.H., BRACKMANN, D.E. et alii. Auditory prostheses research with multiple channel intracochlear stimulation in man. Ann. Otol. Rhinol. Laryngol. 87:1-39,1978.
23. EDGERTON, B.J. Round Table discussion on electrical stimulation and tinnitus. Symposium on Artificial Auditory Stimulation, Erlangen, Set. 29, 1982.
24. EDGERTON, B.J., EISENBERG, L.S. & THIELEMEIR, M.A. Auditory assessment strategy and materiais for adult and child candidates for cochlear implantation. Ann. N.Y. Acad. Set. 405,435-42,1983.
25. EISENWORT, B., BRAUNEIS, K., BURIAN, K. Rehabilitation of the cochlear implant patient. In Gray, R.F. Cochlearlmplants. College Hill Press, San Diego, pp. 194-210,1985.
26. ERLEIR, N., ALENCEWICZ, C. Audiological evaluation of deaf children. J. Speech Hear. Dis. 41: 256-67, 1976.
27. FOURCIN, A.J., ROSEN, S.M., MOORE, B.C. et alii. External electrical stimulation of the cochlea: clinical, psychophysical, speech - perceptual and histological findings. Br. J. Audol. 13(3):85-107,1979.
28. FRANZ, B.K., CLARK, G.M. & BLOOM, D.M. Surgical anatomy of the Round window with special reference to cochlear implantation. The Journal of Laryngology and Otology. 101: 97-102,1980.
29 FRASER, J.G. Selection of Patients. In Gray, R.F. Cochlear Implants. College Hill Press, San Diego, pp. 124-140, 1985.
30. GRAY, R.F. & SCHINDLER, R.A. Complications and Failures of Cochlear Implants. In Gray, R.F. Cochlear Implants. College Hill Press, San Diego, pp, 152-162, 1985.
31. HARRISON, R.V. Cochlear lmplants: a review of the priciples and importam physiological factors. J. Otolaryng. Oct.: 16(5): 268-75,1987.
32. HAWKINS, J. Meeting Report. In Merzenich, M.M., Schindler, R.A. & Soy. Proc. First Intern. Electrical Stimulation of the Acoustic Nerve as a Treatment for Profound Sensorineural Deafness in Man. University of California, San Francisco, pp. 47-62, 1974.
33. HIJONOSA, R., LINDSAY, J.R. Profound Dafess: associated sensory and neural degeneration. Arch. Otolaryngol. 106: 193-209,1980.
34. HOCHMAIR, LJ., HOCHMAIR, E.S., BURIAN, K. et alii, Four years of experience with Cochlear Prostheses. Med. Progr. Teciatol. 8: 107-19,198 1.
35. HOUGH, T. The Cochlear Implant. Okahoma Group reperience to date. Laryngoscope 92: 863-72, 1982.
36. HOUSE, W.F. Cochlear Implanta. Ann. Otol. Rhinol. Laryngol. 85(27): 1-93, 1985.
37. HOUSE, W.F., BERLINER, K.I. The cochlear implant program: an overview. Ann. Otol. Rhinol. Laryng. 91: 1-124, 1982.
38. HOUSE, W.F., BERLINER, K.I., EISENBERG, L.S. Experience with the cochlear implant in preschool children: Ann. Otol. Rhinol. Laryng. 92: 587-92,1983.
39. HOUSE, W.F., URBAN, J. Long term results of electrode implantation and eletronic stimulation of the cochlea in man. Ann. Otol. Rhinol. Laryngol. 82(4): 504-17, 1973.
40. JENSEN, J. Malformations of the innerear in deaf children. Acta Radio!. 286: 23-29, 1963.
41. JOHNSON, L.G. Sequence of degeneration of Cortis's organ and its Frst-order neurons. Ann. Otol. Rhinol. Laryngol. 83: 193-209, 1974.
42. JOHNSON, L.G. Cochlear Anatomy and Histopatology. In Gray, R.F. Cochlear Implants. College Hill Press, San Diego, pp. 50-73,1985.
43. JOHNSON, L.G., HOUSE, W.F. & LINTHICUM, F.M. Otopathological findings in a patient with bilateral Cochlear implants. Ann. Otol. Rhinol. Laryngol. 91(2): 74-89, 1982.
44. KERR, A., SCHUKNECHT, H.F. The spiral ganglion in profound Dafness. Acta Otolaryngol. (65): 586-98, 1968.
45. KIANG, N.J., MOXON, E.C. Physiological considerations in artificial stimulation of the inner cor. Ann. Otol. Rhinol. Laryngol. 81(5): 714-30, 1972.
46. LEAKE-JONES, P.A., REBSCHER, S.J. Cochlear pathology with chronically implanted scala tympani electrode - Cochlear Prostheses. Ann. NY Acad. Set. (405): 203-23,1983.
47. LEAKE-JONES, J., WALSH, S.M. & MERZENICH, M.M. Cochlear pathology following chronic intracochlear electrical stimulation. In Proc. West Coast Cochlear Prostheses Conf. Ann. Otol. Rhinol. Laryngol. 90(2): 6-8, 1981.
48. LIEBERMANN, P. Intonation and syntactic processing of speech. In Wathen-Dum, W. Models for the Perception of Speech and Visual Form. MIT Press, Cambridge, 1967. 49. LUXFORD, W., BRACKMANN, D. The history of Cochlear Implante. In Gray, R.F. Cochlear Implante. College Hill Press, San Diego, pp. 1-26,1985.
50. MANNING, S., MEYERHOFF, W.L. Bringing hearing to the profoundly deaf: a research report. Geriatrics 41(3): 78-80, 1986.
51. MARTIN, M.C. Alternatives to Cochlear implants. In Schindler, R.A, Merzenich, M.M.Cochlear Implants. Raven Press, Mew York, pp. 549-61, 1985.
52. MAC NEAL, D.R. Electrical stimulation with platinum electrodes. In Hambrecht, F.T., Reswick, J.B. Funcdonal Electrical Stánulafon. Marcel Debber Inc., New York, pp. 3-35, 1977.
53. MERZENICH, M.M., MICHELSON, R.P., SCHINDLER, R.A. et alii. Neural encoding of sound sensation evoked by electrical stimulation of the acoustic nerve. Ann. Otol. Rhinol. Laryngol. 82(4): 486-503,1973.
54. MICHELSON, R.P. The results of electrical stimulation of the cochlea in human sensory Dafess. Ann. Otol. Rhinol. Laryngol. 80(6):914-19,1971.
55. MICHELSON, R.P. Electrical simulation of the human cochlea. Arch. of Otolaryngol. 93:317-23,1971.
56. MICHELSON, R.P. MERZENICH, M.M., SCHINDLER, R.A. Present status and future development of the Cochlear prosthesis. Ann. Otol. Rhinol. Laryngol. 84: 494-98, 1975.
57. MICHELSON, R.P. & SCHINDLER, R.A. Multi-channel Cochlear implant: preliminary results in man. Laryngoscope 91: 38-42, 1981.
58. MILLER, C.W. & HEPINEI, S. Cochlear Implant: Audiometric results with a singlechannel device. South Med. J. Feb. 80(4): 170-2,1987.
59. MIYAMOTO, R.T. Eletrically evoked potencials in Cochlear Implant subjects. Laryngoscope 92(2): 178-85, 1986.
60. MIYAMOTO, R.T. & BROWN, D. Electrically evoked brainstem responses in Cochlear implant recipients. Otolaryng. Head and Neek Surgery 96(1): 34-38, 1987.
61. MIYAMOTO, R.T., GOSSETT, S.K., GROOM, G.L. & et alii. Cochlear Implants: an auditory prosthesis for the deaf. Journal of the Indiana State cal Associafon75(3): 174-177, 1982.
62: MIYAMOTO, R.T., MC CONKEY, A., MYRES, W. et alii. Cochlear Implante as sensory aids for deaf children. Indiana Medicine 3: 198-201, 1985.
63. MIYAMOTO, R.T., MYRES, W., WAGNER, M. et alii. Vibrotactile devices as sensory aids for the deaf. Otolaryng. Head and Neck Surgery97(1):57-63, 1987.
64. MIYAMOTO, R.T., MYRES, W., POPE, M. et alii. Cochlear Implants for deaf children. Laryngoscope 96(9): 990-6, 1986.
65. MIYAMOTO, R.T., ROBBINS, A.M., MYRES, W.A. et alii. Cochlear Implantation in the Mondini Inner Ear Malformation. The American Journal of Otology 7(4): 258-61,1986.
66. OTTE, J., SCHUKNECHT, H.E. & KERR, A.G. Ganglion cell population in normal and pathological human Cochlear-implications for Cochlear implantation. Laryngoscope 38: 1231-46, 1978.
67. OWENS, E., KESSLER, D.K., TELLEN, C.C. et alii. The minimal auditory capabilities (MAC) battery. Hearing Aid Journal 9: 34,1981.
68. OWENS, E. & TELLEN, C. Speech perception with hearing aids and Cochlear implants. Arch. Otolaryng. 107: 160-3, 1981.
69. PICKLES, J.O. The Physiology of the Cochlea. In Gray, R.F. Cochlear Implants. College Hill Press, San Diego, pp. 27-49, 1985.
70. POPE, M., MIYAMOTO, R.T., MYRES, W.A. et alli. Cochlear Implant candidate selection. Ear and Hearing 7(2): 24-26, 1986.
71. PUNCH, J.L., ROBBINS, A.M., MYRES, W. et alii. Relationships among selected measures of single-channel Cochlear Implant performance. Ear and Hearing 8(1): 37-43,1986.
72. REBSCHER, S.J. Cochlear Implant design and construction. In Gray, R.F. Cochlear Implants. CoIIege Hill Press, San Diego, pp. 74-123,1985.
73. ROBBINS, A.M., OSBERGER, M.J., MIYAMOTO, R.T. Speech-Tracking performance in single-channel Cochlear implant subjects. Journal of Speech and Hearing Research 28: 565-78, 1985.
74. ROSENBERG, R.A., COHEN, N.L., REEDE, D.L. Radiographic imaging for the Cochlear implant. Ann. Otol. Rhinol. Laryngol. 96(3): 300-4, 1987.
75. SCHUKNECHT, H. Meeting Report. In Merzenich, M.M., Schindler, R.A. & Soy. Proc. First Intern. Conf. Electrical Stimulation of the Acoustic Nerve as a Treatment for Profund Sensorineural Deafness in Man. University of California, San Diego, pp. 37-46,1974.
76. SIMMONS, F.B. Meeting Report. In Merzenich, M.M., Schindler, R.A. & Soy. Proc. First Intern. Conf. Electrical Stimulation of the Acoustic Nerve as a Treatment for Profound Sensorineural Deafness in Man. University of California, San Diego, pp. 123-6, 1974.
77. SIMMONS, F.B. Electrical stimulation of the auditory nerve in man. Arch. Otolaryngol. 84(1): 2-54,1966.
78. SIMMONS, F.B. Implant patient selection. In Schindler, R.A. & Merzenich, M.M. Cochlear Implants. Raven Press, New York, pp.383-7,1985.
79. SIMMONS, F.B. & SMITH, L. Estimating Nerve survival by Eectrical ABR. Ann. NY. Acad. SF. 405: 422-3, 1983.
80. SPOENDLIN, H. Meeting Report. In Merzenich, M.M., Schindler, R.A. & Soy. Proc. First Intern. Conf. Electrical Stimulation of the Acoustic Nerve as a Treatment for Profound Sensorineural Deafness in Man. University of California, San Diego, pp. 7-74, 1974.
81. STAR, A. & BRACKMANN, D,E. Brainstem potentials evoked by Electrical stimulation of the Cochlea in human subjects. Ann. Otol. Rhinol. Laryngol. 88: 550-556, 1979.
82. STEVENS, K.N. Acoustic properties used for the identification of speech sounds. In Parkins, C.W. & Anderson, S.W. Symposium of Cochlear Prosthesis. Ann. NYAcad. Sc.405: 2-17, 1983.
83. VOLTA, A. On the electricity excited by mere contact of conducting substances of different kinds. Trans Royal Soc. Phil. 90: 403-431,1800.
Endereço da Autora:
1321 North Meridian St. Apt. 413
Indianapolis, IN 26.202 - USA
Médica otorrinolaringologista presentemente em programa de aperfeiçoamento no Departament of ENT of the Indiana University School of Medicine (IUSM), Indianapolis, IN 46223


