Ano: 2013 Vol. 79 Ed. 3 - Maio - Junho - (18º)
Seção: Artigo Original
Páginas: 375 a 381
Genótipos de vírus de papiloma humano em carcinoma de células escamosas de cabeça e pescoço na Colômbia
Human papillomavirus types in cases of squamous cell carcinoma of head and neck in Colombia
Autor(es): Katherine Quintero1; Gabriel A. Giraldo2; Mary L. Uribe3; Armando Baena4; Carolina Lopez5; Efrain Alvarez6; Gloria I Sanchez7
DOI: 10.5935/1808-8694.20130065
Palavras-chave: infecções por papillomavirus; neoplasias de cabeça e pescoço; neoplasias laríngeas; neoplasias orofaríngeas; vacinas contra papillomavirus.
Keywords: papillomavirus vaccines; oropharyngeal neoplasms; head and neck neoplasms; papillomavirus infections; laryngeal neoplasms.
Resumo:
Estimar a prevalência de tipos do vírus de papiloma humano (HPV) em câncer de cabeça e pescoço (CCP) é relevante para se prever o impacto da vacina contra o HPV.
OBJETIVO: Estimar a prevalência global, por gênero e idade, do vírus do HPV em CCP.
MÉTODO: Estudo transversal, retrospectivo envolvendo quatro laboratórios de patologia de Medellín, Colômbia. O exame utilizado foi o PCR GP5+/6+ e hibridização reversa. Além disso, os HPV 16 e 18 foram identificados utilizando-se PCR específica para esses tipos.
RESULTADOS: Foram incluídos 175 casos primários de CCP, consecutivamente diagnosticados entre 1999 e 2008, com diagnóstico confirmado e DNA amplificado. A prevalência de HPV foi de 18,9%. O HPV foi encontrado em 23,9%, 17,5% e 13,3% dos casos de cavidade oral, laringe e orofaringe, respectivamente. Entre os casos de VPH+, 82% foram HPV 16 e 18% HPV18. A maioria dos casos foi de pessoas do sexo masculino. Nos homens, a idade de diagnóstico foi menor do que nas mulheres, principalmente naqueles de acometimento na cavidade oral.
CONCLUSÃO: Os HPV 16 e 18 foram encontrados em quase 20% desses casos de CCP. O impacto da vacinação contra o HPV para a prevenção desse câncer na população merece maiores estudos.
Abstract:
Estimating the type-specific prevalence of human papillomavirus (HPV) in head and neck cancer (HNSCC) is helpful in predicting the impact of HPV immunization.
OBJECTIVE: To estimate the overall prevalence, and gender and age-specific prevalence of HPV in HNSCC.
METHOD: This cross sectional retrospective study was carried out in four pathology laboratories of Medellin, Colombia. HPV testing was performed by GP5+/6+ PCR-based RLB and HPV 16 and 18 type-specific PCR.
RESULTS: 175 primary HNSCC cases consecutively diagnosed between 1999 and 2008 with confirmed diagnosis and amplifiable DNA were included. Overall HPV prevalence was 18.9%. HPV was found in 23.9%, 17.5% and 13.3% of the oral cavity, larynx and oropharynx cases respectively. Among HPV positive cases, 82% were HPV 16 and 18% were HPV 18. No other HPV genotypes were identified. Most patients were males. Male patients were younger that their female counterparts, particularly in oral cavity cancer cases.
CONCLUSION: HPV 16 and 18 genotypes were found in nearly 20% of HNSCC cases in Colombian patients. The impact of HPV vaccination for the prevention of HNSCC in this population deserves further evaluation.
![]()
INTRODUÇÃO
O carcinoma espinocelular (CEC) de cabeça e pescoço é o quinto tipo mais comum de câncer no mundo, com cerca de 600.000 casos diagnosticados em 2008 1. A maioria tem origem nas células escamosas da cavidade oral, orofaringe, nasofaringe, hipofaringe e laringe. Tabagismo e etilismo são fatores de risco conhecidos2 e o vírus Epstein-Barr foi reconhecido como causa de câncer de nasofaringe3.
A relação do papilomavírus humano (HPV) com um subconjunto de casos de CEC de cabeça e pescoço encontra-se estabelecida4-7. Casos de CEC de cabeça e pescoço HPV-positivos são associados a idade mais baixa, predominância de sexo masculino e comportamento sexual de risco, como alto número de parceiros e histórico de sexo oral8-10. Pacientes com CEC de cabeça e pescoço HPV-negativos apresentam correlação mais forte com a combinação de tabagismo, etilismo e má higiene oral11. Tumores localizados em amígdalas e base da língua estão mais frequentemente associados a HPV, mas o vírus também já foi observado em tumores de cavidade oral e laringe.
Uma revisão sistemática que incluiu 5.046 peças de CEC de cabeça e pescoço de 60 estudos que utilizaram métodos baseados em PCR para detectar genótipos de HPV12 demonstrou e estimou uma prevalência de DNA de HPV em cerca de 25,9% dos tumores avaliados. A prevalência foi significativamente mais elevada em tumores da orofaringe (35,6%; intervalo de 11% a 100%) do que em casos de acometimento da cavidade oral (23,5%; intervalo de 40% a 80%) ou laringe (24,0%; intervalo de 0% a 100%), com predominância do genótipo HPV 16. Dentre os tumores HPV-positivos, o HPV 16 foi o genótipo mais frequente em CEC de cabeça e pescoço da orofaringe (86,7%), seguido por laringe (69,2%) e cavidade oral (68,2%). O HPV 18 foi o segundo genótipo mais frequente: 2,8% em carcinomas de orofaringe, 34,1% de cavidade oral e 17% de laringe.
Em 2009, a Agência Internacional para Pesquisas sobre Câncer avaliou as evidências disponíveis sobre carcinogenicidade do HPV e concluiu que há evidências suficientes sobre a carcinogenicidade do HPV 16 na cavidade oral, orofaringe e amígdalas, além de evidências limitadas sobre o HPV enquanto carcinógeno na laringe3. Há significativas variações geográficas e temporais sobre a incidência de CEC de cabeça e pescoço. Apesar do declínio no número de casos de CEC de cabeça e pescoço não relacionados a HPV observado na Europa e na América do Norte, foi observado um aumento na tendência temporal da incidência de câncer de orofaringe relacionado a HPV na última década9,13-15.
Foi sugerido que as variações regionais na incidência global e sítio-específicas de CEC de cabeça e pescoço podem se dever ao uso de álcool e fumo, e que as variações temporais podem se dever a mudanças no comportamento sexual e aumento da exposição à infecção por HPV16,17. Apesar da baixa prevalência de HPV em casos de CEC de cabeça e pescoço18, o Brasil apresenta a mais elevada incidência de CEC de cabeça e pescoço dentre os países da América do Sul1,16. A prevenção das doenças causadas pelo HPV é baseada na introdução de vacinas profiláticas que são altamente eficazes na prevenção da infecção por HPV19-21. As vacinas atualmente disponíveis incluem HPV 16 e 18, os dois genótipos de maior prevalência em casos de CEC de cabeça e pescoço. Portanto, espera-se que estas vacinas tenham impacto sobre este tipo de câncer22.
Não há muito estudos na América do Sul sobre a prevalência de HPV em CEC de cabeça e pescoço. O objetivo do presente estudo foi determinar a prevalência dos genótipos de HPV em CEC de cabeça e pescoço por idade e gênero em tumores de cavidade oral, orofaringe e laringe, observada em quatro laboratórios de patologia na cidade de Medellin, na Colômbia.
MÉTODO
Desenho do estudo e população
O presente estudo é uma pesquisa transversal retrospectiva. Cento e setenta e cinco casos consecutivos de CEC de cabeça e pescoço diagnosticados entre 1999 e 2008, identificados nos registros dos departamentos de patologia e das escolas de medicina e odontologia da Universidade de Antioquia e do laboratório de patologia e citologia do departamento de patologia do Hospital Universitário Fundacion San Vicente de Paul foram incluídos no estudo. As lâminas com a histologia de cada um dos casos foram colhidas para a confirmação do diagnóstico patológico e os respectivos blocos de parafina dos casos confirmados foram separados para avaliação. Os dados epidemiológicos sobre sexo, ano do diagnóstico e sítio da lesão foram obtidos a partir dos laudos de anatomia patológica.
Microdissecção e extração de DNA
Cinco cortes histológicos foram obtidos a partir de cada bloco de parafina. A primeira e a última seção foram coradas com hematoxilina e eosina (H&E) para avaliação histológica, enquanto as demais foram submetidas a processo de microdissecção da lesão. Após a confirmação histológica, as lesões foram circuladas e as áreas correspondentes dos tumores submetidas à microdissecção a partir das lâminas não coradas. Bisturi cirúrgico esterilizado foi utilizado em cada caso. O material dissecado foi transferido para tubos não silicone. Xileno (350 µL) foi somado a cada amostra para dissolver a parafina. O tecido livre de parafina foi precipitado com 150 µL de etanol 100% frio e submetido à centrifugação. O material resultante foi deixado para secar em temperatura ambiente durante a noite. A peça seca foi ressuspendida em 100 µL de solução de proteinase K (10 mg/mL de proteinase K em 50 mM Tris, pH 8,3) e incubada durante a noite a 37ºC. Enfim, as amostras foram incubadas a 95ºC por oito minutos para desativar a proteinase K e armazenadas a -20ºC até o seu uso. O corte dos blocos de parafina e a extração de DNA foram conduzidos meticulosamente para evitar contaminação. Blocos de parafina com tecido normal foram incluídos a cada 22 amostras processadas. Controles positivos com tecido positivo para HPV de câncer de colo de útero foram incluídos em blocos de parafina. A qualidade do DNA foi avaliada pela amplificação de um segmento de 209 pares de base do gene humano da β-globina.
Detecção do DNA do HPV
Inicialmente, o DNA do HPV foi detectado pelo primer geral GP5+/6+ PCR, como descrito anteriormente23, seguido da genotipagem dos produtos de PCR por hibridização da linha reversa por blot com marcadores específicos para 37 diferentes genótipos de HPV (HPV tipos 6, 11, 16, 18, 26, 31, 33, 34, 35, 39, 40, 42, 43 , 44, 45, 51, 52, 53, 54, 55, 56, 57, 58, 59, 61, 66, 68, 70, 71, 72, 73, 81, 82/IS39, 82/MM4, 83, 84 , CP6108). Todas as amostras negativas na hibridização após GP5+/6+ PCR foram submetidas a testes de PCR específicos para HPV 16 e 18 24. Os primers utilizados neste procedimento amplificam um fragmento de 96 pares de base (HPV-16) e 115 pares de base (HPV-18) do gene E6, visualizados em gel de agarose 2% corados com brometo de etídio.
Análise estatística
Os casos foram descritos em termos de idade, gênero e sítio do tumor. O percentual de casos positivos para qualquer genótipo de HPV, HPV 16 e HPV 18 foram estimados dentre as amostras de boa qualidade (β-globinapositivas e/ou HPV-positivas). Foi feita análise descritiva da frequência das características epidemiológicas dos casos de infecção por HPV. Subsequentemente, o risco de infecção por HPV (para qualquer genótipo) foi estimado em termos absolutos e ajustados pelas odds ratios de faixa etária, com seus respectivos intervalos de confiança por meio de regressão logística. O teste não paramétrico de Mann-Whitney foi utilizado na comparação das diferenças entre faixas etárias segundo a condição HPV.
Estes testes também foram executados para HPV 16, o genótipo mais comum. O nível de significância de 5% foi adotado em todas as análises. Os resultados foram calculados com o uso do pacote estatístico R versão 2.12.2 (R Development Core Team (2011). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Viena, Áustria. ISBN 3-900051-07-0, URL. (http://www.R-project.org/ http://www.R-project.org/).
Considerações éticas
O presente estudo foi aprovado pela comissão de bioética do Comitê de Pesquisa da Escola de Odontologia da Universidade de Antioquia (Conceito 02-2011, 18 de maio de 2011). O anonimato dos participantes foi garantido em todos os procedimentos. Foram atendidos os preceitos ditados pela Declaração de Helsinque da Associação Médica Mundial, bem como os princípios éticos para pesquisa com seres humanos contidos nas Diretrizes Éticas Internacionais para Estudos Epidemiológicos do Conselho de Organizações Internacionais de Ciências Médicas (CIOMS) em colaboração com a Organização Mundial da Saúde (OMS) de 2008.
RESULTADOS
Descrição dos casos
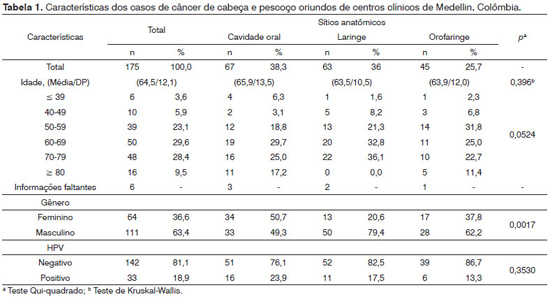
As características dos 175 casos incluídos na presente análise encontram-se na Tabela 1. Lesões na cavidade oral foram observadas em 38,3% dos casos; tumores laríngeos contabilizaram 36% dos casos; e 25,7% dos casos eram de lesão na orofaringe. As idades variaram entre 22 e 97 anos. A idade média de diagnóstico foi de 64,5/(12,1) anos. Em termos gerais, não houve diferença na idade média/DP no momento do diagnóstico das lesões nos vários sítios, mas os tumores de cavidade oral foram diagnosticados em idade mais baixa em homens (dado não exibido). A ampla maioria dos casos tinham entre 50 e 70 anos de idade e eram do sexo masculino (63,4%, 111/175). A distribuição de casos na cavidade oral foi semelhante entre homens e mulheres. Contudo, o percentual de casos de acometimento de laringe (20,6% x 79,4%) e orofaringe (37,8% x 62,2%) foi significativamente mais elevado em indivíduos do sexo masculino (teste do Qui-quadrado p = 0,0017).
Genotipagem de HPV
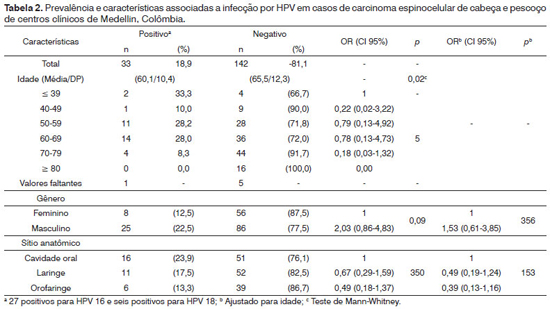
A Tabela 2 descreve a prevalência de HPV e fatores associados ao HPV das 175 amostras. A prevalência geral de DNA de HPV em casos de CEC de cabeça e pescoço foi de 18,9%. HPV foi identificado em 23,9%, 17,5% e 13,3% dos casos de acometimento da cavidade oral, laringe e orofaringe, respectivamente, Vinte e sete amostras (15,4%) eram positivas para HPV 16 e seis (3,42%) para HPV 18. Apesar da idade média dos casos ser de cerca de 64 anos, foi identificada prevalência mais elevada de HPV entre casos mais jovens. Com efeito, a idade média/ (DP) dos casos HPV-positivos foi de 60,1/(10,14) anos, comparados a 65,5/(12,3) anos dos casos negativos, configurando diferença estatisticamente significativa (teste de Mann-Whitney p = 0,02). A proporção dos casos de CEC de cabeça e pescoço HPV-positivos foi mais elevada em homens (22,5%) do que em mulheres (12,5%). A probabilidade de positividade de HPV nos casos de CEC de cabeça e pescoço foi duas vezes maior em homens do que em mulheres, ainda que tal probabilidade mais elevada não reflita significância estatística (OR 2,0; CI 95%: 0,86-4,83) e seja reduzida após o ajuste para idade (OR: 1,53; CI 95%: 0,61-3,85). Apesar da proporção de casos HPV-positivos ter sido mais elevada entre casos de acometimento da cavidade oral, não houve diferença significativa entre estes e os casos de tumores de laringe e orofaringe mesmo após ajuste para idade. A análise restrita a casos positivos para HPV 16 também revelou idade média (60,3/11,4) de casos positivos mais baixa que a de casos negativos (65,3/12,1), sem, contudo, suscitar diferença estatisticamente significativa (teste de Mann-Whitney p = 0,06). Não houve diferença significativa entre os percentuais de casos HPV-positivos de CEC de cabeça e pescoço diagnosticados entre 1999-2003 e 2004-2008 (dados não exibidos).
DISCUSSÃO
A associação causal entre HPV e um subconjunto de casos de CEC de cabeça e pescoço foi demonstrada5-7. Estudos sugerem que o HPV esteja associado a 25%-60% destes casos12. A confirmação da associação entre HPV e câncer abre a oportunidade para a implementação de estratégias de prevenção fundamentadas no controle da infecção por HPV. As vacinas profiláticas para HPV atualmente disponíveis têm demonstrado eficácia próxima de 100% na prevenção da infecção por HPV 16 e 18, com redução projetada no risco de câncer de colo de útero de 50%-70% e impacto significativo sobre as doenças não-genitais relacionadas ao HPV22. A possibilidade de se reduzir a incidência destes tumores pode depender em parte do montante de casos atribuídos aos genótipos incluídos nas vacinas disponíveis. Poucas são as estimativas da contribuição dos genótipos de HPV para casos de CEC de cabeça e pescoço nos países latino-americanos12.
No presente artigo, descrevemos as características demográficas de 175 casos consecutivos de CEC de cabeça e pescoço diagnosticados ao longo de dez anos (1999-2008) e a prevalência de HPV em tais casos. Nossos resultados demonstram prevalência de HPV semelhante à de outros estudos conduzidos em várias regiões do mundo12, mas revelam prevalência mais elevada que a de um estudo que incluiu casos de Brasil, Cuba e Argentina18. Tais achados refletem as observações de variabilidade geográfica tocante à prevalência do HPV em CEC de cabeça e pescoço no mundo. Nosso estudo também identificou que, entre as amostras HPV-positivas, o HPV 16 esteve presente em 82% dos casos e o HPV 18 em 18%. Estes resultados estão em conformidade com dados amplamente relatados que implicam o HPV 16 com a maioria dos casos de CEC de cabeça e pescoço12,25.
Como foi descrito26, também observamos que apesar da alta proporção de casos de CEC de cabeça e pescoço diagnosticados em indivíduos com mais de 50 anos, os pacientes HPV-positivos tendem a ser mais jovens que os HPV-negativos (60,1 x 65,5; teste de Mann-Whitney p = 0,02). Esta diferença persistiu mesmo quando a análise incluiu apenas casos positivos para HPV 16, a despeito da ausência de diferença estatisticamente significativa (dados não exibidos). A prevalência de HPV em CEC de cabeça e pescoço no presente estudo foi mais elevada que aquela observada em casos do Brasil, Argentina e Cuba18. Devido à natureza de nosso estudo, não foi possível coletar informações sobre tabagismo e etilismo. Foi indicado que as proporções de sítios anatômicos incluídos na análise podem influenciar as diferenças de prevalência observadas.
A proporção de tumores de cavidade oral, laringe e orofaringe em tal estudo foram de 31%, 49% e 19%, respectivamente, dado semelhante à proporção de casos citados em nosso estudo. O CEC de cabeça e pescoço é um tumor epitelial maligno com diferenciação espinocelular caracterizada pela formação de queratina, pela presença de pontes intercelulares ou ambas. As características histopatológicas avaliadas em estudos de biópsia e ressecções demonstraram CEC de bem a moderadamente diferenciado, tumores queratinizantes na maioria dos casos, infiltrado inflamatório peritumoral de moderado a grave e padrão de invasão expansivo ou infiltrativo independente do sítio de acometimento tumoral. O HPV foi associado como fator de risco para CEC de cabeça e pescoço não queratinizante nas áreas tonsilar (orofaringe e cavidade oral) e nasossinusal.
Em nosso estudo, a proporção de casos HPV-positivos de cavidade oral foi mais elevada que a de casos de laringe e orofaringe (sem incluir área nasossinusal). Mas estas diferenças não foram estatisticamente significativas após ajuste para idade. O tecido linfoide do anel tonsilar na região da cabeça e pescoço consiste das tonsilas palatina, faríngea e lingual, o que significa que o mesmo é distribuído principalmente ao longo da orofaringe, mas que também envolve a cavidade oral. Vale a pena observar que as biópsias avaliadas representaram, principalmente, a área superficial do tumor e não incluíram representações de tecidos não neoplásicos, em que o tecido tonsilar pode ser mais facilmente reconhecido.
Apesar do tecido tonsilar não ter sido observado nas biópsias de cavidade oral, não podemos excluir a partir das lâminas de histologia o fato de que, em alguns casos, o tumor pode acometer ou se originar nas tonsilas, o que poderia explicar a prevalência mais elevada de DNA de HPV em casos de tumor na cavidade oral. Na mesma linha, talvez nossos casos de orofaringe não tenham incluído o mesmo número de tumores das tonsilas, levando, assim, à subestimação da prevalência de HPV. Além disso, foi relatado que o reconhecimento da morfologia não queratinizante tem baixa reprodutibilidade27. Outro motivo podem ser os métodos usados para determinar a exposição ao HPV. Para a avaliação das estimativas de prevalência em CEC de cabeça e pescoço, foram utilizados testes sorológicos que detectam anticorpos contra as proteínas L1, E6 e E7.
Apesar desses ensaios serem biomarcadores úteis na definição do papel do HPV em CEC de cabeça e pescoço, eles podem apresentar algumas limitações quando utilizados para estimar a fração dos casos de câncer atribuíveis ao HPV. Por exemplo, os anticorpos contra L1 são marcadores de exposição atual ou passada a infecção por HPV em qualquer sítio anatômico, incluindo infecções anogenitais. Sua correlação com a presença de DNA no sítio da lesão é bastante fraca28. Os anticorpos contra as proteínas E6 e E7 se correlacionam com câncer invasivo pelo menos em tumores de colo uterino, mas apenas 60%-70% dos casos de CEC de cabeça e pescoço são positivos para tais anticorpos29. Em câncer de colo uterino, o método mais preciso para avaliar a exposição a HPV é o PCR de DNA de HPV extraído de lesões tumorais microdissecadas30, mas o uso de blocos de parafina exige a implementação de métodos comprovados com alta sensibilidade em material incluído em parafina.
Apesar da biópsia de congelação produzir DNA de boa qualidade, ela impede a condução de identificação e microdissecção do tumor. Com efeito, a potência de nosso estudo reside no uso de blocos de parafina, que foram novamente cortados para análise da patologia e extração do DNA a partir do material dissecado de tumores identificados por análise de anatomia patológica. Também avaliamos a qualidade do DNA por meio da amplificação de um segmento de 209 pares de base do gene da β-globina e da utilização de dois testes de PCR específicos que amplificam fragmentos de dimensões menores (96 pares de base para HPV 16 e 115 para HPV 18) e o gene E6, com sensibilidade elevada demonstrada para este tipo de amostra24.
Ainda que não possamos descartar por completo a possibilidade de falsos negativos por conta de artefatos técnicos, o uso de PCR tipo-específico para HPV 16 e 18 pode ajudar a superar tal limitação, especialmente por serem estes os genótipos predominantes em CEC de cabeça e pescoço. As possíveis limitações de nosso estudo incluem o viés de seleção das amostras. Os casos foram colhidos apenas a partir de quatro laboratórios locais, e não podemos excluir a probabilidade de tais casos não representarem a população total de casos de CEC de cabeça e pescoço diagnosticados na região. Em comparação a Brasil, Cuba e Argentina, as taxas de incidência de CEC de cabeça e pescoço na Colômbia são mais baixas31. O consumo anual per capita de cigarros na Colômbia também é mais baixo32,33. Seria útil avaliar a prevalência de HPV em casos de CEC de cabeça e pescoço no contexto destes perfis epidemiológicos para verificar a fração atribuída a cada fator de risco do CEC de cabeça e pescoço.
CONCLUSÃO
A prevalência de HPV em nossa casuística de quatro laboratórios da cidade de Medellin, Colômbia, foi de 18,9%. O HPV foi encontrado em 23,9%, 17,5% e 13,3% dos casos de acometimento de cavidade oral, laringe e orofaringe, respectivamente. Vinte e sete amostras continham HPV 16 (16,4%) e seis (3,42%) apresentavam HPV 18. Dentre os casos HPV-positivos, 82% eram HPV 16 e 18% HPV 18. Nenhum outro genótipo de HPV foi identificado. Segundo estes dados, a introdução em massa de vacinação contra HPV poderá possivelmente reduzir o número de casos de CEC de cabeça e pescoço na Colômbia. Contudo, a ordem de grandeza de tal efeito é atualmente difícil de prever e requer a elaboração de ensaios clínicos projetados especificamente para avaliar a eficácia da vacinação na prevenção da infecção oral por HPV e redução dos casos de câncer de cabeça e pescoço.
AGRADECIMENTOS
Apoio financeiro: a presente pesquisa teve o apoio parcial da Estratégia de Sustentabilidade 2011-2012 da Universidade de Antioquia, Comitê de Pesquisas, (Código BUPP E01350), Universidade de Antioquia. Agradecemos ao Dr. David Suescun, médico patologista, pela sua contribuição na busca de registros e blocos de parafina de casos de CEC de cabeça e pescoço.
REFERÊNCIAS
1. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127(12):2893-917. http://dx.doi.org/10.1002/ijc.25516 PMid:21351269
2. Pelucchi C, Gallus S, Garavello W, Bosetti C, La Vecchia C. Alcohol and tobacco use, and cancer risk for upper aerodigestive tract and liver. Eur J Cancer. Prev 2008;17(4):340-4. http://dx.doi.org/10.1097/CEJ.0b013e3282f75e91 PMid:18562959
3. Bouvard V, Baan R, Straif K, Grosse Y, Secretan B, El Ghissassi F, et al.; WHO International Agency for Research on Cancer Monograph Working Group. A review of human carcinogens--Part B: biological agents. Lancet Oncol. 2009;10(4):321-2. http://dx.doi.org/10.1016/S1470-2045(09)70096-8
4. Herrero R. Chapter 7: Human papillomavirus and cancer of the upper aerodigestive tract. J Natl Cancer Inst. Monogr. 2003(31):47-51. http://dx.doi.org/10.1093/oxfordjournals.jncimonographs.a003482 PMid:12807945
5. D'Souza G, Kreimer AR, Viscidi R, Pawlita M, Fakhry C, Koch WM, et al. Case-control study of human papillomavirus and oropharyngeal cancer. N Engl J Med. 2007;356(19):1944-56. http://dx.doi.org/10.1056/NEJMoa065497 PMid:17494927
6. Pintos J, Black MJ, Sadeghi N, Ghadirian P, Zeitouni AG, Viscidi RP, et al. Human papillomavirus infection and oral cancer: a case-control study in Montreal, Canada. Oral Oncol. 2008;44(3):242-50. http://dx.doi.org/10.1016/j.oraloncology.2007.02.005 PMid:17467327
7. Herrero R, Castellsagué X, Pawlita M, Lissowska J, Kee F, Balaram P, et al.; IARC Multicenter Oral Cancer Study Group. Human papillomavirus and oral cancer: the International Agency for Research on Cancer multicenter study. J Natl Cancer Inst. 2003;95(23):1772-83. http://dx.doi.org/10.1093/jnci/djg107 PMid:14652239
8. Chaturvedi AK. Epidemiology and clinical aspects of HPV in head and neck cancers. Head Neck Pathol. 2012;6 Suppl 1:S16-24. http://dx.doi.org/10.1007/s12105-012-0377-0 PMid:22782220
9. Mehanna H, Beech T, Nicholson T, El-Hariry I, McConkey C, Paleri V, et al. Prevalence of human papillomavirus in oropharyngeal and nonoropharyngeal head and neck cancer-systematic review and meta-analysis of trends by time and region. Head Neck 2012. [Epub ahead of print].
10. Heck JE, Berthiller J, Vaccarella S, Winn DM, Smith EM, Shan'gina O, et al. Sexual behaviours and the risk of head and neck cancers: a pooled analysis in the International Head and Neck Cancer Epidemiology (INHANCE) consortium. Int J Epidemiol. 2010;39(1):166-81. http://dx.doi.org/10.1093/ije/dyp350 PMid:20022926 PMCid:2817092
11. Gillison ML, D'Souza G, Westra W, Sugar E, Xiao W, Begum S, et al. Distinct risk factor profiles for human papillomavirus type 16-positive and human papillomavirus type 16-negative head and neck cancers. J Natl Cancer Inst. 2008;100(6):407-20. http://dx.doi.org/10.1093/jnci/djn025 PMid:18334711
12. Kreimer AR, Clifford GM, Boyle P, Franceschi S. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev. 2005;14(2):467-75. http://dx.doi.org/10.1158/1055-9965.EPI-04-0551 PMid:15734974
13. Forte T, Niu J, Lockwood GA, Bryant HE. Incidence trends in head and neck cancers and human papillomavirus (HPV)-associated oropharyngeal cancer in Canada, 1992-2009. Cancer Causes Control. 2012;23(8):1343-8. http://dx.doi.org/10.1007/s10552-012-0013-z PMid:22718355
14. Isayeva T, Li Y, Maswahu D, Brandwein-Gensler M. Human papillomavirus in non-oropharyngeal head and neck cancers: a systematic literature review. Head Neck Pathol. 2012;6 Suppl 1:S104-20. http://dx.doi.org/10.1007/s12105-012-0368-1 PMid:22782230
15. Wang XI, Thomas J, Zhang S. Changing trends in human papillomavirus-associated head and neck squamous cell carcinoma. Ann Diagn Pathol. 2012;16(1):7-12. http://dx.doi.org/10.1016/j.anndiagpath.2011.07.003 PMid:22001331
16. Curado MP, Hashibe M. Recent changes in the epidemiology of head and neck cancer. Curr Opin Oncol. 2009;21(3):194-200. http://dx.doi.org/10.1097/CCO.0b013e32832a68ca PMid:19363341
17. Lambert R, Sauvaget C, de Camargo Cancela M, Sankaranarayanan R. Epidemiology of cancer from the oral cavity and oropharynx. Eur J Gastroenterol Hepatol. 2011;23(8):633-41. http://dx.doi.org/10.1097/MEG.0b013e3283484795 PMid:21654320
18. Ribeiro KB, Levi JE, Pawlita M, Koifman S, Matos E, Eluf-Neto J, et al. Low human papillomavirus prevalence in head and neck cancer: results from two large case-control studies in high-incidence regions. Int J Epidemiol. 2011;40(2):489-502. http://dx.doi.org/10.1093/ije/dyq249 PMid:21224273
19. De Carvalho N, Teixeira J, Roteli-Martins CM, Naud P, De Borba P, Zahaf T, et al. Sustained efficacy and immunogenicity of the HPV-16/18 AS04-adjuvanted vaccine up to 7.3 years in young adult women. Vaccine. 2010;28(38):6247-55. http://dx.doi.org/10.1016/j.vaccine.2010.07.007 PMid:20643092
20. FUTURE I/II Study Group,Dillner J, Kjaer SK, Wheeler CM, Sigurdsson K, Iversen OE, Hernandez-Avila M, et al. Four year efficacy of prophylactic human papillomavirus quadrivalent vaccine against low grade cervical, vulvar, and vaginal intraepithelial neoplasia and anogenital warts: randomised controlled trial. BMJ. 2010;341:c3493. http://dx.doi.org/10.1136/bmj.c3493 PMid:20647284 PMCid:2907480
21. Fairley CK, Hocking JS, Gurrin LC, Chen MY, Donovan B, Bradshaw CS. Rapid decline in presentations of genital warts after the implementation of a national quadrivalent human papillomavirus vaccination programme for young women. Sex Transm Infect. 2009;85(7):499-502. http://dx.doi.org/10.1136/sti.2009.037788 PMid:19837728
22. Gillison ML, Chaturvedi AK, Lowy DR. HPV prophylactic vaccines and the potential prevention of noncervical cancers in both men and women. Cancer. 2008;113(10 Suppl):3036-46. http://dx.doi.org/10.1002/cncr.23764 PMid:18980286
23. van den Brule AJ, Pol R, Fransen-Daalmeijer N, Schouls LM, Meijer CJ, Snijders PJ. GP5? PCR followed by reverse line blot analysis enables rapid and high-throughput identification of human papillomavirus genotypes. J Clin Microbiol. 2002;40(3):779-87. http://dx.doi.org/10.1128/JCM.40.3.779-787.2002 PMid:11880393 PMCid:120256
24. Baay MF, Quint WG, Koudstaal J, Hollema H, Duk JM, Burger MP, et al. Comprehensive study of several general and type-specific primer pairs for detection of human papillomavirus DNA by PCR in paraffin-embedded cervical carcinomas. J Clin Microbiol. 1996;34(3):745-7. PMid:8904451 PMCid:228883
25. Giuliano AR, Tortolero-Luna G, Ferrer E, Burchell AN, de Sanjose S, Kjaer SK, et al. Epidemiology of human papillomavirus infection in men, cancers other than cervical and benign conditions. Vaccine. 2008;26 (Suppl 10):K17-28. http://dx.doi.org/10.1016/j.vaccine.2008.06.021 PMid:18847554
26. Johnson-Obaseki S, McDonald JT, Corsten M, Rourke R. Head and neck cancer in Canada: trends 1992 to 2007. Otolaryngol Head Neck Surg. 2012;147(1):74-8. http://dx.doi.org/10.1177/0194599812437332 PMid:22328702
27. Lewis JS Jr, Khan RA, Masand RP, Chernock RD, Zhang Q, Al-Naief NS, et al. Recognition of nonkeratinizing morphology in oropharyngeal squamous cell carcinoma - a prospective cohort and interobserver variability study. Histopathology. 2012;60(3):427-36. http://dx.doi.org/10.1111/j.1365-2559.2011.04092.x PMid:22211374
28. Schiffman M, Safaeian M, Wentzensen N. The use of human papillomavirus seroepidemiology to inform vaccine policy. Sex Transm Dis. 2009;36(11):675-9. http://dx.doi.org/10.1097/OLQ.0b013e3181bce102 PMid:19773679
29. Kreimer AR, Clifford GM, Snijders PJ, Castellsagué X, Meijer CJ, Pawlita M, et al. HPV16 semiquantitative viral load and serologic biomarkers in oral and oropharyngeal squamous cell carcinomas. Int J Cancer. 2005;115(2):329-32. http://dx.doi.org/10.1002/ijc.20872 PMid:15688391
30. Odida M, de Sanjose S, Sandin S, Quiros B, Alemany L, Lloveras B, et al. Comparison of human papillomavirus detection between freshly frozen tissue and paraffin embedded tissue of invasive cervical cancer. Infect Agent Cancer. 2010;5:15. http://dx.doi.org/10.1186/1750-9378-5-15 PMid:20846370 PMCid:2954863
31. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. GLO-BOCAN 2008, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 10 [Internet]. [Acessed 2012 Oct 10]. Available from: http://globocan.iarc.fr/
32. Mackay J, Ericksen M. The demographics of Tobacco. In: Part six: Table A. Geneva: World Health Organization;2002. p.94-101.
33. Shafey O, Eriksen M, Ross H, Mackay J. The tobacco atlas, 2009. [Acessed 2011 May 21]. Available from: http://www.tobaccoatlas.org/
1. Médico (Jovem Pesquisador da U de A, Grupo de Infecção e Câncer - Escola de Medicina - Universidade de Antioquia, Medellin, Colômbia).
2. Odontólogo; Mestrado. Cirurgião Buco-Maxilo-Facial (Professor Assistente - Escola de Odontologia - Universidade de Antioquia e Clínica Las Vegas, Medellin, Colômbia).
3. Bacharel; Mestre (Doutorando - Universidade de Alicante, Alicante, Espanha).
4. Profissional de Estatística (Doutorando em Epidemiologia - Grupo de Infecção e Câncer - Universidade de Antioquia, UdeA, Medellin, Colômbia).
5. Médico; Patologista (Professor Assistente - Departamento de Patologia - Escola de Medicina - Universidade de Antioquia, Medellin, Colômbia).
6. Odontólogo; Mestre (Professor Associado da Escola de Odontologia - Universidade de Antioquia, Medellin, Colômbia).
7. Mestre; Doutor (Professor Associado; Coordenador do Grupo de Infecção e Câncer - Universidade de Antioquia, UdeA, Medellin, Colômbia).
Grupo de Infecção e Câncer, e Departamento de Patologia - Escola de Medicina; Escola de Odontologia; Universidade de Antioquia, Medellin, Colômbia.
Endereço para correspondência:
Gloria I. Sanchez
Grupo Infeccion y Cancer, Facultad de Medicina, Lab 283. Universidad de Antioquia
Cra 51D No 62-29
Medellin, Colômbia
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 11 de outubro de 2012. cod. 10515.
Artigo aceito em 14 de março de 2013.
Esse trabalho de pesquisa recebeu apoio financeiro parcial do Comitê de Pesquisas do Programa de Sustentabilidade da Universidade de Antioquia em 2011-2012 (Código E01350)
Agradecemos ao Dr. David Suescun, patologista por suas contribuições na procura de registros e na preparação de blocos de parafina de casos de CCECCP.