Ano: 2013 Vol. 79 Ed. 3 - Maio - Junho - (13º)
Seção: Artigo Original
Páginas: 342 a 348
Efeito da oxigenação hiperbárica em lesão ototóxica produzida pela amicacina em cobaias
The effects of hyperbaric oxygen therapy upon ototoxic injuries produced by amikacin in guinea pigs
Autor(es): Luciana de Albuquerque Salviano Amora1; Adriana de Andrade Batista Murashima2; Maria Rossato3; Márcia Bento Moreira4; Miguel Ângelo Hyppolito5; Djalma José Fagundes6
DOI: 10.5935/1808-8694.20130060
Palavras-chave: amicacina; cobaias; cóclea; oxigenação hiperbárica.
Keywords: amikacin; cochlea; guinea pigs; hyperbaric oxygenation.
Resumo:
A oxigenação hiperbárica têm favorecido a prevenção e o tratamento de afecções auditivas como a ototoxicidade.
OBJETIVO: Estudar os efeitos da oxigenação hiperbárica em lesão ototóxica promovida pela amicacina. Forma de estudo: Experimental.
MÉTODO: Avaliados aspectos funcionais de 12 cobaias albinas por meio das emissões otoacústicas produtos de distorção e do potencial evocado auditivo de tronco encefálico, antes e após o uso de amicacina (600 mg/kg/dia) e das sessões com oxigenação hiperbárica (2 ATA, 60 minutos). Aspectos morfológicos foram avaliados por meio de microscopia eletrônica de varredura. Grupos de estudo com três animais: grupo 1 - solução salina + oxigenação hiperbárica; grupo 2 - amicacina 8 dias; grupo 3 - amicacina + 7 dias de repouso e grupo 4 - amicacina + oxigenação hiperbárica.
RESULTADOS: Grupo 1 apresentou preservação da funcionalidade e da morfologia durante todo experimento. Grupo 2 demonstrou, ao final do experimento, lesões estatisticamente significantes das células ciliadas com alterações funcionais. Grupos 3 e 4 apresentaram alterações estatisticamente significantes dos aspectos funcionais e morfológicos após o uso da amicacina, mantendo estas alterações após os procedimentos propostos.
CONCLUSÃO: A oxigenação hiperbárica não promoveu alterações na morfologia das células ciliadas da cóclea e aos limiares eletrofisiológicos das cobaias submetidas à amicacina.
Abstract:
Hyperbaric oxygen therapy (HBOT) has enhanced the prevention and treatment of auditory ailments such as ototoxicity.
OBJECTIVE: To study the effects of HBOT upon ototoxic injuries produced by amikacin.
METHOD: This experimental study included 12 albino guinea pigs, whose auditory function was assessed through distortion product otoacoustic emissions (DPOAEs) and brainstem auditory evoked potentials (BAEPs) before and after the administration of amikacin (600 mg/kg/day) and HBOT sessions (2 ATA, 60 minutes). Morphological features were analyzed through scanning electron microscopy. Subjects were divided into four groups, as follows: group 1 - saline solution + HBOT; group 2 - amikacin for 8 days; group 3 - amikacin + seven days of rest; and group 4 - amikacin + HBOT.
RESULTS: Group 1 subjects had preserved function and morphology throughout the experiment; Group 2 subjects had statistically significant levels of hair cell injury and functional impairment; Subjects on groups 3 and 4 had statistically significant functional and morphological impairment after the administration of amikacin, which were still present after the proposed procedures had been carried out.
CONCLUSION: Hyperbaric oxygen therapy did not change the cochlear hair cell morphology or the electro-physiological thresholds of the guinea pigs given amikacin.
![]()
INTRODUÇÃO
Uma grande variedade de medicamentos pode promover, como efeito colateral, uma perturbação transitória ou definitiva na função auditiva e/ou vestibular definida como ototoxicidade medicamentosa1. Os antibióticos aminoglicosídeos fazem parte deste grupo e têm amplo uso, pela sua eficácia e pelo seu baixo custo, na terapêutica de doenças infecciosas. Dentre eles, destaca-se a amicacina, com ocorrência estimada em 13,9% de ototoxicidade2.
A amicacina é utilizada especialmente no grupo pediátrico3,4, com objetivo terapêutico ou profilático e amplamente prescrita no tratamento da sepse e da meningite, bem como no tratamento de bacteremias5, infecções do trato urinário6 e respiratório7,8. O seu emprego proporciona o decréscimo da mortalidade perinatal e o aumento de sobrevida das crianças; no entanto, eleva a possibilidade de sequelas, entre as quais a perda auditiva4.
Estudos experimentais mostram que a amicacina na dose de 400 mg/kg/dia, via intramuscular, provoca completa eliminação das células ciliadas externas (CCE) e lesão parcial das células ciliadas internas (CCI)9,10.
Por outro lado, a oxigenação hiperbárica (OHB), em que o indivíduo é colocado no interior de uma câmara hiperbárica em ambiente com 100% de oxigênio e submetido a uma pressão maior do que a atmosférica, (entre 2 e 3 atmosferas absolutas - ATA)11, tem mostrado efeitos favoráveis em diversas doenças. Atualmente, pesquisas nas áreas da Otorrinolaringologia e da audiologia têm evoluído em parceria com a medicina hiperbárica, de modo específico na modalidade de oxigenação hiperbárica (OHB) na prevenção e no tratamento de afecções como: surdez súbita12-14, perda auditiva induzida por ruído15 e ototoxicidade16.
Com o objetivo de contribuir para o entendimento dos mecanismos fisiopatológicos de otoproteção na orelha interna contra a ototoxicidade induzida por fármacos, este estudo pesquisou especificamente o efeito da OHB sobre as lesões ototóxicas promovidas pela amicacina.
MÉTODO
Estudo clínico e experimental com a aprovação dos Comitês de Ética sob os números de protocolo 035/2011 e 407/10. Os animais escolhidos foram cobaias albinas (Cavia porcellus) -linhagem inglesa, machos, pesando em torno de 400 gramas, selecionadas por meio do reflexo de Preyer.
Amostra
Foram utilizadas 24 cócleas provenientes de 12 cobaias. Os animais foram submetidos à pesquisa das Emissões Otoacústicas Produto de Distorção (EOADP) e ao registro potencial evocado auditivo de tronco encefálico (PEATE) sob anestesia com a associação de cloridrato de cetamina (40 mg/kg) e xilazina (10 mg/kg), pela via intramuscular. Os critérios para inclusão de cobaias na amostra foram EOADP e PEATE presentes. Cobaias com otite, excesso de cerume ou meato acústico externo estreito demais para acomodar a sonda auditiva foram excluídas. Os animais foram distribuídos em quatro grupos:Avaliação funcional auditivaGrupo 1: Três animais (seis cócleas) receberam aplicação subcutânea de solução salina durante 8 dias. Decorridas 48 horas da última aplicação foram submetidas a três sessões de OHB (2 ATA-60 minutos de pressão absoluta) realizadas em dias intercalados, correspondendo ao 11º, 13º e 15º dia de experimento. Grupo 2: Três animais (seis cócleas) receberam amicacina (600 mg/kg/dia), via subcutânea, durante 8 dias consecutivos. Grupo 3: Três animais (seis cócleas) receberam amicacina (600 mg/kg/dia), via subcutânea, durante 8 dias consecutivos. Ficaram em repouso por mais 7 dias, recebendo apenas solução salina via subcutânea. Grupo 4: Três animais (seis cócleas) receberam amicacina (600 mg/kg/dia), via subcutânea, durante 8 dias consecutivos. Decorridas 48 horas de repouso após a última aplicação, foram submetidas a três sessões de OHB (2 ATA - 60 minutos de pressão absoluta) realizadas em dias intercalados, correspondendo ao 11º, 13º e 15º dia de experimento.
A avaliação funcional auditiva foi realizada por meio do exame das EOADP e do registro do PEATE. O equipamento utilizado foi o SMART DPOEA® e o SMART EP® da Intelligent Hearing Systems - Miami/Flórida (EUA).
Os procedimentos para avaliação funcional foram realizados no início do experimento (em todos os grupos), anterior às sessões de OHB (nos grupos 1 e 4), anterior ao Repouso (no grupo 3) e imediatamente anterior à eutanásia (em todos os grupos).
A análise das EOADP seguiu a relação de frequências 2 F(1) - F(2) com relação F(1)/F(2) = 1,22. Foram consideradas as emissões otoacústicas a partir de 1,5 kHz, pois as dimensões do conduto auditivo externo da cobaia fazem com que haja uma dificuldade de detecção das emissões otoacústicas abaixo desta frequência, obtendo respostas que coincidem com as respostas do ruído10. Em conformidade com o relato de outros autores, a intensidade utilizada neste estudo foi de 70 dB NPS para F(1) E F(2)2,16,17.
Para o registro do PEATE, a região do vértex e a região entre as órbitas foram raspadas com lâmina de aço para retirada dos pêlos. A região posterior do pavilhão auricular foi submetida à limpeza com esponja de aço para retirar a oleosidade e melhorar o contato do eletrodo com a pele18. Os eletrodos de superfície foram dispostos da seguinte maneira: um eletrodo positivo no vértex craniano, dois eletrodos negativos na porção posterior do pavilhão das orelhas e um referência (terra) na fronte, entre as órbitas. Os mesmos foram posicionados com interposição de pasta eletrolítica, para melhor condutibilidade do sinal elétrico18.
A estimulação sonora foi realizada por via aérea, através de fones de inserção. O estímulo utilizado foi o clique alternado, com 27,7 estímulos por segundo e duração de 0,1 ms. Frequência fundamental de 1.000 Hz, utilizando a intensidade de 90 dB nHL. O sinal captado pelos eletrodos foi submetido a filtros passa-alta e passa-baixa de 150 e 3.000 Hz, respectivamente. O sinal filtrado e amplificado foi submetido à promediação de 1.024 varreduras dos registros dos potenciais evocados auditivos (PEA), com janela de 12 ms. O resultado final foi fornecido na forma de ondas de potencial elétrico18. Somente a onda I foi considerada para o presente estudo, visto que esta onda registra o potencial no nervo auditivo, fazendo parte ainda do sistema auditivo periférico18. O limiar eletrofisiológico foi pesquisado por meio do oferecimento do estímulo sonoro de maneira decrescente de 10 em 10 dB até o limiar aproximado.
Procedimento de oxigenação hiperbárica
As sessões de OHB foram realizadas no Departamento de Cirurgia Experimental, utilizando uma câmara hiperbárica experimental de pequeno porte, tida como multipaciente. As sessões foram realizadas em dias alternados15, totalizando três sessões. Cada sessão com duração de 100 minutos a 2 ATA cada, sendo 60 minutos de pressão absoluta15.
Preparo para microscopia eletrônica de varredura (MEV)
Ao final do tempo de observação para cada grupo, os animais foram anestesiados conforme protocolo e eutanasiados com o aprofundamento anestésico seguido da decapitação19.
Logo após a abertura da bula timpânica, foi injetada solução de fixação de glutaraldeído a 2,5% lentamente através de uma abertura feita no ápice da cóclea e da janela redonda, permanecendo em imersão por quatro horas a 4ºC9,15,17-20. Após esta fixação com o glutaraldeído, o material foi submetido a cinco lavagens18 em solução tampão fosfato 0,1 M e submetido à microdissecção para exposição das espiras cocleares9,15,17-20. Após as lavagens sucessivas, as cócleas foram refixadas em solução de tetróxido de ósmio a 1% em tampão fosfato 0,1 M por 2 horas a 4ºC, lavadas seguidamente em tampão fosfato 0,1 M e pH de 7,39,15,17-20. Em seguida, procedeu-se à desidratação das estruturas por meio de banhos de etanol em concentrações crescentes de 50, 70, 90 e 95%, durante cerca de 10 minutos cada. Logo após, utilizou-se o etanol 100% em três banhos de 20 minutos cada, deixando-se no último banho as estruturas imersas à temperatura ambiente por 12 horas9,15,17-20. A água ainda presente no material após a desidratação foi removida no processo de secagem, com o uso do método do ponto crítico como dióxido de carbono (CO2) líquido. O equipamento utilizado foi o BAL-TEC CPD 030® (Critical Point Dryer), onde com sucessivos banhos com dióxido de carbono líquido a 4ºC, o etanol foi eliminado e, então, o material foi submetido a aumento de temperatura até 40ºC para que o dióxido de carbono passasse do estado líquido para o estado gasoso, o que aconteceu a 31ºC - ponto crítico9,15,17-20.
O material seco foi montado em porta-espécime cilíndrico (stubs) metálico colado com pasta condutora de carbono9,17. Para adequada análise e observação das estruturas à MEV, as cócleas foram cobertas por uma fina camada de ouro, aplicada com o uso do vaporizador BAL-TEC SCD 050. Após esta preparação, as cócleas estavam eletricamente condutivas para a MEV9,16,17.
Critérios de análise da MEV
Os resultados da MEV, depois de fotografados, foram analisados pela contagem do número de células ciliadas externas da espira basal, E2, E3 da cóclea e da análise de presença/ausência ou presença parcial das células ciliadas internas de todas as espiras e das CCE da apical, em determinado campo fotográfico.
Estudo estatístico
Para análise estatística dos resultados, foram utilizados os testes de Friedman e Wilcoxon para avaliar as diferenças entre as EOADP. Ambos foram utilizados por se tratar da observação de variáveis aleatórias que evoluem no tempo e são extraídas de um mesmo indivíduo. Os testes foram feitos considerando nível de significância de 95%. Para estudar o PEATE, utilizou-se o teste de Friedman, com nível de significância de 95%. Cada cóclea representou um experimento diferente e independente, havendo dependência somente na evolução temporal de cada cóclea. A análise morfológica foi avaliada por meio do teste de Kruskal-Wallis, com nível de significância de 95%. Para esta análise, foram considerados os diferentes níveis da cóclea, basal, E2, E3 e apical. Cada um desses níveis foi avaliado separadamente. Foram considerados os efeitos da droga e os diferentes procedimentos (OHB e Repouso) em cada caso.
Todas as análises foram processadas com o software Microsoft Excel® com auxílio do pacote EXStat®para análises não paramétricas21.
RESULTADOS
A avaliação por meio das EOADP mostrou ausência de respostas para todos os grupos submetidos à AM, quando avaliados após 8 dias consecutivos de uso do fármaco. O teste de Wilcoxon mostrou que houve diferença estatisticamente significante entre a média da relação sinal/ruído (SNR) anterior e posterior à AM, com p-valor < 0,01.
Nos grupos 3 e 4, as EOADP estavam ausentes após os 8 dias de AM, permanecendo ausentes e com redução da média da relação sinal/ruído (SRN) em ambos os grupos após os procedimentos propostos. Foi possível observar diferença estatisticamente significante com p-valor < 0,05 entre a média da SRN após AM e após o repouso ou a OHB.
O grupo 1 apresentou EOADP presentes anterior e posterior à OHB. O teste de Wilcoxon resultou em p-valor > 0,05, indicando que as amostras foram similares sob o ponto de vista das EOADP.
Com relação ao registro do PEATE, os limiares eletrofisiológicos encontravam-se aumentados nos grupos 2, 3 e 4, posterior ao uso da AM, mantendo estes resultados após OHB ou após o repouso. O teste de Friedman resultou em p-valor < 0,05, indicando que os registros pré e pós-AM foram estatisticamente distintos. Após AM, todos os animais apresentaram limiares eletrofisiológicos superiores a 90 dB nHL, representando uma perda auditiva relevante.
Os resultados indicam que os indivíduos apresentaram integridade das estruturas do sistema auditivo periférico anterior ao início do experimento e sofreram alteração destas estruturas após o uso de AM, resultando em deficiência auditiva. Estes resultados foram mantidos, após o término do experimento, independente do procedimento ao qual foram submetidos, repouso ou OHB.
No grupo 1, os limiares eletrofisiológicos encontravam-se inalterados. O teste de Friedman mostrou p-valor = 1, demonstrando que as amostras são idênticas sob o ponto de vista do PEATE.
Considerando a avaliação morfológica, por meio da MEV, foi possível observar lesões significativas das CCE e CCI em todas as espiras estudadas (Figura 1). As CCI foram menos afetadas na região da espira basal nos grupos que fizeram uso do fármaco.
Figura 1. Espira basal da cóclea de cobaia do grupo 2 mostrando lesões de CCE em todas as fileiras e de CCI (MEV - 1.000x).
No grupo 4, lesões de CCE e CCI também foram observadas tanto após os 8 dias consecutivos do fármaco quanto após a OHB, sem ganhos significativos aos aspectos morfológicos (Figura 2). Resultados similares foram encontrados no grupo 3. Os aspectos morfológicos das CCE e CCI não foram alterados no grupo 1, apresentando preservação das três fileiras de CCE e da fileira de CCI (Figura 3).
Figura 2. Espira basal da cóclea de cobaia do grupo 4 com lesões de CCE em todas as fileiras e CCI (MEV - 1.000x).
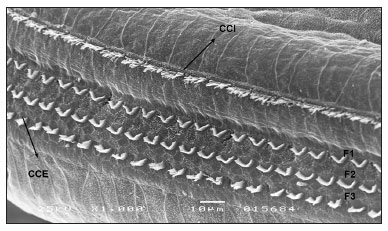
Figura 3. E2 da cóclea de cobaia do grupo 1 com preservação deCCE e CCI. CCI: F1: fileira 1; F2: fileira 2; F3: fileira 3 (MEV - 1.000x).
Em relação à contagem de CCE das espiras basal, E2, E3 e Apical, das amostras que receberam AM e desconsiderando o grupo controle (grupo 1), obteve-se p-valor = 0,5 ao teste de Kruskall-Wallis. No tocante à contagem de CCI das espiras basal, E2, E3 e apical, para as amostras expostas à AM, obteve-se p-valor = 0,22. Em ambos os casos, a hipótese dos grupos serem similares do ponto de vista estatístico foi rejeitada.
Os aspectos morfológicos das CCE e CCI não foram alterados no grupo 1, com preservação das três fileiras de CCE e da fileira de CCI (Figura 3).
DISCUSSÃO
A AM é amplamente utilizada no tratamento de doenças infecciosas, em especial no grupo pediátrico e tem sido relatada com elevado potencial ototóxico, promovendo lesões auditivas de caráter irreversível. O fato se reveste de importância individual, condenando o paciente com deficiência auditiva a transpor barreiras sociais e econômicas para se adaptar muitas vezes intransponíveis, por falta de recursos e ou aceitação da sociedade. Também, do ponto de vista da saúde pública, os custos são bastante expressivos no trabalho de readaptação desses indivíduos e na aquisição e manutenção de aparelhos auditivos normalmente importados.
De acordo com relato da literatura médica, os aminoglicosídeos podem ser detectados na perilinfa 60 a 90 minutos após a administração sistêmica, permanecendo detectáveis nas células ciliadas três a quatro meses depois22. Assim, a adoção de medidas que possam abolir ou diminuir os efeitos deletérios dos medicamentos é um desafio a ser vencido.
Oxigenação Hiperbárica (OHB)
Dentre as possibilidades existentes, a OHB pode ser uma opção, visto que em outras situações tem mostrado eficaz como medida terapêutica no tratamento da surdez súbita13 e na otoproteção contra lesões auditivas promovidas pelo ruído15 e a ototoxicidade causada pela cisplatina16.
O mecanismo exato de proteção da OHB ainda não está claramente estabelecido. No entanto, um dos mecanismos envolvidos na ototoxicidade da AM poderia estar relacionado a processos de produção de isquemia das células ciliares e consequente excesso na produção de espécies reativas de oxigênio e as lesões tipicamente associadas a elas.
Desta forma, com base nos relatos de melhora do estresse oxidativo promovida pela OHB por meio do aumento da produção de antioxidantes e de enzimas antioxidantes como a glutationa e a superóxido dismutase (SOD), bem como a diminuição de marcadores de estresse oxidativo como o malondialdeído, a OHB poderia promover otoproteção por meio da varredura destas espécies reativas de oxigênio produzidas pelo uso da amicacina.
Deste modo, pareceu pertinente estudar os efeitos da OHB sobre as lesões ototóxicas promovidas pelo uso da amicacina com o objetivo de contribuir para o entendimento dos mecanismos fisiopatológicos de otoproteção da orelha interna.
A presente pesquisa focou a avaliação da ototoxicidade em dois parâmetros: o morfológico e o funcional.
Aspectos morfológicos
O estudo morfológico por meio da MEV tem sido rotineiramente utilizado em estudos de ototoxicidade por permitir uma minuciosa análise das células ciliadas da cóclea, demonstrando normalidade e/ou anormalidades existentes quanto à morfologia ciliar destas9,10,15,17,19,23.
Os dados obtidos nesta pesquisa permitem inferir que o uso da AM por via subcutânea produziu alterações morfológicas na estrutura da cóclea dos animais e não foram protegidas pela aplicação da OHB.
Aspectos funcionais
A avaliação funcional por meio da análise das EOADP tem sido demonstrada como um método eficaz para avaliar o estado funcional das CCE15,16,23.
Os achados funcionais encontrados nesta pesquisa estão de acordo com outros estudos experimentais9,10,17 quanto ao potencial ototóxico da AM.
Pesquisadores estudando as alterações ultraestruturais e funcionais da cóclea de animais encontraram lesões extensas de CCE após aplicação sistêmica de AM por 12 dias consecutivos. Os achados corroboram com este trabalho, ratificando o potencial efeito ototóxico do fármaco10.
Os animais que fizeram uso de AM e foram submetidos à OHB apresentaram ausência das EOADP após 8 dias consecutivos de uso do fármaco, com redução da média da relação sinal/ruído (SRN) ao final do experimento, demonstrando ter havido possível piora do estado funcional das CCE da cóclea. Estes achados também foram encontrados no grupo submetido ao repouso após AM.
Alguns autores sugerem que pacientes que se encontram sob regime de aminoglicosídeo apresentam as repostas de EOADP prejudicadas, caindo na razão direta do tempo de tratamento4,24,25.
À luz da literatura, poderíamos supor que esta piora do estado funcional pode ter sido resultado do efeito cumulativo da AM, pois estes achados foram evidentes tanto no grupo submetido ao R quanto no grupo submetido à OHB.
Os limiares eletrofisiológicos, obtidos por meio do registro da onda I, estavam aumentados em todos os grupos submetidos à AM, acima de 90 dB nHL, permanecendo alterados após a OHB. Estes achados foram semelhantes aos do grupo submetido ao repouso. Ambos os procedimentos propostos não representaram ganhos significativos do ponto de vista estatístico, coincidindo com os achados morfológicos destes grupos.
As EOADP podem estar presentes em perdas auditivas de até 50 dB NA26. Os dados obtidos neste estudo, em que as EOADP estavam ausentes, coincidem com os resultados do PEATE, demonstrando o efeito devastador da dose de amicacina aplicada e corroborando com os relatos na literatura de lesões ototóxicas ocasionadas pelo uso de antibióticos aminoglicosídeos4,9,10,17,27-29.
Os efeitos da oxigenação hiperbárica divergiram de relato da literatura que demonstrou a OHB como potencial otoprotetor sobre lesões ototóxicas16, no qual os autores usaram a cisplatina como indutor da lesão ototóxica em um modelo experimental com aplicação de 8 mg/kg/dia, via intraperitoneal durante 3 dias consecutivos e posteriormente submeteram à OHB, relatando melhora dos aspectos morfológicos e funcionais das células ciliadas da cóclea das cobaias analisadas. O número de animais utilizados nesta pesquisa foi baseado na literatura9,10,15,16 e recomendado pelo Comitê de Ética em Pesquisa, não sendo possível inferir que este aspecto tenha se refletido nas diferenças encontradas em nosso estudo. Por outro lado, é possível que as vias metabólicas de produção das lesões sejam diferentes e este tenha sido um aspecto determinante.
Considerações finais
Sabendo que a hiperóxia causada pela oxigenação hiperbárica aumenta a tolerância dos tecidos à isquemia, incrementando os mecanismos biológicos de defesa contra espécies reativas de oxigênio, pode-se propor como perspectivas futuras o desenvolvimento de um novo estudo com metodologia similar, porém, divergindo no tempo de exposição ao fármaco, utilizando as mesmas doses de amicacina e o mesmo protocolo de OHB. Para tanto, seria sugestiva uma avaliação mais minuciosa da melhora do estresse oxidativo com o uso da OHB por meio do aumento da produção de antioxidantes e de enzimas antioxidantes como a glutationa e a superóxido dismutase (SOD), bem como a diminuição de marcadores de estresse oxidativo como o malondialdeído.
CONCLUSÃOA OHB não promoveu ganhos significativos aos aspectos morfológicos das células ciliadas da cóclea lesadas pelo uso da amicacina pela via subcutânea. Os limiares eletrofisiológicos das cobaias que fizeram uso de amicacina não apresentaram ganhos significativos quando submetidas à OHB, permanecendo igual ou maior que 90 dB nHL. A OHB não promoveu melhora do estado funcional das células ciliadas externas da cóclea de cobaias submetidas ao uso de amicacina pela via subcutânea.
AGRADECIMENTOS
Agradecimentos ao Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da FMRP-USP-Laboratório de Neurobiologia da Audição.
Laboratório de Cirurgia Experimental e de Microscopia Eletrônica da FMRP-USP.
REFERÊNCIAS
1. Kasse CA, Hyppolito MA, Cruz OLM, Oliveira JAA. Ototoxicidade e otoproteção. Rev Bras Med. 2008;4:105-15.
2. Hyppolito MA, Oliveira JAA. Ototoxicidade, otoproteção e autodefesa das células ciliadas da cóclea. Medicina (Ribeirão Preto). 2005;(3/4):279-89.
3. Sassada MMY, Ceccon MEJ, Navarro JM, Vaz FAC. Deficiência auditiva em recém-nascidos internados em unidade de terapia intensiva neonatal. Pediatria (São Paulo). 2005;27(3):163-71.
4. Câmara MFC, Azevedo MF, Lima JWO, Sartorato EL. Efeitos de fármacos ototóxicos na audição de recém-nascidos de alto risco. Rev Soc Bras Fonoaudiol. 2010;15(3):376-82. http://dx.doi.org/10.1590/S1516-80342010000300011
5. Bona E, Cembranel LR, Fuentefria AM. Prevalência de agentes infecciosos bacterianos do trato respiratório inferior em um hospital privado de Santa Catarina, Brasil. Rev Panam Infectol. 2009;11(3):23-30.
6. Sharp PM, Saenz CA, Martin RR. Amikacin (BB-K8) treatment of multiple-drug resistant Proteus infections. Antimicrob. Antimicrob Agents Chemother. 1974;5(5):435-8. http://dx.doi.org/10.1128/AAC.5.5.435 PMid:4462458 PMCid:428989
7. Souza MVN, Vasconcelos TRA. Fármacos no combate à tuberculose: passado, presente e futuro. Química Nova. 2005;28(4):678-82. http://dx.doi.org/10.1590/S0100-40422005000400022
8. Campos RS, Couto MDC, Albuquerque CLL, Siqueira AAF, Abreu LC. Efeito do fluxo expiratório ativo-assistido em crianças com pneumonia. Arq Med ABC. 2007;32(Suppl 2):S38-41.
9. Oliveira JAA, Canedo DM, Rossato M. Otoproteção das células ciliadas auditivas contra a ototoxicidade da amicacina. Rev Bras Otorrinolaringol. 2002;68(1):7-13. http://dx.doi.org/10.1590/S003472992002000100002
10. Aquino TJM, Oliveira JAA, Rossato M. Ototoxicity and otoprotection in the inner ear of guinea pigs using gentamicin and amikacin: ultrastructural and functional aspects. Braz J Otorhinolaryngol. 2008;74(6):843-52. PMid:19582340
11. Sociedade Brasileira de Medicina Hiperbárica. Diretrizes de Segurança e Qualidade. São Paulo; 2010.
12. Murakawa T, Kosaka M, Mori Y, Fukazawa M, Misaki K. Treatment of 522 patients with sudden deafness performed oxygenation at high pressure. Nihon Jibiinkoka Gakkai Kaiho. 2000;103(5):506-15. http://dx.doi.org/10.3950/jibiinkoka.103.506 PMid:10853338
13. Maia RA, Cahali S. Surdez súbita. Rev Bras Otorrinolaringol. 2004;70(2):238-48. http://dx.doi.org/10.1590/S0034-72992004000200015
14. Costa-Val R, Silva RCO, Nunes TA, Souza TKP. O papel da oxigenoterapia hiperbárica na doença vascular. J Vasc Bras. 2003;2(3):177-82.
15. Colombari GC, Rossato M, Feres O, Hyppolito MA. Effects of hyperbaric oxygen treatment on auditory hair cells after acute noise damage. Eur Arch Otorhinolaryngol. 2011;268(1):49-56. http://dx.doi.org/10.1007/s00405-010-1338-4 PMid:20652293
16. Yassuda CC, Righetti AE, Cury MC, Hyppolito MA, Oliveira JA, Féres O. The role of hyperbaric oxygen therapy (hot) as an otoprotection agent against cisplatin ototoxicity. Acta Cir Bras. 2008;23 Suppl 1:72-6. http://dx.doi.org/10.1590/S0102-86502008000700013 PMid:18516452
17. Aquino TJM. Ototoxicidade e otoproteção em orelha interna de cobaias utilizando gentamicina e amicacina: aspectos ultra-estruturais e funcionais [Tese de doutorado] Ribeirão Preto: Faculdade de Medicina de Ribeirão Preto Universidade de São Paulo; 2007. PMCid:1876259
18. Körbes D. Toxicidade de agrotóxico organofosforado no sistema auditivo periférico de cobaias: estudo anatômico e funcional [Dissertação de mestrado]. Santa Maria: Universidade Federal de Santa Maria; 2009.
19. Albuquerque AAS, Rossato M, Oliveira JAA, Hyppolito MA. Understanding the anatomy of ears from guinea pigs and rats and its use in basic otologic research. Braz J Otorhinolaryngol. 2009;75(1):43-9. PMid:19488559
20. Hyppolito MA, Oliveira JAA, Lessa RM, Rossato M. Otoproteção da amifostina aos efeitos ototóxicos da cisplatina: estudo em cobaias albinas por emissões otoacústicas produto de distorção e microscopia eletrônica de varredura. Braz J Otorhinolaryngol. 2005;71(3):268-73. PMid:16446928
21. Peixoto PS, Montanher TM (2011). EXSTAT - Excel Statistical Calculator Version 1.7, Oct 2011. Available at: www.ime.usp.br/~pedrosp
22. Roland PS. New developments in our understanding of ototoxicity. Ear Nose Throat J. 2004;83(9 Suppl 4):15-6. PMid:15543837
23. Baggio CL, Silveira AF, Hyppolito MA. Estudo experimental anatômico-funcional da cocleotoxicidade da gentamicina com doses habituais para recém-nascidos. Pró-Fono. 2009;21(2):137-42. http://dx.doi.org/10.1590/S0104-56872009000200009 PMid:19629324
24. Câmara, MFS. Efeitos de fármacos ototóxicos na audição de recém-nascidos de alto risco [Tese doutorado]. São Paulo: Universidade Federal de São Paulo; 2005.
25. Hotz MA, Harris FP, Probst R. Otoacoustic emissions: an approach for monitoring aminoglycoside-induced ototoxicity. Laryngoscope.1994;104(9):1130-4. http://dx.doi.org/10.1288/00005537199409000-00014 PMid:8072361
26. Pinto VS, Lewis DR. Emissões Otoacústicas: produto de distorção em lactentes até dois meses de idade. Pró-Fono. 2007;19(2):195-204. http://dx.doi.org/10.1590/S0104-56872007000200008
27. Selimoglu E. Aminoglyciside-Induced Ototoxicity. Curr Pharm Des. 2007;13(1):119-26. http://dx.doi.org/10.2174/138161207779313731 PMid:17266591
28. Oliveira JAA, Rossato M, Lima WTA. Células ciliadas isoladas em cultura: um novo modelo para estudo da ototoxicidade. Rev Bras Otorrinolaringol. 1995;61(1):70-8.
29. Jornada ALM. Alterações auditivas em recém-nascidos prematuros expostos a antibióticos ototóxicos. [Dissertação de Mestrado]. Porto Alegre: Pontifícia Universidade Católica do Rio Grande do Sul; 2009. PMCid:2690777
1. Mestrado (Fonoaudióloga).
2. Superior completo (Técnica Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - FMRP, Universidade de São Paulo - USP).
3. Nível médio completo (Técnica do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - FMRP, Universidade de São Paulo - USP).
4. Doutorado (Professora Adjunta II do Colegiado de Medicina Veterinária da Universidade Federal do Vale do São Francisco - UNIVASF).
5. Doutorado (Docente do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - FMRP, Universidade de São Paulo - USP).
6. Livre Docência (Professor Associado do Departamento de Cirurgia da Universidade Federal de São Paulo - UNIFESP).
Endereço para correspondência:
Luciana de Albuquerque Salviano Amora
Rua Aristarco Lopes, nº 950/603. Centro
Petrolina - PE. Brasil. CEP: 56302-100
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) do BJORL em 15 de outubro de 2012. cod. 10520.
Artigo aceito em 14 de março de 2013.