Ano: 2012 Vol. 78 Ed. 5 - Setembro - Outubro - (10º)
Seção: Artigo Original
Páginas: 64 a 68
Polimorfismos do gene da interleucina-13 nas posições -1055 C/T e +2044 G/A em pacientes com carcinoma espinocelular de cabeça e pescoço
Interleukin-13 gene polymorphisms at -1055 C/T and +2044 G/A positions in patients with squamous cell carcinoma of head and neck
Autor(es): Bijan Khademi1; Seyed Basir Hashemi2; Abbass Ghaderi3; Ali Shahrestani4; Mohammad Mohammadianpanah5
DOI: 10.5935/1808-8694.20120010
Palavras-chave: carcinoma de células escamosas, interleucina-13, neoplasias de cabeça e pescoço, polimorfismo genético.
Keywords: carcinoma, squamous cell, head and neck neoplasms, il-13, polymorphism, genetic.
Resumo:
O carcinoma espinocelular (CEC) é a neoplasia mais comum do trato aerodigestivo superior. A interleucina-13 (IL-13) é uma citocina imunorreguladora com polimorfismos relatados para seu gene associados com a mesma doença, especialmente asma e alergia. O presente estudo investigou se os polimorfismos do gene da IL-13 (posições 1055C/T no gene promotor da 1L-13 e +2044G/T exon 4) podem distinguir os pacientes com CEC de cabeça e pescoço de controles saudáveis.
MÉTODO: O estudo analisou pacientes com CEC de cabeça e pescoço (n = 137) pareados por idade e sexo com um grupo de controles saudáveis (n = 127). A genotipagem do polimorfismo do gene da IL-13 foi executada pelo método de polimorfismo no comprimento de fragmentos de restrição baseado em reação em cadeia da polimerase.
RESULTADOS: Não foram identificadas diferenças estatisticamente significativas nas frequências dos genótipos e alelos entre pacientes e controles em ambas as posições (p = 0,16). Além disso, não foi observada associação entre os genótipos investigados e outros fatores prognósticos, como idade, sexo, localização do tumor primário, tamanho do tumor e tabagismo.
CONCLUSÃO:O presente estudo sugere que não há associação entre os polimorfismos do gene da IL-13 (nas posições -1055C/T e +2044GI A) e suscetibilidade dos pacientes a CEC de cabeça e pescoço.
Abstract:
Squamous cell carcinoma (SCC) is the most common malignancy that involves the upper aerodigestive tract. Interleukin-13 (IL-13) is an immunoregulatory cytokine that has been reported to have some polymorphisms in it gene associated with same disease especially asthma and allergy. The present study aimed to investigate whether the polymorphisms of IL-13 gene (at positions of 1055C/T in the promoter of1L-13 gene and +2044G/T exon-4) differ in patients with head and neck SCC from healthy controls.
METHODS: This study was investigated in patient with head and neck SCC (n = 137) and age- and sex-matched healthy controls (n = 127). Genotyping of IL-13 gene polymorphism was performed using polymerase chain reaction-based restriction fragment length polymorphism method.
RESULTS: No statistically significant differences were found in the frequencies of genotypes and alleles between patients and control group at both sites (p = 0.16). In addition, no association was observed between investigated genotypes and other potential prognostic factors such as age, sex, primary tumor site, tumor size and smoking.
CONCLUSION: This study suggests that there is no association between IL-13 gene polymorphisms (at position -1055C/T and +2044GI A) and susceptibility of the patients to SCC of head and neck.
![]()
INTRODUÇÃO
O câncer é uma complexa afecção genética derivada do acúmulo de uma série de alterações genéticas. O carcinoma espinocelular de cabeça e pescoço (CECCP) é a neoplasia mais comum do trato aerodigestivo e representa mais de 90% dos tumores malignos dessa região, com 500 mil novos casos em nível mundial1. Trata-se da quinta principal causa de incidência de câncer e, apesar da melhora dos tratamentos convencionais, é ainda a sexta causa de óbitos relacionados ao câncer. A sobrevida dos pacientes com CECCP tem permanecido em níveis desanimadores nos últimos 30 anos2. O CECCP acomete mais homens que mulheres e os mais importantes fatores de risco independentes são tabagismo e etilismo1, ainda que suscetibilidade (fatores imunológicos e idade), fatores ambientais e ocupacionais também possam ter peso. A predisposição genética a CEC é bem reconhecida. Deleções, desequilíbrios alélicos ou perda de heterozigose no braço curto do cromossomo 3 foram associados a comportamento biológico mais agressivo3. O CEC de cabeça e pescoço está associado à produção de citocinas pró-inflamatórias e pró-angiogênicas. A análise in vitro de linhagens celulares derivadas de CECCP e estudos in situ do microambiente local de tumores de cabeça e pescoço demonstram que os tumores de cabeça e pescoço expressam uma série de fatores de crescimento autócrinos e parácrinos e citocinas4.
O gene humano da IL-13 está localizado juntamente com o gene da IL-4 num fragmento de 15 kb no cromossomo 5q31 5. IL-4 e IL-13 compartilham muitas (mas não todas) funções. A triagem de variação desses genes já foi executada à exaustão e vários polimorfismos de nucleotídeo único (SNPs) foram identificados, demonstrando que sua importância funcional está fortemente associada a doenças imunológicas. Recentemente, seis novos polimorfismos foram descritos para o locus da IL-13 incluindo um polimorfismo no exon 4 (+2044G/A), levando à substituição de um aminoácido na posição 130 (Arg130Gln), a forma Gln está associada a elevações nos níveis plasmáticos de IgE em populações americanas e alemãs6. Outro polimorfismo está localizado na região do promotor do gene da IL-13 (-1055 C/T) e altera a regulação de produção de IL-13 e aumenta a ligação de proteínas nucleares7. O presente estudo pretendeu investigar a associação de polimorfismos do gene da IL-13 (nas posições 1055C/T no promotor do gene da IL-13 e +2044G/T no exon 4) em pacientes com CECCP.
MÉTODO
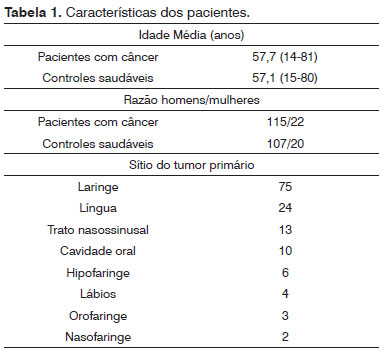
Cento e trinta e sete pacientes (idade média 57,7 anos) com CEC de cabeça e pescoço (115 homens e 22 mulheres) foram comparados a 127 indivíduos sãos pareados por idade e sexo (idade média de 57,1 anos) sem histórico de câncer ou doença autoimune presente em parentes de primeiro grau. (Tabela 1).
Preparação do DNA
DNA foi extraído de amostras periféricas de sangue usando o tradicional método Proteinase-K. O DNA foi então preparado à concentração de 300 ng/µl.
Ensaio de genotipagem
A genotipagem em ambas as posições +2044 e -1055 da IL13 foi feita usando o método de polimorfismo no comprimento de fragmentos de restrição baseado em reação em cadeia da polimerase (PCR). Para avaliar a posição 1055C/T, as sequências de primer de 5'-ACTTCTGGGAGTCAGAGCCA-3' (forward); e 5'-TACAGCCATGTCGCCTTTTCCTGCTCTTCCGTC-3' (reverse) foram usadas. O PCR foi executado em um volume de 15 µl contendo 75 ng de DNA genômico, 1,5 mM KCL solução tampão lX, 1,5 mM MgC12, 0,3 mM dNTPs, 3 pm cada primer e 1,2 unidade de Taq DNA polimerase. O DNA foi primeiramente desnaturado a 94ºC por 5 min, então a temperatura de ciclagem foi ajustada para 94ºC por 30 segundos no primeiro ciclo de desnaturação, 65,5ºC por 30 segundos para o ciclo de anelamento, 72ºC por 30 segundos para o ciclo de extensão, todos repetidos por um total de 30 ciclos, seguidos de extensão final a 72ºC por 10 min. 5 µl de produtos do PCR foram submetidos à eletroforese em géis de agarose a 1,5% e visualizados com brometo de etídio para documentação dos genes. Digestão enzimática foi executada em volume final de 15 µl usando 0,5 µl de enzima "Hpy199I", 1,5 µl de tampão NTB4, 0,15 µl de tampão BSA, 2,85 µl H20 e 10 µl de produto de PCR. As reações foram incubadas a 37ºC por duas horas. Os tamanhos dos fragmentos correspondentes eram: CC = 339, 33 bp, CT = 372, 339, 33 bp e TT = 372 bp. Finalmente, os produtos de PCR digeridos foram submetidos à eletroforese em géis de agarose a 2,7% para separar os fragmentos. As condições de ensaio para o polimorfismo em +2044G/A foram as seguintes: primer forward: 5'-CTTCCGTGAGGACTGAATGAGACGGTC-3' e primer reverse: 5'-GCAAATAATGATGCTTTCGAAGTTTCAGTGGA-3', cada um foi usado em um total de 6 pm por tubo. A enzima de restrição "NlaIV" foi usada para digerir o fragmento 236 bp e produzir os fragmentos GG = 178, 32, 26 bp, GA = 216, 178, 32, 26 bp e AA = 216, 26 bp. A temperatura ótima de anelamento para este teste foi 62,5ºC.
Análise estatística
As frequências de alelos e genótipos e as características quantitativas foram comparadas entre controles e subtipos de pacientes com o uso dos teste do qui quadrado (χ2) e do teste exato de Fisher. Os resultados foram tratados com os programas SPSS 15 e EPI info (versão 2002) e as associações analisadas para ajustes dos diferentes fatores respectivos. Valores de p superiores a 0,05 foram considerados sem significância estatística.
O presente estudo foi aprovado pela Comissão de Ética da instituição.
RESULTADOS
Genótipos e alelos da IL-13, -1055 e +2044
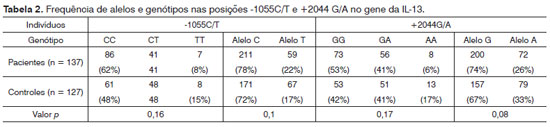
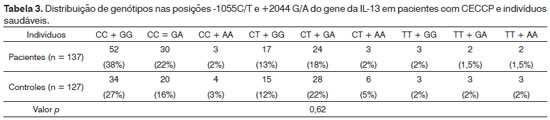
Conforme demonstrado na Tabela 2, a triagem dos pacientes para o genótipo da IL-13 e frequência dos alelos dos polimorfismos C-l055T e G+2044A não revelou diferenças significativas nestes dois genótipos e seus alelos em pacientes com CECCP em comparação aos controles saudáveis. Diferentes genótipos em ambas as posições também foram comparados dois a dois para avaliar suas possíveis combinações. Segundo os dados exibidos na Tabela 3, nenhuma ligação foi identificada dentre os 137 pacientes e os 127 indivíduos no grupo de controle.
Genótipos da IL-13 -1055 e +2044 e fatores predisponentes para CECCP
Os genótipos e alelos colhidos dos dois polimorfismos foram investigados de modo a buscar alguma possível associação com valores basais dos pacientes, como idade e gênero, ou fatores prognósticos/preditivos, tais como sítio to tumor primário, tamanho do tumor e tabagismo. Ainda que CECCP tenha sido uniformemente atribuído a cada um desses fatores, nenhuma associação foi observada no tocante às duas substituições dos polimorfismos.
DISCUSSÃO
Os genes do câncer geralmente se agrupam em oncogenes e genes supressores de tumor. As doenças neoplásicas são complexos distúrbios genéticos que resultam do desequilíbrio entre a ativação de proto-oncogenes e a inativação de genes supressores de tumor. O projeto do genoma humano atualmente oferece uma oportunidade única para a identificação de todas as alterações genéticas associadas ao câncer8. Citocinas e os genes relacionados podem direta ou indiretamente atuar contra os mecanismos de defesa do tumor com mudanças no tipo e qualidade da resposta imunológica2. Respostas imunológicas com linfócitos T helper ou a ativação de linfócitos T citotóxicos são essenciais para combater o tumor. Vários estudos em modelos animais e pacientes humanos com câncer revelaram que, nesses casos, as respostas convencionais de Th1 e a atividade das células CD8+ foram inibidas. A tendência das respostas imunológicas antitumorais a Th2 leva à supressão das respostas de Th1 9,10. Em um estudo, a expressão de citocinas Th1 e Th2 foi avaliada em células tumorais humanas, revelando o domínio das citocinas tipo II em 20 tipos de células tumorais. A fuga das células tumorais ao controle imunológico pode estar relacionada a esse fenômeno10.
Em outros estudos, os pesquisadores observaram que IL-4 e IL-13 podem inibir a regressão tumoral11. Em outro estudo, os efeitos da IL-4 e IL-13 humanas sobre o crescimento clonal de células de câncer de mama foram investigados, relevando que a IL-13 pode reduzir o crescimento clonal de células tipo 3 7. Esses estudos concluíram que a IL-13 tem importante papel na regulação da atividade antitumoral. Houve vários polimorfismos no gene da IL-13. O 1055C/T estava localizado na região promotora do gene da IL-13. A mudança de nucleotídeo C para T nesse ponto pode alterar a ligação e tipo de fator de transcrição e, então, alterar a expressão do gene da IL-13. Vários estudos revelaram que o polimorfismo -1055C/T estava associado a asma alérgica, regulação alterada da produção de IL-13 e aumento na ligação de proteínas nucleares12.
Outro importante polimorfismo do gene da IL-13 é o +2044 G/A, localizado no exon 4, importante região para a interação receptor-ligante. A substituição de arginina por glutamina (Arg130G1n) leva à criação de uma proteína de IL-13 com alta afinidade para seu receptor. Isso pode explicar teoricamente muitos aspectos do fenótipo alérgico (produção de IgE, secreção de muco, inflamação eosinofílica e reação por hipersensibilidade)9. Esse alelo foi associado a aumento da suscetibilidade a diabetes tipo 1 e DPOC e sua frequência foi baixa em pacientes com artrite idiopática juvenil e doença de Graves3. Em nosso estudo, os polimorfismos 1055C/T e +2044G/A foram analisados em pacientes com CEC de cabeça e pescoço. Um estudo foi realizado anteriormente em pacientes com CEC de cabeça e pescoço.
Na literatura há poucos estudos analisando a associação entre os haplótipos da IL-13 e a suscetibilidade a câncer. Faghih et al.13 investigaram a associação entre haplótipos da IL-13 e suscetibilidade de mulheres iranianas ao câncer de mama e não identificaram diferenças significativas na distribuição de genótipos -1512A/C, -1055C/T e +2044G/A ou alelos entre os grupos caso e controle. Contudo, os autores sugeriram uma possível associação entre haplótipo CCA do gene da IL-13 e suscetibilidade a câncer de mama em mulheres iranianas. Em outro estudo, Sameni et al.14 não identificaram associação com polimorfismos do gene da IL-13 (-1055 C/T e +2044 G/A) em pacientes iranianos com câncer de pulmão. Pelo que sabemos, este é o primeiro estudo que investiga os polimorfismos do gene da IL-13 nas posições -1055 C/T e +2044 G/A em pacientes com carcinoma espinocelular de cabeça e pescoço.
CONCLUSÃO
Os resultados do presente estudo indicam que não há associação entre os polimorfismos do gene da IL-13 (nas posições -1055C/T e +2044G/A) e suscetibilidade em pacientes com CECCP.
REFERÊNCIAS
1. Sidransky D. Molecular Biology of Head and Neck Tumors. In: DeVita VT, Hellman S, Rosenberg SA, editors. Cancer: Principles & Practice of Oncology, 8th ed. Philadelphia: Lippincott, Williams, & Wilkins; 2008. p.799-809.
2. Terabe M, Park JM, Berzofsky JA. Role of IL-13 in regulation of anti-tumor immunity and tumor growth. Cancer Immunol Immunother. 2004;53(2):79-85.
3. Heinzmann A, Jerkic SP, Ganter K, Kurz T, Blattmann S, Schuchmann L, et al. Association study of the IL13 variant Arg110Gln in atopic diseases and juvenile idiopathic arthritis. J Allergy Clin Immunol. 2003;112(4):735-9.
4. Chaouchi N, Wallon C, Goujard C, Tertian G, Rudent A, Caput D, et al. Interleukin-13 inhibits interleukin-2-induced proliferation and protects chronic lymphocytic leukemia B cells from in vitro apoptosis. Blood. 1996;87(3):1022-9.
5. Bugawan TL, Mirel DB, Valdes AM, Panelo A, Pozzilli P, Erlich HA. Association and interaction of the IL4R, IL4, and IL13 loci with type 1 diabetes among Filipinos. Am J Hum Genet. 2003;72(6):1505-14.
6. Serve H, Oelmann E, Herweg A, Oberberg D, Serve S, Reufi B, et al. Inhibition of proliferation and clonal growth of human breast cancer cells by interleukin 13. Cancer Res. 1996;56(15):3583-8.
7. Blais Y, Gingras S, Haagensen DE, Labrie F, Simard J. Interleukin-4 and interleukin-13 inhibit estrogen-induced breast cancer cell proliferation and stimulate GCDFP-15 expression in human breast cancer cells. Mol Cell Endocrinol. 1996;121(1):11-8.
8. Taramelli R, Acquati F. The human genome project and the discovery of genetic determinants of cancer susceptibility. Eur J Cancer. 2004;40(17):2537-43.
9. Bacharier LB, Geha RS. Molecular mechanisms of IgE regulation. J Allergy Clin Immunol. 2000;105(2 Pt 2):S547-58.
10. McKenzie GJ, Bancroft A, Grencis RK, McKenzie AN. A distinct role for interleukin-13 in Th2-cell-mediated immune responses. Curr Biol. 1998;8(6):339-42.
11. Becker Y. Molecular immunological approaches to biotherapy of human cancers--a review, hypothesis and implications. Anticancer Res. 2006;26(2A):1113-34.
12. Izuhara K, Arima K. Signal transduction of IL-13 and its role in the pathogenesis of bronchial asthma. Drug News Perspect. 2004;17(2):91-8.
13. Faghih Z, Erfani N, Razmkhah M, Sameni S, Talei A, Ghaderi A. Interleukin13 haplotypes and susceptibility of Iranian women to breast cancer. Mol Biol Rep. 2009;36(7):1923-8.
14. Sameni S, Ghayumi MA, Mortazavi G, Faghih Z, Kashef MA, Ghaderi A. Lack of association between interleukin-13 gene polymorphisms (-1055 C/T and +2044 G/A) in Iranian patients with lung cancer. Mol Biol Rep. 2009;36(5):1001-5.
1. Médico (Professor de Otorrinolaringologia, Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço, Hospital Khalili, Universidade de Ciências Médicas de Shiraz, Shiraz 71936-13511, Irã).
2. Médico (Professor Associado de Otorrinolaringologia, Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço, Hospital Khalili, Universidade de Ciências Médicas de Shiraz, Shiraz 71936-13511, Irã).
3. Médico (Professor de Imunologia, Centro de Pesquisa Oncológica, Universidade de Ciências Médicas de Shiraz, Shiraz, 71936-13511, Irã).
4. Médico (Comissão Discente de Pesquisa, Residente em Otorrinolaringologia, Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço, Hospital Khalili, Universidade de Ciências Médicas de Shiraz, Shiraz 71936-13511, Irã).
5. Médico (Instituto de Pesquisa Oncológica de Shiraz, Departamento de Radioterapia Oncológica, Hospital Namazi, Shiraz, 71936-13511, Irã).
Cancer Research Center, Shiraz University of Medical Sciences, Shiraz, Iran.
Endereço para correspondência:
Mohammad Mohammadianpanah
Cancer research center, Department of Radiation Oncology, Namazi Hospital
Shiraz, Iran
Postcode: 71936-13511. Telefax: 0098 711 6474320
E-mail: mohpanah@sums.ac.ir; mohpanah@gmail.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 26 de janeiro de 2012. cod. 9010.
Artigo aceito em 9 de agosto de 2012.
O presente estudo foi aprovado pela Comissão de Ética da Universidade de Ciências Médicas de Shiraz sob o protocolo número 3487.