Ano: 2002 Vol. 68 Ed. 4 - Julho - Agosto - (2º)
Seção: Artigo Original
Páginas: 453 a 460
Imunoexpressão da citoqueratina 16 e do antígeno nuclear Ki-67 no colesteatoma adquirido da orelha média
Expression patterns of cytokeratin 16 and the nuclear antigen Ki-67 in acquired middle ear cholesteatoma
Autor(es):
Celina S. B. Pereira (1),
Clemente I. R. Almeida (2),
Maria Regina Vianna (3)
Palavras-chave: imuno-histoquímica, citoqueratina, antígeno Ki-67, ouvido médio, colesteatoma
Keywords: immunohystochemistry, cytokeratin, Ki-67 antigen, middle ear, cholesteatoma.
Resumo:
O colesteatoma da orelha média é caracterizado pela presença de epitélio escamoso estratificado queratinizado nesta cavidade, causando destruição óssea e podendo levar a complicações. Algumas substâncias como a citoqueratina 16 e o Ki-67, marcadores de proliferação celular, vêm sendo utilizadas para estudar essa doença. A CK 16 é um filamento protéico, situado no citoplasma das células epiteliais, característico de epitélios hiperproliferativos. O Ki-67 é um antígeno nuclear que aparece nas células em estágio de proliferação. O objetivo deste trabalho foi estudar a imunoexpressão da CK 16 e do Ki-67 no colesteatoma adquirido. Foram colhidas amostras de colesteatoma de 31 pacientes submetidos à cirurgia otológica, sendo 20 adultos e 11 crianças, no período de 1998 e 2000. Essas amostras foram submetidas à análise histológica e imuno-histoquímica para estudo da expressão da CK 16 e do Ki-67 na matriz do colesteatoma. A análise dos resultados mostrou a presença da CK 16 nas camadas suprabasais da matriz do colesteatoma e, do Ki-67, na camada basal, estendendo-se para as camadas suprabasais e, inclusive, para a camada apical da matriz. A reação aos anticorpos anti-CK 16 e Ki-67 foi heterogênea. A correlação entre a CK 16 e o Ki-67 suprabasal com variáveis morfológicas, como acantose do epitélio e hiperplasia da camada basal formando cones epiteliais em direção à perimatriz, foi positiva e significativa. Também houve relação positiva e significativa entre a CK 16 e o Ki-67 suprabasal e apical. Esses resultados permitem concluir que o colesteatoma tem características hiperproliferativas, expressando a CK 16 e o Ki-67 na sua matriz.
Abstract:
Cholesteatomas of the middle ear are characterized by the presence of stratified squamous epithelium in this cavity presenting with highly invasive properties which may cause destruction of the bone and lead to complications. Substances such as cytokeratin (CK) 16 and Ki-67 are some of the markers of cellular proliferation and have been used to study this disease. CK 16 is a protein filament located in the cytoplasm of epithelial cells and typical of hyperproliferating epithelium. Ki-67 is a nuclear antigen found in cells that are in the proliferating stage. The objective of this research project was to study the expression of CK 16 and Ki-67 in acquired cholesteatomas. Samples were obtained from 31 patients submitted to otologic surgery for the removal of a middle ear cholesteatoma from 1998 to 2000. Twenty patients were adults and 11 were children. Samples were studied by histology and by immunohystochemistry for the expression of CK16 and Ki-67 in the matrix of the cholesteatoma. CK 16 was found in the suprabasal layers of the matrix of the cholesteatoma, and Ki-67 was found from the basal layer all the way to the suprabasal and apical layers. Reaction to anti-CK 16 and Ki-67 antibodies was heterogeneous. There was a positive and significant relation between morphological variables such as epithelial acantosis and hyperplasia of the basal layer and the presence of suprabasal CK16 and Ki-67 in the matrix. Based on the results of this study, the authors conclude that cholesteatomas have hyperproliferating characteristics with a significant-expression of CK16 and Ki-67 in the matrix.
![]()
INTRODUÇÃO
Colesteatoma da orelha média é caracterizado pela presença de epitélio escamoso estratificado queratinizado, retendo grande quantidade de lamelas de queratina, no interior desta cavidade, com características hiperproliferativas e destrutivas, podendo evoluir para complicações.
Histologicamente, o epitélio do colesteatoma é semelhante à epiderme da pele normal, contendo as quatro camadas clássicas dos tecidos epidérmicos (basal, espinhosa, granulosa e córnea). O epitélio do colesteatoma é também chamado matriz, e o tecido conjuntivo subepitelial, contendo fibras colágenas, elásticas, fibrócitos e células inflamatórias, perimatriz do colesteatoma1.
O advento da microscopia eletrônica de transmissão permitiu uma avaliação aprofundada da estrutura celular, e foi possível observar a existência de filamentos protéicos no citoplasma das células, de aproximadamente 10 nm de diâmetro, denominados filamentos intermediários. Esses filamentos fazem parte do citoesqueleto e são subdivididos em 5 tipos diferentes, cada qual característico de um determinado tecido2,3. Dentre eles, os mais complexos são a classe das citoqueratinas (CKs), presentes em todas as células epiteliais. Existem 20 CKs catalogadas até o momento, com pesos moleculares que variam entre 40 e 68 kD e pH entre 5 e 8. São subdivididas em CKs ácidas e básicas, e uma CK ácida juntamente com uma básica formam um par de CKs, o que é o mínimo necessário para se constituir um filamento intermediário. De acordo com o padrão de CKs que uma célula expressa, pode-se inferir a que tipo de epitélio ela pertence (simples ou estratificado), o tipo de programa de diferenciação celular que ela segue (esofagiano, córneo ou tipo pele) e o estágio de proliferação celular (normal ou hiperproliferativo), pois cada par de CKs é característico de um determinado epitélio.
Sabe-se que o colesteatoma possui um padrão de CKs semelhante ao da epiderme normal, epitélio do meato acústico externo e camada epitelial da membrana timpânica, contendo os pares de CKs 1-2/10 e 5/14. A mucosa da orelha média expressa CKs diferentes (CKs 8/18 e 19), típicas de epitélios simples. Isto é mais um indício de que a melhor teoria para explicar a etiopatogenia do colesteatoma adquirido é a da migração epitelial.
Além das CKs acima descritas, também há, na matriz do colesteatoma, a expressão da CK 16 nas camadas suprabasais, característica de epitélios hiperproliferativos4,5,6. A CK 16 não aparece na epiderme normal, exceto em áreas submetidas à pressão e atrito e no epitélio de revestimento dos folículos pilosos7. Porém, ela está sempre presente nas doenças epidérmicas hiperproliferativas8, sejam elas benignas (psoríase, verruga vulgar, dermatite de contato, dermatite atópica, dermatomiosite, queratose actínica) ou malignas (carcinoma verrucoso, espinocelular e basocelular). Regiões específicas como o anel timpânico e a região medial e inferior do meato acústico externo, junto ao anel, também expressam esta CK7,9.
Dentre as substâncias utilizadas como marcadores de proliferação celular, existe o Ki-67, que é um antígeno presente no núcleo das células em fase de multiplicação (fases G1 tardia, S, G2 e M do ciclo celular). Alguns autores como Bujía et al.10 e Mayot et al.11 observaram um elevado percentual de células Ki-67 positivas na matriz do colesteatoma em relação à epiderme normal, sendo este percentual diverso em diferentes locais de um mesmo caso, dependendo de variáveis como a espessura do epitélio, presença de granulação e maior quantidade de células inflamatórias na perimatriz.
O objetivo deste trabalho é detectar, utilizando métodos imuno-histoquímicos, a presença da CK 16 e do Ki-67 no colesteatoma, correlacionando-os com variáveis morfológicas, e verificar se há diferenças entre o colesteatoma das crianças e dos adultos.
CASUÍSTICA E MÉTODO
A casuística do presente trabalho constituiu-se de 31 pacientes submetidos à cirurgia otológica por apresentarem história clínica e exame físico compatíveis com quadro de otite média crônica colesteatomatosa, no período entre 1998 e 2000, nos quais foram obtidas amostras para estudo histológico.
A inclusão dos pacientes neste estudo obedeceu aos seguintes critérios:
- Achado de colesteatoma na orelha média durante o procedimento cirúrgico.
- Disponibilidade de tecido emblocado em parafina proveniente de amostras cirúrgicas, com representação do epitélio (matriz do colesteatoma).
Os pacientes operados neste período e incluídos no estudo tinham idades variando entre 4 e 64 anos, com média de 22,16 anos e mediana de 18 anos. Dos 31 pacientes, tivemos 21 do sexo masculino (67,74%) e 10 do sexo feminino (32,26%). Ainda em relação à idade, foram 11 pacientes menores de 16 anos (crianças - 35,48%) e 20 com idade igual ou superior a 16 anos (adultos - 64,52%). A escolha do parâmetro de 16 anos para subdividir os dois grupos etários foi baseada nos trabalhos de Palva et al.12 e Sheehy13.
O material estudado foi fixado em formol a 10% e processado pelas técnicas histológicas habituais, com inclusão em parafina, sendo submetido a secções em micrótomo rotativo, obtendo-se cortes com 3 micrômetros de espessura para os exames histológicos e imuno-histoquímicos. Alguns cortes foram submetidos à coloração pela hematoxilina-eosina para a análise das variáveis morfológicas. Os cortes não corados foram colocados em lâminas previamente imersas no adesivo organosilano (Sigma, EUA), e submetidos à técnica imuno-histoquímica através da imunoperoxidase em procedimento de 3 etapas, com amplificação pelo sistema avidina-biotina-peroxidase, sem tripsinização prévia. Os anticorpos monoclonais utilizados foram o anti-Ki-67 clone Ki-S5 (Dako, Dinamarca) e keratin 16 (hyperproliferation-related keratin) Ab-1 clone LL025 (Neomarkers, EUA).
Os aspectos morfológicos analisados foram:
- Atrofia: adelgaçamento da matriz do colesteatoma, às custas da diminuição do tamanho das células.
- Acantose: aumento da espessura do epitélio, às custas da proliferação das células da camada espinhosa.
- Hiperplasia da camada basal com formação de cones epiteliais: aumento do número de células da camada basal da matriz, formando invaginações para o interior da perimatriz.
- Processo inflamatório associado: caracterizado pela intensidade da permeação da perimatriz por linfócitos, neutrófilos, plasmócitos e macrófagos.
- Presença de tecido de granulação: caracterizado por um tecido conjuntivo frouxo, rico em vasos neoformados e contendo células inflamatórias de permeio.
As variáveis processo inflamatório associado e presença de tecido de granulação só puderam ser avaliadas nos casos onde havia perimatriz à microscopia óptica.
Também foram analisadas as seguintes variáveis, utilizando-se métodos imuno-histoquímicos:
- Ki-67 presente na camada basal da matriz do colesteatoma.
- Ki-67 presente nas camadas suprabasais da matriz.
- Ki-67 presente na porção mais apical da matriz (excluindo-se a camada córnea).
- CK 16 nas camadas suprabasais da matriz.
Tanto as variáveis morfológicas como as imuno-histoquímicas foram avaliadas de forma semiquantitativa e graduadas, de acordo com a intensidade, de 0 a 3, sendo:
0 - ausente, 1 - fraca, 2 - moderada, 3 - acentuada
Foi realizada análise estatística dos dados obtidos utilizando o teste exato de Fisher, o teste não-paramétrico de Mann-Whitney e o coeficiente de correlação de Spearman. Todos os testes foram realizados na forma bicaudal, admitindo-se nível de significância de 5%.
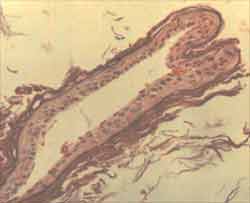
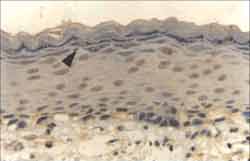
Figura 1. Fragmento de matriz de colesteatoma com atrofia completa do epitélio e intensa ortoqueratose (ä). Não há representação da perimatriz nesta amostra. (HE - X 200).
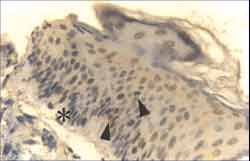
Figura 2. Corte de fragmento de colesteatoma mostrando matriz com acantose proeminente ([), hiperplasia da camada basal (ä) e hipergranulose (i). Na perimatriz observa-se infiltrado inflamatório misto (è), com linfócitos, plasmócitos e histiócitos, além de neoformação vascular. (HE - X 400).
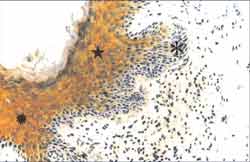
Figura 3. Corte de fragmento de colesteatoma mostrando matriz com intensa hiperplasia da camada basal, formando amplos cones epiteliais ([), que invadem a perimatriz. Nota-se também acantose (ä) na amostra, e o epitélio forma grande quantidade de lamelas de queratina. Na perimatriz há um denso infiltrado inflamatório linfo-histiocitário. (HE - X 100).
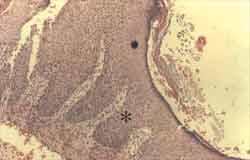
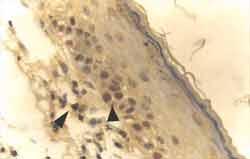
Figura 4. Reação ao anticorpo Ki-67 fortemente positiva, corando os núcleos de células da camada basal da matriz de fragmento de colesteatoma (ä)O anticorpo também corou um linfócito na perimatriz (ä). (IH - X 400).
Figura 5. Reação ao anticorpo Ki-67 fortemente positiva nos núcleos de células da camada basal, estendendo-se para as camadas suprabasais e, inclusive, para a camada apical (ä). (IH - X 400).
Figura 6. Reação ao anticorpo Ki-67 fortemente positiva nos núcleos de células da camada basal da matriz de fragmento de colesteatoma, estendendo-se para as camadas suprabasais (ä). Nota-se discreta hiperplasia da camada basal iniciando a formação de cones epiteliais ([). (IH - X 400).
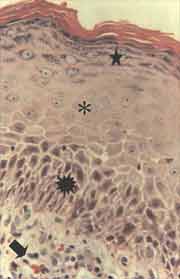
Figura 7. Reação ao anticorpo anti CK-16 fortemente positiva nas camadas suprabasais da matriz de fragmento de colesteatoma (i). Notam-se acantose (ä) e hiperplasia da camada basal da matriz, formando amplos cones epiteliais ([), que invadem a perimatriz. (IH - X 200).
RESULTADOS
Em relação à avaliação clínico-cirúrgica, 11 dos 31 pacientes estudados apresentaram algum tipo de complicação como erosão da parede posterior do meato acústico externo, fístula dos canais semicirculares, erosão da cortical da mastóide, fístula retroauricular, mastoidite, meningite e paralisia facial periférica. De todas as complicações encontradas, a mais freqüente foi a fístula dos canais semicirculares, somando 6 casos.
O resultado anatomopatológico dos 31 casos analisados mostrou heterogeneidade na representação de todas as variáveis estudadas, inclusive em um mesmo caso.
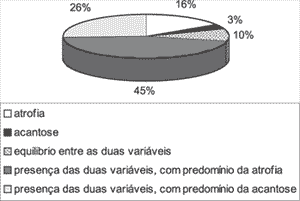
Em quase todos os fragmentos analisados, observou-se alternância entre áreas de epitélio escamoso estratificado adelgaçado e outras onde havia predomínio da acantose. Dos 31 casos estudados no presente trabalho em relação à atrofia e à acantose, 5 casos (16,13%) tiveram só atrofia e um caso (3,22%) praticamente só acantose. Em 3 casos (9,68%) observou-se um equilíbrio entre as áreas de atrofia e acantose. Nos outros 22 casos (70,97%) as duas variáveis apareceram com intensidades diversas, sendo que houve um predomínio da atrofia (valores maiores ou iguais a 2) em 14 casos (45,16% do total de casos) e um predomínio da acantose (valores maiores ou iguais a 2) em 8 casos (25,81% do total). A distribuição destas variáveis pode ser analisada no Gráfico 1.
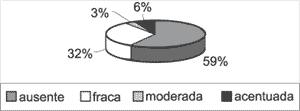
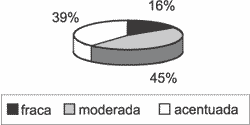
O epitélio dava origem à grande quantidade de lamelas de queratina. Nos locais onde a matriz era mais espessa, notavam-se áreas com hiperplasia da camada basal, formando cones epiteliais que invadiam a perimatriz. A hiperplasia da camada basal com cones epiteliais ocorreu em 41% dos 31 casos estudados, em intensidades variáveis, como mostra o Gráfico 2.
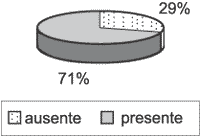
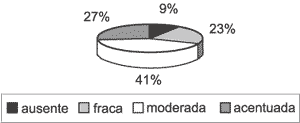
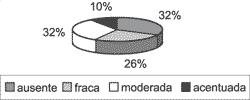
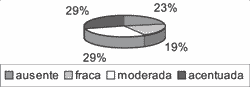
A perimatriz não estava presente em todos os casos. Apenas 22 deles (70,97%) tinham representação do córion (Gráfico 3), logo, só nestes casos a intensidade da inflamação e do tecido de granulação puderam ser analisados. Em relação à inflamação, dos 22 casos avaliáveis, ela estava presente em 20 deles (90,91%), com intensidades variando de fraca a acentuada (Gráfico 4). Já o tecido de granulação apareceu em aproximadamente metade dos casos avaliáveis, em menor intensidade (Gráfico 5).
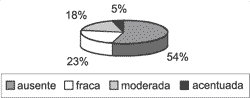
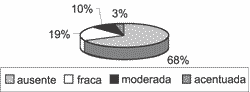
Em relação à avaliação imuno-histoquímica, a heterogeneidade das reações continuou a ser uma constante. Em todas as amostras o Ki-67 estava presente no núcleo das células da camada basal, em intensidades variáveis, porém tendendo a moderada e intensa (Gráfico 6). Em 21 dos 31 casos (67,74%), a reação ao anticorpo Ki-67 estendeu-se para as camadas suprabasais (Gráfico 7), e, em 10 casos (32,26%), manteve-se positiva até a camada mais apical, logo abaixo da camada córnea (Gráfico 8).
Em relação à CK 16, a reação foi predominantemente no citoplasma das células das camadas suprabasais, também em intensidades variáveis em locais diferentes de um mesmo caso. Sete dos 31 casos (22,58%) não reagiram ao anticorpo anti-CK 16 (Gráfico 9).
Em relação à análise estatística dos resultados, foram positivas e significativas as correlações entre as seguintes variáveis, utilizando-se o coeficiente de correlação de Spearman:
- Ki-67 apical com CK 16, Ki-67 suprabasal com CK 16 e Ki-67 suprabasal com Ki-67 apical (p=0,0160, p=0,0001 e p=0,0001 respectivamente).
- Ki-67 suprabasal e CK 16 com hiperplasia da camada basal com formação de cones epiteliais (p=0,0051 e p=0,0040 respectivamente).
- CK 16 e Ki-67 suprabasal com acantose (p=0,0001 e p=0,0001 respectivamente).
Já quanto às variáveis atrofia e acantose, foi utilizado o teste de correlação de Spearman, que mostrou haver correlação negativa e significativa entre elas (p=0,0001).
As outras correlações realizadas não mostraram diferenças estatisticamente significativas entre os grupos estudados (inflamação moderada e acentuada X Ki-67 suprabasal, apical, CK 16 e presença de complicações; complicações X hiperplasia da camada basal formando cones epiteliais; expressão da CK 16 moderada e acentuada entre adultos e crianças).
Gráfico 1. Distribuição das áreas de atrofia e acantose nos 31 casos estudados.
Gráfico 2. Distribuição da variável hiperplasia da camada basal formando cones epiteliais nos 31 casos estudados.
Gráfico 3. Presença e ausência de perimatriz nos 31 casos estudados. Apenas 22 deles (29%) tinham perimatriz presente.
Gráfico 4. Distribuição da variável processo inflamatório associado nos 31 casos estudados.
Gráfico 5. Distribuição do tecido de granulação nos 31 casos estudados.
Gráfico 6. Distribuição da variável Ki-67 basal nos 31 casos estudados.
Gráfico 7. Distribuição da variável Ki-67 suprabasal nos 31 casos estudados.
Gráfico 8. Distribuição da variável Ki-67 apical nos 31 casos estudados.
Gráfico 9. Distribuição da variável CK 16 suprabasal nos 31 casos estudados.
DISCUSSÃO
Em relação à atrofia e à acantose, em 25 dos 31 casos estudados (70,97%), ambas as variáveis estavam presentes na orelha média de um mesmo paciente. Em apenas um dos 31 casos não foi observada área de atrofia. Atrofia significa diminuição do tamanho da célula pela perda da substância celular, com redução dos componentes estruturais. Representa uma forma de resposta adaptativa, onde a célula tem seu funcionamento diminuído, mas não está morta. Quando um número suficiente de células está envolvido, todo o tecido torna-se atrófico. Este processo é decorrente de várias causas, entre elas: diminuição do suprimento sangüíneo, nutrição inadequada e compressão. Como a apoptose pode ser desencadeada por esses mesmos mecanismos, a atrofia pode progredir até o ponto em que as células são lesadas e morrem. Vários trabalhos, como os de Albino, Kimmelman, Parisier4, Chae et al.14 e Tomita15, estudaram a apoptose no colesteatoma e mostraram que substâncias indutoras da apoptose como o fator de necrose tumoral (TNF), o fator transformador do crescimento (TGF- ) e o p53 estão elevadas no colesteatoma quando comparadas com a pele normal.
Correlacionando as variáveis atrofia e acantose, houve relação negativa e significativa entre elas, mostrando que a atrofia e a acantose são inversamente proporcionais. Logo, quanto maior a atrofia em uma determinada área, menor a acantose, e vice-versa.
Para o estudo da inflamação, é necessária a avaliação da perimatriz, já que esta é o sítio onde se encontram as células inflamatórias. Dos 31 casos analisados neste estudo, a perimatriz só foi visualizada em 22 casos (70,97%); por este motivo a inflamação só pôde ser estudada nestes casos. Não há como saber se os outros 9 casos (29,03%) apresentavam ou não inflamação. Segundo Lim & Saunders1, todos os colesteatomas possuem perimatriz, mas nem sempre ela pode ser observada à microscopia óptica. Em alguns casos, a perimatriz é extremamente fina e só é percebida com o auxílio da microscopia eletrônica de transmissão. Nestes casos, as fibras colágenas estão quase ausentes, porém estruturas cristalinas são abundantes, dispersas no material amorfo da perimatriz. Esses autores acreditam que a diminuição na quantidade de fibras colágenas seria um indício da atividade da colagenase, enzima que destrói fibras colágenas e está presente no colesteatoma. Outro fator para justificar esse fato seria a pressão exercida pelo conteúdo do colesteatoma sobre a matriz e a perimatriz, comprimindo o tecido contra o arcabouço ósseo da orelha média. Tanto a atividade da colagenase como a pressão exercida sobre as paredes ósseas da orelha média são fatores que poderiam explicar o poder de erosão óssea que o colesteatoma apresenta. Os resultados do presente trabalho mostraram que os adultos tiveram uma quantidade maior de perimatriz visível à microscopia óptica do que as crianças. Isso é um achado que deveria ser melhor estudado, pois, se realmente existir mais colagenase nas crianças do que nos adultos, isso seria um dado interessante para explicar por que, clinicamente, o colesteatoma nas crianças é mais agressivo do que nos adultos.
Em relação ao presente estudo, dos 22 casos com perimatriz visível à microscopia óptica e que puderam ser avaliados, células inflamatórias foram observadas em 20, perfazendo um total de 90,91% dos casos. A reação inflamatória encontrada foi do tipo mista, contendo neutrófilos, macrófagos, plasmócitos e linfócitos. Não pôde ser feita correlação estatística entre casos com e sem inflamação, pois praticamente todos os casos com perimatriz possuíam células inflamatórias. Esse achado está de acordo com a observação clínica, já que é muito difícil ser encontrado um colesteatoma sem processo inflamatório.
Em relação às variáveis imuno-histoquímicas estudadas, os resultados obtidos no presente trabalho mostram que a CK 16 é expressa pelas células das camadas suprabasais da matriz do colesteatoma, de forma heterogênea, sendo que, dos 31 casos estudados, 7 não reagiram ao anticorpo anti-CK 16, num total de 22,58%, semelhante à estatística de Kakoi et al.16, de 25%.
Também foi analisada a imunoexpressão do antígeno Ki-67, presente no núcleo de células que estão em fase de multiplicação. O ciclo celular é constituído pelas fases G1, S, G2, e M. A fase G0 é aquela onde as células estão quiescentes, em repouso, mas a qualquer momento podem entrar no ciclo e iniciar o processo de multiplicação. As fases G1 e G2 são fases de transição, a fase S é onde ocorre a síntese e duplicação do DNA e a fase M é aquela onde ocorre a mitose propriamente dita. O Ki-67 está presente nas fases G1 tardia, S, G2 e M do ciclo celular, e ausente nas fases G1 precoce e G017,18. É um anticorpo muito utilizado para estudar o potencial de crescimento das células tumorais, analisando a fração de crescimento do tumor, ou seja, quantas células encontram-se no ciclo celular. Cattoreti et al.19 relataram a equivalência entre o Ki-67 e os anticorpos MIB 1, MIB 2 e MIB 3, que foram produzidos utilizando-se partes recombinantes do antígeno nuclear Ki-67. O Ki-67 está presente no núcleo de algumas células basais do epitélio do meato acústico externo, num percentual pequeno. Já no colesteatoma, o percentual de células Ki-67 positivas na camada basal é maior, e estende-se para as camadas suprabasais4,10,20-22. Em relação à camada basal da matriz do colesteatoma, a reação é aproximadamente 2,3 vezes maior do que a encontrada na epiderme do meato acústico externo20,22.
Os resultados do presente trabalho mostraram 100% dos casos apresentando Ki-67 na camada basal. 21 dos 31 casos (67,74%) exibiram células Ki-67 positivas nas camadas suprabasais. 10 casos (32,26%) reagiram ao anticorpo Ki-67 também na camada mais superficial da matriz, logo abaixo da camada córnea (Ki-67 apical), sendo 1 criança (10% dos casos com Ki-67 apical presente) e 9 adultos (90%). A diferença entre a presença do Ki-67 apical nos adultos e nas crianças foi estatisticamente significativa, sendo que nos adultos foram encontradas mais células apicais Ki-67 positivas do que no grupo das crianças, ao contrário do que seria esperado intuitivamente quando comparada clinicamente a agressividade do colesteatoma das crianças e dos adultos. Em relação ao Ki-67 basal e suprabasal, não foram observadas diferenças entre os dois grupos etários. Bujía et al.10 também estudaram a reação do MIB 1 em amostras de matriz de colesteatoma de 15 adultos e 20 crianças e encontraram uma média de células MIB 1 positivas maior no grupo das crianças do que no dos adultos, sendo esta diferença estatisticamente significativa, resultado este oposto ao encontrado no presente trabalho. Como esses autores estudaram um número um pouco maior de crianças em relação a este trabalho (20 e 11 crianças, respectivamente), seria interessante repetir a análise dessas variáveis em um número maior de crianças, para verificar se realmente existem diferenças estatisticamente significativas. Outro fato que deve ser relatado é que no seu estudo, Bujía et al. não especificaram até que idade os indivíduos foram considerados crianças.
A correlação entre as variáveis mostrou algumas diferenças estatisticamente significativas entre elas. Em relação ao processo inflamatório da perimatriz, como mais de 90% dos casos tinham algum grau de inflamação, os casos foram subdivididos em dois grupos, um onde a inflamação era ausente ou fraca (valores menores que 2) e outro onde a intensidade do processo inflamatório variava entre moderada e intensa (valores maiores ou iguais a 2). Não houve correlação entre esses dois grupos e a presença das variáveis CK 16 e Ki-67 suprabasal ou apical. Portanto, neste estudo, pode-se inferir que a inflamação seja uma variável encontrada em praticamente todos os casos de colesteatoma, mas não foi observada correlação positiva entre a intensidade da inflamação e a presença da CK 16 ou do Ki-67 suprabasal e apical, diferentemente dos achados de Sudhoff et al.23, Sudhoff et al.22 e Vennix et al.24.
Uma relação muito interessante foi entre as variáveis Ki-67 suprabasal, Ki-67 apical e CK 16 suprabasal. Houve correlação positiva e estatisticamente significativa entre essas variáveis. Logo, pode-se inferir que quanto maior o valor do Ki-67 suprabasal, maior a quantidade da CK 16. Quanto maior o valor do Ki-67 apical, também é maior a quantidade da CK 16. E, conseqüentemente, quanto maior o Ki-67 suprabasal, maior o Ki-67 apical. Como a CK 16 é característica de epitélios hiperproliferativos e o Ki-67 é um indicativo de proliferação celular, esses resultados confirmam a natureza hiperproliferafiva do colesteatoma.
Continuando a análise estatística das variáveis estudadas, procurou-se verificar alguma relação entre a existência de complicações e a presença das variáveis Ki-67 suprabasal, Ki-67 apical, CK 16, hiperplasia da camada basal com cones epiteliais e inflamação (moderada e acentuada). Não houve associação entre complicações e a presença de todas essas variáveis. Seria interessante retestar essas variáveis com uma casuística maior, pois, empiricamente, casos considerados mais agressivos, com elevado poder de destruição óssea e de evoluir para complicações, deveriam expressar quantidades maiores do Ki-67 suprabasal, apical ou da CK 16. Hoppe, em 199525, também analisou a expressão do Ki-67 em nove colesteatomas considerados agressivos, 30 menos agressivos e seis recidivas. A divisão entre maior e menor agressividade dos casos de colesteatoma baseou-se em achados intra-operatórios, como o grau de erosão óssea e presença de processo inflamatório e de tecido de granulação exuberantes. Este autor também não encontrou diferença estatisticamente significativa entre os tipos de colesteatoma, porém sua casuística em relação aos casos considerados agressivos foi ainda menor do que a do presente trabalho (nove casos agressivos e 11 casos com complicação, respectivamente).
Já em relação aos cones epiteliais e à acantose, a correlação foi positiva e significativa entre estas variáveis e a expressão do Ki-67 suprabasal e da CK 16 suprabasal. Logo, quanto maior a expressão do Ki-67 suprabasal e da CK 16 suprabasal, maior a hiperplasia da camada basal e a acantose do epitélio. Esses resultados mostram que a hiperplasia da camada basal formando cones epiteliais tem relação direta com as variáveis indicativas de hiperproliferação, estando de acordo com os trabalhos de Bernal Sprekelsen et al.20, Hoppe25, Mayot et al.11 e Sudhoff et al.22. E, também, quanto mais espessa a matriz, maior a expressão da CK 16 e do Ki-67, sendo que esses resultados estão de acordo com os de Bernal Sprekelsen20 e Sudhoff et al.22.
CONCLUSÕES
O colesteatoma é uma doença hiperproliferativa, apresentando a CK 16 nas camadas suprabasais e o antígeno nuclear Ki-67 na camada basal, estendendo-se para as camadas suprabasais e, inclusive, para a camada apical de sua matriz, em intensidades variáveis em diferentes locais da orelha média do mesmo paciente.
Quanto maior a concentração do Ki-67 suprabasal e do Ki-67 apical, maior a quantidade da citoqueratina 16 nas camadas suprabasais da matriz do colesteatoma. Quanto mais espessa a matriz do colesteatoma e maior a quantidade de cones epiteliais invadindo a perimatriz, maior a expressão da citoqueratina 16 e do Ki-67 nas camadas suprabasais.
Não houve relação estatisticamente significativa entre o aumento da inflamação na perimatriz e maior expressão da citoqueratina 16 e Ki-67 nas camadas suprabasais da matriz do colesteatoma. Não houve diferença estatisticamente significativa entre o colesteatoma nos dois grupos etários (crianças e adultos) em relação às variáveis CK 16 e Ki-67 suprabasal, apenas em relação ao Ki-67 apical, onde notou-se um aumento na intensidade desta variável no grupo dos adultos em relação às crianças.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Lim DJ & Saunders WH. Acquired cholesteatoma: light and electron microscopic observatios. Ann Otol 1972;81:2-12.
2. Cooper D, Schermer A, Sun TT. Classification of human epithelia and their neoplasms using monoclonal antibodies to keratins: strategies, applications, and limitations. Lab Invest 1985;52:243-56.
3. Moll R, Franke WW, Schiller DL. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cultured cells. Cell 1982;31:11-24.
4. Albino AP, Kimmelman CP, Parisier SC. Cholesteatoma: a molecular and cellular puzzle. Am J Otol 1998;19:7-19.
5. Kim CS & Chung JW. Morphologic and biologic changes of experimentally induced cholesteatoma in mongolian gerbils with anticytokeratin and lectin study. Am J Otol 1999;20:13-8.
6. Pereira CSB. Análise de estudos da expressão das citoqueratinas no colesteatoma adquirido. São Paulo, 1997 (dissertação - mestrado - Faculdade de Ciências Médicas da Santa Casa de São Paulo).
7. Lepercque S, Broekaert D, Van Cauwenberge P. Cytokeratin expression patterns in the human tympanic membrane and external ear canal. Eur Arch Otorhinolaryngol 1993;250:78-81.
8. Weiss RA, Eichner R, Sun TT. Monoclonal antibody analysis of keratin expression in epidermal diseases: a 48- and 56- kDalton keratin as molecular markers for hyperproliferative keratinocytes. J Cell Biol 1984;98:1397-405.
9. Broekaert D, Coucke P, Leperque S, Ramaekers F, Van Muijen G, Boedts D, Leigh I, Lane B. Immunohistochemical analysis of the cytokeratin expression in middle ear cholesteatoma and related epithelial tissues. Ann Otol Rhinol Laryngol 1992;101:931-8.
10. Bujía J, Holly A, Antolí-Candela F, Tapia MG, Kastenbauer E. Immunobiological Peculiarities of cholesteatoma in children: quantification of epithelial proliferation by MIB1. Laryngoscope 1996;106:865-7.
11. Mayot D, Béné MC, Perrin C ,Faure GC. Restricted expression of Ki-67 in cholesteatoma epithelium. Arch Otolaryngol Head Neck Surg 1993;119:656-8.
12. Palva A, Karma P, Kärjä J. Cholesteatoma in children. Arch Otolaryngol 1977;103:74-7.
13. Sheehy JL. Management of cholesteatoma in children. Adv Oto-Rhino-Laryng 1978;23:58-64.
14. Chae SW, Song JJ, Suh HH, Lim HH, Hwang SJ. Expression patterns of p27Kip1 and Ki-67 in cholesteatoma epithelium. Laryngoscope 2000;110:1898-901.
15. Tomita S. Aspectos moleculares do colesteatoma - imunoexpressão das proteínas controladoras do ciclo celular:p53, bax e bcl-2. São Paulo, 2000 (tese - doutorado - Escola Paulista de Medicina).
16. Kakoi H, Tamagawa Y, Kitamura K, Anniko M, Hiraide F, Kitajima Y. Cytokeratin expression patterns by one- and two- dimensional electrophoresis in pars flaccida cholesteatoma and pars tensa cholesteatoma. Acta Otolaryngol 1995;115:804-10.
17. Brown DC & Gatter KC. Monoclonal antibody Ki-67: its use in histopathology. Histopathology 1990;17:489-503.
18. Gerdes J, Lemke H, Baisch H, Wacker H, Schwab U, Stein H. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki-67. J Immunol 1984;133:1710-5.
19. Cattoretti G, Becker MHG, Key G, Duchrow M, Schlüter C, Galle J, Gerdes J. Monoclonal antibodies against recombinant parts of the Ki-67 antigen (MIB 1 and MIB 3) detect proliferating cells in microwave-processed formalin-fixed paraffin sections. J Pathol 1992;168:357-63.
20. Bernal Sprekelsen M, Ebmeyer J, Buchbinder A, Sudhoff H. Comparative analysis of the proliferative capacity of cholesteatoma. Acta Otorrinolaringol Esp 2000;51:299-307.
21. Ergün S, Zheng X, Carlsöö B. Antigen Expression of epithelial markers, collagen IV and Ki67 in middle ear cholesteatoma. An immunohistochemical study. Acta Otolaryngol (Stockh) 1994;114:295-302.
22. Sudhoff H, Bujía J, Fisseler-Eckhoff A, Holly A, Schulz-Flake C, Hildmann H. Expression of a cell-cycle-associated nuclear antigen (MIB1) in cholesteatoma and auditory meatal skin. Laryngoscope 1995;105:1227-31.
23. Sudhoff H, Borkowski G, Bujia J, Hildmann H, Fisseler-Eckhoff A. Immunhistochemische untersuchungen von mittelohrschleimhautresten im cholesteatom. HNO 1997;45:630-5.
24. Vennix PPCA, Kuijpers W, Peters TA, Tonnaer ELGM, Ramaekers FCS. Keratinocyte differentiation in acquired cholesteatoma and perforated tympanic membranes. Arch Otolaryngol Head Neck Surg 1996;122:825-32.
25. Hoppe F. Untersuchung zum proliferationsverhalten von cholesteatomen. HNO 1995;43:710-5.
1 - Doutoranda na área de Otorrinolaringologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
2 - Professor Titular da Faculdade de Medicina de Jundiaí.
3 - Anátomo-patologista do Hospital Alemão Oswaldo Cruz.
Endereço para correspondência: Dra. Celina S. B. Pereira: Rua Sabará, 566 conj. 23
Higienópolis 01239-011 - São Paulo - SP - E-mail: cpereira@dialdata.com.br
Artigo selecionado entre os 10 melhores trabalhos na área de Otologia, recebendo menção honrosa, ganhou o prêmio de melhor trabalho da supra-especialidade.