Ano: 2012 Vol. 78 Ed. 4 - Julho - Agosto - (12º)
Seção: Artigo Original
Páginas: 59 a 65
Expressão da proteína ligadora de cálcio S100 A7 (psoriasina) no carcinoma laríngeo
Expression of calcium binding protein S100 A7 (psoriasin) in laryngeal carcinoma
Autor(es): Rogério Costa Tiveron1; Luiz Carlos Conti de Freitas1; David L Figueiredo1; Luciano N Serafini2; Rui Celso Martins Mamede1; Marco A Zago3
Palavras-chave: carcinoma de células escamosas, neoplasias laríngeas, proteínas S100.
Keywords: carcinoma, squamous cell, laryngeal neoplasms, S100 proteins.
Resumo:
Muitos estudos relatam o aumento da expressão de S100 A7 (psoriasina) em lesões neoplásicas. Destacam-se trabalhos em carcinoma da mama, espinocelular da bexiga, pele e cavidade oral. Não foi demonstrada expressão da S100 A7 em câncer de laringe.
OBJETIVO: Identificar a expressão da proteína ligadora de cálcio S100 A7 e sua correlação com carcinomas espinocelular da laringe.
MATERIAL E MÉTODOS: Amostras de tecido neoplásico de 63 pacientes foram submetidos à imunohistoquímica com o anticorpo S110 A7. Os resultados foram classificados e comparados.
RESULTADOS: O grupo bem diferenciado teve a maior pontuação de falha no tratamento. O grupo moderadamente diferenciado apresentou escores mais elevados do que o grupo pouco diferenciado. Pontuações mais altas predominaram nos estágios I e II no grupo moderadamente diferenciado, enquanto a distribuição do escore foi mais homogênea em estados avançados (III e IV). Em relação às falhas no tratamento, o grupo pontuação zero (04/03 complicações: 75%) diferiu significativamente da pontuação restante (13/59: 22%).
CONCLUSÕES: A S100 A7 foi expressa em 93,7% dos casos de câncer de laringe, com maior positividade nos tumores mais diferenciados e taxa significativamente menor de falha no tratamento. A pontuação obtida não teve impacto sobre a sobrevivência.
Abstract:
Many studies have reported increased expression of S100 A7 (psoriasin) in neoplastic lesions. Among them are studies on breast carcinoma, bladder squamous cell carcinoma, skin tumors and oral cavity squamous cell carcinoma. The expression of S100 A7 has not been described for laryngeal cancer.
OBJECTIVE: This study aims to identify the expression of the calcium-binding protein S100 A7 and its correlation with squamous cell carcinomas of the larynx.
MATERIAL AND METHODS: Specimens from 63 patients were submitted to immunohistochemistry testing with antibody S100 A7. Results were classified and compared.
RESULTS: The group with highly differentiated tumors had the highest treatment failure scores. Moderately differentiated tumors had higher treatment failure scores than poorly differentiated tumors. Higher scores were predominantly seen on stages I and II in moderately differentiated tumors, whereas score distribution was more homogeneous in advanced stage disease (III and IV). Regarding failure in treatment, the group scoring zero (3/4 complications: 75%) differed significantly from the remaining groups (13/59: 22%).
CONCLUSIONS: S100 A7 marker was expressed in 93.7% of laryngeal cancer cases, with higher positive correlation rates in more differentiated tumors and significantly lower rates of treatment failure. Scores had no impact on survival rates.
![]()
INTRODUÇÃO
Apesar dos muitos progressos no diagnóstico e tratamento das neoplasias laríngeas, a sobrevida dos pacientes acometidos aumentou pouco nos últimos 30 anos. Acredita-se que isso se deva ao curso heterogêneo da afecção, sendo de fundamental importância identificar os tumores mais agressivos de maneira a elevar as taxas de cura por meio da aplicação de tratamentos específicos. Muitas características clínicas e histopatológicas que podem definir esse grupo de tumores têm sido intensamente estudadas. Ênfase tem sido dada nos últimos anos às alterações celulares e moleculares, ainda que sem sucesso1.
O estudo da proteína psoriasina ainda encontra-se em seus estágios iniciais2; contudo, sua presença na urina sugere que este pode ser um marcador não invasivo capaz de identificar casos de câncer e, segundo Skliris et al.3, ao ser regulada pela atividade do receptor de estrógeno, este gene pode representar um importante vetor para terapia alvo. Relatos frequentes de expressão aumentada deste gene em lesões neoplásicas têm sido publicados. Dentre estes estão os estudos sobre carcinoma ductal de mama, carcinoma espinocelular de bexiga, tumores de pele e carcinoma espinocelular da cavidade oral4,5.
Assim, o objetivo do presente estudo foi identificar a expressão imunoistoquímica da psoriasina S100 A7 em carcinomas espinocelulares de laringe (CECL) e sua correlação com as variáveis demográficas dos pacientes e com as características histológicas do tumor. Um objetivo adicional foi comparar as curvas gerais de sobrevida dos pacientes que expressam este gene às daqueles que não o expressam.
MATERIAIS E MÉTODOS
Foram selecionados 63 pacientes com diagnóstico histopatológico de CECL tratados cirurgicamente, que deram seu consentimento informado por escrito para participar do estudo (Protocolo CEP nº 9371/2003). Os critérios de inclusão foram a disponibilidade de amostra de tecido representativa para processamento histológico, definição precisa do sítio do tumor primário e dados clínicos e de seguimento completos. As peças foram processadas segundo a rotina para estudos anatomopatológicos. Os dados clínicos, sociodemográficos, anatomopatológicos e de seguimento dos pacientes foram armazenados num sistema de controle de dados.
Para as reações de imunohistoquímica, foram obtidos cortes seriados de 4 mm do bloco representativo e montados em lâminas com solução adesiva 3-aminopropiltrietoxisilano (Sigma Chemical Co.®, St. Louis, MO). Os cortes foram submetidos à recuperação de antígeno com calor por 3 minutos em vaporizador em solução 10 mM de ácido cítrico pH 6,0. A peroxidase endógena foi bloqueada com solução aquosa de peróxido de hidrogênio a 6%. O anticorpo usado para a reação imunoistoquímica foi S 100 A7 (psoriasina) - anticorpo monoclonal líquido de rato NCL-L-S100 A7 (Novocastra Laboratories, Newcastle-upon-Tyne, UK). Um polímero de dextrano e o sistema de amplificação de enzimas NovoLink (Novocastra) foram usados para evitar uma reação endógena devido à presença de biotina e avidina. O material foi incubado com o anticorpo primário a 37ºC em câmara úmida durante a noite e com um anticorpo secundário diluído em PBS por 30 minutos a 37ºC. Depois da lavagem com PBS, as lâminas foram incubadas com o sistema de amplificação Novolink a 37ºC por 30 minutos. Finalmente, os cortes foram lavados em água corrente por 10 minutos, contracorados com hematoxilina de Harris por 10 segundos, lavados novamente em água corrente, desidratados com etanol, clareados em xileno e montados com resina Permount (code S15-100, Fisher Scientific®, Fair Lawn, NJ). Os controles positivos (pele normal) foram usados para cada lote de reações. Os controles negativos (brancos) foram preparados substituindo-se o anticorpo primário por PBS.
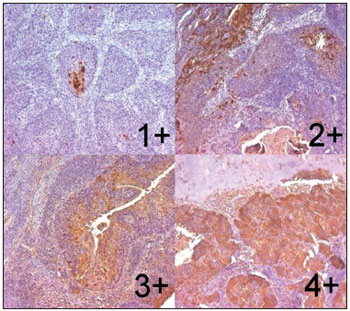
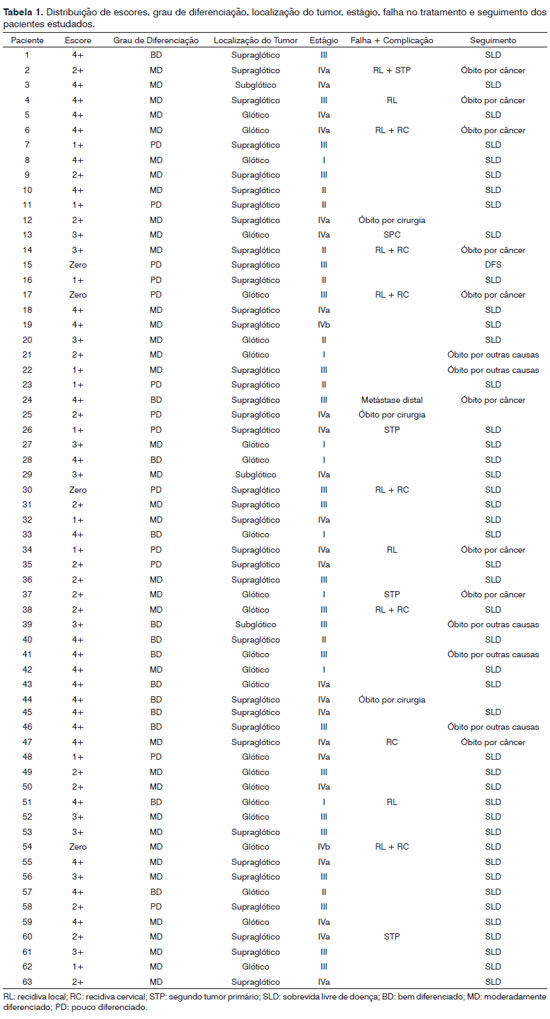
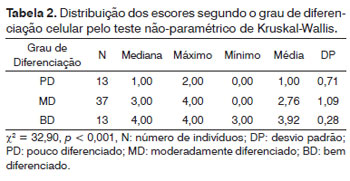
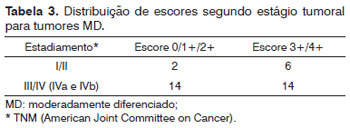
As reações foram examinadas por dois patologistas sem ciência dos casos e definidos por consenso. As reações foram avaliadas subjetivamente como zero (até 5% das células neoplásicas marcadas), 1+ (5-25%), 2+ (25-50%), 3+ (50-75%) e 4+ (acima de 75%) (Figura 1). Imunomarcações positivas acima de 5% foram consideradas para análise estatística.
Figura 1. Peça de laringe de carcinoma espinocelular após reação imunohistoquímica com expressão de psoriasina S100 A7. Escores 1+, 2+, 3+ e 4+ (Ampliação 100X).
Os diferentes escores obtidos para as reações foram comparados aos dados clínicos, histopatológicos e de seguimento dos pacientes. Os dados foram analisados estatisticamente por meio de métodos não-paramétricos, já que a variável escore não apresentou distribuição normal. A variável escore foi analisada enquanto variável numérica. O nível de significância foi definido com p < 0,05.
RESULTADOS
Características da Amostra
A amostra consistia de 63 pacientes, 58 homens com idades entre 27 e 78 anos (média 57,46 anos) e cinco mulheres com idades entre 47 e 59 anos (média 53,2 anos). A maioria dos pacientes tinha tumores localizados na supraglote (36 casos) e na glote (24 casos), com incidência respectiva de 57% e 38%. Apenas três casos (4,7%) tinham tumores originados na subglote. Com relação ao estadiamento clínico, oito casos estavam no estágio I, oito no estágio II, 22 no estágio III e 25 no estágio IV, três dos quais no estágio IVb. Os tumores glóticos estavam distribuídos em todos os estágios, com oito classificados como estágio I; dentre os tumores supraglóticos, 15 estavam no estágio III e 15 no estágio IV. Apenas dois dos 63 pacientes não eram tabagistas e 52 eram etilistas.
Dos 63 pacientes estudados, 17 (27%) foram a óbito, 11 (17,4%) por conta da neoplasia e seis (9,5%) por causas não relacionadas à neoplasia. Recidiva local foi observada em 10 casos, sete pacientes tiveram recidiva local e um teve metástases distais. Um segundo tumor primário foi observado em cinco casos.
Todos os tumores foram classificados histologicamente segundo seu grau de diferenciação, sendo 13 (20,6%) bem diferenciados (BD), 37 (58,7%) moderadamente diferenciados (MD) e 13 (20,6%) pouco diferenciados (PD). A maioria dos tumores glóticos (91,7%) era moderadamente diferenciada (16/24 = 66,7%) ou bem diferenciada (6/24 = 25%); apenas dois eram pouco diferenciados. Os tumores supraglóticos eram mais uniformemente diferenciados, com sete (19,4%) bem diferenciados, 19 (52,7%) moderadamente diferenciados e 10 (27,8%) pouco diferenciados. Dentre os tumores subglóticos, dois eram moderadamente diferenciados e um era pouco diferenciado.
Determinação dos Escores
O escore foi 0+ em quatro casos (6,3%), 1+ em 10 casos (15,9%), 2+ em 15 casos (23,8%), 3+ em 10 casos (15,9%) e 4+ em 24 casos (38,1%). Os escores obtidos (Tabela 1) foram relacionados às variáveis clínicas e sociodemográficas dos pacientes e às características histopatológicas dos tumores. A distribuição dos escores foi bastante semelhante para os vários sítios anatômicos, exceto pela subglote, devido ao baixo número de casos. Tumores glóticos tendiam a classificações 3+ e 4+ (15 de 24), enquanto que os supraglóticos tendiam a ter um escore mais baixo (20 de 36).
Os escores foram comprados ao grau de diferenciação celular por meio do teste não-paramétrico de Kruskal-Wallis, cujos resultados são apresentados na Tabela 2. Houve diferença estatística significativa entre grupos. Os escores do grupo BD foram significativamente mais elevados que os dos grupos MD e PD, enquanto o grupo MD teve escores significativamente mais elevados que o grupo PD (BD > MD > PD). Tumores pouco diferenciados apresentavam intervalo de escore mais baixo, ou seja, nenhum apresentou escore 3 ou 4+. Considerando-se apenas os tumores moderadamente diferenciados, a análise dos escores em relação a estadiamento é apresentada na Tabela 3, em que os estágios I e II, estágios III e IV e escores 0, 1 e 2+ e 3 e 4+ são agrupados.
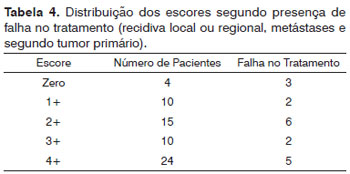
Nenhuma relação significativa foi detectada entre escores e as seguintes variáveis: sítio do tumor, estágio clínico, idade do paciente, presença de recidiva regional e/ou local, segundo tumor primário e óbito. A Tabela 4 exibe as correlações entre falha do tratamento definida como presença de recidiva loco-regional, metástases e um segundo tumor primário, e os diferentes escores. Houve diferença estatisticamente significativa (p = 0,02) entre o escore zero (3/4 = 75%) e os demais (15/59 = 25,4%) e falha do tratamento.
As várias curvas foram comparadas pelo método de Kaplan-Meier e o teste de Log-Rank. Nenhuma diferença significativa de sobrevida foi observada quando os escores foram analisados separadamente ou em conjunto. Dois grupos foram considerados para efeitos de comparação das curvas de sobrevida obtidas entre grupos de escores: grupo 1, com positividade ausente ou baixa (considerando-se os escores zero, 1+ e 2+), e grupo 2, com forte positividade (considerando-se os escores 3+ e 4+).
DISCUSSÃO
A expressão de psoriasina S100 A7 foi observada em 93,7% das amostras analisadas e seus escores estavam distribuídos entre os vários sítios anatômicos, exceto pela subglote, devido ao baixo número de casos. Os tumores glóticos demonstraram maior tendência a serem classificados como 3 e 4+ (15/24 = 62,5%), enquanto que os supraglóticos tendiam a escores de imunomarcação mais baixos (20/36 = 55,5%). Tumores pouco diferenciados receberam escores mais baixos. Isso explica a maior tendência dos tumores glóticos de receberem um escore mais alto, já que mais deles apresentavam maior diferenciação. Semelhantemente, os tumores supraglóticos tiveram escores mais baixos por serem pouco diferenciados, ainda que não tenha sido observada diferença significativa nos escores em relação a sítio de acometimento tumoral. Esse fato pode ser explicado pela função provável desse gene, que age quando as células são bem diferenciadas. Segundo Moubayed et al.4, este gene não parece ter uma função nos tumores indiferenciados.
Dos 37 tumores moderadamente diferenciados, 19 (19/36 = 53,7%) estavam localizados na supraglote, 16 (16/24 = 66,6%) na glote e dois na subglote. A maioria desses tumores (56,7%, 21/37) foram classificados como maior que 2+; contudo, a análise de sua distribuição segundo o estágio clínico revelou que aqueles classificados como estágio I ou II tendiam a obter escores superiores a 2+ (6/8), enquanto que os classificados como estágio III e IV demonstravam uma distribuição de escores mais uniforme. Em outras palavras, os escores se reduziam com o aumento da massa tumoral. Assim, a ação do gene da psoriasina parece estar concentrada nas etapas mais precoces da carcinogênese.
Rigopoulou et al.6 detectaram fatores de suscetibilidade para carcinoma papilar de tireoide que variavam de acordo com as populações investigadas (espanhóis, americanos e alemães), demonstrando que tal suscetibilidade dependia de fatores genéticos e ambientais. Esta análise não foi possível de ser feita no presente estudo porque apenas dois pacientes eram não tabagistas. Nenhum efeito do consumo de álcool foi detectado sobre a expressão do gene da psoriasina dentre os pacientes etilistas. Da mesma forma, nenhuma elação significativa foi traçada entre idade do paciente e escore do tumor.
Apesar do seguimento clínico dos presentes pacientes ter sido mais curto que o recomendado na literatura, a comparação das taxas de sobrevida em relação aos escores obtidos (analisados individualmente ou em grupos) não demonstrou uma diferença estatisticamente significativa.
Falha do Tratamento
A taxa de sobrevida da amostra presente foi de 73% (46/63) e a taxa de óbito foi de 27% (17/63 = 27%). Os óbitos se deveram a falha do tratamento em 12,7% (8/63) dos casos, a complicações associadas ao tratamento em 4,7% (3/63) e a outras causas em 9,5% (6/63) dos casos. Assim, 64,7% (11/17) dos óbitos se deveram ao tumor ou ao seu tratamento.
Dos 63 pacientes estudados, 25,3% (16/63) tiveram algum tipo de falha durante o tratamento (10 recidivas locais, sete recidivas cervicais, uma metástase e cinco segundos tumores primários, para um total de 23 eventos em 16 pacientes) e sete ainda estão vivos. Dentre os casos de falha do tratamento, a recidiva locorregional (doravante chamada apenas "recidiva") foi observada em 10 casos, enquanto metástases distais e a ocorrência de um segundo tumor primário (doravante chamadas "outros") foram observadas em cinco casos, com um paciente sendo acometido simultaneamente por recidiva e um segundo tumor primário. A distribuição desses eventos foi semelhante entre a glote (cinco recidivas e dois outros) e a supraglote (seis recidivas e quatro outros). Não houve casos observados na subglote.
Considerando-se apenas a presença de falha durante tratamento (detectada em 16 casos), pode-se observar que falha de tratamento ocorreu em 29,1% (7/24) dos tumores glóticos e em 25% (9/36) dos supraglóticos. Uma explicação para a maior agressividade observada nos tumores glóticos é que esses tumores não são tratados com radioterapia ou cirurgia endoscópica (tratamento indicado para estágios mais precoces). Assim sendo, a amostra de tumores glóticos aqui estudada provavelmente consistia da fração mais agressiva desses tumores.
Nenhuma diferença foi observada entre etilistas e não etilistas no tocante aos vários fatores estudados. Assim, ainda que o álcool tenha um papel comprovado na etiologia das neoplasias laríngeas, a substância não teve impacto sobre a sobrevida dos presentes pacientes, em contraste com a opinião de Dikshit et al.7.
Falha de tratamento ocorreu em 25% (2/8) dos tumores estágio I, em 12,5% (1/8) dos tumores estágio II, em 22,7% (5/22) dos tumores estágio III e em 28% (7/25) dos tumores estágio IV. A falha observada no estágio I foi em tumor glótico, quando foi feita uma tentativa de tratar o paciente com cirurgia parcial da laringe. Sabe-se que carcinomas supraglóticos têm diferentes comportamentos biológicos quando comparados a carcinomas da laringe, sempre demonstrando maior agressividade devido às frequentes metástases linfonodais, conforme relatado por Greenman et al.8. Entretanto, acredita-se que outros mecanismos influenciem sua agressividade, como a incidência mais elevada de tumores estágio III e IV em comparação às neoplasias glóticas, já que os tumores supraglóticos são diagnosticados mais tardiamente quando o volume de células neoplásicas é maior. No presente estudo, a maioria dos tumores supraglóticos foram classificados nos estágios III e IV, mas não exibiram maior agressividade.
Os escores no grupo que teve falha de tratamento foram zero+ em 75% dos casos (3/4), 1+ em 20% (2/10), 2+ em 26,6% (4/15), 3+ em 20% (2/10) e 4+ em 20,1% (5/24). Estes números nos levam a concluir que a falha do tratamento foi significativamente mais frequente dentre pacientes com escore zero para o gene da psoríase. Devemos enfatizar que a recidiva local é consequência do ato cirúrgico quando são deixadas margens de segurança escassas no leito cirúrgico, estando assim muito mais relacionada à indicação e execução da cirurgia do que à agressividade do tumor. Não é este o caso da recidiva regional que, ainda que relacionada à indicação e execução da dissecção de linfonodos cervicais, deve-se à maior agressividade do tumor. Outras falhas associadas ao tratamento na qual a indicação errônea de tratamento não está envolvida são metástases distais e presença de um segundo tumor primário. Estas três complicações - recidiva regional, metástase e um segundo tumor primário - estiveram presentes em 13 casos, ou seja, em 19,4% dos tumores supraglóticos (7/36) e em 25% (6/24) dos tumores glóticos. Elas afetaram oito casos com escore inferior a 3+ (8/29 = 27,6%) e cinco casos com escore superior a 2+ (5/34 = 14,7%). A ocorrência de complicações estatisticamente significativas foi confirmada em casos com escore de psoriasina zero+ e as complicações também tenderam a ocorrer entre pacientes com escore < 3+.
Dos tumores analisados, 20,6% eram bem diferenciados, 58,7% eram moderadamente diferenciados e 20,6% eram pouco diferenciados. A distribuição da diferenciação celular foi semelhante à população de pacientes que apresentaram falha no tratamento, com tumores bem diferenciados em 23% dos casos (3/13), moderadamente diferenciados em 27% (10/37) e pouco diferenciados em 30% (4/13). Isso mostra que a diferenciação celular não teve influência sobre a falha do tratamento. A distribuição da diferenciação celular foi a mesma em todas as regiões anatômicas. Não há evidências da existência de diferenças biológicas intrínsecas dentre os tumores presentes nos diferentes sítios anatômicos. Entretanto, os tumores supraglóticos tendem a ser mais indiferenciados que os glóticos, fato não observado no presente estudo.
Psoriasina
No presente estudo, a expressão do marcador de psoriasina (S100 A7) foi detectada em 93,7% dos casos de CECL, sendo forte nos tumores diferenciados e fraca nos pouco diferenciados. A expressão mais intensa da psoriasina em tumores diferenciados está de acordo com os resultados obtidos por Leygue et al.9, que detectaram forte expressão positiva de psoriasina em carcinomas in situ e expressão menor em carcinomas invasivos. Esses autores avaliaram a expressão do mRNA da psoriasina em biópsias congeladas de tecido mamário de carcinomas ductais in situ, carcinomas invasivos e de tecidos normais. Sabemos que tumores mais diferenciados tendem a ser menos agressivos, com melhor decurso e sobrevida dos pacientes. Contudo, esse fato não foi confirmado no presente estudo, já que não detectamos diferenças na sobrevida entre os grupos estudados. Watson et al.10 relataram que a expressão de psoriasina foi amplamente detectada em tumores in situ e em apenas 18% dos tumores invasivos, sugerindo que tal expressão esteja associada a mudanças na diferenciação epitelial e deve ter um papel no desenvolvimento tumoral precoce. Um fator adicional para seu envolvimento na progressão do carcinoma ductal é sua localização na região do cromossomo 1 que frequentemente (> 50% dos casos) apresenta perda de heterozigose em tumores invasivos11.
Em estudo recente, Moubayed et al.4 determinaram a expressão de mRNA de psoriasina por RT-PCR em biópsias de pele de pacientes com lesões pré-neoplásicas, com carcinomas espinocelulares, carcinomas basocelular e controles normais. Eles detectaram expressão aumentada em pacientes com lesões pré-neoplásicas e carcinoma basocelular, além de expressão significativamente aumentada nos carcinomas espinocelulares. Os autores concluíram que, como nos casos de carcinomas ductais da mama e carcinomas espinocelulares da bexiga, o aumento na expressão da psoriasina deve ter um importante papel na progressão do câncer de pele. Watson et al.10 também acreditam que a psoriasina tem um importante efeito sobre o desenvolvimento do fenótipo invasivo, o que pode ser tanto um efeito indireto da resposta imunológica celular do hospedeiro ou até mesmo um efeito direto que contribui para a invasão tumoral. Nesta amostra, dentre os tumores moderadamente diferenciados, a expressão tendeu a diminuir com o aumento do estágio do tumor. A observação de que 75% dos tumores com escore zero tiveram falha no tratamento mostra que a invasão tumoral é favorecida pela ausência de psoriasina.
Segundo Zhou et al.5 a proteína ligante de cálcio atua na transdução e portanto na carcinogênese do epitélio, mas sua função ainda não foi completamente determinada. De acordo com Petersson et al.12, a psoriasina expressada desenvolve um fenótipo de resistência a apoptose e, segundo Wolk et al.13, a falta de expressão inibe a diferenciação celular e aumenta a motilidade celular, facilitando a invasão. Assim, a psoriasina tem expressão aumentada em tumores diferenciados durante a fase pré-invasiva e diminuída nos tumores menos diferenciados e naqueles em estágio invasivo4. Krop et al.14 acreditam que a psoriasina atua na promoção da angiogênese destacando as células que regem a função anti-invasiva, explicando, assim, a elevada expressão do gene em tumores bem diferenciados ou estrógeno-negativos.
Segundo Fukuzawa et al15, o gene da psoriasina age na transcrição, e o segmento do gene que exerce esta função em carcinomas espinocelulares da cavidade oral é de -1513 a -988. Segundo Mandal et al.16, a psoriasina modula a resposta imunológica, favorecendo o crescimento do câncer de mama nos estágios iniciais. Contudo, Zhou et al.3 demonstraram que a psoriasina age inibindo ou sendo inibida pelo complexo beta-catenina. Assim, segundo esses autores, em situações de expressão elevada há uma redução do complexo beta-catenina e o tecido pré-neoplásico é transformado em carcinoma espinocelular bem diferenciado de baixa agressividade. Um carcinoma espinocelular será pouco diferenciado e altamente agressivo quando a expressão do complexo beta-catenina for elevada o suficiente para inibir a expressão da psoriasina.
Em nossa opinião, esse gene atua nas fases iniciais da tumorigênese, sendo importante na origem dos tumores diferenciados. Entretanto, à medida que os tumores se tornam indiferenciados, a influência do gene desaparece ou os genes são consumidos para que o processo ocorra. Este deve ter sido o modo de ação do gene da psoriasina envolvido nos tumores laríngeos, ou seja, o gene participa na diferenciação tumoral e os tumores se tornam mais agressivos à medida que a expressão do gene é reduzida. O presente estudo foi o primeiro a avaliar a expressão desse marcador em neoplasia laríngea e estudos adicionais podem obter informações complementares que tornarão esse gene, expressado em 93,7% dos casos, em um marcador para presença e agressividade de CECL.
CONCLUSÕES
O marcador psoriasina S100 A7 foi expressado em 93,7% dos presentes casos de CECL, com maior positividade em tumores bem diferenciados, tendendo a diminuir com o aumento do estágio em tumores moderadamente diferenciados. Falha de tratamento foi mais frequente dentre os pacientes com escore zero, apesar do escore não ter impacto sobre a sobrevida.
REFERÊNCIAS
1. Figueiredo DL, Mamede RC, Proto-Siqueira R, Neder L, Silva WA Jr, Zago MA. Expression of cancer testis antigens in head and neck squamous cell carcinomas. Head Neck. 2006;28(7):614-9.
2. Barbieri MR, Andrade CD, Silva WA Jr, Marques AA, Leopoldino AM, Montes MB, et al. Expression of human protein S100A7 (psoriasin), preparation of antibody and application to human larynx squamous cell carcinoma. BMC Res Notes. 2011;4(1):494.
3. Skliris GP, Lewis A, Emberley E, Peng B, Weebadda WK, Kemp A, et al. Estrogen receptor-beta regulates psoriasin (S100A7) in human breast cancer. Breast Cancer Res Treat. 2007;104(1):75-85.
4. Moubayed N, Weichenthal M, Harder J, Wandel E, Sticherling M, Gläser R. Psoriasin (S100A7) is significantly up-regulated in human epithelial skin tumours. J Cancer Res Clin Oncol. 2007;133(4):253-61.
5. Zhou G, Xie TX, Zhao M, Jasser SA, Younes MN, Sano D, et al. Reciprocal negative regulation between S100A7/psoriasin and beta-catenin signaling plays an important role in tumor progression of squamous cell carcinoma of oral cavity. Oncogene. 2008;27(25):3527-38.
6. Rigopoulou D, Martinez-Laso J, Martinez-Tello F, Alcaide JF, Benmamar D, Hawkins F, et al. Both class I and class II HLA antigens are thyroid cancer susceptibility factors. Tissue Antigens. 1994;43(5):281-5.
7. Dikshit RP, Boffetta P, Bouchardy C, Merletti F, Crosignani P, Cuchi T, et al. Lifestyle habits as prognostic factors in survival of laryngeal and hypopharyngeal cancer: a multicentric European study. Int J Cancer. 2005;117(6):992-5.
8. Greenman J, Homer JJ, Stafford ND. Markers in cancer of the larynx and pharynx. Clin Otolaryngol Allied Sci. 2000;25(1):9-18.
9. Leygue E, Snell L, Hiller T, Dotzlaw H, Hole K, Murphy LC, et al. Differential expression of psoriasin messenger RNA between in situ and invasive human breast carcinoma. Cancer Res. 1996;56(20):4606-9.
10. Watson PH, Leygue ER, Murphy LC. Psoriasin (S100A7). Int J Biochem Cell Biol. 1998;30(5):567-71.
11. Munn KE, Walker RA, Varley JM. Frequent alterations of chromosome l in ductal carcinoma in situ of the breast. Oncogene. 1995;10(8):1653-7.
12. Petersson S, Bylander A, Yhr M, Enerbäck C. S100A7 (Psoriasin), highly expressed in ductal carcinoma in situ (DCIS), is regulated by IFN-gamma in mammary epithelial cells. BMC Cancer. 2007;7:205.
13. Wolk K, Witte E, Wallace E, Döcke WD, Kunz S, Asadullah K, et al. IL-22 regulates the expression of genes responsible for antimicrobial defense, cellular differentiation, and mobility in keratinocytes: a potential role in psoriasis. Eur J Immunol. 2006;36(5):1309-23.
14. Krop I, März A, Carlsson H, Li X, Bloushtain-Qimron N, Hu M, et al. A putative role for psoriasin in breast tumor progression. Cancer Res. 2005;65(24):11326-34.
15. Fukuzawa H, Kiyoshima T, Kobayashi I, Ozeki S, Sakai H. Transcription promoter activity of the human S100A7 gene in oral squamous cell carcinoma cell lines. Biochim Biophys Acta. 2006;1759(3-4):171-6.
16. Mandal S, Curtis L, Pind M, Murphy LC, Watson PH. S100A7 (psoriasin) influences immune response genes in human breast cancer. Exp Cell Res. 2007:313(14):3016-25.
1. Médico, Doutor (Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço - Escola de Medicina de Ribeirão Preto da Universidade de São Paulo - Brasil).
2. Médico, Doutor (Departamento de Patologia - Escola de Medicina de Ribeirão Preto da Universidade de São Paulo - Brasil).
3. Médico, Doutor (Departamento de Medicina Interna - Escola de Medicina de Ribeirão Preto da Universidade de São Paulo - Brasil).
Endereço para correspondência:
Rui Celso Martins Mamede
Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço. Hospital das Clínicas
Av. Bandeirantes, 3900. Monte Alegre
Ribeirão Preto - SP. Brasil. CEP: 14049-900
Tel: 55 (16) 3602-2353
E-mail:rcmmamed@fmrp.usp.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 26 de outubro de 2011. cod. 8868.
Artigo aceito em 18 de março de 2012.