Ano: 2012 Vol. 78 Ed. 3 - Maio - Junho - (20º)
Seção: Artigo Original
Páginas: 122 a 128
Otoproteção em cobaias expostas a agrotóxico e ginkgo biloba
Otoprotection in guinea pigs exposed to pesticides and ginkgo biloba
Autor(es): André a Dulor Finkler1; Aron Ferreira da Silveira2; Gisiane Munaro3; Crisley Dossin Zanrosso4
Palavras-chave: citoproteção, compostos organofosforados, ginkgo biloba, toxicidade.
Keywords: cytoprotection, toxicity, ginkgo biloba, organophosphorus compounds.
Resumo:
Os agrotóxicos são amplamente utilizados na agricultura e, atualmente, fazem parte do grupo de agentes químicos que podem levar à perda auditiva. A identificação de drogas que, associadas aos ototóxicos, possam atuar como otoprotetores é objeto de estudo.
OBJETIVO: Analisar a existência de efeito otoprotetor do extrato de Ginkgo biloba aos possíveis danos cocleares causados pelo agrotóxico do grupo dos organofosforados - metamidofós, avaliando-se as alterações anatômicas por meio da microscopia eletrônica de superfície.
MATERIAL E MÉTODO: Estudo experimental prospectivo utilizando 21 cobaias, que sofreram ação da administração de soro fisiológico, agrotóxico e ginkgo biloba isoladamente e associadas, durante sete dias consecutivos. Após, as cócleas foram removidas e avaliadas anatomicamente pela microscopia eletrônica de varredura.
RESULTADOS: As cobaias submetidas ao agrotóxico apresentaram alterações morfológicas cocleares, com lesões nas três espiras analisadas na microscopia eletrônica, intensificadas de acordo com a dosagem recebida do agente. As cobaias tratadas com agrotóxico e Ginkgo biloba apresentaram uma manutenção da arquitetura ciliar nas células ciliadas externas em todas as espiras da cóclea.
CONCLUSÃO: O extrato de Ginkgo biloba, por sua ação antioxidante, atuou como fator otoprotetor à ototoxicidade pelo agrotóxico em cobaias.
Abstract:
Pesticides are widely used in agriculture, despite the risk of hearing loss related to the exposure to their chemical components. This study looks into protective drugs to counteract the ototoxicity of pesticides.
OBJECTIVE: This study aims to analyze the effect ginkgo biloba extract may have in protecting against possible cochlear damage caused by organophosphate pesticides (methamidophos). Anatomic changes are assessed through surface and electron microscopy.
MATERIALS AND METHODS: This is a prospective experimental study. Twenty-one guinea pigs were given saline solution, pesticide, and ginkgo biloba alone or combined for seven consecutive days. Then their cochleas were removed and examined in a scanning electron microscope.
RESULTS: Pesticide-exposed guinea pigs had morphological alterations in their cochleas and injuries in the three turns analyzed through electron microscopy. Injury intensity varied according to the dosages of the agents given to the test subjects. Guinea pigs treated with pesticide and ginkgo biloba maintained the architecture of their outer hair cells in all cochlear turns.
CONCLUSION: The antioxidant properties found in the ginkgo biloba extract protected guinea pigs from pesticide ototoxicity.
![]()
INTRODUÇÃO
A agricultura é uma significativa e rentável atividade em termos sociais e empresariais. Contudo, a saúde do trabalhadores desse setor exige atenção, devido à exposição a ruídos, vibração e produtos químicos potencialmente prejudiciais ao ouvido interno1.
Aproximadamente 3 milhões de pessoas sofrem com a intoxicação por agrotóxicos em todo o mundo anualmente. Os óbitos chegam a cerca de 350 mil, dois terços dos quais em países em desenvolvimento2. No Brasil, a ocorrência de intoxicação por agrotóxicos organofosforados ainda é elevada, apesar da redução relativa em seu uso observada nos últimos oito anos. Atualmente, cerca de 2,5 a 3 milhões de toneladas de agrotóxicos são utilizados anualmente em todo o mundo pelo setor agrícola3.
As inúmeras alterações provocadas pela intoxicação por organofosforados em seres humanos são bem conhecidas. Apesar de haver acordo na literatura no tocante à associação existente entre exposição a organofosforados e alterações auditivas, poucos são os estudos que avaliam o uso de medicamentos otoprotetores e as alterações histológicas do sistema auditivo. Vários medicamentos já foram testados por suas propriedades otoprotetoras: tiossulfato de sódio, dietilcarbamato, ACTH e seus derivados, ácido 4-metiltiobenzoico, ácido lipoico, glutationa e seus é steres, metionina, procaína, hormônio alfa-melanócito-estimulante (melatonina), antioxidantes, como ginkgo biloba e fosfomicina, e compostos do enxofre4-6. A semelhança anatômica e fisiológica entre o sistema auditivo periférico dos seres humanos e das cobaias tem encorajado o uso desses animais, uma vez que seus resultados podem ser correlacionados aos em humanos, servindo, assim, de alerta para possíveis lesões causadas pelo contato com organofosforados.
Segundo o que apresentamos acima, o uso de cobaias é justificável na presente pesquisa, cujo objetivo é identificar o efeito otoprotetor de medicamentos já amplamente utilizados na prática clínica com outros fins, como o extrato de ginkgo biloba (EGB 761). Os danos cocleares causados pelo organofosforado metamidofós administrado em doses prejudiciais às células ciliadas externas (CCE) foram avaliados em função das mudanças anatômicas observadas por microscopia eletrônica de varredura (MEV), comparando as cócleas dos animais em tratamento com ginkgo biloba com animais de controle.
MATERIAIS E MÉTODOS
Descrição do Estudo
Estudo experimental executado com 21 cobaias (Cavia porcellus), desenvolvido na Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), totalizando 42 cócleas.
As diretrizes do Instituto de Recursos de Animais de Laboratório para o uso de animais em laboratório foram seguidas pelo Colégio Brasileiro de Experimentação com Animais (COBEA), bem como princípios éticos de biossegurança. O projeto de pesquisa foi primeiramente enviado para análise e aprovação do Comitê de ética para Experimentação com Animais (CETEA) de FMRP-USP, aprovado sob protocolo número 175/2009.
Os animais foram selecionados no Biotério Central de FMRP-USP. Os Critérios para a inclusão de cobaias na amostra foram presença de reflexo de Preyer (contração do pavilhão auditivo após estímulo sonoro), emissões otoacústicas por produto de distorção e peso entre 400 e 600 gramas. Após 24 horas de repouso auditivo, os animais foram avaliados por meio de otoscopia do meato acústico externo. Cobaias com otite, cerume ou meato externo estreito demais para acomodar a sonda auditiva foram excluídas. Animais sem EOAPD presente foram excluídos.
Os medicamentos usados no estudo são:Ketamina (65 mg/Kg).; Soro fisiológico a 0,9%; Tiopental (Thionembutal®); Metamidofós; Extrato de ginkgo biloba
As cobaias foram divididas em cinco grupos:
Grupo 1 (Grupo Controle) - três animais de laboratório (seis cócleas) nos quais soro fisiológico a 0,9% foi injetado pela via intraperitoneal por sete dias consecutivos.
Grupo 2 (Grupo Controle) - dois animais de laboratório (quatro cócleas), aos quais foi administrado 0,3 mg/kg/dia de metamidofós por injeção intraperitoneal por sete dias consecutivos.
Grupo 3 (Grupo de Estudo) - sete animais (14 cócleas), aos quais foi dado extrato de ginkgo biloba oral 100 mg/kg/dia e metamidofós passados 90 minutos da administração do extrato a 0,3 mg/kg/dia por injeção intraperitoneal por sete dias consecutivos.
Grupo 4 (Grupo de Estudo) - dois animais (quatro cócleas), aos quais foi administrado metamidofós 3,0 mg/kg/dia por injeção intraperitoneal por sete dias consecutivos.
Grupo 5 (Grupo de Estudo) - sete animais (14 cócleas), aos quais foi dado extrato de ginkgo biloba oral 100 mg/kg/dia e metamidofós passados 90 minutos da administração do extrato a 3,0 mg/kg/dia por injeção intraperitoneal por sete dias consecutivos.
O organofosforado metamidofós, escolhido é comercializado pela Fersol® Ltda, sendo a droga mais utilizada na agricultura (90%) na comunidade rural de Córrego de São Lourenço7. Os sintomas de intoxicação referidos pelos trabalhadores foram coceira, enrubescimento facial e irritação da mucosa dos olhos e da faringe.
Para avaliar a otoproteção das CCE expostas a lesão por metamidofós foi usado o extrato de ginkgo biloba (EGb761) comercializado no Brasil sob o nome TEBONIN® - Byk Química, 40mg/ml. Trata-se de um extrato amplamente utilizado na prática clínica que não apresenta efeitos colaterais importantes. Suas interações medicamentosas encontram-se bem descritas8.
A dose mínima de metamidofós usada para ototoxicidade foi a mesma usada em um estudo anterior9 e confirmada por meio de nosso grupo controle. O ginkgo biloba proporcionou otoproteção às CCE expostas a medicamento potencialmente ototóxico8,10 e foi baseado nesses estudos que decidimos utilizar a mesma dosagem.
As cobaias foram pesadas diariamente imediatamente antes da administração do medicamento. Os medicamentos foram administrados através de seringas descartáveis para insulina BD®, tamanho 21G1 (25 x 8 - 0,8 x 25 mm).
Avaliação Morfológica
No dia seguinte à administração dos medicamentos de cada grupo, as cobaias foram sacrificadas com injeção intraperitoneal de tiopental (Thionembutal®) e tiveram suas cócleas removidas imediatamente e abertas, expondo seu conteúdo.
Em seguida, as cócleas foram perfundidas em solução de fixação de glutaraldeído a 2,5% através da janela redonda, de modo a preservar as estruturas vestibulococleares. Então, o material foi lavado cinco vezes em tampão de fosfato 0,1M e microdissecado para expor as espiras cocleares. Novamente, o material foi colocado em tampão de fosfato 0,1M por 12 horas e depois foi lavado na mesma solução. Então, o material foi refixado em solução constituída de tetróxido de ósmio em 1% de tampão de fosfato 0,1M durante 1 hora a 4ºC. Em seguida, o material foi lavado em três banhos de água bidestilada por 2 ou 3 minutos e imerso em solução aquosa de ácido tânico a 1% por 1 hora a 4ºC.
As peças foram, então, desidratadas em banhos sucessivos de etanol em concentrações crescentes de 50%, 70%, 90% e 95% durante 10 minutos cada. Depois, foi usado etanol a 100% em 3 banhos sucessivos de 20 minutos cada, deixando as peças em temperatura ambiente por 12 horas no último banho.
Após a desidratação, a água restante nas peças foi secada no equipamento BAL-TEC - CPD 030 - Critical Point Dryer (Balzers, 40 Liechtenstein) por meio do processo de ponto crítico. As peças foram, então, removidas para a câmara do equipamento e cobertas em dióxido de carbono (CO2) líquido.
Para melhor visualização na MEV, as cócleas foram fixadas pelo seu fundo a um cilindro de metal com pasta carbônica condutiva Colloidal Graphite (Electron Microscopy Sciences - Hatfield, PA). As estruturas a serem analisadas foram cobertas com uma laca fina de ouro 24 quilates por meio de processo de evaporação no equipamento BAL-TEC - SCD 050 - Sputter Coater (Balzers, Liechtenstein), tornando-as condutivas, seguindo o processo descrito em estudos anteriores8,9,11,12. Depois deste processo de preparação, as peças foram levadas ao microscópio eletrônico por varredura JEOL Scanning Electron Microscope - JSM 5200 (Tóquio, Japão).
A análise estrutural foi padronizada pelo estudo do terço médio das três primeiras espiras cocleares. O giro apical não foi analisado por conta de seu desarranjo natural, que poderia obscurecer os resultados12. Quando o microscópio eletrônico por varredura foi aplicado ao órgão de Corti, a imagem produzida foi congelada e fotografada para ser análise posterior no tocante à integridade ou lesão de CCE.
A integridade das CCE foi definida pela análise dos estereocílios. células com estereocílios bem formados e em arranjo normal foram consideradas íntegras (normais), enquanto aquelas com estereocílios ausentes, mal formadas, deformadas ou em desarranjo foram consideradas lesionadas8,13.
Com relação à EOAPD, foi considerada sua presença ou ausência. Foi adotado um procedimento aleatório com diferente número de repetições (2 a 3 cobaias para o grupo de controle e 7 cobaias para cada um dos grupos expostos a metamidofós e EGB).
RESULTADOS
Na presente seção, são apresentados os resultados sobre o efeito otoprotetor do extrato de ginkgo biloba nas cobaias submetidas à exposição aguda a metamidofós no sistema aditivo periférico. Os resultados da MEV, depois de fotografados, foram analisados pela observação do número de células ciliadas externas da espira basal da cóclea e seu padrão de organização.
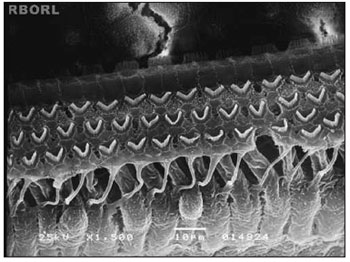
O dano induzido pelo agrotóxico no sistema auditivo periférico foi identificado por MEV da cóclea. No grupo 1 (grupo controle - soro fisiológico a 0,9%), observou-se a manutenção da arquitetura normal das CCE (Figura 1).
Figura 1. Fotomicrografia de órgão de Corti normal encontrado em cobaia do grupo 1, demonstrando espira basal. Observe estruturas não lesionadas em A: extensão digital da células de Deiter; B: células ciliadas externas; C: estereocílios das células ciliadas externas; D: membrana reticular. Ampliação 1000×.
Analisando-se os grupos em que agrotóxico foi administrado, a MEV evidenciou alterações morfológicas em 100% das cócleas nos grupos 2 (0,3 mg/Kg/dia) e 4 (3 mg/Kg/dia), com lesões mais extensas no último grupo.
No grupo 2 (grupo controle - 0,3 mg/Kg/dia de metamidofós intraperitoneal por 7 dias), mudanças anatômicas mais frequentemente encontradas foram lesões de CCE nas espiras E2 e E3, evidenciadas por distorção ciliar, desarranjo do padrão em W e encurtamento ou até ausência de cílios. Tais alterações foram observadas nas espiras 1, 2 e 3. Ver Figura 2.
Figura 2. Fotomicrografia de órgão de Corti normal encontrado em cobaia do grupo 2, exibindo espira E2. Observe ausência de CCE em F2 e F3. CCI: células ciliadas internas; CCE: células ciliadas externas; F1: espira 1; F2: espira 2; F3: espira 3. Ampliação 750×.
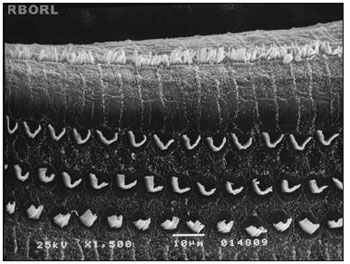
No grupo 3 (ginkgo biloba oral 100mg/kg 90 minutos antes de metamidofós 0,3 mg/Kg/dia por 7 dias) não houve dano significativo às CCE pela MEV a nenhuma das cócleas estudadas (Figura 3).
Figura 3. Fotomicrografia de órgão de Corti normal encontrado em cobaia do grupo 3, exibindo espira E2. Observe arranjo normal das células ciliadas externas. Ampliação 1500×.
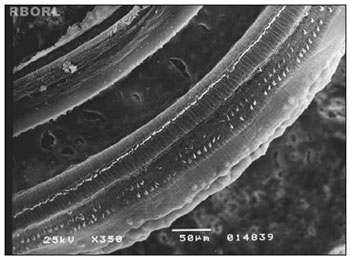
As alterações morfológicas encontradas no grupo 4 (metamidofós 3,0 mg/Kg/dia por 7 dias) foram mais extensas e caracterizadas pela ausência de cílios nas CCE, desarranjo do padrão em W das células e cílios dobrados. A alteração morfológica observada na espira basal ocorreu apenas na terceira espira das CCE. Em E3, foram observados danos graves nos três giros das CCE (Figura 4).
Figura 4. Fotomicrografia de órgão de Corti normal encontrado em cobaia do grupo 4, exibindo E3 panoramicamente. Observe ausência de CCE em F1, F2 e F3. Ampliação 350×.
No grupo 5 (100mg/kg/dia de ginkgo biloba e metamidofós 3,0 mg/Kg/dia 90 minutos depois por 7 dias), todas as CCE mantiveram sua forma normal e arranjo ao final do experimento, como exibido na Figura 5.
Figura 5. Fotomicrografia de órgão de Corti normal encontrado em cobaia do grupo 5, mostrando espira basal. Observe CCE não lesionada. Ampliação 1500×.
O giro apical não foi analisado neste estudo por ser responsável pela detecção de tons graves e pelo dano ototóxico ser observado principalmente em tons agudos. Além disso, esse giro exibe um desarranjo natural em suas células, o que dificultaria a análise anatômica. As células ciliadas internas (CCI) não foram observadas no presente estudo, já que são menos danificadas pela exposição ao agente ototóxico em comparação às CCE.
DISCUSSÃO
Na otologia, a cobaia é amplamente utilizada como animal experimental por ser fácil de manusear, oferecer boa dissecção coclear e manipulação, Além da facilidade de infundir anestésicos e medicamentos experimentais pelas vias intraperitoneal ou intramuscular8,11,14.
O tipo mais comum de lesão de CCE encontrado na análise foi ausência de estereocílios, seguida por distorção ciliar com desarranjo do padrão em W. Esse achado coincide com outras publicações11,15.
Do final da década de 1980 até os dias atuais, estudos foram feitos para compreender os mecanismos da ototoxicidade e os medicamentos que poderiam proteger as células ciliadas. Acreditamos que o campo de pesquisa que estuda os mecanismos endógenos de autodefesa das células ciliadas do órgão de Corti, conjuntamente com a pesquisa genética e avaliação funcional, seja a forma mais racional de nos levar a resultados concretos que permitam o melhor controle das lesões e a prevenção da toxicidade no ouvido interno.
A ação dos agrotóxicos sobre o sistema nervoso causa sintomas tardios, o que significa que eles não ocorrem imediatamente após a intoxicação aguda7,16. Em doses baixas e repetidas, os organofosforados, possivelmente, induzem a perda ou redução dos ramos neuronais17.
Os resultados confirmam a tendência de progressão da lesão morfológica segundo o nível de intoxicação por organofosforados, já que um número maior de lesões foi observado no grupo 4 em comparação ao grupo 2, lembrando que o primeiro grupo de cobaias recebeu dose mais alta de agrotóxico.
Analisando os resultados da MEV, é possível inferir que as lesões causadas pelo agente organofosforado no órgão de Corti ocorrem, predominantemente, nas CCE e progridem do ápice para a base da cóclea. Nas espiras cocleares analisadas, a primeira linha de CCE é a primeira a ser lesionada, seguida da segunda a terceira fileira. Essa sequência de lesões coincide com a altura da CCE, sendo E3 a primeira a ser lesionada; a segunda espira que sofre maior dano devido ao organofosforado é E2 e a espira basal é a terceira com muitas alterações.
Estudos anteriores em cobaias submetidas a medicamentos sototóxicos divergem do presente estudo na observação por MEV. Quando as cobaias foram expostas ao antibiótico amicacina, as lesões predominaram nas duas primeiras espiras e apresentaram CCE mais baixas normais em comparação a E3, cujas alterações estruturais confirmam o estudo18, que identificou mudanças mais intensas na primeira fileira de CCE, seguida da segunda linha. Outro estudo13 demonstrou que aminoglicosídeos danificam o órgão de Corti principalmente nas CCE, com progressão da agressão da base para o ápice da cóclea, sendo a primeira fileira de CCE a primeira a ser lesionada, seguida da segunda e terceira fileiras.
Em pesquisas nas quais a cisplatina foi estudada, os autores19 descreveram extensas lesões nas CCE da espira basal da cóclea, concordando com outro estudo15, em que os autores encontraram alterações mais evidentes na espira basal, com ausência de cílios nas três primeiras fileiras de CCE, seguidas por E2 e E3, respectivamente. Houve mudanças ciliares nas células ciliares internas, com cílios presentes; Porém, em desordem.
No presente estudo, os animais que receberam extrato de ginkgo biloba antes de agrotóxico mantiveram a citoarquitetura das CCE e não demonstraram mudanças estruturais no órgão de Corti, em acordo com um estudo feito com ratos9. Tais estudos demonstraram o efeito otoprotetor do ginkgo biloba às CCE expostas a cisplatina. Noventa minutos depois dos animais receberem 100 mg/kg/dia de ginkgo biloba, foi usada uma dose de 1,0 mg/kg/dia por 10 dias consecutivos de cisplatina e, depois, a medida da ação potencial por MEV demonstrou o efeito protetor do ginkgo biloba.
O EGB 761 age como um limpador de radicais livres, evitando a peroxidação lipídica, aumentando os níveis de GSH e a atividade das enzimas antioxidantes, Além da atividade da superóxido dismutase (SOD)20. Como resultado, o EGB 761 contribuiu para prevenir contra os efeitos ototóxicos do metamidofós. Seus princípios ativos, em particular ginkgolídeos e flavonóides, são responsáveis pelos efeitos antioxidantes e, supostamente, migram para o ouvido interno9. Então, este estudo demonstrou que o EGB 761 surtiu efeito sobre a toxicidade induzida pelo organofosforado metamidofós.
O ginkgo biloba tem propriedades antioxidativas e age reduzindo a peroxidação lipídica, aumentando os níveis de catalase, superóxido dismutase e glutationa, removendo os ânions intracelulares de superóxido e radicais livres. No plasma, age formando complexos com fosfolipídios, aumentando sua atividade antioxidante. No nível intracelular, age sobre fosforilação oxidativa do RNA mitocondrial e sobre o aparelho de Golgi, suportando o mecanismo de reparo de DNA e melhorando o status antioxidante, com aumento dos níveis intracelulares de glutationa e redução da incorporação de 3H-timidina21.
Concordando com outros autores10, observamos por MEV que o ginkgo biloba oferece efeito protetor para as células ciliadas externas, ou para a espira basal da cóclea, ou para as espiras E2 e E3 após 7 dias consecutivos de agrotóxico usado nas doses de 0,3 mg/kg/dia, e 3,0 mg/kg/dia quando em combinação com ginkgo biloba.
Considerando os mecanismos da ototoxicidade relacionados à antioxidação celular e formação de radicais livres, bem como a ação favorável do extrato de ginkgo biloba na redução da peroxidação lipídica, com limpeza de superóxidos e prevenção da formação de radicais livres, devemos considerar a possibilidade de usar ginkgo biloba na exposição a metamidofós, objetivando minimizar seus efeitos ototóxicos. O extrato de ginkgo biloba é amplamente utilizado em seres humanos, com efeitos colaterais desprezíveis, e demonstra evidências de otoproteção contra metamidofós, relacionado às CCE das cócleas de cobaias expostas ao organofosforado.
CONCLUSÃO
Segundo o que observamos por MEV, é possível concluir que, quanto mais longa a exposição ao agrotóxico, maior seria o dano às células ciliadas externas das cobaias. Contudo, cobaias que receberam ginkgo biloba tiveram suas células ciliadas externas do ouvido interno morfologicamente intactas.
REFERÊNCIAS
1. Manjabosco CAW. Perfil audiométrico de trabalhadores agrícolas. In: Morata TC, Zucki F. (org.). Caminhos para a saúde auditiva: ambiental-ocupacional. São Paulo: Plexus; 2005. p.53-66.
2. World Health Organization. The Health and Environment linkages initiatives (HELI) [Site na internet] Disponível em: http://www.who.int/heli/risks/toxics/chemicals/en/. Acessado em 06 de fevereiro 2012.
3. Meyer A, Chrisman J, Moreira JC, Koifman S. Cancer mortality among agricultural workers from Serrana Region, state of Rio de Janeiro, Brazil. Environ Res. 2003;93(3):264-71.
4. Rybak LP, Ravi R, Somani SM. Mechanism of protection by diethyldithiocarbamate against cisplatin ototoxicity: antioxidant system. Fundam Appl Toxicol. 1995;26(2):293-300.
5. Stengs CH, Klis SF, Huizing EH, Smoorenburg GF. Protective effects of a neurotrophic ACTH(4-9) analog on cisplatin ototoxicity in relation to the cisplatin dose: an electrocochleographic study in albino guinea pigs.. Hearing Res. 1998;124(1-2):108-17.
6. Sockalingam R, Freeman S, Cherny TL, Sohmer H. Effect of high-dose cisplatin on auditory brainstem responses and otoacoustic emissions in laboratory animals. Am J Otol. 2000;21(4):521-7.
7. Araújo AJ, Lima JS, Moreira JC, Jacob SC, Soares MO, Monteiro MCM, et al. Exposição múltipla a agrotóxicos e efeitos à saúde: estudo transversal em amostra de 102 trabalhadores rurais, Nova Friburgo, RJ. Ciênc Saúde Colet. 2007;12(1):115-30.
8. Hyppolito MA, Oliveira JAA, Rossato M, Holanda F. Ototoxicidade da cisplatina e otoproteção pelo extrato de ginkgo biloba às células ciliadas externas: estudo anatômico e eletrofisiológico. Rev Bras Otorrinolaringol. 2003;69(4):504-11.
9. Körbes D. Toxicidade de agrotóxico organofosforado no sistema auditivo periférico de cobaias: estudo anatômico e funcional [dissertação]. Santa Maria: Universidade Federal de Santa Maria; 2009.
10. Fukaya H, Kanno H. Experimental studies of the protective effect of ginkgo biloba extract (GBE) on cisplatin-induced toxicity in rats. J Otorhinolaryngol Soc Jap. 1999;102(7):907-17.
11. Oliveira JAA, Canedo DM, Rossato M. Otoproteção das células ciliadas auditivas contra a ototoxicidade da amicacina. Rev Bras Otorrinolaringol. 2002;68(1):7-13.
12. Aquino TJM. Ototoxicidade e otoproteção em orelha interna de cobaias utilizando gentamicina e amicacina: aspectos ultra-estruturais e funcionais [tese doutorado]. Ribeirão Preto: Faculdade de Medicina de Ribeirão Preto Universidade de São Paulo; 2007.
13. Oliveira JAA, Bernal TMO. Ototoxicidade de aminoglicosídeos e otoproteção. In: Campos CAH, Costa HOO. Tratado de Otorrinolaringologia. 1.ed. São Paulo: Roca; 2003. p.148-67.
14. Canedo DJM. Resistência à ação ototóxica de antibióticos aminoglicosídeos [dissertação]. Ribeirão Preto: Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo; 1999.
15. Hyppolito MA, Oliveira AA, Lessa RM, Rossato M. Amifostine otoprotection to cisplatin ototoxicity: a guinea pig study using otoacoustic emission distortion products (DPOEA) and scanning electron microscopy. Braz J Otorhinolaryngol. 2005;71(3):268-73.
16. Alavanja MC, Hoppin JA, Kamel F. Health effects of chronic pesticide exposure: cancer and neurotoxicity. Annu Rev Publ Health. 2004;25:155-97.
17. Perez NM, Calore EE, Vilela-de-Almeida L, Narciso ES. Aspectos morfológicos e morfomé tricos do cérebro de ratos na intoxicação crônica pelo organofosforado metamidofós. Rev Inst Adolfo Lutz. 2006;65(1):50-3.
18. Aquino TJM, Oliveira JAA, Rossato M. Ototoxicity and otoprotection in the inner ear of guinea pigs using gentamicin and amikacin: ultrastructural and functional aspects. Braz J Otorhinolaryngol. 2008;74(6):843-52.
19. Kasse CA, Cruz OLM, Ilha LCN, Costa HO, Lopes EC, Coelho F. The use of Maytenus ilicifolia to prevent cisplatin-induced ototoxicity. Braz J Otorhinolaryngol. 2008;74(5):712-7.
20. Huang X, Whitworth CA, Rybak LP. Ginkgo biloba extract (EGb 761) protects against cisplatin-induced ototoxicity in rats. Otol Neurotol. 2007;28(6):828-33.
21. Fosslien E. Mitochondrial medicine-molecular pathology of defective oxidative phosphorylation. Ann Clin Lab Sci. 2001;31(1):25-67.
1. Fonoaudióloga; Especialista em Audiologia Clínica e Ocupacional (CEFAC); Mestre em Disturbios da Comunicação Humana (UFSM). (Fonoaudióloga da Unidade de Ensino Especial Concórdia e Professor Adjunto do Curso de Fonoaudiologia da ULBRA).
2. Doutor (Professor Titular do Departamento de Morfologia/Centro de Ciências da Saúde/UFSM).
3. Fonoaudióloga, Mestre em Disturbios da Comunicação Humana/UFSM. (Estudante de Medicina/ULBRA).
4. Graduanda do curso de Medicina. (Estudante de Medicina/ULBRA).
Endereço para correspondência:
Avenida Francisco Trein, nº487, apto 603, Cristo Redentor
Porto Alegre - RS. CEP: 091350-200
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 13 de janeiro de 2012 . cod. 8987
Artigo aceito em 27 de fevereiro de 2012.