Ano: 2012 Vol. 78 Ed. 3 - Maio - Junho - (19º)
Seção: Artigo Original
Páginas: 116 a 121
Avaliação da expressão gênica de metaloproteinases de matriz e seus inibidores em colesteatomas por amplificação de ácidos nucleicos
Cholesteatoma gene expression of matrix metalloproteinases and their inhibitors by RT-PCR
Autor(es): Carlos Eduardo Borges Rezende1; Ricardo Peres do Souto2; Priscila Bogar Rapoport3; Laís de Campos4; Marcela Bovo Generato5
Palavras-chave: colesteatoma da orelha média, expressão gênica, inibidores teciduais de metaloproteinases, metaloproteinases da matriz.
Keywords: cholesteatoma, gene expression, matrix metalloproteinases, middle ear, tissue inhibitor of metalloproteinases.
Resumo:
O colesteatoma adquirido da orelha média é uma lesão epitelial escamosa queratinizante e hi-perproliferativa benigna que pode resultar na destruição das estruturas ósseas circunvizinhas do osso temporal. Estudos recentes demonstram que alterações na produção celular de metaloproteinases de matriz (MMPs) e seus inibidores específicos (TIMPs) contribuem para a fisiopatologia do colesteatoma.
OBJETIVO: Verificar a aplicabilidade da amplificação de RNA para avaliação da expressão de isoformas de MMPs e TIMPS em colesteatomas para correlação com a agressividade da doença.
MATERIAIS E MÉTODOS: Estudo prospectivo. Dezenove casos de colesteatomas em diferentes estágios de evolução foram selecionados. RNA extraído das biópsias foi submetido à transcrição reversa - reação da polimerase em cadeia (RT-PCR) para amplificação semiquantitativa de MMP2, MMP3, MMP9, MMP13 e TIMP1. Resultados: Seis colesteatomas apresentaram reação positiva para pelo menos um dos genes estudados. Quatro amostras amplificaram apenas um gene (MMP2 ou MM13) e duas amostras amplificaram três genes (MMP2, TIMP1 e MMP3 ou MMP13). Nenhuma amostra amplificou MMP9.
CONCLUSÃO: A avaliação da expressão gênica de MMPs e TIMPs em colesteatomas pode ser realizada por RT-PCR, apesar de dificuldades técnicas. Não foi possível realizar associação entre o perfil de expressão gênica e a agressividade da doença.
Abstract:
Acquired middle ear cholesteatoma is a benign keratinizing hyperproliferative squamous epithelial lesion that may result in the destruction of the bone structures surrounding the temporal bone. Recent studies show that variations in cellular production of matrix metalloproteinases (MMPs) and their specific inhibitors (TIMPs) contribute to the pathophysiology of cholesteatoma.
OBJECTIVE: This study aims to analyze the use of RNA amplification tests to evaluate the expression of MMP and TIMP isoforms in cholesteatomas and their correlation with disease severity.
MATERIALS AND METHODS: This is a prospective study. Nineteen cholesteatoma cases at different stages were selected. RNA collected from biopsy specimens was submitted to reverse transcription polymerase chain reaction (RT-PCR) for semiquantitative amplification of MMP2, MMP3, MMP9, MMP13 and TIMP1.
RESULTS: Six cholesteatomas were positive for at least one of the studied genes. Four samples amplified a single gene (MMP2 or MMP13) and two samples amplified three genes (MMP2, TIMP1 and MMP3 or MMP13). No sample amplified MMP9.
CONCLUSION: RT-PCR can be used to assess MMP and TIMP gene expression in cholesteatomas despite technical difficulties. Gene expression profiles could not be related to disease severity.
![]()
INTRODUÇÃO
O colesteatoma adquirido da orelha média é uma lesão epitelial escamosa queratinizante e hiperproliferativa benigna semelhante à epiderme1, que se desenvolve dentro da cavidade timpânica2-4. Apresenta-se como uma espé cie de cisto epidermoide, com uma matriz extracelular formada por epitélio escamoso, estratificado e queratinizado, sobre uma perimatriz secundária, contendo fibras colágenas, elásticas, fibroblastos e células inflamatórias5,6. O colesteatoma de orelha média é caracterizado por uma intensa proliferação celular, resultando no acúmulo de debris de queratina, destruição das estruturas ósseas circunvizinhas do osso temporal, podendo afetar a integridade dos ossículos, dos vasos sanguíneos, do nervo facial e invadir a orelha interna ou cavidade intracraniana7-9. Em consequência, o colesteatoma leva à perda auditiva, podendo provocar zumbido, vertigem, perda do equilíbrio e outras complicações graves, como meningite, trombose do seio sigmoide, paralisia facial e abscesso cerebral2.
Recentemente, tornou-se evidente que a atividade proteolítica desempenhada pelo colesteatoma exerce fundamental importância na remodelação óssea na orelha média e osso temporal10. A destruição óssea e a recorrência são muito relevantes na fisiopatologia do colesteatoma e esses aspectos o tornam uma doença perigosa e de difícil tratamento11. Alterações na proliferação, diferenciação e migração dos queratinócitos são influenciadas pela ativação de fibroblastos na perimatriz e pela liberação de citocinas e fatores de crescimento pelas células no infiltrado inflamatório4,12.
A lesão dos tecidos adjacentes ao colesteatoma é também devido à cooperação de várias enzimas proteolíticas, tais como ativadores do plasminogênio e metaloproteinases de matriz (MMPs)3,7. As MMPs são endopeptidases dependentes de zinco e cálcio, sintetizadas como proenzimas por diferentes tipos de células, como fibroblastos, queratinócitos, macrófagos e células endoteliais e ativadas por clivagem proteolítica8,10,13-16. As atividades proteolíticas das MMPs são precisamente controladas durante a ativação por seus precursores e inibidas por inibidores endógenos, alfa macroglobulinas e pelos inibidores teciduais de metaloproteinases (TIMPs)8,17. O balanço entre MMPs e TIMPs é crítico para a determinação da integridade da matriz extracelular (MEC) e, deste modo, variações na presença e na atividade destas proteínas podem contribuir para diversos dos eventos teciduais observados nos colesteatomas3,8,17.
A identificação de isoenzimas MMPs específicas (MMP2, MMP3 e MMP9) em colesteatomas foi primeiro realizada em 199617, empregando imunohistoquímica. Desde então, vários grupos utilizaram a mesma técnica para analisar alterações dessas enzimas nos colesteatomas em comparação aos tecidos sãos. Foram relatados aumentos da presença de MMP97,10,11,14, MMP25, MMP118, MMP8 e MMP1319. A marcação imunológica de MMP2, 3 e 9 ocorreu principalmente nas camadas basais e suprabasais do epitélio do colesteatoma10,14,17 e, no caso de MMP9, particularmente nas áreas infiltradas por células inflamatórias8.
O objetivo desse estudo é verificar a aplicabilidade da técnica de amplificação de ácidos nucleicos para avaliação da expressão dos genes de metaloproteinases de matriz e seus inibidores, empregando-se a reação de polimerização em cadeia com transcrição reversa (RT-PCR) semiquantitativa. Uma vez que a adequação da técnica proposta seja estabelecida, pretende-se relacionar a agressividade dos colesteatomas, baseada em dados de história clínica, da avaliação audiométrica e dos achados tomográficos e a expressão destes genes.
MATERIAIS E MÉTODOS
O estudo foi prospectivo, oferecendo subsídios à obtenção dos objetivos propostos e favorecendo o aprofundamento dos conhecimentos sobre a temática, Além de contribuir para a identificação de fatores determinantes dos fenômenos ou eventos20. O estudo foi realizado com 19 pacientes entre 5 e 70 anos de idade, com o diagnóstico clínico-radiológico de otite média crônica colesteatomatosa em diferentes graus de evolução, atendidos no ambulatório de otorrinolaringologia e operados no período entre 2007 e 2009. Foram excluídos pacientes que apresentassem mastoidectomia prévia e cujos resultados anatomopatológicos não confirmassem o diagnóstico de colesteatoma. O projeto de pesquisa foi aprovado pelo parecer nº 356/2007 do Comitê de ética em Pesquisa da instituição.
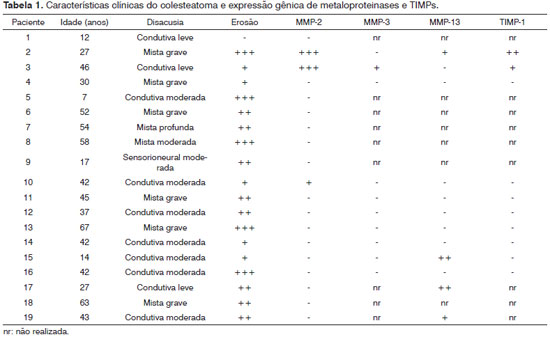
O comprometimento auditivo foi avaliado por meio da realização de audiometria tonal e vocal, variando desde disacusia condutiva leve até disacusia sensorioneural profunda. Na tomografia, foram considerados alguns sinais importantes acerca da extensão do colesteatoma, tais como erosão do esporão de Chaussé , erosão da cadeia ossicular, fístula do canal semicircular lateral, erosão do tegmen tympani e deiscência do canal de Fallopio. A extensão da erosão foi avaliada pelo número de estruturas afetadas. Erosão em apenas uma estrutura foi considerada como +; erosão em duas estruturas como ++ e em três ou mais estruturas como +++. Nenhum dos pacientes apresentava complicações em estágio avançado, como paralisia facial, meningite, encefalite e abscesso cerebral.
Todas as cirurgias de remoção do colesteatoma foram por mastoidectomia com técnica aberta e os achados cirúrgicos de extensão e erosão da doença corroboraram com os achados radiológicos, relacionados à integridade do teto da orelha média (tegmen tympani), da parede do canal semicircular lateral, do esporão de Chaussé e do canal do nervo facial (canal de Fallopio).
As amostras de material altamente sugestivas de colesteatoma, posteriormente confirmadas como tal, mediante exame anatomopatológico das peças retiradas cirurgicamente, totalizaram 19 casos. Os tecidos foram imediatamente congelados em nitrogênio líquido e mantidos em freezer a -70ºC para que se preservasse a integridade do ácido ribonucleico mensageiro (RNAm). A extração do RNA foi realizada por extração com Trizol® (Invitrogen) ou afinidade do RNA em coluna Illustra RNAspin® (GE Helthcare). O RNA foi quantificado por espectrofotometria UV em 260 nm em aparelho GeneQuant® (Amersham-Pharmacia) ou por fluorometria em aparelho Qubit® (Invitrogen). O RNA total foi transformado em DNA complementar (cDNA) por meio de reação de transcrição reversa, utilizando oligo dT como iniciador de reação e a enzima Superscript RT III® (Invitrogen). O cDNA específico de cada isoforma de MMP ou TIMP foi amplificado por PCR, utilizando-se mistura reagente Master Mix (Promega®) e pares de iniciadores de reação ("primers") descritos na literatura (gliceraldeído-3-fosfato desidrogenase - GAPDH21 e MMP2, 3, 9 e 1322) ou escolhidos em função das respectivas sequências de mRNA depositadas no GenBank (TIMP-1). Os detalhes dos iniciadores são apresentados no Quadro 1. O protocolo de amplificação foi: uma incubação inicial a 94ºC durante 5 minutos, seguida de 35 ciclos de três temperaturas: 94ºC durante 1 minuto (desnaturação), 58ºC por 1 minuto (anelamento), 72ºC por 1 minuto (extensão) e finalizado por incubação a 72ºC durante 10 minutos. Os produtos de PCR foram separados por eletroforese (tampão TAE, 100 V) em gel de agarose 2% adicionado de brometo de etídio e visualizados por fluorescência. A imagem do gel foi capturada por câmera fotográfica digital.
RESULTADOS
A caracterização clínica do colesteatoma dos 19 pacientes estudados é apresentada na Tabela 1. A média de idade dos pacientes foi de 38,7 anos, com mínimo de 7 e máximo de 67 anos. Nesta amostra, houve predominância de colesteatomas operados na orelha direita (14/19 ou 73,7%). Analisando-se a erosão das estruturas da orelha detectada pelas imagens de TC, houve variação desde ausência de erosão (paciente 1); erosão de apenas uma estrutura (cinco pacientes); duas estruturas (oito pacientes) até três estruturas (cinco pacientes). Em relação à disacusia, a situação mais comum foi a perda auditiva mista.
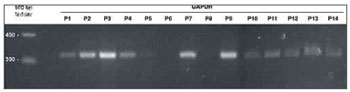
O primeiro procedimento para a análise da expressão gênica foi a amplificação do mRNA do gene GAPDH, assumindo a expressão idêntica desta enzima da via glicolítica para todos os tecidos analisados. Apesar de diferenças nas concentrações de RNA obtido a partir das diferentes amostras, observou-se que a condição na qual havia maior homogeneidade no rendimento de amplificação de GAPDH foi durante análise de volumes equivalentes das amostras (Figura 1). A amplificação de GAPDH a partir da amostra do paciente 9 foi realizada com 30, 35 e 40 ciclos de PCR. Observou-se que aos 35 ciclos, condição de amplificação utilizada no estudo, ainda não havia saturação da reação.
Figura 1. Amplificação de GAPDH utilizando volumes fixos das preparações de RNA. Análise por eletroforese em gel de agarose 2% corado por brometo de etídio. Padrão de peso molecular = 100 bp ladder. P1-P14: pacientes 1 a 14.
Todas as amostras foram submetidas à reação de RT-PCR para as metaloproteinases 2 e 9 e observou-se que apenas as amostras 2, 3 e 10 apresentaram amplificação para a MMP2, enquanto nenhuma das amostras apresentou resultado para a MMP9 (resultado representado na Figura 2A). Em sequência, as amostras 2,3,4,10,11,12,13,14,15 e 16 foram amplificadas para MMP3, MMP13 e TIMP1, sendo observada clara amplificação de TIMP1 e MMP13 nas amostras 2, 15, 17 e 19 e de MMP3 e TIMP1 na amostra 3 (resultado representado na Figura 2B). Algumas reações não foram realizadas por limitação da quantidade de RNA, devido a dificuldades técnicas do processamento das amostras, que eram reduzidas e apresentavam-se altamente queratinizadas. Os resultados de amplificação de MMPs e TIMPs obtidos são sumarizados na Tabela 1.
Figura 2. Amplificação de isoformas de MMPs e TIMPs para amostras selecionadas. Análise por eletroforese em gel de agarose 2% corado por brometo de etídio. Padrão de peso molecular = 100 bp ladder. (A) MMP-2 e MMP-9 para as amostras P2 e P3. (B) MMP-3, MMP-13 e TIMP-1 para as amostras P2, P3 e P4.
DISCUSSÃO
A otite média crônica colesteatomatosa ainda é um importante problema de saúde pública, principalmente nos países subdesenvolvidos e em desenvolvimento. Embora seja uma doença benigna e inflamatória, apresenta comportamento tumoral agressivo, muitas vezes destruidor, deteriorando partes moles, revestimentos ósseos e ossículos, prejudicando a audição e com risco de invasão a estruturas nobres adjacentes, como nervos, vasos, cóclea, labirinto e cérebro.
A presença das MMPs e seus inibidores pode estar relacionada com maior atividade lítica do colesteatoma. Com a amplificação de ácidos nucleicos, pode-se analisar a expressão das diferentes metaloproteinases de matriz e seus inibidores e tentar correlacionar esta atividade molecular com a agressividade da doença. Uma vez confirmada esta, seria possível propor estratégias para controlar o seu desenvolvimento bioquímico. De fato, alguns estudos encontram correlação positiva entre a agressividade do colesteatoma e o aumento de MMP25 e de MMP910,23, conforme seria esperado, considerando-se a ação biológica destas enzimas. A inibição de MMPs está sendo testada como forma de tratamento para várias alterações otorrinolaringológicas24; no entanto, em um estudo pioneiro propondo tratamento do colesteatoma de animais de experimentação com ilomostat, um inibidor farmacológico de MMPs, não houve retardo ou impedimento da progressão da doença25.
Neste estudo, foi possível observar alta expressão de MMP2 nas amostras 2 e 3 e em menor intensidade na amostra 10. A enzima MMP9 surpreendentemente apresentou resultado negativo para todas as amostras, apesar de vários grupos de pesquisa encontrarem sua expressão aumentada7,10,13,23. é importante destacar que o par de primers de MMP9 amplifica RNA humano22. Além de MMP2, encontrou-se expressão de MMP3 (amostra 3), MMP13 (amostras 2, 15, 17 e 19) e TIMP1 (amostras 2 e 3). A presença de MMP3, MMP13 e TIMP1 em células de colesteatomas já havia sido relatada anteriormente3,16,13.
Apesar do avanço das técnicas de análise de ácidos nucleicos, apenas dois artigos na literatura específica analisam a expressão gênica de MMPs e seus inibidores em colesteatomas utilizando RT-PCR. A carência de artigos avaliando a presença de RNA mensageiros de MMPs e TIMPs em colesteatomas pode ser consequência das dificuldades técnicas para o processamento do RNA das biópsias de colesteatomas, também encontradas neste estudo.
A detecção de uma isoenzima MMP por histoquímica ou RT-PCR não garante que a enzima se encontre ativa, pois as metaloproteinases são sintetizadas em uma forma inativa, que deve sofrer proteólise parcial, para poderem exercer sua capacidade catalítica, ou seja, são zimogênios10. A atividade enzimática de MMPs em amostras biológicas é verificada em laboratório por meio de separação em eletroforese, seguida de hidrólise de gelatina, técnica conhecida como zimografia. Trata-se de uma técnica de padronização complexa e não é incomum gerar resultados conflitantes entre diferentes grupos de pesquisa. Isso foi verificado para MMP2, sendo que dois grupos não encontraram aumento da sua atividade enzimática de colesteatomas em zimograma10,26, enquanto que trabalhos mais recentes realizados por outros três grupos detectaram a atividade gelatinolítica da isoenzima1,8,16. O mesmo tipo de controvérsia ocorre na análise zimográfica de MMP9: aumento da atividade foi relatado em dois estudos8,10 e atividade basal em outro13. Além dessas duas isoformas, as atividades de MMP1 e 3 em colesteatomas também foram avaliadas em zimograma, sendo observado o aumento apenas para a primeira13.
A análise da literatura a respeito das alterações de MMPs em colesteatomas revela que ainda há muito a ser explorado na caracterização destas enzimas como marcadores da doença. O uso de RT-PCR para tal finalidade foi quase totalmente ignorado até agora. Esta tecnologia de amplificação de ácidos nucleicos poderia ser mais explorada para uma análise inicial rápida de várias isoformas da família das MMPs que ainda não foram investigadas, cuja expressão pode se encontrar alterada em colesteatomas. Além disso, muito pouco foi estudado a respeito dos inibidores TIMPs, fundamentais no controle da atividade das MMPs.
Foram verificadas importantes dificuldades técnicas para a análise da expressão dos genes das metaloproteinases de matriz e seus inibidores específicos por meio da técnica de RT-PCR. Outros estudos com uma amostragem maior de pacientes, ou com maior número de variáveis, seriam interessantes para permitir correlação clínica com a expressão destes genes nos colesteatomas.
CONCLUSÃO
A expressão das metaloproteinases de matriz e de seus inibidores é fato nos colesteatomas. Por meio da amplificação de ácidos nucleicos, em algumas amostras foram detectados mRNA de MMP2, MMP3, MMP3 e TIMP1, mas não MMP9. Porém, não foi possível identificar diferenças na expressão das MMPs e dos TIMPs que possam ser associadas à agressividade da doença.
REFERÊNCIAS
1. Laeeq S, Faust R. Modeling the cholesteatoma microenvironment: coculture of HaCaT keratinocytes with WS1 Fibroblasts induces MMP-2 activation, invasive phenotype, and proteolysis of the extracellular matrix. Laryngoscope. 2007;117(2):313-8.
2. Khujadze M, Vashakidze N, Gogniashvili G, Khelashvili B. The results of surgical treatment of middle ear cholesteatoma by using open and closed techniques. Georgian Med News. 2008;(163):21-4.
3. Kobayashi H, Asano K, Kanai K, Suzaki H. Suppressive activity of vitamin D3 on matrix metalloproteinase production from cholesteatoma keratinocytes in vitro. Mediators Inflamm. 2005;2005(4):210-5
4. Ricciardiello F, Cavaliere M, Mesolella M, Iengo M. Notes on the microbiology of cholesteatoma: clinical findings and treatment. Acta Otorhinolaryngol Ital. 2009;29(4):197-202.
5. Morales DSR, Penido NO, Silva IDCG, Stávale JN, Guilherme A, Fukuda Y. Matrix Metalloproteinase 2: an important genetic marker for cholesteatomas. Braz J Otorhinolaringol. 2007;73(1):55-61.
6. Alves AL, Pereira CSB, Ribeiro FAQ, Fregnani JHTG. Analysis of histopathological aspects in acquired middle ear cholesteatoma. Braz J Otorhinolaryngol. 2008;74(6):835-41.
7. Shibosawa E, Tsutsumi K, Takakuwa T, Takahashi S. Stromal expression of matrix metalloproteinase-9 in middle ear cholesteatomas. Am J Otol. 2000;21(5):621-4.
8. Suchozebrska-Jesionek D, Szymański M, Kurzepa J, Gołabek W, Stryjecka-Zimmer M. Gelatinolytic activity of matrix metalloproteinases 2 and 9 in middle ear cholesteatoma. J Otolaryngol Head Neck Surg. 2008;37(5):628-32.
9. Hamajima Y, Komori M, Preciado DA, Choo DI, Moribe K, Murakami S, Ondrey FG, et al. The role of inhibitor of DNA-binding (Id1) in hyperproliferation of keratinocytes: the pathological basis for middle ear cholesteatoma from chronic otitis media. Cell Prolif. 2010;43(5):457-63.
10. Schmidt M, Grünsfelder P, Hoppe F. Induction of matrix metalloproteinases in keratinocytes by cholesteatoma debris and granulation tissue extracts. Eur Arch Otorhinolaryngol. 2000;257(8):425-9.
11. Vitale RF, Ribeiro FAQ. The role of tumor necrosis factor-alpha (TNF-alpha) in bone resorption present in middle ear cholesteatoma. Braz J Otorhinolaryngol. 2007;73(1):123-7.
12. Juhász A, Sziklai I, Rákosy Z, Ecsedi S, ádány R, Balázs M. Elevated level of tenascin and matrix metalloproteinase 9 correlates with the bone destruction capacity of cholesteatomas. Otol Neurotol. 2009;30(4):559-65.
13. Banerjee AR, James R, Narula AA. Matrix metalloproteinase-2 and matrix metalloproteinase-9 in cholesteatoma and deep meatal skin. Clin Otolaryngol Allied Sci. 1998;23(4):345-7.
14. Schmidt M, Grünsfelder P, Hoppe F. Up-regulation of matrix metalloproteinase-9 in middle ear cholesteatoma - correlations with growth factor expression in vivo? Eur Arch Otorhinolaryngol. 2001;258(9):472-6.
15. Sternlicht MD, Werb Z. How metalloproteinases regulate cell behavior. Annu Rev Cell Dev Biol. 2001;17:463-516.
16. Mehta D, Daudia A, Birchall JP, Banerjee AR. The localization of matrix metalloproteinases-8 and -13 in cholesteatoma, deep-meatal and post-auricular skin: a comparative analysis. Acta Otolaryngol. 2007;127(2):138-42.
17. Schönermark M, Mester B, Kempf HG, Bläser J, Tschesche H, Lenarz T. Expression of matrix-metalloproteinases and their inhibitors in human cholesteatomas. Acta Otolaryngol. 1996;116(3):451-6.
18. Visse R, Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry. Circ Res. 2003;92(8):827-39.
19. Migirov L, Weissburd S, Wolf M. Mastoidectomy in the elderly. ORL J Otorhinolaryngol Relat Spec. 2010;72(2):80-3.
20. Cervo AL, Bervian PA. Metodologia científica. 5. ed. São Paulo: Prentice Hall. 2002. 242p.
21. Theodoro TR, de Matos LL, Sant Anna AV, Fonseca FL, Semedo P, Martins LC, et al. Heparanase expression in circulating lymphocytes of breast cancer patients depends on the presence of the primary tumor and/or systemic metastasis. Neoplasia. 2007;9(6):504-10.
22. Konttinen YT, Ainola M, Valleala H, Ma J, Ida H, Mandelin J, et al. Analysis of 16 different matrix metalloproteinases (MMP-1 to MMP-20) in the synovial membrane: different profiles in trauma and rheumatoid arthritis. Ann Rheum Dis. 1999;58(11):691-7.
23. Holt JJ. Cholesteatoma and otosclerosis: two slowly progressive causes of hearing loss treatable through corrective surgery. Clin Med Res. 2003;1(2):151-4.
24. De S, Fenton JE, Jones AS. Matrix metalloproteinases and their inhibitors in non-neoplastic otorhinolaryngological disease. J Laryngol Otol. 2005;119(6):436-42.
25. Lehman DA, Wilmoth JG, Prevatt AR, Schultz GS, Antonelli PJ. Inhibition of matrix metalloproteinases in gerbil cholesteatoma: preliminary findings. Otolaryngol Head Neck Surg. 2002;126(4):404-8.
26. Banerjee AR, Jones JL, Birchall JP, Powe DG. Localization of matrix metalloproteinase 1 in cholesteatoma and deep meatal skin. Otol Neurotol. 2001;22(5):579-81.
1. Mestrando em ciências da saúde pela FMABC (Professor afiliado da disciplina de otorrinolaringologia da FMABC).
2. Doutor em Bioquímica pela USP (Prof. Adjunto de Bioquímica da FMABC).
3. Doutora em Medicina pela Universidade de São Paulo (USP). (Profª. Titular de Otorrinolaringologia da FMABC).
4. Acadêmica do Curso de Ciências Farmacêuticas da FMABC (Acadêmica do Curso de Ciências Farmacêuticas da FMABC).
5. Acadêmica do Curso de Ciências Farmacêuticas da FMABC (Acadêmica do Curso de Ciências Farmacêuticas da FMABC).
Endereço para correspondência:
Faculdade de Medicina do ABC
Av. Príncipe de Gales,821
Santo André - SP. CEP: 09060-650
Av. Pereira Barreto, 1395, cj 34. Torre Norte, Bairro Paraíso
Santo André - SP. CEP: 09190-610
E-mail: carlosbrezende@ig.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 12 de janeiro de 2012 . cod. 8985.
Artigo aceito em 26 de fevereiro de 2012.
Este estudo recebeu apoio financeiro do Núcleo de Estudos, Pesquisa e Assessoria à Saúde (NEPAS). L.C. e M.B.G. receberam bolsa do programa PIBIC-CNPq.