Ano: 2012 Vol. 78 Ed. 1 - Janeiro - Fevereiro - (11º)
Seção: Artigo Original
Páginas: 68 a 74
Atividade antimicrobiana da Terminalia arjuna Wight & Arn.: uma planta etnomedicinal contra patógenos causadores de infecções no ouvido
Antimicrobial activity of Terminalia arjuna Wight & Arn.: An ethnomedicinal plant against pathogens causing ear infection
Autor(es): Kamal Rai Aneja1; Chetan Sharma2; Radhika Joshi3
Palavras-chave: extratos vegetais, orelha, patologia, produtos com ação antimicrobiana.
Keywords: ear, pathology, plant extracts, products with antimicrobial action.
Resumo:
Infecções de ouvido representam uma das doenças mais comuns do mundo. Diferentes agentes etiológicos são responsáveis por tais infecções.
OBJETIVO: Avaliar o potencial antimicrobiano de extratos de folhas e da casca de Terminalia arjuna contra Staphylococcus aureus, Acinetobacter sp., Proteus mirabilis, Escherchia coli, Pseudomonas aeruginosa e Candida albicans - patógenos que causam infecções de ouvido e como esses extratos se comparam às medicações tópicas atualmente disponíveis.
MATERIAIS E MÉTODOS: Metanol, etanol, acetona, extratos aquosos (quentes e frios) de folhas e casca da T. arjuna foram testados para avaliação de suas atividades antimicrobianas.
RESULTADOS: Dos três solventes orgânicos avaliados, o extrato acetônico das folhas foi o que teve o melhor resultado contra S. aureus. O extrato orgânico da casca exibiu quase o mesmo grau de ação antimicrobiana entre todas as bactérias gram-negativas, exceto contra P. aeruginosa. Entretanto, o extrato aquoso da casca de T. arjuna exibiu boa atividade contra S. aureus. Nenhum dos extratos exibiu atividade antifúngica.
CONCLUSÃO: O extrato orgânico obtido a partir da casca e folhas de T. arjuna pode ser usado para tratar infecções bacterianas de ouvido, especialmente aquelas causadas por S. aureus, que exibiu maiores zonas de inibição do que gotas herbáceas; entretanto, ainda necessitamos de estudos mais detalhados - como ensaios in vivo e avaliações de propriedades farmacocinéticas para avaliarmos sua utilidade terapêutica no tratamento de infecções de ouvido.
Abstract:
Ear infection is one of the common diseases occurring throughout the world. Different etiological agents are responsible for ear infections.
AIM: To assess the antimicrobial potential of Terminalia arjuna leaves and bark extracts against Staphylococcus aureus, Acinetobacter sp., Proteus mirabilis, Escherchia coli, Pseudomonas aeruginosa and Candida albicans, pathogens causing ear infections and their comparison with locally available ear drops.
MATERIALS AND METHODS: Methanol, ethanol, acetone, aqueous (hot and cold) extracts from the leaves and bark of T. arjuna were tested for their antimicrobial activity.
RESULTS: Of the three organic solvents evaluated, acetonic leaf extract was found to be best against S. aureus. Organic bark extract showed almost equal inhibition of all tested Gram negative bacteria except P. aeruginosa. However, aqueous extract of T. arjuna bark exhibited good activity against S. aureus. All the extracts were unable to exhibit any antifungal activity.
CONCLUSION: Organic extract obtained from the T. arjuna bark and leaves may be used to treat the bacterial ear pathogens especially S. aureus, which has shown greater inhibition zones than the herbal drops, however, we still need more detailed studies as in vivo testing and pharmacokinetics properties for their therapeutic utility in treating ear infections.
![]()
INTRODUÇÃO
A infecção auditiva é mais comum em crianças do que adultos; em torno de 75% das crianças apresenta pelo menos três ou mais infecções auditivas nos três primeiros anos de vida1. Estas infecções são causadas principalmente por bactérias (Pseudomonas aeruginosa, Staphylococcus aureus, S. epidermidis, Streptococcus pneumoniae, Escherichia coli e Proteus mirabilis) e fungos (Aspergillus niger, A. fumigatus, A. flavus e Candida albicans)2-5.
A eficácia clínica de vários agentes medicamentosos está sendo ameaçada pelo surgimento de patógenos multirresistentes aos antibióticos. As bactérias naturalmente desenvolvem resistência a medicamentos antimicrobianos. Entretanto, nos últimos anos o uso abusivo e errôneo de antibóticos tem feito com que cada vez mais bactérias do gênero estafilococos evoluíssem para se tornar "superbactérias" resistentes a medicamentos, como a meticilina e a vancomicina6-8. O crescente fracasso destas drogas e a resistência exibida pelos agentes infecciosos microbianos patogênicos tem levado as companias farmacêuticas a pesquisar uma potencial atividade antimicrobiana em várias plantas para desenvolver novos agentes antimicrobianos7,9. As ervas medicinais estão voltando à cena, com um 'renascimento' da fitoterapia em todo o mundo; de acordo com a Organização Mundial de Saúde, 80% da população mundial utiliza medicamentos tradicionais extraídos de plantas para cuidar das suas necessidades primárias de saúde10-12.
A natureza conferiu à Índia uma rica flora amplamente distribuída pelo país. As ervas medicinais têm sido usadas no tratamento e cura de várias doenças na prática da medicina tradicional indiana, como os métodos do Ayurveda, Unani e Siddha13,14. A Terminalia arjuna (Wight & Arn.), comumente denominada arjuna (família Combretaceae), é uma árvore decídua perene que atinge 20 a 25 metros de altura e é encontrada em toda a Índia, na Birmânia (Myanmar), no Sri Lanka e nas Ilhas Maurício. As folhas da arjuna são simples, oblongas ou elípticas, com uma superfície superior verda clara e escura e uma superfície inferior marrom clara. As flores são bissexuadas, sésseis e brancas, e se organizam em axillary spikes curtos ou numa panícula terminal. A casca é lisa, de cor externa rosa-cinza, e se descasca na forma de pedaços curvos e relativamente planos de maior tamanho15,16. A casca e as folhas desta planta têm sido usadas nos sistemas de medicina nativa para curar diversas doenças. A casca é usada para tratar a angina (hritshool), e como expectorante, antidisentérico, purgativo e laxativo, e também no tratamento da leucodermia, anemia, hiperidrose, asma, tumores e doenças cardiovasculares16,17. As folhas servem para tratar dores de ouvido18. A casca também possui atividade anticancerígena, antiviral e antimicrobiana19,20.
As plantas têm uma capacidade ilimitada de sintetizar metabólitos secundários, como taninos, terpenoides, alcaloides, flavonoides, glicosídeos e fenóis, os quais apresentam propriedades antimicrobianas11,21,22. As folhas e a casca da T. arjuna contêm glicosídeos com ação cardioprotetora, flavonoides com efeito antioxidante, antiinflamatório, antimicrobiano (luteolina), anticancerígeno e redutor de lípides, taninos com atividade adstringente, cicatrizante, antioxidante, anticancerígena, antiviral e antimicrobiano. Além desses fitocompostos, a casca também contém triterpenóides com efeito principalmente cardioprotetor e antibacteriano (ácido arjúnico, arjungenina e arjunetina)15,16,23.
Várias plantas medicinais de uso tradicional não têm sido pesquisadas sistematicamente para investigar sua ação contra patógenos microbianos24. Uma revisão na literatura mostrou alguns estudos sobre a atividade antibacteriana e antifúngica de várias partes dessa árvore, tais como a casca23,25,26, as folhas, as raízes e as frutas15,27,28. Entretanto, faltam estudos sobre antimicrobianos para combater patógenos causadores das infecções auditivas. O presente estudo teve como objetivo validar o potencial antimicrobriano das folhas e da casca da T. arjuna em relação a patógenos bacterianos e fúngicos envolvidos nas infecções auditivas. Os patógenos foram isolados de pacientes na região de Kurukshetra e comparados com gotas otológicas disponíveis localmente, visando encontrar um extrato inédito para o tratamento das infecções auditivas.
MATERIAL E MÉTODOS
Coleta de plantas
A casca e as folhas da Terminalia arjuna foram coletadas de árvores presentes ao longo das ruas na Universidade de Kurukshetra, em Haryana. A identidade taxonômica da planta foi confirmada pelo doutor B. D. Vashishta, do Departamento de Botânica da Universidade de Kurukshetra, em Kurukshetra.
Extração do material da planta
As amostras foram cuidadosamente lavadas em água corrente, seguido de água destilada esterelizada, e depois secadas a ar na temperatura de 400C, durante 4-5 dias; a seguir, as amostras foram homogenizadas e moídas com um moedor esterelizado até se tornar um pó fino e depois armazenadas em garrafas de ar comprimido. Quatro solventes (etanol, metanol, acetona, e água quente e fria) foram utilizados para a extração. Uma amostra de 10 g de casca e folhas homogeneizadas foi separadamente colocada em recipientes cônicos contendo cada um 100 ml de acetona, etanol, metanol (95%) e água destilada esterilizada. A mesma quantidade (10 g) de casca e folhas homogeneizadas foi separadamente imersa em 100 ml de água destilada quente em recipientes cônicos e deixada em repouso durante 30 minutos em banho-maria, sendo agitada ocasionalmente; em seguida, todos os recipientes foram colocados em um agitador rotatório a 200 rpm durante 24 horas29-31. Cada preparação foi filtrada em papel filtro esterilizado Whatman no 1 e por fim concentrada por secagem em vácuo a 40°C usando um rotaevaporador. O extrato seco resultante foi esterilizado durante uma noite por irradiação UV; a esterilização foi verificada por meio de placas de ágar nutriente, e as amostras foram armazenadas a 40C em recipientes estéreis rotulados até uso subsequente14,32.
Microorganismos de teste
As cinco bactérias, Staphylococcus aureus (HM626197)*(Gram-positivo), Acinetobacter sp. (HM626198), Proteus mirabilis (HM626199), Escherchia coli (HM626200) e Pseudomonas aeruginosa (HM626201) (Gram-negativo) e uma levedura, Candida albicans, usadas nesse estudo foram isoladas de pacientes com infecção auditiva nos ambulatórios locais de otorrinolaringologia em Kurukshetra. As cepas bacterianas foram identificadas por coloração, características bioquímicas e moleculares (sequenciamenteo de 16S RNAr)33, e a levedura foi identificada por coloração e características morfológicas e de cultura5,34,35. Foram feitas subculturas em ágar nutriente dos isolados de bactérias; foi feito cultivo da levedura em ágar de malte levedura. Todos foram incubados aerobicamente a 37ºC. Os meios de cultura foram adquiridos do laboratório Hi Media Laboratory Pvt. Ltd., Bombaim, Índia.
Solução otológica em gotas
Três soluções de gotas otológicas comumente prescritas por otorrinolaringologistas (dois medicamentos alopáticos, Ciplox - antibacteriano, e Candid - antifúngico, e um preparado de gotas otológicas fitoterapêuticas, Bilwa Tel - antimicrobiano) foram usados no presente estudo, tendo sido adquiridos no mercado local em Kurukshetra.
Investigação da atividade antimicrobiana
Os extratos de casca e folhas de T. arjuna em acetona, metanol, etanol, água quente e fria foram usados na avaliação da atividade antimicrobiana por meio da técnica de difusão em ágar pelo método do poço36,37. Nesse método, é feita a subcultura de um isolado puro de cada microorganismo em placas de ágar a 37°C durante 24 horas. Uma placa de cada microorganismo foi selecionada e uma alça estéril foi utilizada para tocar pelo menos quatro colônias por placa para transferência a um meio de solução fisiológica (0,85%) sob condições assépticas. A densidade de cada suspensão microbiana foi ajustada para conformar ao padrão equivalente a 106 cfu/ml (padrão 0.5 McFarland) para uso como o inóculo no ensaio pela técnica da difusão em ágar pelo método do poço. Um volume de cem microlitros (100µl) de inóculo em cada organismo de teste foi espalhado sobre placas de ágar para obter um crescimento confluente. As placas de ágar foram secas e poços de 8 mm foram feitos nas placas de ágar inoculadas com uma broca esterilizada; a porção inferior de cada poço foi selada com meio de ágar específico derretido. Os extratos secos foram reconstituídos em dimetilsulfóxido (DMSO) a 20% para a análise do bioensaio38. Um volume de 100µl de cada extrato foi injetado diretamente nos poços (de forma triplicada) nas placas de ágar inoculadas, para cada organismo testado. As placas permaneceram em repouso durante 1 hora para que o extrato difundisse no ágar, e incubadas a 37ºC durante 24 horas32,39. O controle negativo foi feito com DMSO estéril a 20%, e o controle positivo foi feito com gotas otológicas de Ciplox (para as bactérias), Candid (para os fungos) e Bilwa tel (antimicrobiano). A atividade antimicrobiana, indicada por uma zona de inibição em torno do poço contendo o extrato, foi registrada quando acima de 8 mm40. Os experimentos foram feitos de forma triplicada; foram calculados os valores médios dos diâmetros das zonas de inibição e o desvio padrão (±).
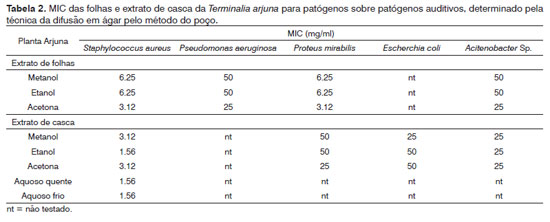
Determinação da concentração inibitória mínima (MIC)
A MIC para cada organismo testado foi determinada pela técnica de difusão em ágar pelo método do poço modificada. A diluição seriada de cada extrato foi feita reconstituindo-se o extrato seco (100 mg/ml) em DMSO a 20%, seguida de diluição em água destilada esterilizada (1:1) para se obter uma faixa de concentrações decrescentes de 50 mg/ml a 0,39 mg/ml. Um volume de 100 µl de cada diluição foi introduzido nos poços (repetido três vezes) das placas de ágar previamente inoculadas com 100µl do inóculo padrão (106 cfu/ml) da cepa microbiana. Todas as placas de teste foram incubadas aerobicamente a 37ºC durante 24 horas, e observadas em busca das zonas de inibição. A MIC, considerada como a menor concentração do extrato de teste que inibiu completamente o crescimento do microorganismo, evidenciada por uma zona clara de inibição (>8 mm), foi registrada para cada organismo testado32,37,41,42.
Análise estatística
Os dados foram apresentados como a média ± DP (desvio padrão). Os resultados foram analisados estatísticamente por meio do teste T de Dennett. Valores de p inferiores a 0,01 foram considerados significativos.
RESULTADOS
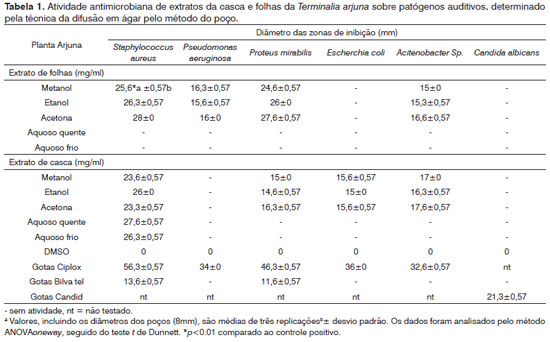
A atividade antibacteriana de extratos da casca e folhas da T. arjuna nas placas de agar variou conforme os solventes. Nenhum dos dez extratos investigados pela sua atividade antifúngica apresentou uma zona de inibição contra a Candida albicans, carecendo, assim, de atividade antifúngica. Os controles positivos produziram zonas de inibição significativas contra as bactérias e fungos testados, e os controles negativos não produziram qualquer efeito inibitório observável contra os organismos testados (Tabela 1).
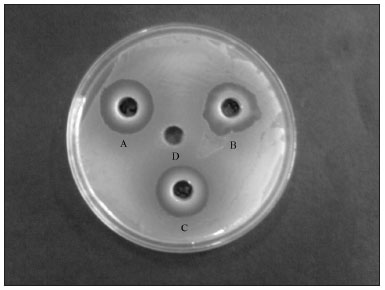
Os dados apresentados na Tabela 1 mostram que os seis extratos com solventes orgânicos da casca e folhas apresentaram atividade antibacteriana contra os quatro patógenos bacterianos testados, em relação aos cinco microorganismos avaliados. O extrato acetônico de folhas mostrou-se o mais eficaz contra o Staphylococcus aureus (28 mm) (Figura 1), seguido do Proteus mirabilis (27,6 mm), Acinetobacter sp (16,6 mm) e o Pseudomonas aeruginosa (16 mm). Os diâmetros das zonas de inibição geradas pelos extratos metanólicos e etanólicos contra o S. aureus e o P. mirabilis variaram de 24,6 mm a 26,3 mm. O S. aureus e o P. mirabilis foram os patógenos mais sensíveis, tendo sobrevivido até 1,56 mg/ml e 3,12 mg/ml respectivamente (Tabela 2); portanto, o MIC correspondente foi de 3,12 mg/ml e 6,25 mg/ml. As zonas de inibição produzidas por extratos orgânicos de folhas contra o P. aeruginosa e o Acitenobacter sp. variaram de 15 mm a 16,6 mm. O P. aeruginosa e o Acitenobacter sp. se mostraram comparativamente menos sensíveis, já que sobreviveram até 25 mg/ml (extratos metanólicos e etanólicos) e 12,5 mg/ml (extrato acetônico); portanto, seu MIC foi de 50 mg/ml e 25 mg/ml respectivamente. Não foi observada atividade antibacteriana contra o E. coli. por parte dos extratos aquosos e orgânicos dos extratos de folhas.
Figura 1. Zona de inibição antibacteriana de extratos orgânicos das folhas da T. arjuna contra S. aureus por extratos acetônicos (A), metanólicos (B), etanólicos (C) e o controle negativo DMSO (D).
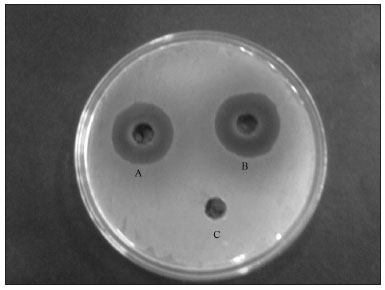
Os cinco extratos de casca com solventes orgânicos e aquosos apresentaram atividade antibacteriana contra o S. aureus; a maior zona de inibição ocorreu no extrato aquoso quente (27,6 mm), seguida do extrato aquoso frio (26,3 mm) (Figura 2), extrato com etanol (26 mm), com metanol e com acetona (ambos 23 mm). O S. aureus foi novamente o patógeno mais sensível, tendo sobrevivido até a concentração de 0,78 mg/ml em extratos com água quente, água fria e etanol (Tabela 2); portanto, seu MIC foi de 1,56 mg/ml, seguido dos extratos metanólicos e acetônicos a 3 mg/ml. As zonas de inibição produzidas pelos três extratos contra o Acitenobacter sp. variaram de 16,3 mm a 17 mm. O Acitenobacter sp. se mostrou comparativamente menos sensível, já que sobreviveu até 12,5 mg/ml; seu MIC foi de 25 mg/ml. As zonas de inibição produzidas pelos extratos de casca com solventes orgânicos contra o P. mirabilis e o E. coli foram semelhantes, variando de 14,6 mm a 16,3 mm. O P. mirabilis sobreviveu até 12,5 mg/ml (acetona) e 25 mg/ml (metanol e etanol); portanto, o MIC foi de 25 mg/ml e 50 mg/ml, respectivamente. O E. coli sobreviveu até 25 mg/ml (etanol e acetona) e 12,5 mg/ml (metanol); portanto o MIC foi de 50 mg/ml e 25 mg/ml, respectivamente. Os extratos orgânicos e aquosos de casca não apresentaram atividade antibacteriana contra o P. aeruginosa. Os resultados foram estatisticamente significativos, com p < 0.001 comparado com os controles.
Figura 2. Zona de inibição antibacteriana de extratos aquosos da casca da T. arjuna contra S. aureus por extratos aquosos quente (A), aquoso frio (B) e o controle negativo DMSO(C).
DISCUSSÃO
Os extratos orgânicos das folhas do T. arjuna apresentaram boa atividade contra os quatro patógenos bacterianos auditivos (Staphylococcus aureus, Pseudomonas aeruginosa, Proteus mirabilis e Acitenobacter sp.); não houve atividade contra o E. coli. Curiosamente, o extrato da casca também apresentou boa bioatividade contra as quatro bactérias acima; entretanto, o P. aeruginosa não se mostrou sensível aos extratos da casca. Não houve atividade antifúngica contra o C. albicans por parte dos extratos de folhas e casca da T. arjuna. Um estudo anterior havia mostrado que extratos de raízes dessa planta tinham atividade contra o Aspergillus niger e a Candida albican27.
Os extratos aquosos da casca e folhas da T. arjuna não apresentaram atividade antifúngica contra a C. albicans e nem atividade antibacteriana contra as bactérias testadas, exceto o S. aureus (Gram positivo), o qual se mostrou sensível aos extratos aquosos quente e frio de casca da T. arjuna. O espectro limitado de atividade antimicrobiana dos extratos aquosos pode ser devido a três fatores: em primeiro lugar, a polaridade dos compostos antibacterianos faz com que os mesmos sejam mais prontamente extraídos por solventes orgânicos do que por extratos aquosos; em segundo lugar, compostos ativos podem estar presentes em uma quantidade insuficiente no extrato bruto para apresentar atividade na dose empregada; e, em terceiro lugar, mesmo que o princípio ativo esteja presente em doses altas, poderia haver outros constituintes no extrato exercendo efeitos antagonistas contra os compostos bioativos43.
Dentre os três extratos orgânicos de folhas que foram estudados, o extrato acetônico apresentou a melhor atividade antibacteriana, comparado com os extratos contendo etanol e metanol (Tabela 1); esse achado corrobora estudos anteriores11,37,44,45, que concluiram ser a acetona o melhor solvente. A atividade antibacteriana dos extratos de casca e folhas da T. arjuna em relação aos patógenos bacterianos envolvidos em infecções auditivas pode ser devida à presença de metabólitos secundários, tais como o ácido arjúnico, a arjungenina, a arjunetine e a luteolina, sobre os quais a atividade antimicrobiana já foi relatada15,16,23.
Esse estudo mostrou que extratos da casca e folhas da T. arjuna têm atividade antibacteriana de amplo espectro contro patógenos auditivos, evidenciado pela formação de zonas de inibição para bactérias Gram positivas e negativas. Curiosamente, os extratos orgânicos dessa planta mostraram atividade mais potente contra as bactérias testadas do que solução em gotas otológicas fitoterápicas padrão (Bilwa tel); assim, têm grande potencial como gotas otológicas fitoterápicas para o controle das infecções auditivas.
CONCLUSÃO
Nossos resultados nos permitem concluir que todos os extratos de T.arjuna testados (nas preparações com acetona, etanol ou metanol) apresentaram boa atividade contra patógenos auditivos Gram positivos e negativos; a inibição foi maior contra as bactérias Gram positivas do que as Gram negativas. Esse achados provavelmente explicam o uso desta planta por povos nativos há gerações para o tratamento das infecções. Até o momento, poucos estudos têm sido realizados sobre a atividade antimicrobiana e os usos clínicos plausíveis destes compostos fitoterápicos. São ainda necessários estudos adicionais dessa planta, tais como pesquisas in vivo, para determinar a toxicidade, os efeitos colaterais e as propriedades farmacocinéticas desses compostos, visando identificar os princípios bioativos para uso clínico no tratamento das infecções auditivas. A atividade antibacteriana pode ser ampliada se os componentes ativos forem purificados e a dosagem apropriada para uso clínico for estabelecida. Há a necessidade de desenvolver um fitocomposto comercial eficaz e isento de efeitos colaterais e sem o problema da indução de resistência medicamentosa.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Gates GA. Consideration of Otitis Media treatment. Otolaryngol Head Neck Surg. 1996;114(4):525-30.
2. Roland PS, Stroman DW. Microbiology of acute otitis externa. Larygoscope. 2002;112(7 Pt 1):166-77.
3. Rosenfeld RM, Brown L, Cannon RC, Dolor JR, Ganiats GT, Hannley M, et al. Clinical practice guideline: Acute otitis externa. American Acad Otolaryngology-Head and Neck Surgery Foundation. 2006;134(4 Suppl):s4-s23.
4. Dhingra PL. Diseases of Ear, Nose and Throat. 4th ed. New Delhi: Reed Elsevier India. Private Limited; 2007.
5. Aneja KR, Sharma C, Joshi R. Fungal infection of the ear: A common problem in the north eastern part of Haryana. Int J Ped Otorhinolaryngol. 2010;74(6):604-7.
6. Bandow JE, Brotz H, Leichert LIO, Labischinski H, Hecker M. Proteomic approach to understanding antibiotic action. Antimicrob Agents Chemother. 2003;47(3):948-55.
7. Anonymous. Fighting superbugs. CQ Researcher. 2007;17(29):673-96.
8. Aneja KR, Sharma C, Joshi R. Antimicrobial susceptibility pattern of common human pathogenic bacteria and yeasts against commercially available drugs. In: R Lawrence, AK Gulati, G Abraham. Antimicrobial Resistance: From Emerging Threat to Reality., New Delhi: Narosa Publishing House; 2009. p.84-90.
9. Scazzocchio F, Cometa MF, Tomassini L, Palmery M. Antibacterial activity of Hydratis canadensis extract and its major isolated alkaloids. Planta Med. 2001;67(6):561-4.
10. Clark AM. Natural products as a resource for new drugs. Pharmacy Research. 1996;13(8):1133-44.
11. Cowan, MM. Plant products as antimicrobial agents. Clin Microbiol Rev. 1999;12(4):564-82.
12. WHO. Traditional Medicine: Growing needs and potential. WHO Policy Perspectives on Medicine. World Health Organization: Geneva; 2002. p.1-6.
13. Dahanukar SA, Kulkarni RA, Rege NN. Pharmacology of medicinal plants and natural products. Indian J Pharmacol. 2000;32(4):S81-S118.
14. Kumar VP, Chauhan NS, Padh H, Rajani M. Search for antibacterial and antifungal agents from selected Indian medicinal plants. J Ethnopharmacol. 2006;107(2):182-8.
15. Dwivedi S. Terminalia arjuna Wight & Arn.-A useful drug for cardiovascular disorders. J Ethnopharmacol. 2007;114(2):114-29.
16. Jain S, Yadav PP, Gill V, Vasudeva N, Singla N. Terminalia arjuna a sacred medicinal plant; phytochemical and pharmacological profile. Phytochem Rev. 2009;8(2):491-502.
17. Udupa KN. Scope of use of Terminalia arjuna in ischaemic heart disease. Ann Natl Acad Indian Med. 1986;1:54.
18. Khory RN. The Bombay material medica and their therapeutics. Renina's Union Press; 1867.
19. Tripathi VK, Singh B. Terminalia arjuna- its present status (a review). Orient J Chem. 1996;12(1):1-16.
20. Cooper EL. CAM, eCAM, Bioprospecting: the 21st century pyramid. Evid Based Compliment Alternat Med. 2005;2(2):125-7.
21. Sher A. Antimicrobial activity of natural products from medicinal plants. Gomal J Med Sci. 2009;7(1):72-8.
22. Das K, Tiwari RKS, Shrivastava DK. Techniques for evaluation of medicinal plant products as antimicrobial agent: Current methods and future trends. J Med Plants Res. 2010;4(2):104-11.
23. Singh DV, Gupta MM, Kumar TRS, Saikia D, Khanuja SPS. Antibacterial principles from the bark of Terminalia arjuna. Curr Sci. 2008;94(1):27-9.
24. Farrukh A, Iqbal A. Broad spectrum antibacterial and antifungal properties of certain traditionally used Indian medicinal plants. World J Microbiol Biotechnol. 2003;19(6):653-7.
25. Aggarwal RR, Dutt S. Chemistry, pharmacology and therapeutic actions of Terminalia arjuna. Proc Nat Acad Sci. 1936;6:305.
26. Perumalsamy R, Ignacimuthu S, Sen A. Screening of 34 Indian Medicinal plants for antibacterial properties. J Ethnopharmacol 1998;62(2):173-82.
27. Chouksey BK, Srivastava SK. Antifungal agent from Terminalia arjuna. Indian J Chem. 2001;40B:354-6.
28. Ramya S, Kalaivani T, Rajasekaran C, Jepachanderamohan P, Alaguchamy N, Kalayasundaram M, et al. Antimicrobial activity of aqueous extracts of bark, root, leaves and fruits of Terminalia arjuna Wright & Arn. Ethanobotanical leaflets. 2008;12:1192-7.
29. Akueshi CO, Kadiri CO, Akueshi EU, Agina SE, Ngurukwem B. Antimicrobial potential of Hyptis sauvedena Poit (Lamisceae). Nigeria J Bot. 2002;15(1):37-41.
30. Ogundiya MO, Okunade MB, Kolapo AL. Antimicrobial activities of some Nigerian Chewing Sticks. Ethnobotanical leaflets. 2006;10(1):265-71.
31. Preethi R, Devanathan VV, Loganathan M. Antimicrobial and antioxidant efficacy of some medicinal plants against food borne pathogens. Advances Biol Res. 2010;4(2):122-5.
32. Okeke MI, Iroegbu CU, Eze EN, Okoli AS, Esimone, CO. Evaluation of extracts of the roots of Landolphia owerrience for antibacterial activity. J Ethnopharmacol. 2001;78(2-3):119-27.
33. Lawongsa P, Boonkerd N, Wongkaew S, O Gara F, Teaumroong N. Molecular and phenotypic characterization of potential plant growth-promoting Pseudomonas from rice and maize rhizospheres. World J Microbiol Biotechnol. 2008;24( 9):1877-84.
34. Aneja KR. Experiments in Microbiology, Plant Pathology and Biotechnology. 4th ed. New Delhi: New Age International Publishers; 2003.
35. Cappuccino JG, Sherman N. Microbiology Lab Manual. 7th ed. USA: Benjamin Cummings Publishing Company; 2008.
36. Ahmad I, Beg AZ. Antimicrobial and phytochemical studies on 45 Indian medicinal plants against multi-drug resistant human pathogens. J Ethnopharmacol. 2001;74(2):113-23.
37. Aneja KR, Joshi R, Sharma C. Antimicrobial activity of Dalchini (Cinnamomum zeylanicum bark) extracts on some dental caries pathogens. J Phar Res. 2009;2(9):1370-2.
38. Rajasekaran C, Meignanam E, Vijayakumar V, Kalaivani T, Ramya S, Premkumar N, et al. Investigation on antibacterial activities of leaf extracts of Azadirachta indica A. Juss (Meliaceae) a traditional medicinal plant of India. Ethnabotanical Leaflets. 2008;12(1):1213-7.
39. Rios JL, Recio MC, Villar A. Screening methods for natural products with antibacterial activity: a review of the literature. J Ethnopharmacol. 1980;23(2-3):127-49.
40. Hammer KA, Carson CF, Riley TV. Antimicrobial activity of essential oils and other plant extracts. J App Microbiol. 1999;86(6):985-90.
41. Thongson C, Davidson PM, Mahakarnchanakul W, Weiss J. Antimicrobial activity of ultra sound- assisted solvent - extracted spices. Lett Appl Microbiol. 2004;39(5):401-6.
42. Nkere CK, Iroegbu CU. Antibacterial screening of the root, seeds and stem bark extracts of Picralima nitida. Afr J Biotechnol. 2005;4(6):522-6
43. Sangetha SN, Zuraini Z, Sasidharan S, Suryani S. Antimicrobial activities of Cassia surattensis and Cassia fistula. J Mol Bio Biotech. 2008;1(1):1-4.
44. Eloff JN. Which extractant should be used for the screening and isolation of antimicrobial components from plants? J Ethnopharmacol. 1998;60(1):1-8.
45. Nair R, Kalariya T, Sumitra C. Antibacterial activity of some selected Indian medicinal plants. Turk J Biol. 2005;29(1):41-7.
1. Doutor (Professor).
2. Pesquisador acadêmico (Kurukshetra).
3. Pesquisadora.
Endereço para correspondência:
Chetan Sharma
Department of Microbiology, Kurukshetra University
Kurukshetra- 136 119, Haryana, India
Mob: +91 9812287101
E-mail : chetanmicro147@gmail.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 8 de setembro de 2010. cod. 7312
Artigo aceito em 20 de fevereiro de 2011.
* o sequenciamento de nucleotídeos das cinco bactérias foram submetidas ao banco de dados GenBank, os quais forneceram o número de acesso GenBank HM626197-HM626201