Ano: 2012 Vol. 78 Ed. 1 - Janeiro - Fevereiro - (6º)
Seção: Artigo Original
Páginas: 37 a 42
Método prático de obtenção de amostras de meato acústico externo e membrana timpânica para estudo histológico e imunohistoquímico
Method for removal of samples of ear canal and tympanic membrane for histologic and immunhistochemical study
Autor(es): João Daniel Caliman e Gurgel1; Celina Siqueira Barbosa Pereira2; José Humberto Tavares Guerreiro Fregnani3; Fernando de Andrade Quintanilha Ribeiro4
Palavras-chave: histologia, imunoistoquímica, meato acústico externo, membrana timpânica, osso temporal.
Keywords: ear canal, histology, immunohistochemistry, temporal bone, tympanic membrane.
Resumo:
Ossos temporais humanos constituem valiosas fontes de estudo das doenças relacionadas à orelha. Apesar dos vários métodos existentes para obtenção de amostras de ossos temporais de cadáveres, geralmente estes métodos não são descritos em detalhes nos artigos envolvendo pesquisa.
OBJETIVOS: Descrever um método prático e rápido para obtenção de amostras de meato acústico externo e membrana timpânica, e verificar sua viabilidade para estudo histológico e imunohistoquímico.
MATERIAL E MÉTODO: Para este estudo experimental, foram obtidas 31 amostras de meato acústico externo e membrana timpânica de cadáveres com a utilização de furadeira convencional e broca do tipo serra copo. O material foi dissecado para obtenção de amostras em bloco contendo o meato acústico externo e a membrana timpânica. Estas amostras foram analisadas por histologia e imunohistoquímica.
RESULTADOS: Foi possível a remoção de amostras de pequeno volume e de boa qualidade, o que facilitou a obtenção de amostras contendo todo o meato acústico externo e membrana timpânica. Em todas as amostras, foi possível realização de estudo histológico e imunohistoquímico.
CONCLUSÃO: O método aqui descrito foi facilmente exequível, reprodutível e produziu amostras de boa qualidade, seja para treinamento ou pesquisa experimental. Todas as amostras foram viáveis para a realização de estudo histológico e imunohistoquímico.
Abstract:
Temporal bones are valuable resources to study ear diseases. Although there are several methods for removing temporal bones from cadavers, such methods are not usually described in enough details in experimental research papers.
OBJECTIVES: To describe a simple and rapid method for ear canal and tympanic membrane removal, and to evaluate its viability for histologic and immunohistochemical studies.
MATERIALS AND METHODS: In this experimental study, we obtained 31 ear canal and tympanic membrane samples from cadavers, with a conventional power drill and plug cutter. The material was dissected and samples containing ear canals and tympanic membranes were obtained in blocks. The samples were analyzed by histology and immunohistochemistry.
RESULTS: Removal of small and good quality samples containing entire ear canals and tympanic membranes. In all the samples, it was possible to perform both histological and immunohistochemical analyses.
CONCLUSION: This method was easily achievable, reproducible and yielded good quality samples, both for training purposes and for experimental research. All the samples were viable for histological and immunohistochemical analyses.
![]()
INTRODUÇÃO
Ossos temporais humanos constituem valiosas fontes de estudo das doenças relacionadas à orelha. A fisiopatologia da perda auditiva, dos distúrbios do equilíbrio, da paralisia facial, de doenças específicas da orelha, como o colesteatoma, entre outras, podem ser pesquisadas por meio do estudo de amostras de ossos temporais obtidas de cadáveres. Estas amostras são de extrema importância, não só para pesquisa experimental, mas também para treinamento de médicos em formação1,2. Em qualquer programa de treinamento e residência em Otorrinolaringologia, é de extrema importância a disponibilidade de ossos temporais para estudo3. Apesar dos vários métodos existentes para obtenção de amostras de ossos temporais de cadáveres, geralmente estes métodos não são descritos em detalhes pelos autores de artigos envolvendo pesquisa experimental histológica e/ou imunohistoquímica4-6. Durante a remoção do osso temporal do cadáver, cuidado especial deve ser tomado para que seja minimizada a ocorrência de autólise e de artefatos, que poderiam prejudicar a qualidade da amostra para pesquisa. A presença de fatores, como história de septicemia, de uso de medicamentos, tempo de óbito prolongado, manuseio e fixação inadequados da peça, pode interferir na integridade celular e nas características histológicas e imunohistoquímicas, criando vieses e prejudicando a análise dos resultados1.
Quando o objetivo de um determinado trabalho envolve a análise exclusivamente da epiderme do meato acústico externo e da membrana timpânica, a remoção de todo o osso temporal não é necessária. Neste caso, é possível a utilização de um método rápido e que produz uma peça de reduzido volume, para que possa ser facilmente armazenada e transportada em pequenos recipientes.
Os objetivos deste estudo foram descrever um método prático e rápido para obtenção de amostras de meato acústico externo e membrana timpânica, e verificar sua viabilidade para estudo histológico e imunohistoquímico.
MATERIAL E MÉTODO
O projeto de pesquisa foi submetido à apreciação do Comitê de Ética em Pesquisa da instituição e aprovado sob número 052/10.
Para a realização deste estudo observacional, foram obtidas 31 amostras de meato acústico externo e membrana timpânica de cadáveres.
Os critérios de inclusão foram:
Cadáveres vítimas de morte por causa violenta;
Menos de 6 horas de óbito;
Estes critérios foram utilizados na tentativa de excluir cadáveres com história de doenças crônicas que poderiam interferir na expressão dos marcadores imunohistoquímicos a serem pesquisados. Houve limitação do tempo de óbito para que fosse mantida a integridade celular, permitindo o estudo histológico e imunohistoquímico.
Os critérios de exclusão foram:
Presença de fratura do osso temporal com laceração da membrana timpânica e/ou da pele do meato acústico externo;
Cadáveres com história de assistência hospitalar imediatamente antes do óbito;
Sinais de infecção sistêmica ou otológica;
A laceração da pele do meato acústico externo ou da membrana timpânica poderia dificultar a manutenção do formato cilíndrico destas estruturas durante a confecção dos blocos em parafina. Os demais critérios de exclusão foram utilizados para reduzir a possibilidade de interferência de medicamentos ou processos infecciosos na expressão dos marcadores imunohistoquímicos pesquisados.
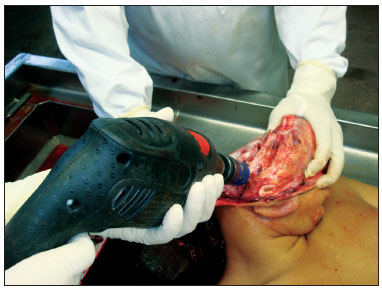
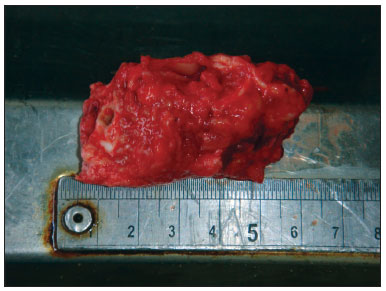
A obtenção das amostras se iniciou após a realização normal da necropsia. A remoção das peças foi realizada respeitando os preceitos de biossegurança, com utilização de capote, máscara para proteção de toda a face e luvas. Com a calvária e o encéfalo já removidos, o músculo temporal foi rebatido e o orifício do meato acústico externo exposto o mais próximo possível ao osso, facilitando o manuseio da broca serra copo, que apresentava 5 cm de diâmetro e 6 cm de profundidade. Para o início do corte, a furadeira era encostada já em funcionamento na superfície da região a ser removida, com pouca pressão sobre o osso, em sentido discretamente anterossuperior (Figura 1). Com o corte já iniciado, moderada pressão era feita até o término do corte, interessando todo o meato acústico externo, membrana timpânica e caixa do tímpano, incluindo a cadeia ossicular. Após o uso da furadeira, com o auxílio de um formão de 20 mm, era realizada uma osteotomia na região do ápice petroso, com liberação de todas as conexões ósseas ainda presentes. Os remanescentes musculares eram incisados com bisturi e a peça, finalmente removida (Figura 2). O fragmento era colocado imediatamente em solução de formol a 10%. No laboratório de dissecção, o fragmento era colocado em suporte próprio para este fim em mesa com microscópio, aspirador e instrumentos adequados para dissecção do meato acústico externo e da membrana timpânica.
Figura 1. Orientação da furadeira e da broca para início do corte.
Figura 2. Aspecto da peça após sua obtenção.
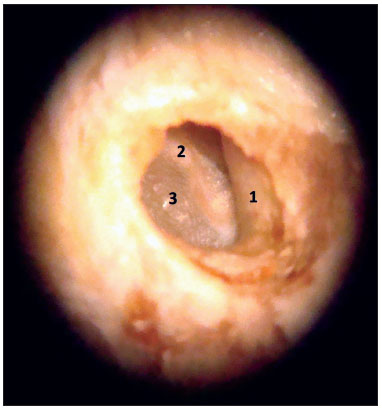
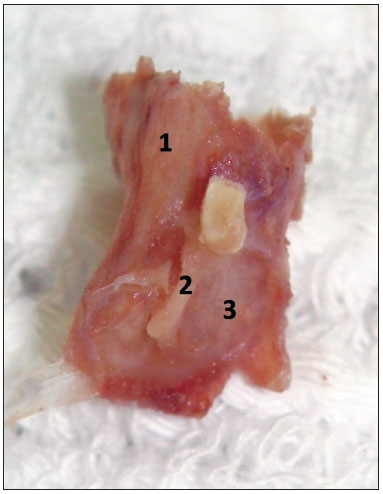
Antes do início do uso do microscópio, os tecidos moles ainda remanescentes eram removidos até próximo ao osso timpânico. A pele do meato acústico externo era completamente dissecada, sempre com o cuidado de evitar lacerações, que poderiam prejudicar a manutenção do formato cilíndrico do meato durante a confecção dos blocos em parafina. A dissecção do anel fibrocartilagíneo e da membrana timpânica era sempre iniciada em sua região posterior, como em uma timpanoplastia convencional, e depois estendida para toda a circunferência do anel fibrocartilagíneo (Figura 3). O martelo era mantido junto à membrana timpânica para que fosse facilitada a orientação ântero-posterior e súpero-inferior da peça durante a confecção dos blocos em parafina (Figura 4). Para que o formato cilíndrico do meato acústico externo junto da membrana timpânica fosse mantido, inicialmente a parafina era colocada no interior do meato e, posteriormente, em seu redor, para a confecção dos blocos. O tempo entre a obtenção das amostras e a confecção dos blocos em parafina variou entre cinco e 15 dias.
Figura 3. Imagem da peça vista pelo microscópio (aumento de 10x). 1: Meato acústico externo; 2: Cabo do martelo; 3: Camada timpânica.
Figura 4. Aspecto final da amostra, pronta para ser emblocada em parafina. 1: Meato acústico externo; 2: Cabo do martelo inserido na camada mucosa da membrana timpânica; 3:Camada mucosa da membrana timpânica.
Com a finalidade de testar a viabilidade do método, foram realizados estudos histológico e imunohistoquímico das amostras. Os blocos foram submetidos a secções longitudinais em micrótomo rotativo, obtendo-se cortes com três micrômetros de espessura para o exame histológico, com a coloração de hematoxilina-eosina (HE). As lâminas com os fragmentos de meato acústico externo e membrana timpânica foram analisadas com auxílio de microscópio óptico modelo Axioscope 40 (Carl Zeiss do Brasil), com ocular de 10x e objetivas de 5x, 10x, 20x e 40x. As lâminas foram fotografadas com uma câmera Axiocam MRc5 (Zeiss) conectada a um computador. Para a obtenção das imagens digitais do material e medidas de área, foi utilizado o software Axiovision 4.8. As lâminas preparadas continham as paredes superior e inferior do meato, além da membrana timpânica em seu maior diâmetro.
Para coloração imunohistoquímica foram utilizados anticorpos anti-CK16 e Ki-67. Cortes não corados e em lâminas previamente imersas no adesivo organosilano foram submetidos à técnica imunohistoquímica por meio da imunoperoxidase, em procedimento de três etapas, com amplificação pelo sistema avidina-biotina-peroxidase, sem tripsinização prévia7. Os anticorpos monoclonais primários utilizados foram o anti-cytoqueratin 16 clone LL025 (Diagnostic Biosystems®, EUA) e anti-Ki-67 clone Ki-S5 (Dako®, Dinamarca), ambos na diluição de 1:100. O anticorpo secundário foi o Max polymer detection system (Kit Novolink, Novocastra®) e o revelador, a diaminobenzidina (DAB, Dako®).
As lâminas foram posteriormente avaliadas por dois observadores experientes quanto à manutenção das características histológicas e imunohistoquímicas (imunoexpressão da CK16 e do KI-67) da epiderme das amostras obtidas pelo método descrito neste trabalho.
RESULTADOS
Com o aprimoramento e a prática na execução da técnica, o tempo de cada fase da obtenção das amostras foi gradualmente reduzindo de acordo com a curva de aprendizado. A fase de trabalho com o cadáver inicialmente durou 30 minutos para cada amostra, até que a técnica fossa totalmente padronizada. Assim que isso aconteceu, os fragmentos passaram a ser obtidos em apenas 2 minutos. Durante a fase de trabalho no laboratório de dissecção, cada peça foi dissecada inicialmente em 50 minutos. Após as primeiras dissecções do meato acústico externo e da membrana timpânica, apenas 15 minutos eram necessários para remoção das amostras em bloco e sem lacerações de todo o meato acústico externo, membrana timpânica e martelo para estudo histológico e imunohistoquímico. Todas as amostras obtidas foram viáveis para a pesquisa histológica e imunohistoquímica com a utilização deste método (Figura 5, 6 e 7).
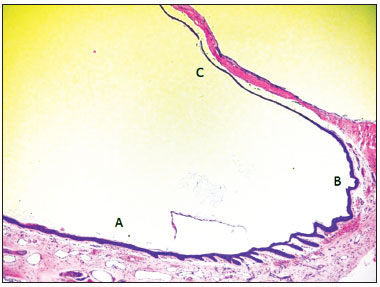
Figura 5. Fotomicrografia mostrando o epitélio da porção inferior do meato acústico externo (A), anel fibrocartilagíneo (B) e membrana timpânica (C) (HE - 50x). Observar a presença de cones epiteliais na epiderme da parede inferior do meato acústico externo, próximo ao anel fibrocartilagíneo.
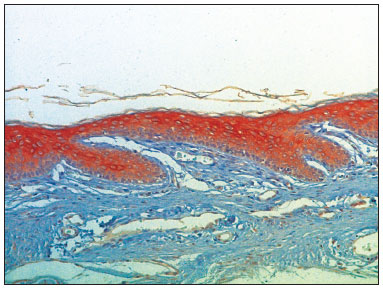
Figura 6. Fotomicrografia mostrando a epiderme da parede inferior do meato acústico externo com expressão de CK16 (IHQ-200x).
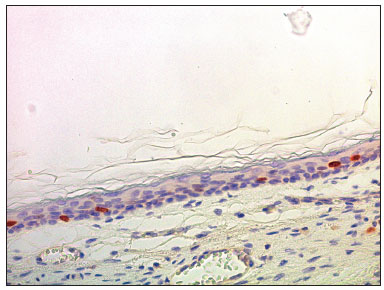
Figura 7. Fotomicrografia mostrando a epiderme da parede inferior do meato acústico externo com a presença de núcleos corados para Ki-67 na camada basal e na parte profunda camada espinhosa (IHQ - 400x).
DISCUSSÃO
Vários métodos para a obtenção de amostras de ossos temporais já foram descritos tanto para treinamento quanto para estudo experimental. Para a obtenção de amostras de osso temporal, sua remoção pode ser realizada em bloco ou, para a obtenção de amostras mais específicas, brocas do tipo serra copo podem ser utilizadas. A remoção em bloco pode ser realizada por meio de cortes com serra manual, elétrica ou com auxílio de formões. Neste caso, todo o osso temporal é removido em bloco (block method) e o osso pode ser estudado em sua totalidade. A obtenção de amostras com uso da broca serra copo pode ser tanto iniciada na superfície interna do crânio, para obtenção de amostras de orelha interna, incluindo o meato acústico interno, mas apenas a região medial do meato acústico externo, parte das células da mastoide, do seio sigmoide e apenas a metade lateral da tuba auditiva1,3. No método lateral, o mesmo descrito neste trabalho, é possível a obtenção de amostras contendo todo o meato acústico externo, membrana timpânica, cadeia ossicular e parta da cavidade da orelha média1. Apesar de vários autores já terem realizado pesquisa experimental envolvendo o meato acústico externo e membrana timpânica de cadáveres, poucos trabalhos descrevem de forma detalhada o método de obtenção e preparação das amostras para estudo histológico e/ou imunohistoquímico5,6,8,9.
O método descrito neste estudo foi realizado com a utilização de ferramentas de baixo custo (furadeira convencional e broca do tipo serra copo, utilizados em marcenaria) ao invés de ferramentas e brocas especiais como já descrito anteriormente, tendo sido obtido um resultado similar1. O instrumental utilizado na dissecção foi similar ao utilizado em outros trabalhos8. Os estudos já publicados sugerem a importância do tempo limite de 24 horas entre a fixação do material e a confecção dos blocos, necessidade de injeção de materiais fixadores na região a ser estudada ou mesmo resfriamento do cadáver, para que fossem evitados artefatos ou autólise1. No presente trabalho, estes procedimentos não foram necessários devido ao curto período entre o óbito e a fixação das amostras em formol a 10%. O período entre a fixação e a confecção dos blocos em parafina, entre cinco e 15 dias, não influenciou negativamente na qualidade das amostras, o que pôde ser comprovado pelos estudos histológico e imunohistoquímico.
CONCLUSÃO
O método descrito neste estudo foi facilmente exequível, reprodutível e produziu amostras de boa qualidade para serem estudadas, seja para treinamento ou pesquisa experimental. À medida que as amostras foram sendo obtidas, com uma maior experiência no método, houve substancial diminuição do tempo necessário para execução de cada etapa. Todas as amostras foram viáveis para a realização de estudos histológico e imunohistoquímico.
REFERÊNCIAS
1. Nadol JB Jr. Techniques for human temporal bone removal: Information for the scientific community. Otolaryngol Head Neck Surg. 1996;115(4):298-305.
2. George AP, De R. Review of temporal bone dissection teaching: how it was, is and will be. J Laryngol Otol. 2010;124(2):119-25.
3. Walvekar RR, Harless LD, Loehn BC, William Swartz. Block method of human temporal bone removal: a technical modification to permit rapid removal. Laryngoscope. 2010;120(10):1998-2001.
4. Bento RF, Miniti A, Bogar P, Caldas Neto SC, Rodrigues Jr AJ. Manual de Dissecção do Osso Temporal. 2a edição. São Paulo: Fundação Otorrinolaringologia; 1997.
5. Lepercque S, Broekaert D, van Cauwenberge P. Cytokeratin expression patterns in the human tympanic membrane and external ear canal. Eur Arch Otorhinolaryngol. 1993;250(2):78-81.
6. Broekaert D, Boedts D. The proliferative capacity of the keratinizing annular epithelium. Acta Otolaryngol. 1993;113(3):345-8.
7. Hsu SM, Raine L, Fanger H. Use of avidin-biotin-peroxidase complex (ABC) in immunoperoxidase techniques: a comparison between ABC and unlabeled antibody (PAP) procedures. J Histochem Cytochem. 1981;29(4):577-80.
8. Devèze A, Koka K, Tringali S, Jenkins HA, Tollin DJ. Active middle ear implant application in case of stapes fixation: a temporal bone study. Otol Neurotol. 2010;31(7):1027-34.
9. Tringali S, Koka K, Holland NJ, Jenkins HA, Tollin DJ. Round window membrane implantation with an active middle ear implant: effects of performance of round window exposure and transducer tip diameter in human cadaveric temporal bones. Audiol Neurotol. 2010;15(5):291-302.
1. Doutorando em Medicina (Otorrinolaringologia) pela Faculdade de Ciências Médicas da Santa Casa de São Paulo (Médico Otorrinolaringologista e Cirurgião Crânio-maxilo-facial).
2. Doutora em Medicina (Otorrinolaringologia) pela Faculdade de Ciências Médicas da Santa Casa de São Paulo (Professora Assistente do Departamento de Morfologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo).
3. Doutor em Oncologia pela Fundação Antônio Prudente (Coordenador do Núcleo de Apoio ao Pesquisador do Hospital de Câncer de Barretos - Fundação PIO XII , Brasil ).
4. Doutor em Medicina (Otorrinolaringologia) pela Escola Paulista de Medicina (Professor Adjunto do Departamento de Otorrinolaringologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo).
Faculdade de Ciências Médicas da Santa Casa de São Paulo.
Endereço para correspondência:
João Daniel Caliman e Gurgel
Av. Gov. Jones dos Santos Neves, 1271 - Centro
Linhares - ES. CEP: 2900-032
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 21 de outubro de 2011. cod. 8854
Artigo aceito em 4 de dezembro de 2011.