Ano: 2011 Vol. 77 Ed. 6 - Novembro - Dezembro - (9º)
Seção: Artigo Original
Páginas: 728 a 735
Efeitos da cisplatina em cobaias: histologia coclear e genotoxidade
Cisplatin effects on guinea pigs: cochlear histology and genotoxicity
Autor(es): Cacineli Marion de Franceschi1; Tania Tochetto2; Aron Ferreira da Silveira3; Mara Rejane Fantinel4; Thaís Doeler Algarve5
Palavras-chave: cobaias, células ciliadas auditivas, genotoxicidade, histologia.
Keywords: hair cells, auditory, genotoxicity, guinea pigs, histology.
Resumo:
Conhecer as respostas do DNA aos agentes externos como a cisplatina pode ser relevante para o diagnóstico e tratamento das alterações auditivas causadas pela administração deste fármaco.Objetivos: Verificar a influência da cisplatina sobre a cóclea e o DNA de cobaias. Material e Método: Estudo experimental executado com 12 cobaias (Cavia porcellus). O critério de inclusão de cobaias na amostra foi a presença de reflexo de Preyer e emissões otoacústicas produto de distorção (EOAPDs). As cobaias foram dividas em dois grupos: Grupo controle (GC) - composto de seis cobaias, às quais foi administrada solução fisiológica por seis dias consecutivos, via intraperitoneal; Grupo estudo (GE) - composto por seis cobaias, às quais foi administrada cisplatina em seis doses consecutivas de 3mg/kg/dia via intraperitoneal. Vinte e quatro horas após a última aplicação de cisplatina as cobaias foram sacrificadas, foi coletada amostra sanguínea e as cócleas foram removidas. Resultados: Administração de cisplatina não provocou alterações genotóxicas. A análise histológica mostrou alterações no órgão de Corti e gânglio espiral. Conclusão: A cisplatina provoca alterações na histologia coclear como perda da microcitoarquitetura normal do órgão de Corti e redução dos neurônios do gânglio espiral com alterações celulares. No entanto, não foram detectados danos genotóxicos.
Abstract:
To understand how the DNA answers to external agents such as cisplatin may be relevant to the diagnosis and treatment of hearing disorders caused by the administration of such drug. Objectives: To investigate the cisplatin influence on the cochlea and DNA of guinea pigs. Material and Methods: Experimental study carried out with 12 guinea pigs (Cavia porcellus). The inclusion criterion was the presence of Preyer's reflex and distortion-product otoacoustic emissions. Guinea pigs were divided into two groups: Control Group (CG) - made up of six guinea pigs, to which we administrated saline solution during six consecutive days, intraperitoneally; and a Study Group (SG) - made up of six guinea pigs, to which we administrated cisplatin during six consecutive doses of 3mg/kg/day intraperitoneally. Twenty-four hours after the last administration of cisplatin the guinea pigs were slaughtered, blood samples were collected and the cochleae were removed. Results: The administration of cisplatin did not cause identifiable changes to the DNA. Histological analysis showed changes in the organ of Corti and spiral ganglion. Conclusion: Cisplatin causes changes in cochlear histology, such as the loss of the normal micro-cytoarchitecture of the organ of Corti, and reduction of neurons of the spiral ganglion with cell alterations, however, DNA damage was not detected.
![]()
INTRODUÇÃO
A cisplatina é um quimioterápico largamente utilizado em adultos e crianças no tratamento de tumores sólidos com excelentes resultados, porém tem muitos efeitos colaterais1,2. A toxicidade da cisplatina é encontrada nos rins, sistema nervoso central e/ou periférico, intestino, medula óssea e também no órgão de Corti3.
Ao atingir o órgão de Corti, a cisplatina inicia sua ação deletéria pelas células de sustentação, seguida pelas células ciliadas externas, principalmente nos giros médio e basal, posteriormente estria vascular e nervo auditivo4.
Durante a administração de cisplatina, ocorre um bloqueio nos canais iônicos das células ciliadas externas, impedindo a transdução do estímulo e causando perda auditiva5.
A cisplatina provoca alterações no sistema antioxidante das células ciliadas externas da cóclea3. Além disto, ocorre a produção de espécies reativas de oxigênio (ROS), o que provoca a morte celular6. O estresse oxidativo ocorre quando há produção aumentada de radicais livres ou quando os mecanismos antioxidantes estão prejudicados7.
O Ensaio Cometa tem uma ampla variedade de aplicações, incluindo biomonitoramento humano, genotoxicologia e monitoramento ecológico, como ferramenta para investigar danos e reparo ao ácido desoxirribonucleico (DNA) em resposta a uma série de agentes nocivos8. Ainda fornece informações valiosas sobre as características intrínsecas do DNA de células individuais9.
Conhecer as respostas do DNA aos agentes externos, como a cisplatina, pode ser relevante para a prevenção, diagnóstico e tratamento das alterações auditivas causadas pela administração deste fármaco.
Assim, o presente trabalho objetiva verificar a influência da cisplatina sobre a histologia da cóclea e o DNA de cobaias.
MATERIAL E MÉTODO
Delineamento da pesquisa
Estudo experimental no qual foram estudadas 12 cobaias (Cavia porcellus), pela facilidade de manipulação e dissecação coclear, além de manutenção simples e resistência a infecções10,11.
Foram seguidas as diretrizes do Guia para os Cuidados e Uso de Animais de Laboratório do Colégio Brasileiro de Experimentação Animal (COBEA)12, e também os princípios éticos e de biossegurança.
O critério de inclusão de cobaias na amostra foi a presença de reflexo de Preyer (contração do pavilhão auricular frente a estímulo sonoro) e emissões otoacústicas produto de distorção (EOAPDs).
Os fármacos utilizados no estudo foram:Cisplatina: concentração de 1 mg/ml; Solução fisiológica de cloreto de sódio a 0,9%; Halotano.
As cobaias foram dividas em dois grupos:
Grupo controle (GC) - composto de seis cobaias, às quais foi administrada solução fisiológica de cloreto de sódio a 0,9% por seis dias consecutivos, via intraperitoneal;
Grupo estudo (GE) - composto por seis cobaias, às quais foi administrada cisplatina em seis doses consecutivas de 3mg/kg/dia via intraperitoneal.
A audição foi avaliada pela ocorrência do reflexo de Preyer e registro das EOAPDs antes do início e 24 horas após o encerramento das aplicações de cisplatina. Para testar o reflexo de Preyer, foi percutido o agogô, campânula grande, com intensidade superior a 90 dB. As cobaias deveriam apresentar contração do pavilhão auricular. Para a avaliação das EOAPDs, as cobaias foram sedadas com halotano. O registro das EOAPDs foi feito com utilização do aparelho de emissões otoacústicas (EOAs) modelo SmartEp da marca Intelligent Hearing Systems® (IHS).Foram analisadas as emissões otoacústicas nas frequências de 500 Hz a 6000 Hz. Os resultados foram impressos para análise e comparação.
O critério de integridade funcional da cóclea foi a presença EOAPDs13. As EOAPDs foram também avaliadas pela comparação dos valores médios da relação sinal/ ruído por frequência no início e fim do experimento, a fim de observar indícios de sofrimento precoce das células ciliadas externas14.
A análise dos danos ao DNA foi feita por meio do Ensaio Cometa. Para tal, foi realizada coleta de amostra sanguínea, pós-administração de cisplatina.
O Ensaio Cometa foi realizado de acordo com o método proposto por Singh et al.15 e modificado por Collins et al.16. Todos os passos foram realizados sem luz direta para prevenir danos adicionais ao DNA.
Foram preparadas duas lâminas para cada cobaia, onde foram contados 50 núcleos por lâmina. Ambas as lâminas foram analisadas por dois observadores independentes. Para o índice de dano (ID), foi considerada a média dos danos observados pelos dois analisadores para 100 núcleos por cobaia.
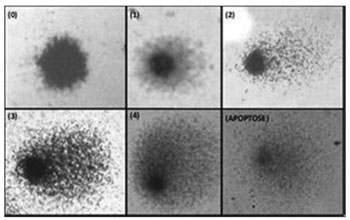
As células "cometa", assim chamadas por terem forma similar a um cometa, coradas com nitrato de prata, foram analisadas em microscópio óptico normal e classificadas de acordo com o tamanho da cauda em relação à cabeça (Figura 1)8:
Figura 1. Classificação do dano ao DNA das cobaias analisadas (Fronza, 2010)17.Classe 0 (ID0): sem cauda (sem dano); Classe 1 (ID1): com uma pequena cauda menor que o diâmetro da cabeça; Classe 2 (ID2): com o comprimento da cauda entre uma e duas vezes o diâmetro da cabeça; Classe 3 (ID3): com uma cauda longa superior a duas vezes o diâmetro da cabeça; Classe 4 (ID4): cauda longa e mais espalhada (em forma de leque) do que a classe 3; Apoptose: ausência de núcleo.
Após a última aplicação de cisplatina nas cobaias do GE e solução salina nas cobaias do GC, imediatamente após a realização das EOAPDs, os animais foram anestesiados com cloridrato de xilazina 2% e cloridrato de cetamina 10% via intramuscular, e sacrificados pelo método de decapitação.
Seus ossos temporais foram rapidamente removidos e abertos para a exposição da cóclea, com corte no crânio no sentido longitudinal mediano, estendendo-se posteriormente à região vestibulococlear.
Para evitar a destruição das células por autólise ou bactérias e preservar a morfologia e a composição dos tecidos, as cócleas foram fixadas com formaldeído 4% em solução tamponada (pH 7,5). Após a fixação, foi realizada a desidratação, com banhos de concentração crescente de etanol, de 70% até etanol puro (100%). Para a inclusão em parafina, utilizou-se o xilol para que as peças se tornassem translúcidas. Em seguida, colocou-se um pouco de parafina fundida e deixou-se solidificar a temperatura ambiente, formando-se um bloco com a cóclea no seu interior. Após, os blocos foram seccionados por meio de uma navalha de aço acoplada ao micrótomo, de onde se obtiveram cortes de 6 a 8μm de espessura. Foi utilizada a coloração dupla pela hematoxilina e eosina, que corou as lâminas em tons de azul e vermelho18.
Foi utilizado o microscópio óptico binocular da marca Olympus modelo, CX40, para visualização do material coclear e DNA.
Os resultados da microscopia óptica foram fotografados e analisados.
O projeto foi aprovado pelo Comitê Interno de Ética em Experimentação Animal da UFSM.
Análise estatística
A normalidade dos dados foi testada por meio do teste de Kolmogorov-Smirnov, o qual determina se a característica estudada da amostra é oriunda de uma população com distribuição normal.
Quando testada a normalidade das variáveis em estudo, verificou-se que todos os dados testados seguiram uma distribuição normal.
Foi utilizado o teste T-Student ao analisarem-se as orelhas (direita e esquerda), a média de amplitude das EOAPDs e Ensaio Cometa. Considerou-se como diferença significativa valores de p menores que 0,05 (p<0.05).
Para o cálculo do índice de dano (ID), foi utilizada a seguinte fórmula de acordo com Cavalcanti et al.19.
ID= (0 x n0) + (1 x n1) + (2 x n2) + (3 x n3) + (4 x n4), onde n = número núcleos de cada classe analisada.
Desta forma, o índice de dano para 100 nucleoides pode variar de zero (completamente sem danos 0 X 100) a 400 (totalmente danificadas 100 X4).
Foi utilizado o coeficiente de correlação de postos de Spearman para correlacionar o índice de dano ao DNA. O coeficiente ρ de Spearman varia entre -1 e 1. Quanto mais próximo estiver destes extremos, maior será a associação entre as variáveis. O sinal negativo da correlação significa que as variáveis variam em sentido contrário. 0,70 (+ ou -) indica uma forte correlação. Considerou-se como correlação significante ao nível de 0,001.
RESULTADOS
As cobaias foram divididas em dois grupos: GC, referente às cobaias que receberam solução salina, e GE, referente às cobaias que receberam cisplatina. Cada grupo foi composto por seis cobaias.
Não se verificou diferença estatisticamente significativa entre o comportamento das orelhas direita e esquerda quando analisadas pelo teste T-Student. Assim, os dados obtidos de ambas as orelhas foram estudados em conjunto.
Verificou-se presença do reflexo de Preyer e das EOAPDs em todas as cobaias do GC e do GE, antes do início da aplicação de solução fisiológica e cisplatina, respectivamente, totalizando 24 orelhas.
Após seis dias de aplicação de cisplatina, quatro cobaias do GE foram a óbito. Foi possível a remoção das oito cócleas para análise histológica e em uma delas foi possível coleta de sangue para análise do DNA, bem como nas cobaias restantes.
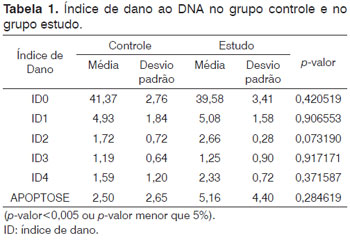
Não houve diferença estatisticamente significativa no Ensaio Cometa entre as cobaias do GC e GE (Tabela 1).
Nas cobaias do GC, a aplicação de solução fisiológica a 0,9% resultou em nenhum ou pouco dano ao DNA, isto é, houve correlação altamente negativa (-0,943*) entre as variáveis ID0 (sem dano, sem cauda) e ID1 (com pouco dano, apresentando uma pequena cauda menor que o diâmetro da cabeça) (*correlação significante ao nível de 0,001).
Nas cobaias do GE, a aplicação de cisplatina 3mg/ kg por seis dias consecutivos causou pouco dano ou dano total ao DNA, isto é, houve correlação altamente negativa (-1,00*) entre as variáveis apoptose (totalmente danificada, com ausência de núcleo) e ID1 (com pouco dano, apresentando uma pequena cauda menor que o diâmetro da cabeça) (*correlação significante ao nível de 0,001).
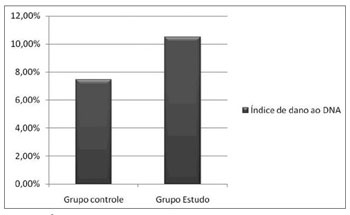
O índice de dano ao DNA nas cobaias do GC (7,45%) foi inferior ao das cobaias do GE (10,5%) (Figura 2).
Figura 2. Índice de dano ao DNA por grupo.
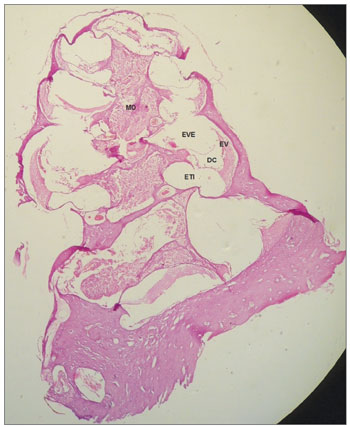
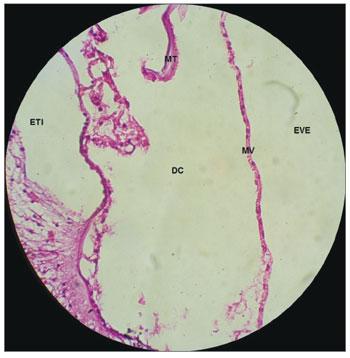
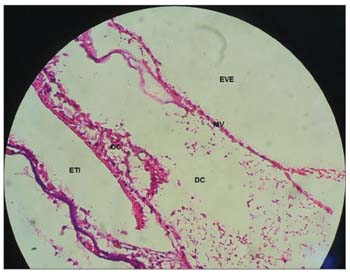
Nas cobaias do GC, que receberam solução fisiológica de cloreto de sódio a 0,9%, a estrutura microscópica da cóclea em corte da base ao ápice, mostrou as espiras e o modíolo ao centro, dentro do qual encontram-se os neurônios do gânglio espiral (Figura 3); a estria vascular sem alterações (Figuras 4 e 5); o ramo coclear com aspecto normal, sem desmielinização (Figura 6); os neurônios do gânglio espiral sem alterações (Figura 6) e a membrana vestibular de aspecto normal, retilínea e sem vacuolização citoplasmática (Figuras 7 e 8).
Figura 3. Estrutura microscópica da cóclea de cobaia do GC em corte da base ao ápice, demonstra as espiras, o modíolo no centro, dentro do qual encontram-se os neurônios do gânglios espirais. Aumento de 4x. MO: Modíolo; EVE: Escala Vestibular; ETI: Escala Timpânica; DC: Ducto Coclear; EV: Estria Vascular.
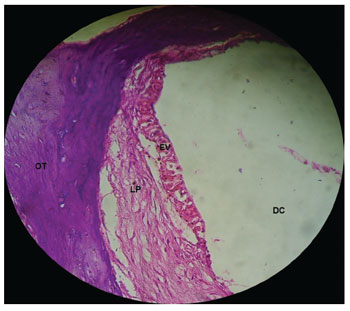
Figura 4. Estria vascular com aspecto normal sem alterações em cobaia do GC. Aumento 40x. DC: Ducto Coclear; EV: Estria Vascular; LP: Lâmina Própria; OT: Osso Temporal.
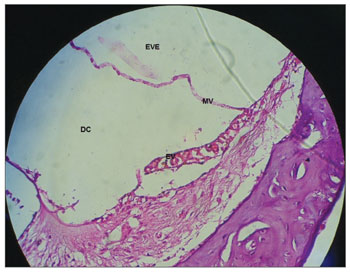
Figura 5. Estria vascular sem vacuolização em cobaia do GC. Aumento 40x. MV: Membrana Vestibular; EVE: Escala Vestibular; DC: Ducto Coclear; EV: Estria Vascular.
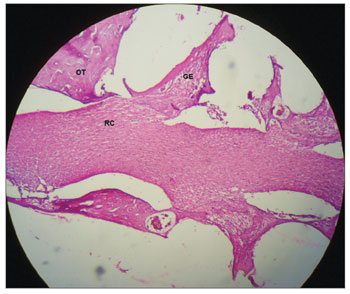
Figura 6. Início do ramo coclear demonstrando aspecto normal e sem desmielinização em cobaia do GC. Aumento 10x. OT: Osso Temporal; GE: Gânglio Espiral; RC: Ramo Coclear.
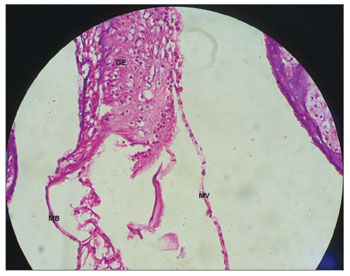
Figura 7. Membrana de vestibular sem vacuolização, íntegra e retilínea em cobaia do GC. Aumento 40x. MV: Membrana Vestibular; MB: Membrana Basilar; GE: Gânglio Espiral.
Figura 8. Membrana de vestibular sem vacuolização, íntegra e retilínea, em cobaia do GC. Aumento 10x. MV: Membrana Vestibular; MT: Membrana Tectória; EVE: Escala Vestibular; ETI: Escala Timpânica; DC: Ducto Coclear.
DISCUSSÃO
Não houve diferença estatisticamente significante entre os grupos no teste Ensaio Cometa (Tabela 1). De fato, a cisplatina não produz danos detectáveis pelo Ensaio Cometa, devido à produção de ligações cruzadas que interferem na migração do DNA20-24.
Para a análise do DNA nas cobaias do GC, houve correlação altamente negativa entre as variáveis ID0 e ID1. Quanto maior o ID0, menor ID1 e vice-versa, isto é, não há índices elevados de dano ao DNA nas cobaias do GC.
Já nas cobaias do GE, houve correlação altamente negativa entre as variáveis apoptose e ID1, ou seja, à medida que aumenta o número de apoptose, diminui o ID1 e vice-versa, com isso é possível verificar que, nas cobaias do GE, há baixo índice de dano ao DNA, ou a célula está destruída. Slattery & Warchol25 verificaram que o tratamento com cisplatina causa apoptose das células ciliadas auditivas e vestibulares.
Verificou-se que o índice de dano ao DNA foi baixo tanto nas cobaias do GC como nas cobaias do GE. Nas cobaias do GC, o índice de dano encontrado foi de 7,45% (Figura 2). Nas cobaias do GE, o índice de dano foi de 10,5% (Figura 2). Foi possível verificar um pequeno aumento no índice de dano ao DNA nas cobaias que receberam cisplatina.
Nas cobaias do GC, administrada solução fisiológica salina 0,9%, verificou-se que a estrutura microscópica da cóclea em corte da base ao ápice demonstra as espiras, o modíolo no centro, dentro do qual encontram-se os neurônios do gânglio espiral (Figura 3), estria vascular com aspecto normal sem alterações (Figura 4 e 5), ramo coclear com aspecto normal, sem desmielinização (Figura 6) e neurônios do gânglio espiral sem alterações (Figura 7), membrana vestibular de aspecto normal, retilínea e sem vacuolização citoplasmática (Figura 7 e 8). Outros estudos também não constataram alteração histológica nos grupos não tratados com cisplatina26,27.
A baixa qualidade das lâminas histológicas dificultou as análises. Os blocos foram feitos com parafina, para que a qualidade das lâminas fosse alta; o ideal seriam blocos de resina. No entanto, este material não estava disponível.
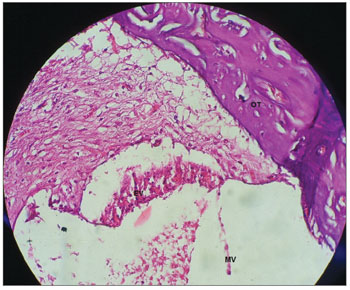
Nas cobaias que receberam cisplatina, houve alterações generalizadas nas células da estria vascular, com ausência de definição celular (Figura 11). A estria vascular é um dos alvos principais da cisplatina na cóclea27-29. No entanto, Cardinaal et al.26 não verificaram alterações na estria vascular de cobaias que receberam cisplatina por oito dias consecutivos, tanto com a menor dose diária (0,7 mg/kg/dia) como na dose diária mais elevada (2,0mg/kg/ dia). Outros experimentos também não encontraram nenhum efeito histológico na estria vascular (dose de 2mg/ kg/dia por 4, 6 e 8 dias consecutivos)27-29. Assim, é possível inferir que a dose capaz de causar lesão na estria vascular é maior que 2,0 mg/kg/dia.
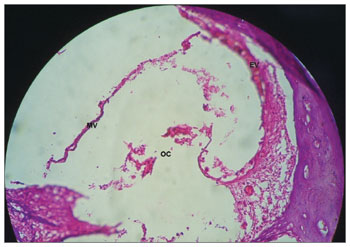
Figura 9. Extensa perda da microcitoarquitetura normal do órgão de Corti, células ciliadas externas e internas sem definição. Ausência de membrana tectória em cobaia tratada com cisplatina na dose de 3mg/kg por seis dias consecutivos. Aumento 40x. MV: Membrana Vestibular; EVE: Escala Vestibular; ETI: Escala Timpânica; DC: Ducto Coclear; OC: Órgão de Corti.
Figura 10. Ausência completa do órgão de Corti em espira média da cóclea de cobaia tratada com cisplatina na dose de 3mg/kg por seis dias consecutivos. Aumento 40x. MV: Membrana Vestibular; EV: Estria Vascular; OC: Órgão de Corti.
Figura 11. Alterações generalizadas nas células da estria vascular, sem definição da organização celular e aspecto da membrana vestibular de cobaia tratada com cisplatina na dose de 3mg/kg por seis dias consecutivos. Aumento 40x. MV: Membrana Vestibular; EV: Estria Vascular; OC: Órgão de Corti.
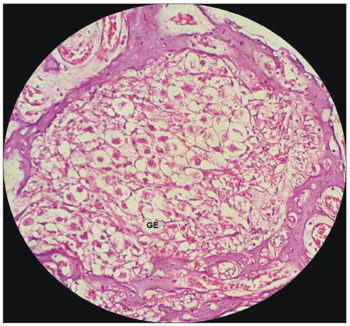
Nas cobaias do GE, os neurônios do gânglio espiral mostram-se esparsos e com alterações celulares, como a ausência de núcleos (Figura 12). Tais achados concordam com Cardinaal et al.26, que encontraram mudanças morfológicas nas células do gânglio espiral, como vacuolização citoplasmática. Outros estudos também relatam alterações no gânglio espiral27-29. Nota-se que o gânglio espiral é um dos alvos principais das alterações causadas pela cisplatina27-29.
Figura 12. Aspecto dos neurônios do gânglio espiral de cobaia tratada com cisplatina na dose de 3mg/kg por seis dias consecutivos. Aumento 40x. GE: Gânglio Espiral.
Nas cobaias que receberam cisplatina (GE), dose de 3mg/kg por seis dias consecutivos, verificou-se extensa perda da microcitoarquitetura normal do órgão de Corti (Figura 9), células ciliadas externas e internas sem definição (Figura 9), ausência de membrana tectória (Figura 9), ausência completa do órgão de Corti em espira média da cóclea (Figura 10). Estes achados corroboram os de Cardinaal et al.26, que mostram perda grave de células ciliadas externas, em especial no giro basal e médio da cóclea. Outros estudos também mostram alterações no órgão de Corti, com extensa lesão nas células ciliadas externas27-29. No entanto, relatam que o giro basal é o mais afetado27
Apesar de a cisplatina não causar alterações genotóxicas estatisticamente significantes identificáveis pelo Ensaio Cometa, foi possível observar alterações na histologia coclear. Tais achados corroboram outros estudos, que relatam a produção de ligações cruzadas que interferem na migração do DNA no Ensaio Cometa20-24. Assim, supõese que a cisplatina provoca alterações no mecanismo antioxidante celular. O mecanismo de ototoxicidade da cisplatina deve-se a alterações no sistema antioxidante das células ciliadas externas da cóclea3. Além disso, ocorre a produção de espécies reativas de oxigênio (ROS), o que provoca a morte celular6. Van Ruijven et al.29 demonstraram a presença de DNA-platinado nos núcleos da maioria das células no órgão de Corti após administração de cisplatina. Assim, a cisplatina forma ligações cruzadas com o DNA, o que impede a migração do DNA no Ensaio Cometa. No entanto, a cisplatina diminui a capacidade antioxidante das células, provocando a morte celular, o que causa as alterações cocleares identificadas na análise histológica.
CONCLUSÃO
A cisplatina provoca alterações na histologia coclear, como perda da microcitoarquitetura normal do órgão de Corti e redução dos neurônios do gânglio espiral com alterações celulares. No entanto, não foram detectados danos genotóxicos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Saleh S, El-Demerdash E. Protective effects of L-arginige against cisplatin-induced renal oxidative stress and toxicity: role of nitric oxide. Basic Clin Phramacol Toxicol. 2005;97(2):91-7.
2. Schweitzer VG. Cisplatin-induced ototoxicity: the effect of pigmentation and inhibitory agents. Laryngoscope. 1993;103(4Pt2):1-52.
3. Hypolito MA, Oliveira JAA. Ototoxidade, otoproteção e autodefesa das células ciliadas da cóclea. Medicina (Ribeirão Preto). 2005;38(3/4):279-89.
4. Sergi B, Ferraresi A, Troiani D, Paludetti G, Fetoni AR. Cisplatin ototoxicity in the guinea pig: vestibular and cochlear damage. Hear Res. 2003;182(1-2):56-64.
5. McAlpine D, Johnstone BM. The ototoxic mechanism of cisplatin. Hear Res. 1990;47(3):191-203.
6. Rybak LP, Whitworth CA, Mukherjea D, Ramkumar V. Mechanisms of cisplatin-induced ototoxicity and prevention. Hear Res. 2007; 226(1-2):157-67.
7. Dröge W. Free radicals in the physiological control of cell function. Physiol Rev. 2002;82(1):47-95.
8. Collins A, Dusinská M, Franklin M, Somorovská M, Petrovská H, Duthie S, et al. Comet assay in human biomonitoring studiesreliability, validation and applications. Environ Mol Mutagen. 1997; 30(2):139-46.
9. Mckenna DJ, Mckeown SR, Mckelvey-Martin VJ. Potential use of the comet assay in the clinical management of cancer. Mutagenesis. 2008;23(3):183-90.
10. Hyppolito MA, Oliveira JA, Rossato M, Holanda F.. Ototoxicidade da cisplatina e otoproteção pelo extrato de ginkgo biloba às células ciliadas externas: estudo anatômico e eleltrofisiológico. Rev. Bras. Otorrinolaringol. 2003;69(4):504-11.
11. Baggio, C. Análise Microscópica das Células Ciliadas Externas no uso da Gentamicina. [Dissertação]. Santa Maria: Universidade Federal de Santa Maria; 2007. 63 f. Mestrado em Distúrbios da Comunicação Humana.
735 Brazilian Journal of Otorhinolaryngology 77 (6) Novembro/Dezembro 2011 http://www.bjorl.org.br / e-mail: revista@aborlccf.org.br 12. Colégio Brasileiro de Experimentação Animal (COBEA). Disponível em: . Acesso em: 20 out 2008.
13. Hyppolito MA, Lessa RM, Oliveira JAA de, Rossato M. Otoproteção da amifostina aos efeitos ototóxicos da cisplatina: estudo em cobaias albinas por emissões otoacústicas produtos de distorção e microscopia eletrônica de varredura. Braz J Otorhinolaryngol. 2005;71(3):268-273.
14. Kasse CA, Cruz OLM, Ilha LCN, Costa HO, Lopes EC, Coelho F. O uso de Maytenus ilicifolia na prevenção da ototoxicidade induzida pela cisplatina. Braz J. Otorhinolaryngol. 2008.; 74(5):712-717
15. Singh NP, McCoy MT, Tice RR, Schneider EL. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp Cell Res. 1998;175(1):184-91
16. Collins AR, Duthie SJ. The kinetics of repair of oxidative DNA damage (strand breaks and oxidised pyrimidines) in human cells. Mutat Res. 1995;336(1):69-77.
17. Fronza, AB. Associação entre audição, tabagismo e genotoxicidade em adultos jovens. [Dissertação]. Santa Maria: Universidade Federal de Santa Maria; 2010. 121f. Mestrado em Distúrbios da Comunicação Humana.
18. Junqueira LCU, Carneiro J. Histologia e seus Métodos de Estudo. In: Histologia básica. 9ª ed. Rio de Janeiro: Guanabara Koogan; 1999, cap. 1, p. 1-18.
19. Cavalcanti BC, Sombra CML, Oliveira JHHL, Berlinck RGS, Moraes MO, Pessoa C. Citotoxicity and genotoxicity of ingenamine G isolated from the Brazilian marine schponge Pachychalina alcaloidifera. Comp Biochem Physiol A. 2008;147(4):409-15.
20. Wozniak K, Czechowska A, Blasiak J. Cisplatin-evoked DNA fragmentation in normal and cancer cells and its modulation by free radical scavengers and the tyrosine kinase inhibitor STI571. Chem Biol Interact. 2004;147(3):309-18.
21. Almeida GM, Duarte TL, Steward WP, Jones GD. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair. 2006;5(2):219-25.
22. Nadin SB,Vargas-Roig LM, Drago G, Ibarra J, Ciocca DR. DNA damage and repair in peripheral blood lymphocytes from health individuals and cancer patients: A pilot study on the implications in the clinical response to chemotherapy. Cancer Lett. 2006;239(1):84-97.
23. Sheikh-Hamad D. Cisplatin-induced citoxicity: is the nucleus relevant? Am J Physiol - Renal Physiol. 2008;295(1):F42-F43.
24. Mendonça LM, Santos GC dos, Santos RA dos, Takahashi CS, Bianchi MDLP, Antunes LMG. Evaluation of curcumin and cisplatin-induced DNA damage in PC12 cells by the alkaline comet assay. Hum Exp Toxicol. 2010 ago. [capturado em: 20 out.2010].; 29(8):635-43. Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/20051457.
25. Slattery EL, Warchol ME. Cisplatin ototoxicity blocks sensory regeneration in the avian inner ear. J Neurosci. 2010 [capturado em: 18 jan.2011]; 30(9):3473-8. Disponível em: http://www.jneurosci.org/cgi/content/full/30/9/3473#B33.
26. Cardinaal RM, Groot JC de, Huizing EH, Veldman JE, Smoorenburg GF. Dose-dependent effect of 8-day cisplatin administration upon the morphology of the albino guinea pig cochlea. Hear Res. 2000;144(1- 2):135-46.
27. van Ruijven MWM, Groot JCMJ de, Smoorenburg GF. Time sequence of degeneration pattern in the guinea pig cochlea during cisplatin administration. A quantitative histological study. Hear Res. 2004;197(1- 2):44-54.
28. van Ruijven MWM, Groot JCMJ de, Klis SFL, Smoorenburg GF. The cochlear targets of cisplatin: an electrophysiological and morphological time-sequence study. Hear Res. 2005; 205(1-2):241-8.
29. van Ruijven MWM, Groot JCMJ de, Hendriksen F, Smoorenburg GF. Immunohistochemical detection of platinated DNA in the cochlea of cisplatin-treated guinea pigs. Hear Res. 2005; 203(1-2):112-21.
1. Mestre em Distúrbios da Comunicação Humana - UFSM, Fonoaudióloga.
2. Doutora, Professor Associado da Universidade Federal de Santa Maria no Curso de Fonoaudiologia e Programa de Pós-Graduação em Distúrbios da Comunicação Humana.
3. Doutor, Professor Titular da Universidade Federal de Santa Maria no Departamento de Morfologia e Programa de Pós-Graduação em Distúrbios da Comunicação Humana.
4. Biomédica, Mestranda do Programa de Pós-graduação em Bioquímica Toxicológica-UFSM.
5. Farmacêutica, Mestranda do Programa de Pós-graduação em Bioquímica Toxicológica-UFSM.
Universidade Federal de Santa Maria.
Endereço para correspondência:
Cacineli Marion de Franceschi
Rua Caetano José Rigon, Nº 466, Bairro Vera Cruz
Sobradinho - RS. CEP: 96900-000
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 25 de março de 2011. cod. 7663.
Artigo aceito em 14 de julho de 2011.
CAPES